5806256278
Część III: Termodynamika układów biologicznych
fj.i = H-RTlnrij lub m = + RTlnCj
gdzie: |i - potencjał chemiczny przy jednostkowym stężeniu lub liczbie moli
Równowaga chemiczna
Układ znajduje się w stanie równowagi chemicznej, gdy przebiegają w nim tylko procesy odwracalne, a liczba moli wszystkich substancji (lub ich stężenie) nie ulega zmianie w czasie. Jak już wiemy, termodynamicznym warunkiem odwracalności procesu jest zerowa wartość różniczki entropii, dS = 0.
Z warunku stałości składu w stanie równowagi wynika, że brak jest w nim sił napędowych prowadzących do zmiany składu. Siłą napędową zmiany stężenia danej substancji jest jej potencjał chemiczny. Wynika stąd wprost, że w stanie równowagi potencjały chemiczne wszystkich substancji są równe zero. Pamiętając, że potencjał chemiczny i-tej substancji jest pochodną entalpii swobodnej po stężeniu tej substancji dochodzimy do wniosku, że w stanie równowagi entalpia swobodna układu osiąga minimum. Jeżeli entalpia jest większa niż to minimum, to układ znajduje się poza stanem równowagi i będzie zmieniał swój skład dążąc do minimum entalpii swobodnej. Wynika stąd ciekawy wniosek: reakcje chemiczne w warunkach izotermiczno-izobarycznych przebiegają samorzutnie w kierunku obniżenia entalpii swobodnej. Rozważmy odwracalną reakcję chemiczną:
A + B<=> C + D
Przebieg tej reakcji najwygodniej jest śledzić wprowadzając pojęcie współrzędnej reakcji, £. Gdy w układzie znajdują się wyłącznie substraty £ = 0, a gdy reakcja przebiegnie całkowicie i w układzie będą wyłącznie produkty £ = 1. Wprowadźmy jeszcze jedno pojęcie: zmiana entalpii swobodnej, AG równe z definicji:
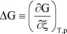

współrzędna reakcji, ć
Należy zwrócić uwagę na nieco mylący symbol zmiany entalpii swobodnej. Wbrew formie zapisu nie jest to różnica entalpii swobodnej między dwoma stanami, ale pochodna, czyli szybkość « zmian entalpii swobodnej. Ta właśnie wielkość decyduje o kierunku przebiegu reakcji:
■ AG < 0 - przebieg spontaniczny: przybywa produktów
■ AG = 0 - stan równowagi
9
0
Wyszukiwarka
Podobne podstrony:
Część III: Termodynamika układów biologicznych Ldv - współczynnik ultrafiltracji lub osmozy Z faktu
Część III: Termodynamika układów biologicznych Materiały Pomocnicze do Wykładów z Podstaw
Część III: Termodynamika układów biologicznych ■ AG > O - reakcja przebiega spontanicznie, ale w
Część III: Termodynamika układów biologicznych 2N2 + 502 + 2H20 = 4H+ + 4N03 Standardowa zmiana ent
Część III: Termodynamika układów biologicznych Do opisu wymiany entropii z otoczeniem wygodnie jest
Część III: Termodynamika układów biologicznych Przez dłuższy czas poszukiwano wyjścia z tego problem
Część III: Termodynamika układów biologicznych W przypadku strumieni sprzężonych niektóre strumienie
Część III: Termodynamika układów biologicznych dt Na uwagę zasługuje fakt, że występowanie
Część III: Termodynamika układów biologicznych ■ przyjęliśmy liniową
Część III: Termodynamika układów biologicznychPOMIARY KALORYMETRYCZNEWstęp Pomiary kalorymetryczne
Część III: Termodynamika układów biologicznych niższej niż zadana temperatura doświadczenia T°,
Część III: Termodynamika układów biologicznych układu na jednym poziomie może być traktowany jako ca
Część III: Termodynamika układów biologicznych roztworu składnika B i proces się powtarza. W miarę j
Część III: Termodynamika układów biologicznych gdzie L, M, N są pochodnymi cząstkowymi funkcji g
Część III: Termodynamika układów biologicznych Tak więc objętość jest funkcją stanu gazu
Część III: Termodynamika układów biologicznych układach biologicznych. Od tego czasu badania takie
Część III: Termodynamika układów biologicznych r - współrzędna pracy. Należy teraz dla każdego
Część III: Termodynamika układów biologicznych ■ energia swobodna (F) zwana także
Część III: Termodynamika układów biologicznych dH = TdS - Vdp + Pidiij + pjdn } Jeżeli założymy, że
więcej podobnych podstron