1
Ile wynosi standardowa zmiana entalpii reakcji , której stała równowagi rośnie dwukrotnie, gdy temperatura zmienia się od 315 K do 347 K? Wynik podać w kJ/mol.
Odpowiedź: 19.685
Wzór: 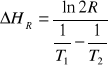
2
Mol jednoatomowego gazu doskonałego zamkniętego w cylindrze z ruchomym tłokiem podgrzano od 407 K do 594 K. Oblicz zmianę entalpii tego procesu. Wynik podać w J.
Odpowiedź: 3886.795
Wzór: ![]()
3
W pewnym procesie izochorycznym zależność energii swobodnej układu od temperatury wyraża równanie F = 63.7 + 71.8T [J]. Ile wynosi zmiana entropii układu w tym procesie? Wynik podaj w J•K-1.
Odpowiedź: -71.8
Wzór: ![]()
=> wystarczy przepisać z danych ale uwaga na znak!!
4
Substancje A i B tworzą roztwory doskonałe. W 30oC prężności par nasyconych tych związków wynoszą odpowiednio 293.1 kPa i 50 kPa. Roztwór o składzie molowym xA = 0.46 i temperaturze 30oC zamknięto w cylindrze z ruchomym tłokiem obciążonym ciśnieniem p. Obliczyć, jaki będzie stosunek liczby moli fazy ciekłej do gazowej, gdy ciśnienie będzie wynosiło 0.9 ciśnienia, w którym układ ten zaczyna wrzeć. (wynik podaj z dokładnością do 0.01)
Odpowiedź: 5
p wrzenia=xA*pA0 + (1-xA)*pB0
p=0,9 * p wrzenia
p=xA'*pA0+(1-xA')*pB0 => xA' = p-pB0/pA0-pB0
y=(xA'*pA0)/p
n cieczy/n pary = (y-xA)/(xA-xA')
5
Obliczyć średnie ciepło parowania złota, jeśli wiadomo, że temperatura wrzenia pod ciśnieniem 74533 Pa wynosi 3153 K a 2664 K pod ciśnieniem 6557 Pa. Wynik podać w J/mol.
Odpowiedź: 347130.109
Wzór: 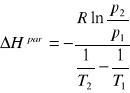
6
Standardowa entalpia tworzenia gazowego toluenu wynosi 50.00 kJ/mol w temperaturze T=298K. Znając standardowe entalpie tworzenia: Htw,CO2(g)(298K)=-393.77 kJ/mol i Htw,H2O(c)(298K)=-285,9 kJ/mol. obliczyć standardową entalpię spalania tego związku. Podać wynik w kJ/mol.
Piszemy reakcje i uzupełniamy współczynniki:
![]()
(delta H) = -(delta) ![]()
+7(delta) ![]()
+4(delta) ![]()
Odpowiedź: -3949.99
7
Molowa pojemność cieplna pary wodnej pod stałym ciśnieniem określa równanie: Cp=28.83+13,74*10do-3T -1.435*10do-6T2 J/molK. Ile ciepła wydzieli się podczas ochładzania 155g pary wodnej od temp 390°C do100°C pod ciśnieniem 1 atm. M h2o to 18g/mol. Podać wynik w kJ
Odpowiedź: -89.56
Cp=28,83+13.74*10^-3T-1.435*10^-6T^2
n=m/M=155/18=8,61
T1=390°C=663 K
T2=100°C=373 K
deltaH= n* całka od T1 do T2 z (28,83+13.74*10^-3T-1.435*10^-6T^2)
deltaH=8,61 [28,83*(373-663)+13.74*10^-3*(373^2-663^2)/2-1.435*10^-6*(373^3-663^3)/3]
8
Gdy 7.3 mole gazu spełniającego równanie stanu gazu doskonałego, zajmującego w temperaturze 340.5K 59dm3 poddano izotermicznemu rozprężaniu, jego entropia wzrosła o 6.6 J*K-1. Oblicz F tego procesu, wynik podaj w J.
Odpowiedź: -2247.3
Wzór: ![]()
9
Obliczyć entropię molową dwuatomowego gazu doskonałego w temperaturze 273 K, pod ciśnieniem 852630 Pa wiedząc, że molowa entropia standardowa Sº tego gazu w temperaturze 298 K wynosi 197.4 J·K-1.
Odpowiedź: 177.87
Wzór: S=S° + 5/2R ln(T/T0) - Rln p/p0
10
Gaz doskonały (liczba moli gazu wynosi 2.11) o temperaturze 308K rozprężano izotermicznie w sposób odwracalny. Jaką pracę wykonał gaz, jeśli jego ciśnienie zmalało 1.4-krotnie? Wynik podać w J.
Odpowiedź: -1817.99
Wzór: W = -nRT ln1.4
11
9.4 moli dwuatomowego gazu doskonałego znajdujących się w warunkach standardowych rozpręża się adiabatycznie przesuwając tłok obciążony ciśnieniem 53665 Pa do wyrównania ciśnień po obu stronach tłoka. Obliczyć zmianę entropii tego procesu. Wynik podać w J•K-1.
Odpowiedź: 10.19
pzew=p2
Wzór: T2 = {[pT1/p1] + [5/2T1]} / [7/2]
S = n7/2RlnT2/T1 - nRln p2/p1
12
W stalowym cylindrze o objętości 6 dm3 zamknięto 0.1 mola związku A3(g) i ogrzano do temperatury 691 K. Wiedząc, że w reakcji A3(g) = 3A(g) rozpadło się 36 % trimerów, obliczyć stałą równowagi reakcji Kp w tej temperaturze. Gazy A3 i A traktować jak gaz doskonały.
Odpowiedź: 1.8
Wzór:
A3 => 3A
początek 0,1<A3> ; 0<3A>
reakcja -ξ <A3> ; 3ξ<3A>
równowaga 0,1-ξ <A3> ; 3ξ<3A> n(tot)=0,1+2ξ=0,172
ξ=0,36*0,1=0,036
p(tot)=n(tot)RT/V=164689,25
X(A3)=n(A3)/n(tot)=0,1-0,036/0,172=0,372
X(3A)= n(3A)/n(tot)=3*0,036/0,172=0,628
Kp={[X(3A)•p(tot)/p°]^3}/{X(A3)•p(tot)/p°}=1,758
13
Reakcja 2A+B=3C+D przebiega w fazie gazowej. Gdy zmieszano 1 mol A, 2 mole B i 1 mol D, po ustaleniu się równowagi w temp. 301 k i pod ciśnieniem 2 atm, mieszanina zawierała 0.9 mola C. Oblicz ułamek molowy B w stanie równowagi.
Odpowiedź: 0.4
Wzór:
2A + B = 3C + D
n pocz 1 2 (-) 1
n reaguje -2x -x 3x x
n rowno. 1-2x 2-x 3x 1-x
ul molowe (1-2x)/(4+x) (2-x)/(4+x) 3x/(4+x) (1-x)/(4+x)
n całkowite=(1-2x)+(2-x)+3x+(1-x)= 4+x
podają nam liczność C= 3x=0.9
x=0.3
Xb=(2-x)/(4+x) Przeważnie wchodzi wynik 0.4 :P
14
Opierając się na danych z poniższej tabeli, obliczyć wartość lnKp reakcji 2A(g) + B(g) = 2C(g) w temperaturze 374 K, zakładając niezależność i od temperatury.
Odpowiedź: 6.1
...........So..........delta [H]tw
A(g)... 188 ......... 62.08
B(g) ...205.6........ 0
C(g)... 240.5........33.85
Wzór:
delta S=2C-2*A-B
delta H=2*C-2*A
A= -deltaH + TdeltaS
A=RTlnKp
lnKp=A/(R*T)
Tylko trzeba uważać na jednostki, bo przeważnie S podawane jest w [J/molK] a deltaH w [kJ/mol]!!
15
4.1 moli metanu znajdujących się w warunkach standardowych (T1=273.15, p=1,01325*105Pa) rozpręża się adiabatycznie przesuwając tłok obciążony ciśnieniem 50027Pa do wyrównania ciśnień po obu stronach tłoka. Obliczyć zmianę entropii tego procesu. Metan spełnia równanie sztywnych kul (b=42.8*10-6m3*mol-1)
Odpowiedź: 5.6
Nie bierzemy wartości temp. z nawiasu!! (standardowa to 298K); Cv metanu =>3R; Cp=>4R; pzew=p2
Wzór: T2 = {[pT1/p1] + [3T1]} / [4]
S = n4RlnT2/T1 - nRlnp2/p1
16
Oblicz zmianę energii swobodnej w kwazistatycznym procesie izotermicznego sprężania 7 moli gazu doskonałego, od ciśnienia p1 do ciśnienia p2 w temperaturze T. Wynik podaj w J.
T= const. i proces kwazistatyczny
(delta)G=-T(delta)S=-T(-nR [całka od p1 do p2]dp/p)=-T(-nRln[p2/p1])=nRT ln[p2/p1]
17
1.15 moli 1-atomowego gazu doskonałego o początkowej temperaturze 327K podlega przemianie, której towarzyszy zmiana entalpii równa -1630J. Obliczyć końcową temperaturę gazu.
Odpowiedź: 258.81
Wzór: T2=[2H+n5RT1]/[n5R]
18
4.12 moli tlenu pod początkowym ciśnieniem 52 kPa i o początkowej temperaturze 269 K rozprężało się adiabatycznie, przesuwając tłok obciążony ciśnieniem 25.1 kPa aż do wyrównania się ciśnień po obu stronach tłoka. Obliczyć pracę wykonaną przez układ. Wynik podać w dżulach, ciepło właściwe oszacować na podstawie geometrii cząsteczki tlenu. Tlen opisać równaniem stanu gazu doskonałego.
Odpowiedź: -3404.82
Wzór: T2 = {[pT1/p1] + [5/2T1]} / [7/2]
W=n5/2R(T2-T1)
Wyszukiwarka
Podobne podstrony:
Chemia fiz zad
15 wyznaczanie ciepła spalania, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy, Chem
Egzamin - chemia fizyczna (2), Egzamin chem.fiz
Chemia Fizyczna - dokumenty, Chemia fizyczna prawie wszystko, Omówić pojęcie: układ, otoczenie, para
Chemia Fizyczna - dokumenty, wyk%B3ad 8, Układy dwuskładnikowe - równowaga ciecz - para
chemia fizyczna ps, Studia, Mibm, semestr II, Chemia Fizyczna, !chemia fiz
11 wyznaczanie ciepła rozpuszczania, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy,
15 wyznaczanie ciepła spalania(1), Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy, C
31 wyznaczanie izotermy mieszania trzech cieczy, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, la
chemia fizyczna wykłady, sprawozdania, opracowane zagadnienia do egzaminu Sprawozdanie 9 chemia f
Chemia Fizyczna dokumenty fizyczna kolo
Chemia fiz - ćw. 1-2, Chemia Fizyczna
chemia fizyczna MiBM, Studia, Mibm, semestr II, Chemia Fizyczna, !chemia fiz
więcej podobnych podstron