1
ĆWICZENIE 56
Temat: Spektrofotometryczna analiza ludzkiej
hemoglobiny.
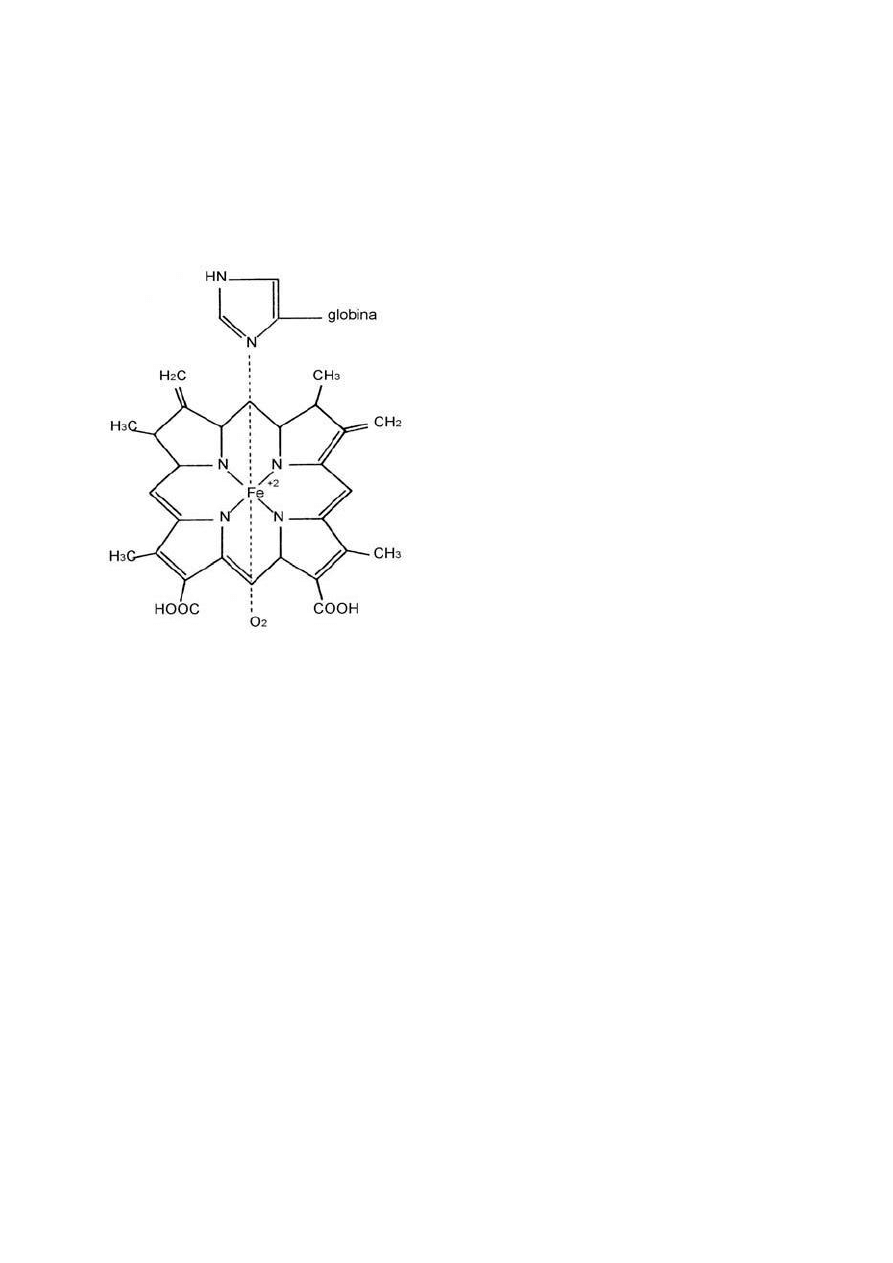
Hemoglobina jest białkiem złożonym z grupy prostetycznej zwanej hemem,
złączonej z atomem dwuwartościowego żelaza i białka prostego - globiny. Na
cząsteczkę hemoglobiny przypadają cztery
hemy (każda z nich może przyłączyć
cząsteczkę tlenu) i cztery globiny
(składającej się z czterech łańcuchów:
dwóch alfa i dwóch beta). W kapilarach płuc
hemoglobina po połączeniu się z tlenem
przybiera postać oksyhemoglobiny (HbO
2
)
(krew
utlenowana,
tętnicza),
która
następnie krążąc po całym organizmie
roznosi tlen do wszystkich tkanek. Tam
następuje odłączenie tlenu i przyłączenie
dwutlenku węgla (krew odtlenowana Hb) i
w końcu zostaje przetransportowany do
płuc, a jego miejsce zajmuje tlen.
Hemoglobina ma zdolność wiązania tlenu w
sposób odwracalny, zależny od ciśnienia
parcjalnego tego gazu. W warunkach prawidłowych l g hemoglobiny może związać
1,34 cm
3
tlenu. Proces wiązania tlenu przez hemoglobinę nazywa się utlenowaniem,
ponieważ nie towarzyszy mu zmiana stopnia utlenienia żelaza hemowego.
Wiązaniu tlenu przez hemoglobinę towarzyszy zmiana kształtu cząsteczki
polegająca na przemieszczeniu poszczególnych podjednostek względem siebie.
Spektroskopia optyczna obejmuje metody badania materii przy użyciu
promieniowania elektromagnetycznego, które może być w danym układzie
wytwarzane lub może z układem oddziaływać. Zajmuje się ona interpretacją widm.
W jednym ze sposobów pomiarów spektroskopowych, padające promieniowanie
elektromagnetyczne może oddziaływać ze składnikami układu (związki chemiczne,
jony, ugrupowania atomów, atomy i inne). Jako wynik tych oddziaływań może być
obserwowana:
a) absorpcja promieniowania elektromagnetycznego,
b) odbicie,
c) refrakcja,
d) polaryzacja,
e) rozproszenie lub wtórna emisja (luminescencja, fosforescencja czy
fluorescencja) zjawisko Ramana.
2
Zjawisko
absorpcji
stanowi
podstawę
spektrofotometrii absorpcyjnej w nadfiolecie i
zakresie
widzialnym.
Podstawowe
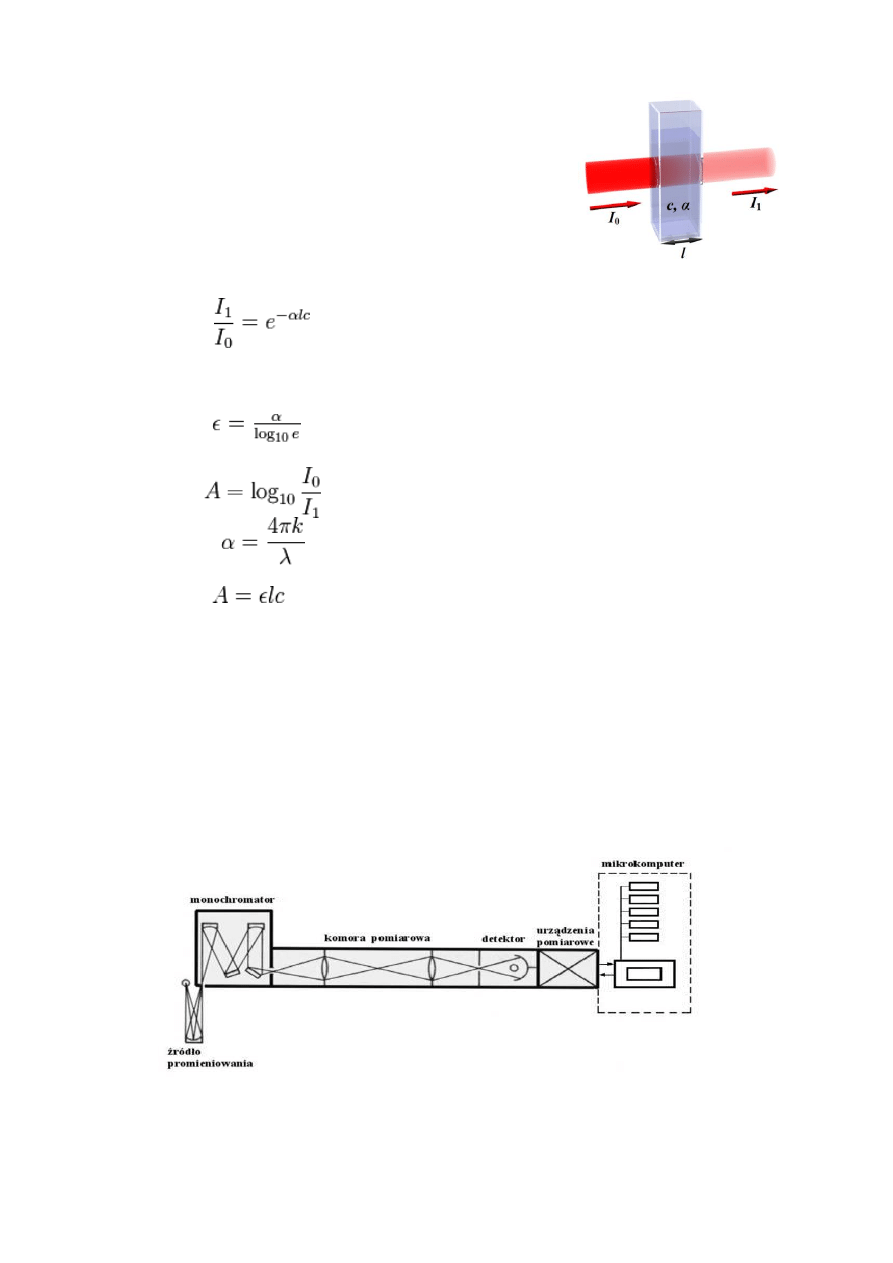
prawo
spektrofotometrii absorpcyjnej to prawo Lamberta-
Beera, które wyraża się następująco:
jeśli
to
gdzie:
A - absorbancja
I
0
–natężenie światła padającego na
ciało
I
1
- natężenie światła po przejściu
przez ciało
l - droga jaką pokonuje światło w
ciele.
c - stężenie molowe substancji
absorbującej w roztworze
α - molowy współczynnik absorpcji
zwany poprawnie absorbancją
molową
λ - długość fali pochłanianego światła
k - molowy współczynnik ekstyncji
Prawo mówi o tym, że absorbancja światła monochromatycznego jest zależna do
stężenia roztworu, do grubości
warstwy absorpcyjnej i od długości fali
pochłanianego światła.
Spektrofotometr jest urządzeniem pomiarowym, umożliwiającym pomiar
transmitancji i/lub absorbancji ciał stałych, ciekłych i gazowych w funkcji
długości fali lub liczb falowych. Ogólny schemat blokowy spektrofotometru
przedstawia rysunek poniżej
.
Schemat blokowy spektrofotometru.

3
Widma hemoglobiny
Hemoglobina występująca w formie utlenowanej jako oksyhemoglobina, badana
na spektrofotometrze wykazuje dwa maksima absorpcji w żółtej i zielonej części
widma (578nm i 540nm). Hemoglobina odtlenowana ma barwę czerwonofioletową i
jej widmo posiada jedno maksimum absorpcji przy długości fali równej 565nm.
Methemoglobina ma barwę brunatną i w widmie można obserwować cztery
maksima absorpcji dla fal o długości 631nm, 576nm, 540nm i 500nm.
Część doświadczalna
I Uruchomienie spektrofotometru.
a) Włączyć spektrofotometr (przełącznik na tylnym panelu) oraz drukarkę.
b) Odczekać 1min, aż instrument wykona autotest. Wynik testu wydrukuje
drukarka.
II Wykonanie linii bazowej.
UWAGA !!! Należy pamiętać by nie dotykać powierzchni czynnych kuwety
(powierzchnie gładkie).
a) nalać do kuwety pomiarowej wodę destylowaną (ok. 1ml)
b) umieścić kuwetę w uchwycie wewnątrz spektrofotometru tak, by przez część
przezroczystą kuwety przechodziło światło i zamknąć pokrywę pomieszczenia
pomiarowego
c) nacisnąć przycisk „SCAN”
d) z widocznego menu na wyświetlaczu, wybrać „Baseline Menu”
e) zatwierdzić przyciskiem „E” (Enter)
f) z następnego menu wybrać „Store Baseline”
g) zatwierdzić „E” (Enter)
h) wpisać i zatwierdzić parametry linii bazowej
Enter Start WL [nm]: 450
Enter End WL [nm]:
700
Enter Speed [nm/min]: 600
i) po wybraniu parametrów nacisnąć przycisk “RUN / PRINT” Odczekać, aż
instrument dokona kalibracji linii bazowej
W momencie błędnego wpisywania parametrów, można anulować aktualnie
wpisywaną wartość naciskając przycisk „C” (Cancel). W przypadku zauważenia
pomyłki po zatwierdzeniu wielkości, linię bazową należy wykonać od początku
wracając do głównego menu przez naciśnięcie przycisku „SCAN”.

4
UWAGA !!! Przed wykonaniem dalszej części ćwiczenia należy koniecznie
założyć gumowe rękawiczki.
III Obserwacja widm pochodnych hemoglobiny.
1) Powstanie hemoglobiny oraz jej przejście w kontakcie z tlenem
atmosferycznym w oksyhemoglobinę. W wyniku kontaktu hemoglobiny z
powietrzem atmosferycznym uzyskuje się jej pochodną – oksyhemoglobinę.
a) w probówce znajduje się 80x rozcieńczony preparat oksyhemoglobin
b) przenieść do kuwety (za pomocą pipetki plastikowej lub pipety automatycznej)
preparat oksyhemoglobiny (ok. 1ml)
c) nacisnąć kilkakrotnie klawisz „SCAN” do momentu pojawienia się menu
d) wybrać
„WL Scan Menu”,
„E” (Enter), a następnie
„Scan”,
„E” (Enter).
e) ustawić parametry pomiaru:
Enter Start WL [nm]:
450 “E”
Enter End WL [nm]:
700 “E”
Enter Speed [nm/min]: 600 “E“
Enter Scale [nm/cm]:
25
“E“
Enter min Abs:
0.00 “E“
Enter max Abs:
2.00 “E“
f) wcisnąć przycisk „RUN / PRINT“. W celu obejrzenia całego wykresu na
wyświetlaczu użyj przycisków strzałek:
Lewo
←
,
Prawo →.
g) wydrukować wynik używając przycisku „RUN / PRINT”. Przejście do
następnego pomiaru bez drukowania następuje przez naciśnięcie przycisku
„NEXT”
h) wyniki zapisać w tabeli 1 (długości fali i absorbancja dla oksyhemoglobiny)
UWAGA !!! Należy zachować szczególną ostrożność w czasie pracy z tym
odczynnikiem chemicznym.
i) wyjąć kuwetę ze spektrofotometru
j) korzystając z dozownika dodać do kuwety, zawierającej preparat
oksyhemoglobiny, szczyptę ditioninu sodu (szczyptę określa asystent)
k) wymieszać pipetką plastikową
l) wykonać widmo (patrz punkt c) i wydrukować wynik ( w 2 powtórzeniach)
m) wartość charakterystycznej długości fali i maksymalnej absorbancji dla
hemoglobiny zapisać w tabeli nr 1
5
n) wyjąć kuwetę i przez 1 min mieszać próbkę plastikową pipetą nabierając cały
płyn i wypuszczając go powoli kroplami
o) wykonać następny pomiar widma
p) powtarzać punkt l i m do momentu, aż otrzymane widmo będzie przypominało
widmo oksyhemoglobiny
q) wyniki zapisać w tabeli nr 1
UWAGA !!! Należy pamiętać o dokładnym przepłukaniu kuwety przed
przystąpieniem do pomiaru widma methemoglobiny.
2)
Methemoglobina
a) umieścić w kuwecie 1ml 80 x rozcieńczonego preparatu oksyhemoglobiny
b) podać do kuwety 15-20µl 0,16% żelazicjanku potasu, wymieszać pipetką
plastikową
c) wykonać pomiar widma i wydruk wyników
d) wyniki zapisać w tabeli nr 1
Tabela 1.
λ
A
SCAN( nr)
oksyhemoglobina
1
2
hemoglobina
1
oksyhemoglobina
1
2
methemoglobina
1
2
3
4
Sprawozdanie powinno zawierać:
1. Załączone i opisane wykresy widm absorbcji uzyskane dla hemoglobiny i
wszystkich jej pochodnych.
2. Tabele pomiarowe.
3. Wnioski.
Literatura:
1. Kłyszejko –Stefanowicz L.
Ćwiczenia z biochemii PWN Warszawa-Poznań
1980r.
2. Nowicka-Janowska T.
Spektofotometria UV/VIS w analizie chemicznej PWN
Warszawa 1988r.
Wyszukiwarka
Podobne podstrony:
Ćwiczenie nr 56(1)
Ćwiczenia nr 6 (2) prezentacja
cwiczen
Cwiczenie nr 8 Teksty id 99954
Cwiczenia nr 2 RPiS id 124688 Nieznany
Cwiczenia nr 10 (z 14) id 98678 Nieznany
Ćwiczenie nr 1 (Access 2007)
cwiczenie nr 8F
Cwiczenie nr 2 Rysowanie precyzyjne id 99901
Cwiczenia nr 1 z l Zepoloych do
CWICZENIE NR 4 teoria
ćwiczenie nr 4
więcej podobnych podstron