
1
UNIWERSYTET ŚLĄSKI W KYTOWICYCH
I PRACOWNIA FIZYCZNA
Ć W I C Z E N I E NR 31
POMIYR CIEPŁY MOLOWEGO POWIETRZY
METODĄ ROZŁYDOWYNIY KONDENSYTORY
ZAGADNIENIA DO KOLOKWIUM WSTĘPNEGO
-gaz doskonały, gaz rzeczywisty, izoprocesy gazu doskonałego
-I zasada termodynamiki, zasada ekwipartycji energii, liczba stopni swobody
-pojemność cieplna gazów, ciepła molowe
c
p
i c
v
-energia naładowanego kondensatora
-pomiar ciśnienia gazu metodą manometru cieczowego (U-rurki).
OPIS ĆWICZENIA
Energia zgromadzona w naładowanym kondensatorze służy do podgrzania powietrza
wypełniającego objętość izolowanego zbiornika ( temosu ). Przekaz energii następuje metodą
rozładowania się kondensatora poprzez spiralę grzejną znajdującą się wewnątrz termosu. Mierząc
zmianę ciśnienia powietrza w termosie
∆p
przy pomocy manometru cieczowego i znając parametry
elektryczne kondensatora możemy obliczyć wartość
c
v
dla powietrza. W obliczeniach korzystamy
z wykresu
∆p
(U
2
)
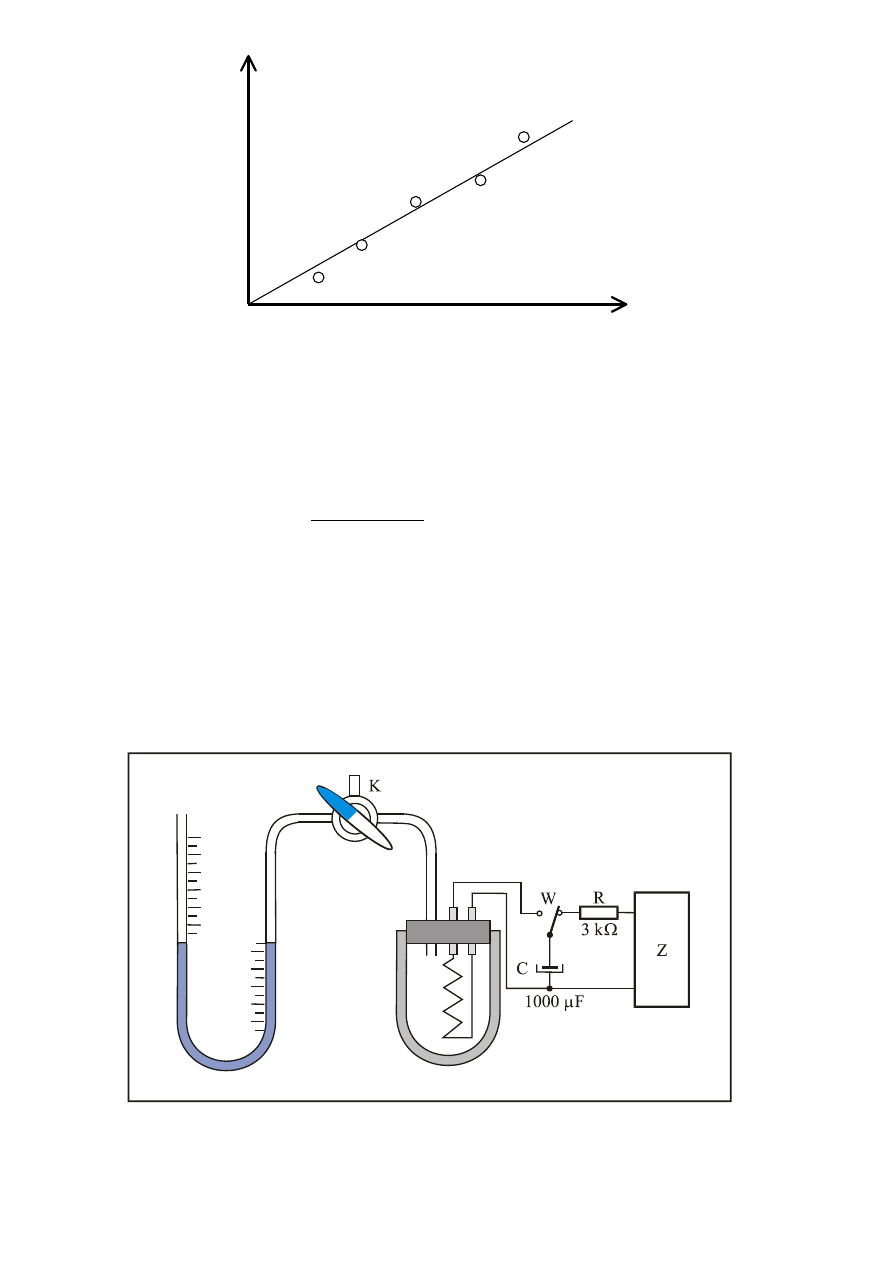
otrzymanego z wyników pomiarowych. Przykładowy wykres zawiera rys. 1.
APARATURA
-zestaw do pomiaru ciepła molowego
-zasilacz prądu stałego
-dwa przewody wysokonapięciowe
WZORY SCHEMATY
ENERGIA NAŁADOWANEGO KONDENSATORA:
2
2
1
CU
E
C
=
(31. 1.)
C
-pojemność kondensatora
U
-napięcie
PRZYROST ENERGII GAZU, PRZY V=const.

2
T
C
n
E
v
∆
⋅
⋅
=
∆
( 31.2.)
n
-ilość moli gazu w objętości V
C
V
-ciepło molowe przy V=const.
∆
-przyrost temperatury
Z RÓWNANIA STANU GAZU DOSKONAŁEGO OTRZYMUJEMY:
R
n
V
p
T
⋅
⋅
∆
=
∆
(31.3.)
∆p -przyrost ciśnienia
V
-objętość gazu (= 212ml ± 5ml )
R
-stała gazowa ( = 8,31 J/mol
.
K
Podstawiając
( 3.)
do
( 2.)
:
R
V
p
C
E
V
⋅
∆
⋅
=
∆
(31.4.)
SPRAWNOŚĆ POZYSKANIA ENERGII CIEPLNEJ PRZEZ GAZ WYNOSI:
C
E
E
∆
=
η
(31.5.)
Po podstawieniu
( 1. )
i
( 4. )
do
( 5.)
otrzymujemy:
p
U
V
R
C
C
v
∆
⋅
⋅
⋅
=
2
2
η
(31.6.)
Wartość
p
U
∆
2
wyznaczamy z wykresu / ∆p=(U
2
) /
3
Rys.1. Przykładowy wykres zależności
∆∆∆∆p
(
U
2
)
.
2
aU
P
=
∆
(31. 7.)
a
- nachylenie prostej na wykresie zależności ∆
P
=f (U
2
)
a
V
R
C
C
V
⋅
⋅
⋅
⋅
=
2
η
( 31.8.)
PRZYROST CIŚNIENIA GAZU W OBJĘTOŚCI V (
mierzony manometrem cieczowym
rys. 2
.)
WYNOSI:
h
g
p
⋅
⋅
=
∆
ρ
( 31.9.)
g = 9,81 m/s
2
gęstość cieczy w manometrze cieczowym
ρ = 700 kg/m
3
Rys. 2. Schemat zestawu do pomiaru ciepła molowego powietrza
∆∆∆∆p
U
2
4
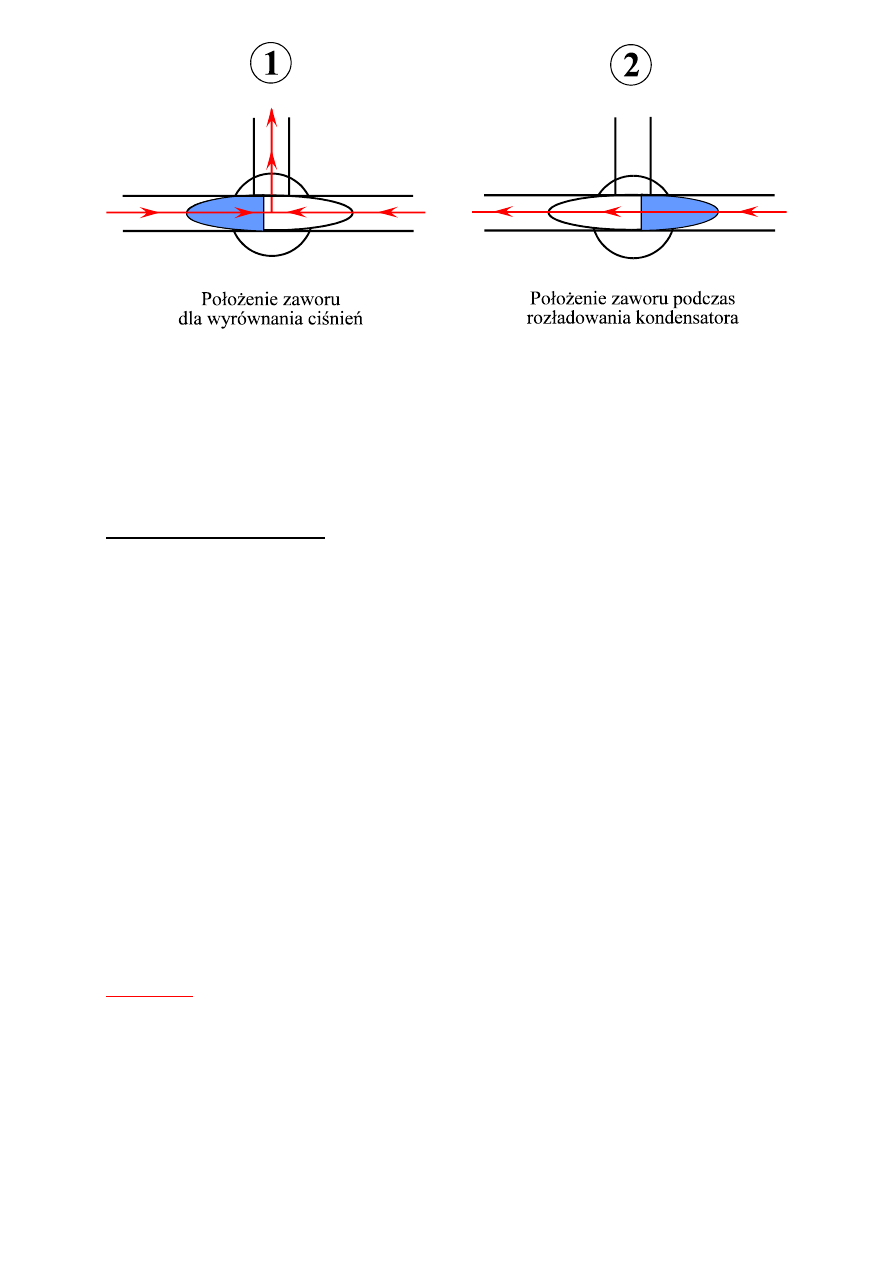
Rys. 3 Schemat przepływu powietrza przez kran trójdrożny w zależności od położenia
pokrętła zaworu
WYKONANIE ĆWICZENIA
1. Zapoznać się z zestawem pomiarowym i obsługą zaworu kranu trójdrożnego ( rys.3.)
2. Podłączyć zestaw pomiarowy do zasilacza prądu stałego
zwracając uwagę na biegunowość!
3. Wyrównać ciśnienie w objętości
V
z ciśnieniem atmosferycznym ( zawór w pozycji
„1”
).
4. a) Ustawić w zasilaczu przełącznik odczytu na napięcie
U
. Ustawić pokrętłem
W
żądaną wartość napięcia
U
min
=100V.
b) Ustawić przełącznik odczytu zasilacza na prąd
I [mA]
.
c) Ustawić przełącznik na płycie zestawu w pozycji
ŁADOWANIE
, naładować
kondensator, aż wskaźnik odczytu prądu zasilacza wskaże minimum 1mA.
5. Ustawić zawór kranu trójdrożnego w pozycji
„2”
6. Rozładować kondensator (przełącznik w pozycji
ROZŁADOWANIE
), odczytać
różnicę poziomów cieczy w manometrze cieczowym
h.
7. Czynności z pkt.3-5 wykonać wielokrotnie dla ustalonego napięcia
U
.
8. Wykonać pomiary ( pkt.3-8 ) dla kolejnych napięć, aż do
U
max
=300V.
UWAGA!!!
-w czasie podłączania do zestawu zasilacz powinien być
WYŁĄCZONY Z SIECI!
-ostrożnie przekręcać zawór kranu trójdrożnego (SZKŁO JEST KRUCHE)
-ilość pomiarów w pkt.7 i 8 ustalić z prowadzącym na podstawie serii pomiarów próbnych.

5
OBLICZENIA
1. Dla każdego napięcia obliczyć wartości średnie
h
i niepewność pomiarową
∆∆∆∆h
.
2. Korzystając ze wzoru ( 31.9. ) obliczyć wartość przyrostu ciśnienia
∆∆∆∆p
i niepewność
pomiarową.
3. Obliczyć wartość
U
2
i niepewność pomiarową
∆∆∆∆U
2
.
4. Obliczenia z pkt 1-3 powtórzyć dla wszystkich ustalonych napięć.
5. Wykreślić zależność
∆∆∆∆p
od
U
2
( wg rys. 1.).
6. Wyznaczyć nachylenie prostej
a
na wykresie metodą regresji liniowej i określić
niepewność pomiarową
∆∆∆∆a.
7. Obliczyć wartość ciepła molowego powietrza
C
v
( wzór 31.8.) i niepewność pomiarową
∆∆∆∆C
v
, przyjmując η = 11%.
LITERATURA
1. S. Szczeniowski, „FIZYKA DOŚWIADCZALNA”, t. II, PWN Warszawa 1972 .
2. D. Hallidday, R. Resnick, „FIZYKA” ,t.I, PWN Warszawa 1989.

6
Wyszukiwarka
Podobne podstrony:
ĆWICZENIE NR 31, BIOTECHNOLOGIA POLITECHNIKA ŁÓDZKA, CHEMIA FIZYCZNA
Ćwiczenie nr 31, sprawozdania, Fizyka - Labolatoria, Ćwiczenie nr31
Ćwiczenie nr 31
Ćwiczenia nr 6 (2) prezentacja
cwiczenie nr 7F
cwiczenie nr 2
Ćwiczenie nr 4
cwiczenia nr 5 Pan Pietrasinski Nieznany
cwiczenia nr 7
Cwiczenie nr 8 Teksty id 99954
Cwiczenia nr 2 RPiS id 124688 Nieznany
Cwiczenia nr 10 (z 14) id 98678 Nieznany
Ćwiczenie nr 1 (Access 2007)
cwiczenie nr 8F
Cwiczenie nr 2 Rysowanie precyzyjne id 99901
Foliogram nr 31
więcej podobnych podstron