
Z. Kąkol-Notatki do Wykładu z Fizyki
Wykład 34
34. Fale i cząstki
34.1 Fale
materii
Omawiane na poprzednich wykładach doświadczenia były interpretowane raz
w oparciu o obraz falowy (np. dyfrakcja) innym razem w oparciu o model cząsteczko-
wy (np. efekt Comptona).
Jeżeli światło ma dwoistą falowo-cząsteczkową naturę, to być może materia też ma taką
dwoistą naturę. Taką sugestię zaprezentował w 1924 L. de Broglie min. w oparciu ob-
serwację, że Wszechświat składa się wyłącznie ze światła i materii oraz że pod wieloma
względami przyroda jest zadziwiająco symetryczna. Chociaż materię traktowano jako
cząstki de Broglie zasugerował, że należy zbadać czy materia nie wykazuje również
własności falowych.
De Broglie nie tylko zaproponował istnienie fal materii ale również przewidział ich
długość. Założył, że długość przewidywanych fal materii jest określona tym samym
związkiem, który stosuje się do światła.
Analizując zderzenie fotonu z elektronem (efekt Comptona) zastosowano do tego
zderzenia zasadę zachowania pędu. Do tych obliczeń potrzebne było wyrażenie na
pęd
fotonu
.
λ
λ
h
c
hc
c
hv
c
E
mc
p
f
=
=
=
=
=
(34.1)
Analogiczne wyrażenie zostało zaproponowane przez de Broglia dla fal materii
p
h
=
λ
(34.2)
Wyrażenie to wiąże teraz pęd cząstki materialnej z długością przewidywanych fal mate-
rii.
Przykład 1
Jaką długość fali przewiduje równanie (34.2) dla obiektów „masywnych” np. dla piłki,
o masie 1 kg, poruszającej się z prędkością 10 m/s, a jaką dla „lekkich” np. elektronów
przyspieszonych napięciem 100 V?
Dla piłki p= m
v
= 1 kg·10 m/s = 10 kg m/s
Stąd długość fali de Broglie’a
m
10
6
.
6
kgm/s
10
Js
10
6
.
6
35
34
−
−
⋅
=
⋅
=
=
p
h
λ
Ta wielkość jest praktycznie równa zeru zwłaszcza w porównaniu z rozmiarami obiek-
tu. Doświadczenia prowadzone na takim obiekcie nie pozwalają więc na rozstrzygnięcie
czy materia wykazuje własności falowe (
λ zbyt mała). Przypomnijmy, że falowy cha-
34-1
Z. Kąkol-Notatki do Wykładu z Fizyki
rakter światła przejawia się gdy wymiary liniowe obiektów są porównywalne z długo-
ścią fali.
Natomiast elektrony przyspieszone napięciem 100 V uzyskują energię kinetyczną
E
k
= eU = 100 eV = 1.6·10
-17
J
Prędkość jaką uzyskują elektrony wynosi
s
m
10
9
.
5
kg
10
1
.
9
J
10
6
.
1
2
2
6
31
17
⋅
=
⋅
⋅
⋅
=
=
−
−
m
E
k
v
Odpowiednia długość fali de Broglie’a wynosi
nm
12
.
0
m
10
2
.
1
s
m
kg
10
*
9
.
5
10
1
.
9
Js
10
6
.
6
10
6
31
34
=
⋅
=
⋅
⋅
⋅
=
=
=
−
−
−
v
m
h
p
h
λ
Jest to wielkość rzędu odległości między atomowych w ciałach stałych.
Można więc zbadać falową naturę materii (tak jak promieni Roentgena) skierowując
wiązkę elektronów, o odpowiedniej energii, na kryształ. Takie doświadczenie przepro-
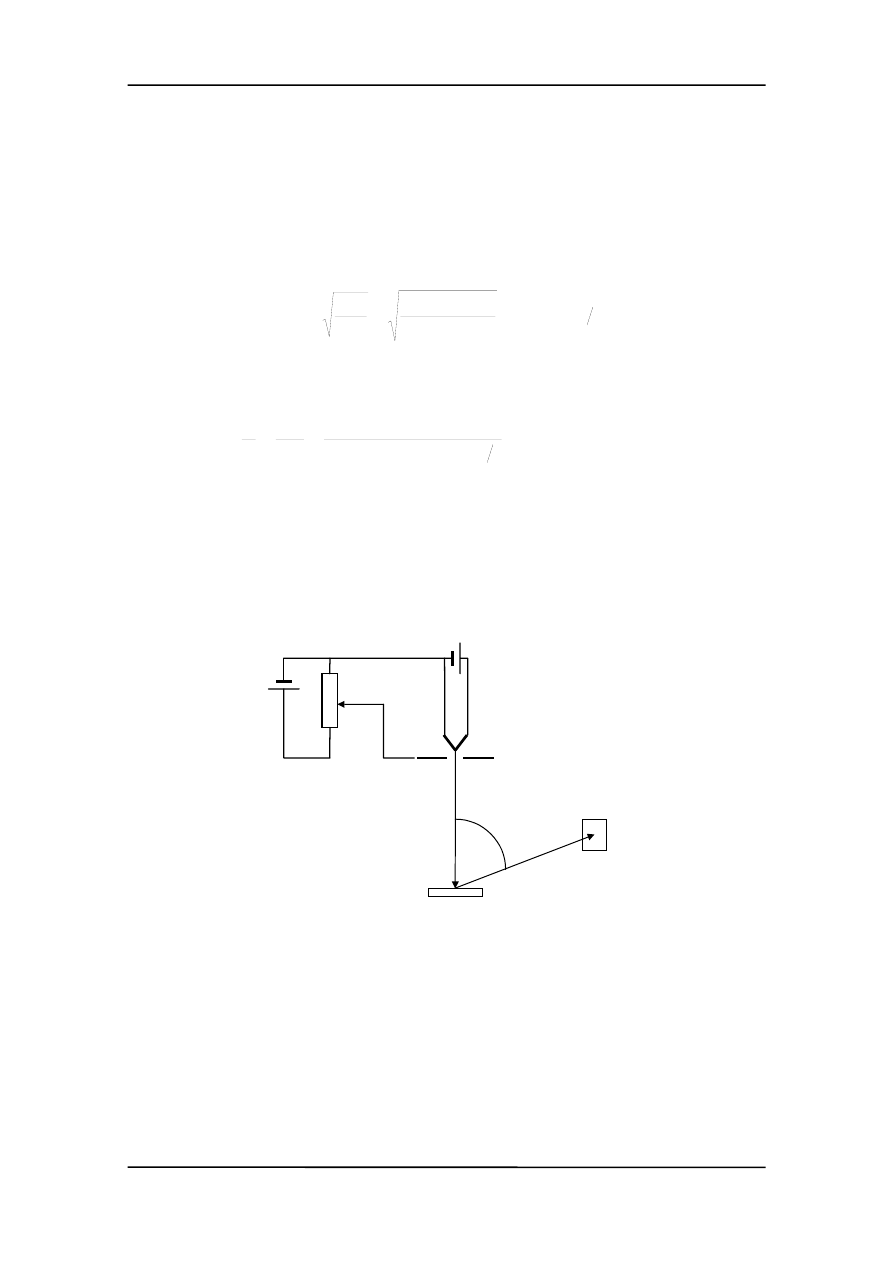
wadzili w 1961 roku Davisson i Germer w USA oraz Thomson w Szkocji. Na rysunku
przedstawiono schemat aparatury pomiarowej.
włókno
wiązka
padająca
wiązka
odbita
kryształ
detektor
ϕ
Elektrony emitowane z ogrzewanego włókna przyspieszane są regulowanym napięciem.
Wiązka zostaje skierowana na kryształ niklu a detektor jest ustawiony pod pewnym
szczególnym kątem
ϕ. Natężenie wiązki ugiętej na krysztale jest odczytywane przy
różnych napięciach przyspieszających. Okazuje się, że prąd w detektorze ujawnia mak-
simum dyfrakcyjne przy kącie równym 50° dla U = 54 V.
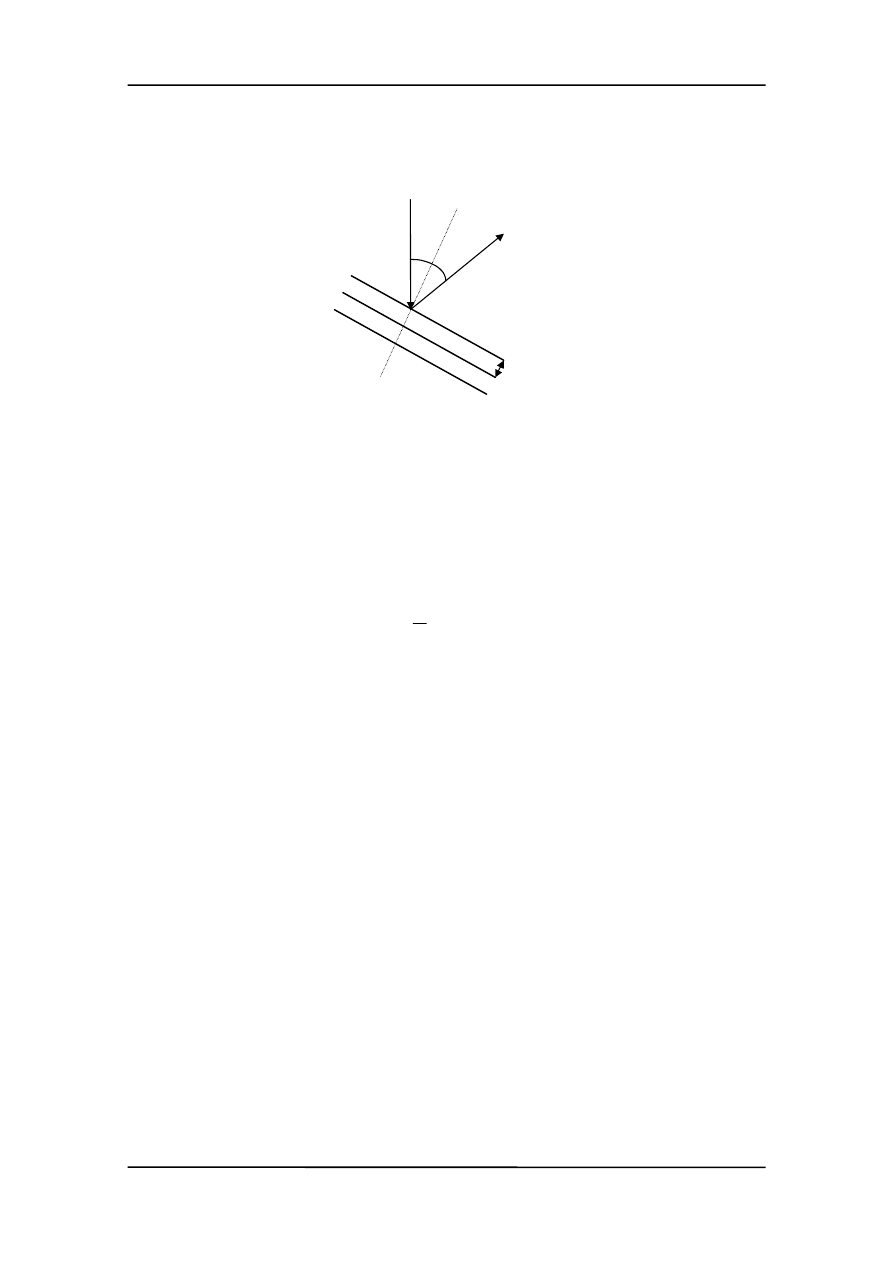
Jeżeli skorzystamy z prawa Bragga możemy obliczymy wartość
λ, dla której obserwu-
jemy maksimum w tych warunkach
θ
λ
sin
2d
=
34-2
Z. Kąkol-Notatki do Wykładu z Fizyki
Dla niklu d = 0.091 nm. Ponieważ
ϕ = 50° więc θ = 90° - ϕ/2 = 65° (rysunek).
ϕ
θ
d
Długość fali obliczona w oparciu o te dane wynosi:
λ = 2·0.091 nm·sin65° = 0.165 nm
Teraz w oparciu o znaną energię elektronów (54 eV) obliczymy długość fali de Bro-
glie’a analogicznie jak w przykładzie 1
nm
165
.
0
=
=
p
h
λ
Ta doskonała zgodność stanowiła argument za tym, że w pewnych okolicznościach
elektrony wykazują naturę falową.
Dzisiaj wiemy, że inne cząstki, zarówno naładowane jak i nienaładowane, wykazują
cechy charakterystyczne dla fal. Dyfrakcja neutronów jest powszechnie stosowaną
techniką eksperymentalną używaną do badania struktury ciał stałych.
Tak więc, zarówno dla materii, jak i dla światła, musimy przyjąć istnienie dwoistego ich
charakteru.
34.2 Struktura atomu i fale stojące
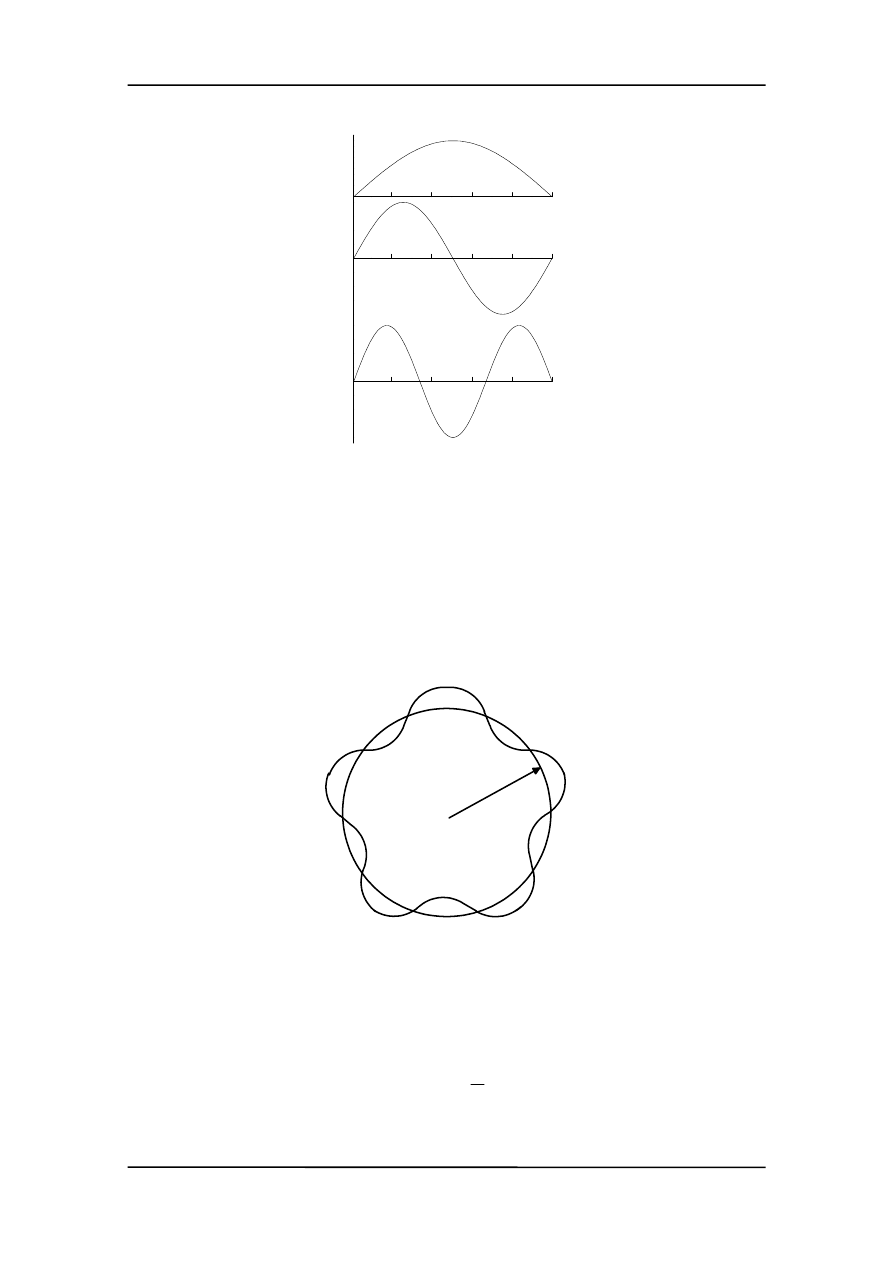
Jeżeli na ruch fali nie ma żadnych ograniczeń to fala może mieć dowolną długość.
Inaczej sytuacja przedstawia się gdy ruch fal zostanie ograniczony przez nałożenie
pewnych warunków fizycznych. Np. dla fal w strunie odpowiada to wyodrębnieniu od-
cinka struny zamocowanego na obu końcach (np. struna w skrzypcach).
Występują wtedy dwie ważne różnice:
• ruch jest teraz opisywany przez
falę stojącą
(a nie bieżącą),
• mogą występować tylko pewne długości fal tzn. mamy do czynienia
z kwantyzacją
długości fali wynikającą z ograniczeń nałożonych na falę (rysunek poniżej).
Na rysunku widać trzy pierwsze stany kwantowe dla drgającej struny.
34-3
Z. Kąkol-Notatki do Wykładu z Fizyki
l
0
n = 1
0
l
n = 3
0
l
n = 2
Jeżeli więc ruch elektronów jest ograniczony w atomach to możemy się spodziewać
przez analogię, że:
• ruch elektronów może być opisany przez
stojące fale materii
,
• ruch ten zostaje
skwantowany
.
Rysunek poniżej przedstawia stojącą falę materii związaną z orbitą o promieniu r. Dłu-
gość fali de Broglie’a została dobrana tak, aby orbita o promieniu r zawierała całkowitą
liczbę n fal materii.
r
Wtedy otrzymujemy
λ
π
n
r =
2
czyli
p
h
n
r
=
π
2
Prowadzi to natychmiast do
34-4

Z. Kąkol-Notatki do Wykładu z Fizyki
,....
3
,
2
,
1
2
=
=
=
n
h
n
pr
L
π
Warunek kwantyzacji Bohra jest teraz konsekwencją przyjęcia, że elektron jest repre-
zentowany przez odpowiednią falę materii i zastosowania odpowiednich warunków
brzegowych.
34.3 Mechanika
falowa
W 1926 roku E. Schrödinger sformułował
mechanikę falową
(jedno ze sformułowań
fizyki kwantowej) min. w oparciu o założenie, że stacjonarne stany w atomach odpo-
wiadają
stojącym falom materii
.
Dla fal w strunie zaburzenie może być opisane za pomocą poprzecznego wychylenia y,
dla fal elektromagnetycznych poprzez wektor natężenia pola elektrycznego E.
Analogiczną miarą dla fal materii jest
funkcja falowa
ψ
.
Teraz spróbujemy znaleźć taką funkcję dla prostego zagadnienia ruchu cząstki o masie
m pomiędzy sztywnymi ściankami odległymi o l.
Funkcję falową można otrzymać przez analogię do zagadnienia struny umocowanej na
obu końcach. Z warunków brzegowych wynika, że na obu końcach struny muszą wy-
stępować węzły. Oznacza to (przez to żądanie)
że długość fali jest skwantowana
:
...
,
2
,
1
2
lub
2
=
=
=
n
n
l
n
l
λ
λ
Zaburzenie falowe dla struny jest opisane przez falę stojącą (Wykład 15)
y(x,t) = 2Asinkxcos
ωt
dla której rozkład przestrzenny (amplitudy) jest dany przez
y(x) = Asinkx
gdzie k = 2
π/λ. Ponieważ λ jest skwantowane to k też jest skwantowane.
Prowadzi to do warunku
,......
2
,
1
,
sin
=
=
n
l
x
n
A
y
π
Wykres tej funkcji dla n =1, 2, 3 pokazany jest na stronie 34-4.
Rozważmy teraz cząstkę poruszającą się pomiędzy sztywnymi ściankami (rysunek na
następnej stronie)
Ponieważ ścianki są sztywne, cząstka nie może przeniknąć przez nie, tak więc stojąca
fala materii opisująca tę cząstkę ma węzły na ściankach. Inaczej mówiąc funkcja falowa
ψ przyjmuje wartość zero w punktach x = 0 i x = l.
34-5
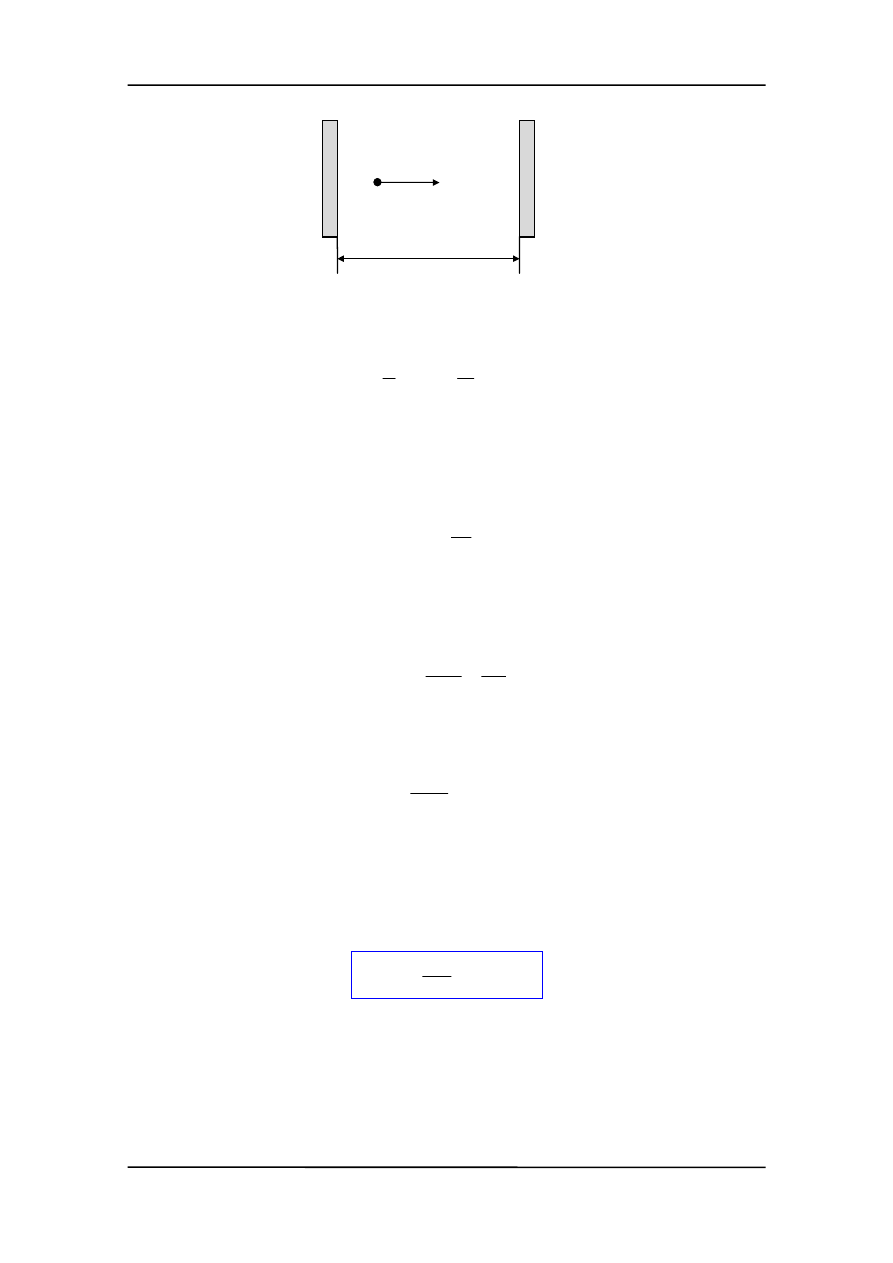
Z. Kąkol-Notatki do Wykładu z Fizyki
l
m
v
W konsekwencji dopuszczalne fale materii muszą mieć długość fal danych równaniem
...
,
2
,
1
,
2
lub
2
=
=
=
n
n
l
n
l
λ
λ
Ponieważ mówimy o fali materii (reprezentującej cząstkę) to jest to po prostu fala de
Broglie’a, dla której możemy zastąpić
λ przez h/p.
Prowadzi to do związku
l
nh
p
2
=
Widzimy, że
pęd cząstki uwięzionej pomiędzy ściankami jest skwantowany
.
Dla cząstki pęd p jest związany z energią kinetyczną E
k
relacją
m
p
m
E
k
2
2
2
2
=
= v
Zestawienie tego równania z równaniem na pęd cząstki prowadzi do warunku kwanty-
zacji energii
......
,
2
,
1
,
8
2
2
2
=
=
n
ml
h
n
E
Cząstka nie może mieć dowolnej energii (jak w obrazie klasycznym) ale ściśle określo-
ne wartości dane powyższym równaniem.
Amplituda fal materii zmienia się tak samo jak amplituda dla fali stojącej w strunie tzn.
jest dana analogicznym równaniem:
,......
2
,
1
,
sin
=
=
n
l
x
n
A
π
ψ
(34.3)
34.4 Znaczenie
funkcji
ψ
Funkcję
ψ skonstruowaliśmy przez analogię do funkcji opisującej amplitudę fali sto-
jącej w strunie. Ale nie wyjaśniony jest jeszcze sposób w jaki
ψ przedstawia ruch cząst-
34-6

Z. Kąkol-Notatki do Wykładu z Fizyki
ki. Wiemy już, że długość fali materii (de Broglie’a) wiąże się bezpośrednio z pędem
cząstki. Pozostaje wyjaśnić z czym wiąże się
ψ.
Jako pierwszy fizyczną interpretację funkcji falowej podał Max Born. Zasugerował, że
wielkość
ψ
2
w dowolnym punkcie przedstawia miarę prawdopodobieństwa, że cząstka
znajdzie się w pobliżu tego punktu tzn. w jakimś obszarze wokół tego punktu np. w prze-
dziale x, x+dx
.
Ta interpretacja funkcji
ψ daje statystyczny związek pomiędzy falą i związaną z nią
cząstką. Nie mówimy gdzie cząstka jest ale gdzie prawdopodobnie się znajdzie
.
Tak więc dla cząstki poruszającej się pomiędzy dwoma ściankami odległymi o l
,......
2
,
1
,
sin
2
2
=
=
n
l
x
n
A
π
ψ
(34.4)
nie opisuje położenia cząstki ale
rozkład (gęstość) prawdopodobieństwa
.
Na rysunku przedstawiona jest zależność
ψ
2
(x) dla trzech pierwszych stanów ruchu
cząstki.
ψ
2
0
l
n = 2
E
2
= 4E
1
X
0
l
n = 3
E
3
= 9E
1
l
0
n = 1
E
1
= h
2
/ 8m
Zwróćmy uwagę, że przykładowo dla n = 1 cząsteczka ma większą tendencję (prawdo-
podobieństwo) do przebywania w środku niż przy ściankach. Jest to sprzeczne z fizyką
klasyczną, która przewiduje jednakowe prawdopodobieństwo przebywania cząstki
gdziekolwiek pomiędzy ściankami (linie poziome na rysunku). Podobnie jest dla wyż-
szych n. Oczywiście całkowite prawdopodobieństwo znalezienia cząstki pomiędzy
ściankami jest równe jedności.
34-7
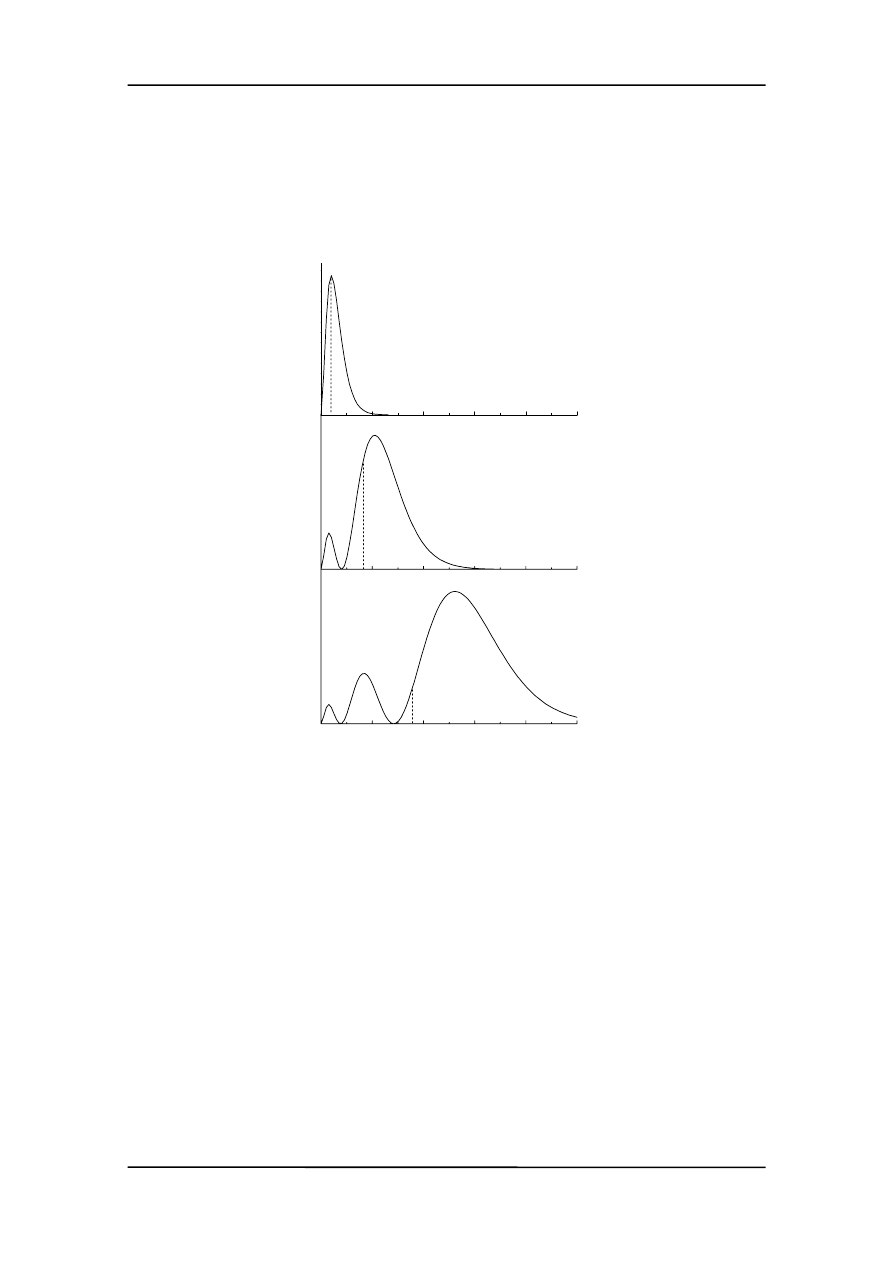
Z. Kąkol-Notatki do Wykładu z Fizyki
Zagadnienie cząstki poruszającej się pomiędzy sztywnymi ściankami ma mało realne
zastosowanie w fizyce. Dlatego poniżej pokazane są wyniki zastosowania mechaniki
falowej do problemu atomu wodoru.
Sam problem jest trudny matematycznie. Dlatego pokazane są tylko wyniki zależności
ψ(r) dla n = 1, 2, 3 dla orbitalnej liczby kwantowej l = 0, (rozkład sferycznie syme-
tryczny).
n =1
0
5
10
15
20
25
r/r
Bohra
n = 3
n = 2
ψ
(r)
2
Widać, że mamy ponownie do czynienia z rozkładem prawdopodobieństwa. Istnieje ob-
szar w którym elektron może przebywać (z niezerowym prawdopodobieństwem). Mó-
wimy o
orbitalach
zamiast o orbitach.
Linią przerywaną zaznaczono promienie orbit przewidywane w modelu Bohra.
Są, jak widać orbity dla których ta wartość odpowiada maksimum prawdopodobieństwa
znalezienia elektronu.
34.5 Zasada
odpowiedniości
Chociaż teorie w fizyce mają ograniczenia to zazwyczaj w sposób ciągły dają wyni-
ki coraz mniej zgodne od doświadczenia, tzn. nie „urywają” się nagle.
Np. mechanika Newtonowska staje się coraz mniej dokładna gdy prędkość zbliża się do
prędkości światła.
Dla mechaniki kwantowej też istnieje taka granica. Fizyka kwantowa przechodzi w fi-
zykę klasyczną dla dużych liczb kwantowych. To twierdzenie nazywamy
zasadą odpo-
wiedniości
.
34-8
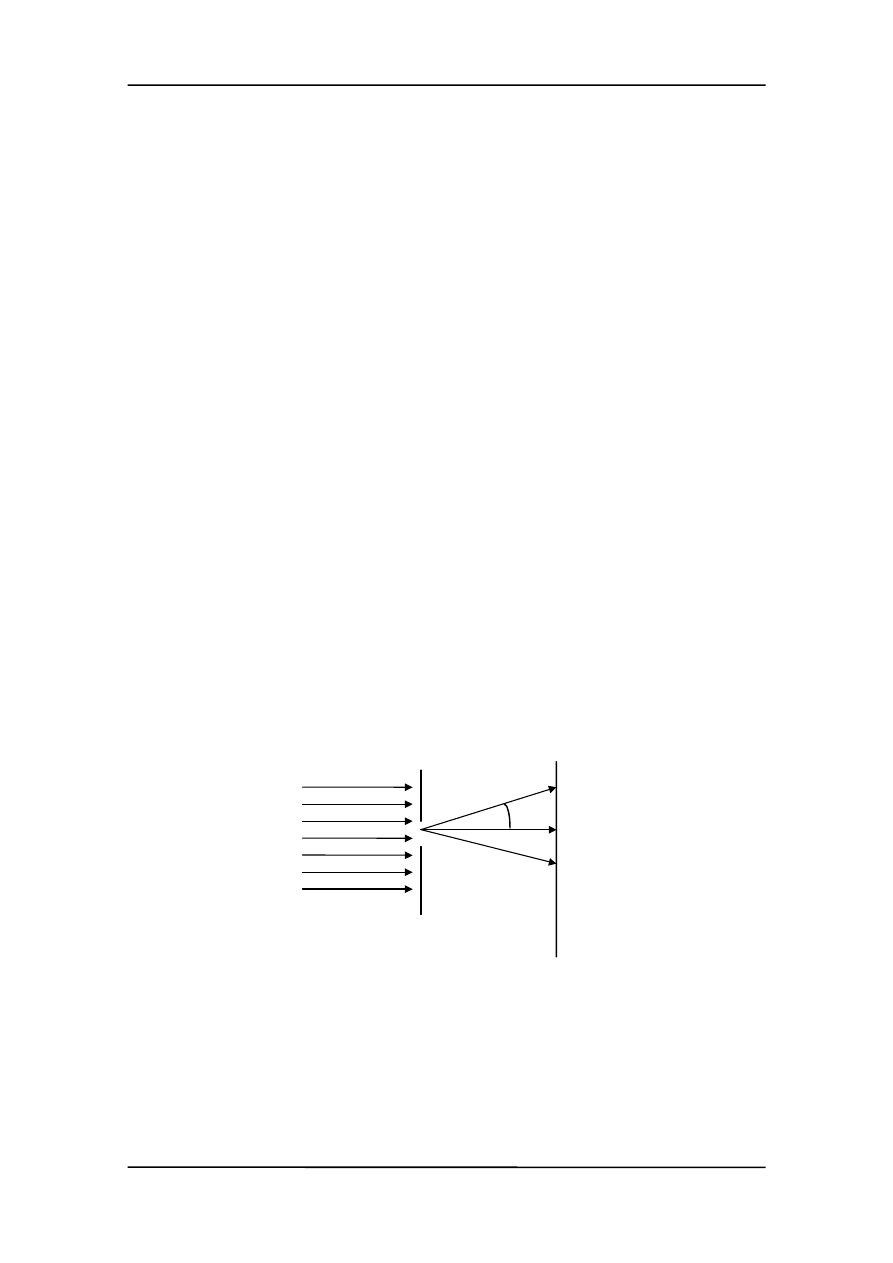
Z. Kąkol-Notatki do Wykładu z Fizyki
W przykładzie z wykładu 31 widzieliśmy, że dla makroskopowego wahadła nie uwi-
dacznia się natura kwantowa podobnie jak w układach makroskopowych nie widzimy
dyskretnej natury materii (cząsteczek, atomów, elektronów itp.).
Wyliczona wtedy względna zmiana energii wyniosła
∆E/E = 4.7·10
-31
= hv/nhv
Stąd otrzymujemy bardzo dużą wartość liczby kwantowej n
≈ 2·10
30
; możemy stosować
mechanikę klasyczną.
34.6 Zasada
nieoznaczoności
W poprzednim paragrafie najbardziej szczegółową informacją jaką udało się uzy-
skać o ruchu elektronów były krzywe prawdopodobieństwa. Czy musimy zadowolić się
taką informacją czy też jest możliwy pomiar, który da nam odpowiedź na temat ewen-
tualnych orbit po których poruszają się elektrony?
Obserwacje przedmiotów opierają się na rejestrowaniu światła odbitego przez te przed-
mioty. Światło w „zderzeniu” z przedmiotem o dużej masie praktycznie nie zaburza je-
go ruchu, ale całkiem inną sytuację mamy w przypadku elektronów. Tutaj też spodzie-
wamy się, że zobaczymy elektron gdy odbijemy od niego światło (tak jak widzimy np.
stół rejestrując światło odbite od niego). W tym jednak przypadku elektron w zderzeniu
z fotonem dozna odrzutu, który całkowicie zmieni jego ruch (przypomnijmy sobie efekt
Comptona). Zmiany tej nie można uniknąć ani dokładnie ocenić. Gdyby więc istniały
orbity to byłyby one całkowicie niszczone przy próbie pomiarów mających potwierdzić
ich istnienie. Dlatego wolimy mówić o prawdopodobieństwie niż o orbitach.
Aby przetestować nasze możliwości pomiarowe rozważmy wiązkę elektronów pa-
dających z prędkością
v
0
na szczelinę o szerokości
∆y, tak jak na rysunku.
v
0
∆y
θ
a
Jeżeli elektron przechodzi przez otwór to znamy jego położenie z dokładnością
∆x.
Elektrony ulegają ugięciu na szczelinie tak, że na ekranie obserwujemy obraz dyfrak-
cyjny. Oznacza to, że elektrony mają teraz oprócz prędkości poziomej także składową
w kierunku y (są odchylone). Spróbujmy ocenić tę składową pionową prędkości. Rozpa-
trzmy np. elektron padający na ekran w miejscu pierwszego minimum dyfrakcyjnego
(punkt a na rysunku poniżej). Pierwsze minimum jest dane równaniem
34-9

Z. Kąkol-Notatki do Wykładu z Fizyki
∆ysin
θ = λ
a dla małego kąta
∆y
θ ≅ λ
Aby elektron doleciał do punkt a (1-sze minimum) musi mieć prędkość pionową
∆
v
y
taką, że
0
sin
v
v
y
∆
=
≅
θ
θ
Korzystając z obu powyższych równań otrzymujemy
y
y
∆
=
∆
λ
0
v
v
lub inaczej
∆
v
y
∆y =
λ
v
0
Długość fali wiązki elektronowej jest dana przez h/p czyli h/m
v
0
. Podstawiając to do
ostatniego równania otrzymujemy
0
0
v
v
v
m
h
y
y
≅
∆
∆
co można zapisać
∆p
y
∆y ≅ h
Jeżeli chcemy poprawić pomiar y (zmniejszyć
∆y) to w wyniku zmniejszenia szerokości
szczeliny otrzymujemy szersze widmo dyfrakcyjne (mocniejsze ugięcie). Inaczej mó-
wiąc zwiększone zostało
∆p
y
. Równani to przedstawia ograniczenie nałożone na do-
kładność pomiarów przez przyrodę (nie ma nic wspólnego z wadami aparatury pomia-
rowej).
Równanie to jest szczególnym przypadkiem ogólnej zasady podanej przez
W. Heisenberga znanej jako
zasada nieoznaczoności
.
W zastosowaniu do pomiaru pędu i położenia głosi ona, że
h
z
p
h
y
p
h
x
p
z
y
x
≥
∆
∆
≥
∆
∆
≥
∆
∆
(34.5)
Tak więc żadna składowa ruchu elektronu nie może być określona z nieograniczoną do-
kładnością. Ta sama zasada obowiązuje w odniesieniu do energii i czasu.
34-10
Wyszukiwarka
Podobne podstrony:
34 fale i cząstki
34 Fale i cząstki
Fale i cząstki zadania 2 liceum
Fale i cząstki zadania liceum
Fale i cząstki zadania 2 liceum
Fale i cząstki
Spr 34 dyspersja cząstkowa
Fale i cząstki zadania 2 liceum
Spr 34 dyspersja cząstkowa
Spr 34 dyspersja cząstkowa
Fale i cząstki zadania liceum
b 34 2013 10 X k
07 CZĄSTKI I FALE
b 34 2013 10 01
loveparade 2010 anlage 34 genehmigung bauaufsicht 21 07 10
więcej podobnych podstron