gdzie:
[
]
]
kmol
/
kJ
,
reakcji
entalpia
H
−
∆
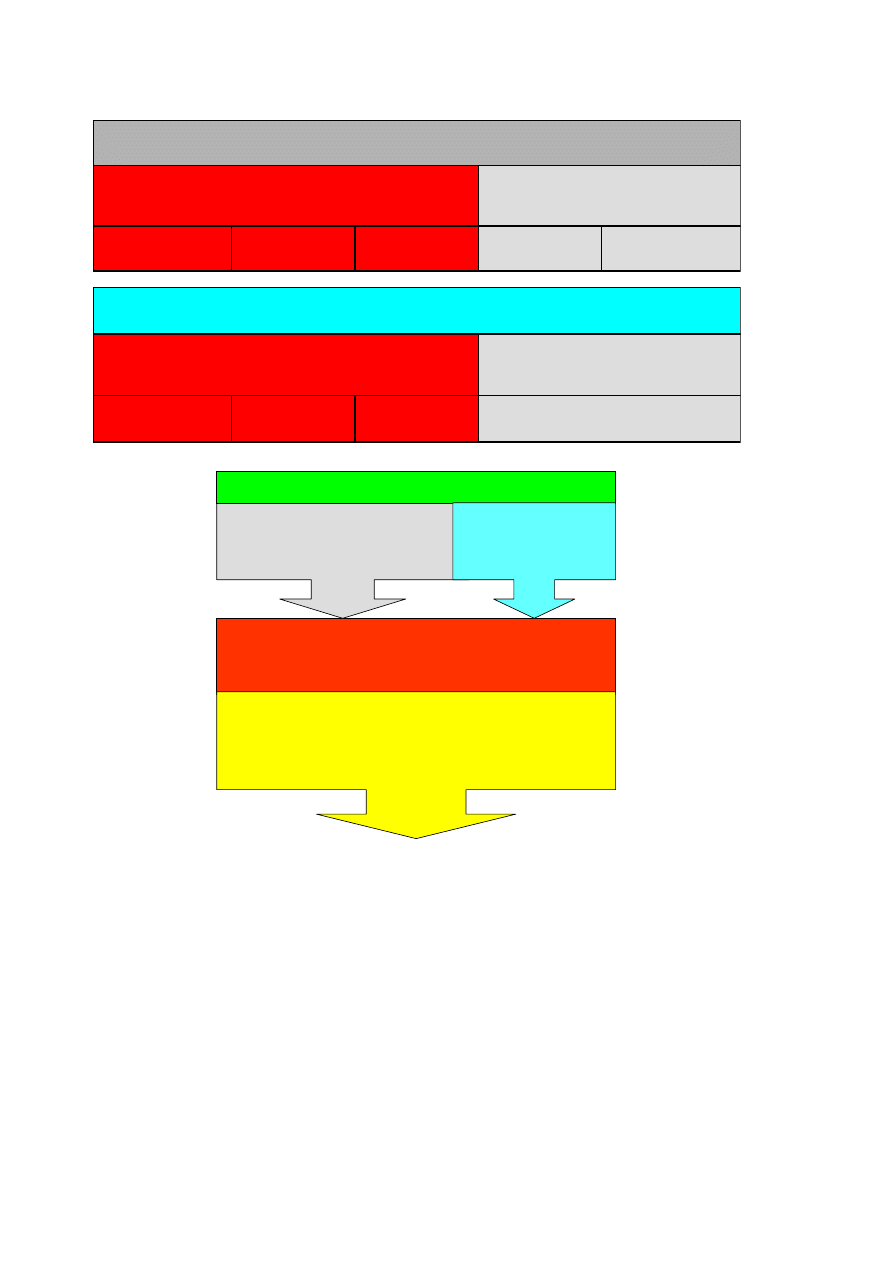
SUBSTANCJA PALNA
BALAST
C
S
H
2
POPIÓŁ
WILGO
Ć
PALIWO STAŁE , PALIWO CIEKŁE
SUBSTANCJA PALNA
BALAST
C
S
H
2
CO
2
,N
2
, H
2
O
PALIWO GAZOWE
KOMORA SPALANIA
SUBSTRATY
PALIWO
POWIETRZE
PRODUKTY SPALANIA
S
(romb)
+ O
2
=SO
2
+ H
∆∆∆∆
= - 296,9 kJ/mol
2H
2
+ O
2
= 2H
2
O + H
∆∆∆∆
= - 285,9 kJ/mol
C
+ O
2
= CO
2
+ H
∆∆∆∆
= - 393,51 kJ/mol
C+ 0.5O
2
= CO
+ H
∆∆∆∆
=
- 110,5 kJ/mol

Spalanie zupełne – jeżeli w spalinach nie ma palnych części gazowych (np. CO, C
x
H
y
).
Spalanie całkowite – jeżeli w produktach spalania nie ma palnych części stałych (np. sadza,
koksik lotny i in.).
Współczynnik nadmiaru powietrza
λ
:
min
a
n
a
n
=
λ
min
a
a
n
,
n
– rzeczywista ilość powietrza doprowadzonego do spalania, teoretyczna ilość
powietrza niezbędna do spalenia zupełnego i całkowitego paliwa [kmol/j.p].
j.p – jednostka ilości paliwa: w przypadku paliw stałych i ciekłych j.p=kg paliwa wilgotnego
lub dla paliw gazowych j.p=kmol gazu suchego.
Kontrakcja chemiczna
∆∆∆∆
V
ch
– różnica objętości substratów i wilgotnych produktów
spalania.
Kontrakcja fizyczna
∆∆∆∆
V
f
– różnica objętości substratów i produktów po uwzględnieniu
wykroplenia się pary wodnej.
Kontrakcja całkowita
∆∆∆∆
V=
∆∆∆∆
V
f
+
∆∆∆∆
V
ch
– suma kontrakcji chemicznej i fizycznej.
Wartość opałowa – Q
i
jest to ilość ciepła, jaka powstaje w wyniku spalania zupełnego
i całkowitego jednostki ilości paliwa przy założeniu, że produkty spalania zostaną ochłodzone
do temperatury substratów, a para wodna zawarta w spalinach nie ulega wykropleniu.
Ciepło spalania – Q
s
jest to ilość ciepła, jaka powstaje w wyniku spalania zupełnego
i całkowitego jednostki ilości paliwa przy założeniu, że para wodna zawarta w spalinach
ulegnie całkowitemu wykropleniu.
r
m
Q
Q
s
i
⋅′
′
−
=
m
′′
– masa skroplin uzyskana ze spalenia jednostki ilości paliwa: dla paliw stałych i
ciekłych [kg/kg], dla paliw gazowych [kg/um
3
]
r
– entalpia skraplania pary, [kJ/kg]
Paliwa ciekłe i stałe: Q
i
[kJ/kg], Q
s
[kJ/kg],
Paliwa gazowe:
Q
i
[kJ/um
3
], Q
s
[kJ/um
3
].
1 um³ (umowny metr sześcienny) jest to ilość substancji zawartej w 1 m³ gazu doskonałego
lub półdoskonałego o ściśle określonym ciśnieniu pN i temperaturze TN. Parametry pN, TN
nazywamy parametrami umownymi.
Najczęściej przyjmuje się następujące wartości parametrów umownych: pN = 1 bar,
TN = 273,15 K, które nazywa się parametrami umownymi SI.
Bilans energetyczny kalorymetru Junkersa
u
w
d
E
E
E
&
&
&
∆
+
=
d
E
&
– strumień energii doprowadzonej do układu,
w
E
&
– strumień energii wyprowadzonej z układu,
1
u
2
u
u
E
E
E
&
&
&
−
=
∆
, to przyrost strumienia energii układu.
Gaz:
g
I&
,
kg
E
&
,
pg
E
&
, Q
&
Powietrze:
p
I&
,
kp
E
&
,
pp
E
&
Straty ciepła do
otoczenia:
str
Q
&
.
Woda chłodząca:
1
w
I&
Woda chłodząca:
2
w
I&
Spaliny:
ks
E
&
,
ps
E
&
,
s
I&

gdzie:
g
I&
–
strumień entalpii spalanego gazu,
p
I&
–
strumień entalpii powietrza doprowadzanego do procesu spalania,
1
w
I&
–
strumień entalpii wody chłodzącej, dopływającej do kalorymetru Junkersa,
kg
E
&
–
strumień energii kinetycznej spalanego gazu,
kp
E
&
–
strumień energii kinetycznej powietrza doprowadzanego do procesu spalania,
pg
E
&
–
strumień energii potencjalnej spalanego gazu,
pp
E
&
–
strumień energii potencjalnej powietrza doprowadzanego do procesu spalania,
Q
&
–
strumień ciepła wydzielonego w wyniku spalania gazu,
s
I&
–
strumień entalpii spalin,
ks
E
&
–
strumień energii kinetycznej spalin,
ps
E
&
–
strumień energii potencjalnej spalin,
2
w
I&
–
strumień entalpii wody chłodzącej, wypływającej z kalorymetru Junkersa,
str
Q
&
–
strumień strat ciepła do otoczenia.
Pomiar powinien być przeprowadzony w stanie ustalonym, wtedy
0
E
u
=
∆
&
Warunki, które powinny być spełnione, aby kalorymetr Junkersa znajdował się w stanie
ustalonym są następujące:
•
stałe natężenie przepływu: gazu, powietrza, wody chłodzącej oraz spalin,
•
stałe ciśnienie gazu, otoczenia,
•
stały rozkład temperatury.
Aby zminimalizować straty ciepła przez konwekcję oraz promieniowanie powinny być
dodatkowo spełnione następujące warunki:
•
różnica temperatury
w
t
∆
między temperaturą wody wypływającej
2
w
t
i dopływającej
1
w
t
z /do kalorymetru Junkersa powinna mieścić się w przedziale
K
10
6
t
t
t
1
w
2
w
w
÷
=
−
=
∆
•
ś
rednia arytmetyczna temperatura wody chłodzącej kalorymetr
w
t powinna być równa
temperaturze otoczenia
ot
w1
w2
w
t
)
t
0,5(t
t
=
+
=
.

Jeżeli kalorymetr Junkersa znajduje się wstanie ustalonym, to przyrost strumienia energii
układu
0
E
E
E
∆
u1
u2
u
=
−
=
&
&
&
, czyli strumień energii układu pozostaje niezmienny
1
u
E
2
u
E
&
&
=
,
zatem:
w
E
d
E
&
&
=
Strumień energii dopływającej do układu
d
E
&
:
w1
pp
kp
p
pg
kg
g
d
I
E
E
I
Q
E
E
I
E
&
&
&
&
&
&
&
&
&
+
+
+
+
+
+
+
=
Strumień energii wypływającej z układu
w
E
&
:
str
w2
ps
ks
s
w
Q
I
E
E
I
E
&
&
&
&
&
&
+
+
+
+
=
Wobec tego, że w stanie ustalonym spełnione jest równanie
w
d
E
E
&
&
=
zatem:
str
2
w
ps
ks
s
1
w
pg
kp
p
pg
kg
g
Q
I
E
E
I
I
E
E
I
Q
E
E
I
&
&
&
&
&
&
&
&
&
&
&
&
&
+
+
+
+
==
+
+
+
+
+
+
+
Założenia upraszczające bilans energetyczny kalorymetru Junkersa:
•
ze względu na bardzo małą prędkość przepływu (v
≈
0 ): gazu, powietrza oraz spalin,
można pominąć strumienie energii kinetycznej: gazu, powietrza oraz spalin
ks
E
,
kp
E
,
kg
E
&
&
&
≈
0,
•
ze względu na to, że różnica poziomów
∆
h <80-100m, można pominąć strumienie
energii potencjalnej: gazu, powietrza oraz spalin
ps
pp
pg
E
,
E
,
E
&
&
&
≈
0
•
nie ma kontrakcji chemicznej, czyli różnica między objętością substratów oraz
objętością wilgotnych produktów spalania
∆
V
ch
= 0
0
V
V
V
produktów
otnych
lg
wi
substratów
ch
=
−
=
∆
gdzie:
s
produktów
otnych
lg
wi
p
g
substratów
V
V
V
V
V
=
=
+
=
,
−
s
p
g
V
,
V
,
V
objętość gazu, powietrza, spalin

- jeżeli założymy dodatkowo, że gęstość gazu (
g
ρ ), powietrza (
p
ρ
), spalin (
s
ρ
) jest taka
sama:
s
p
g
ρ
≈
ρ
≈
ρ
to można zapisać, że suma masy gazu (
g
m
) i powietrza (
p
m
), czyli substratów jest
w przybliżeniu równa masie spalin (
s
m )
s
p
g
m
m
m
≈
+
-
jeżeli założymy, z błędem
±
0,5%, że ciepło właściwe gazu
pg
c
, powietrza
pp
c
, spalin
ps
c
przy stałym ciśnieniu jest w przybliżeniu takie samo:
p
ps
pp
pg
c
c
c
c
≈
≈
≈
-
z definicji wartości opałowej wynika, że temperatura gazu (t
g
), powietrza (t
p
) i spalin(t
s
)
jest taka sama
t
s
t
p
t
g
t
=
=
=
wobec tego po obustronnym pomnożeniu równania:
s
p
g
m
m
m
≈
+
przez iloczyn
s
ps
p
pp
g
pg
p
t
c
t
c
t
c
t
c
⋅
⋅
≈
⋅
≈
⋅
≈
⋅
uzyskuje się następujące równanie :
s
ps
s
p
pp
p
g
pg
g
t
c
m
t
c
m
t
c
m
⋅
⋅
≈
⋅
⋅
+
⋅
⋅
które po wykorzystaniu równania definiującego entalpię :
I = m c
p
t

można zapisać w następującej postaci:
s
p
g
I
I
I
≈
+
gdzie:
g
I
–
entalpia gazu,
p
I
–
entalpia powietrza,
s
I
–
entalpia spalin,
Posługując się strumieniem entalpii (
I&
), czyli ilorazem entalpii ( I ) i czasu (
τ
):
τ
=
I
I&
można napisać, że suma strumieni entalpii gazu (
g
I&
) i powietrza (
p
I&
) jest równa
strumieniowi entalpii spalin (
)
I
s
&
:
s
p
g
I
I
I
&
&
&
=
+
•
strumień strat ciepła do otoczenia:
0
Q
Q
Q
r
k
str
=
+
=
&
&
&
gdzie:
k
Q
& – strumień ciepła, traconego do otocznia przez konwekcję,
r
Q
& – strumień ciepła, traconego do otocznia przez promieniowanie.
0
Q
k
=
&
,
0
Q
r
=
&
wynika to z konstrukcji kalorymetru Junkersa oraz warunków
przeprowadzania pomiaru, o czym wspomniano wcześniej:
K
10
6
t
t
t
1
w
2
w
w
÷
=
−
=
∆
,
ot
t
)
1
w
t
2
w
t
(
5
,
0
w
t
=
+
=

Ostatecznie, po wprowadzeniu uproszczeń, bilans energetyczny kalorymetru Junkersa można
zapisać w następującej postaci:
2
w
1
w
I
I
Q
&
&
&
=
+
lub po przekształceniu
(
)
1
w
2
w
2
tw
1
tw
w
1
w
2
w
t
t
c
m
I
I
Q
−
⋅
⋅
=
−
=
&
&
&
&
gdzie:
Q
&
– strumień ciepła wydzielonego podczas spalenia określonej ilości gazu,
I
,
I
w2
w1
&
&
– strumień entalpii wody chłodzącej na dopływie oraz wypływie z kalorymetru
Junkersa,
tw2
tw1
c
– średnie ciepło właściwe wody w zakresie temperatur t
w1
i t
w2
. Ponieważ zmiana
temperatury wody jest niewielka, wobec tego można nie uwzględniać wpływu temperatury
wody na wartość ciepła właściwego wody i przyjmować wartość c
w
=4,19 kJ/kgK.
Strumień wydzielanego ciepła:
s
gN
Q
V
Q
⋅
=
&
&
gdzie :
s
Q – ciepło spalania paliwa gazowego,
gN
V
&
– strumień spalanego gazu [um³].
Ciepło spalania gazu Q
s
:
(
)
(
)
gN
V
1
w
t
2
w
t
w
c
w
m
gN
V
1
w
t
2
w
t
w
c
w
m
gN
V
Q
s
Q
−
⋅
⋅
=
−
⋅
⋅
=
=
&
&
&
&

Wartość opałowa gazu:
gN
skr
s
s
i
V
r
m
Q
r
m
Q
Q
⋅
−
=
⋅′
′
−
=
gdzie:
m
′′
– masa skroplin uzyskana ze spalenia jednostki ilości paliwa gazowego, [kg/um³]
r
– entalpia skraplania pary, [kJ/kg]
⋅
=
′′
3
gN
skr
um
kg
,
V
m
m
Ilość spalonego gazu oblicza się ze wzoru:
g
g
g
N
gN
N
T
V
p
T
V
p
=
g
N
N
g
g
gN
T
p
T
V
p
V
⋅
⋅
⋅
=
, [um³]
Ciśnienie gazu suchego (
g
p
)
s
b
g
g
p
p
p
p
−
+
∆
=
g
p
∆
– nadciśnienie gazu w gazomierzu, [Pa]
b
p – ciśnienie barometryczne, [Pa]
s
p – ciśnienie nasycenia pary wodnej w t
s
, [Pa]

MATERIAŁY PRZYDATNE DO ANALIZY WYNIKÓW POMIARÓW
1. Rozporządzenie Ministra Gospodarki z dnia 2lipca 2010 w sprawie szczegółowych
warunków funkcjonowania systemu gazowego (Dz.U.z 2010r. Nr.133, poz.891.
2. Polskie Normy :
•
PN-C-04750: Paliwa gazowe. Klasyfikacja, oznaczenia i wymagania.
•
PN-C-04753:Gaz ziemny. Jakość gazu dostarczanego odbiorcom z sieci
rozdzielczej.
WZGLĘDNA GĘSTOŚĆ GAZU
Stosunek gęstości danego gazu do gęstości suchego powietrza w tej samej temperaturze i pod
tym samym ciśnieniem.
LICZBA WOBBEGO
Liczba Wobbego-Wo, [kJ/um
3
]: ciepło spalania gazu podzielone przez pierwiastek
kwadratowy ze względnej gęstości gazu odniesionej do powietrza:
Wartość liczby Wobbego jest podstawą do podziału paliw gazowych na podgrupy.
p
g
d
ρ
ρ
=
∆
=
d
Q
Wo
s
=
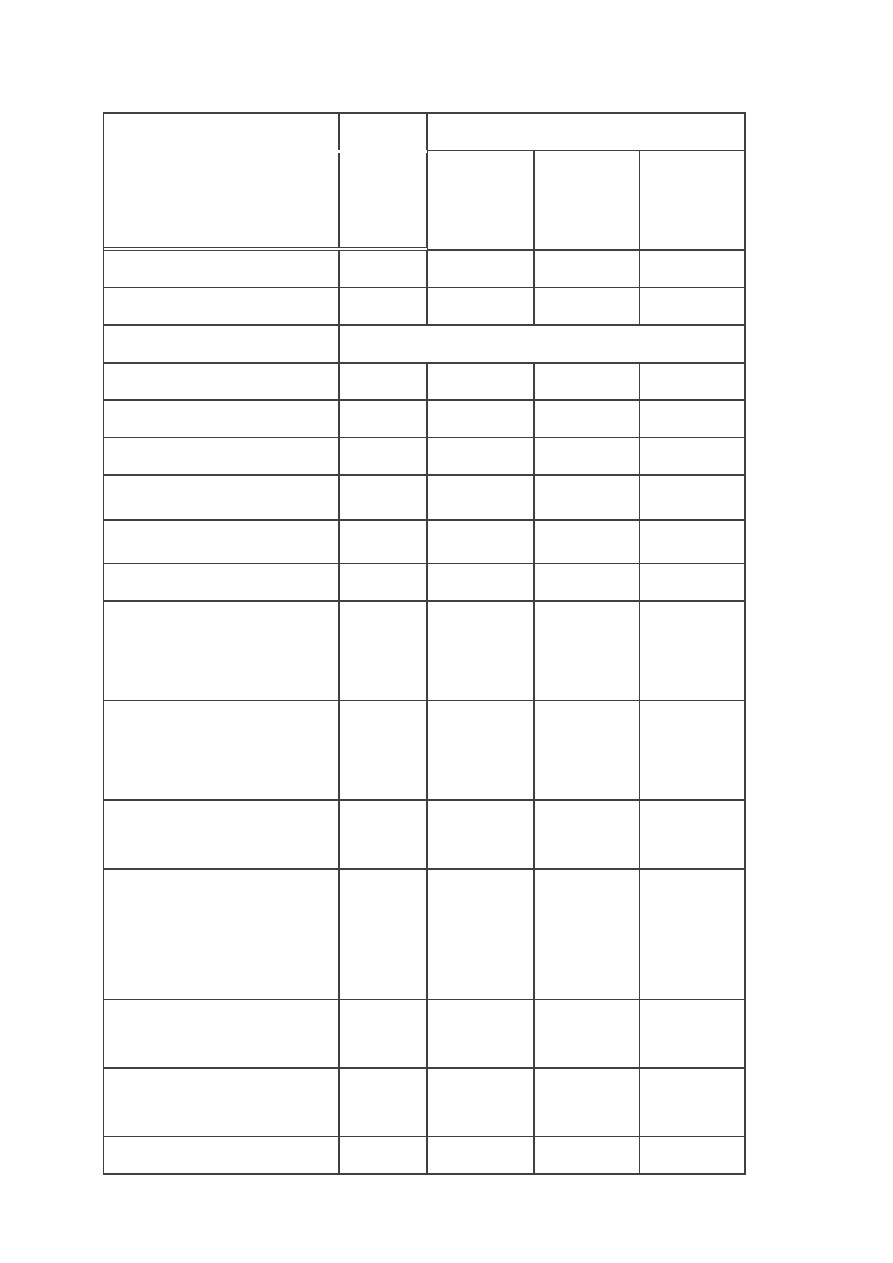
System
Wyszczególnienie
Jednostka
gazu
ziemnego
grupy E
gazu
ziemnego
grupy Lw
gazu
ziemnego
grupy Ls
ciepło spalania
MJ/m
3
≥ 34,1
≥
30,1
≥
26,1
wartość opałowa
MJ/m
3
≥ 31,0
≥
27,0
≥
24,0
górna liczba Wobbego
- nominalna
MJ/m
3
50,0
41,5
35,0
- zakres zmienności
MJ/m
3
45,0-54,0
37,5-45,0
32,5-37,5
zawartość siarkowodoru
mg/m
3
≤ 7,0
≤
7,0
≤
7,0
zawartość tlenu
% mol/mol
≤ 0,2
≤
0,2
≤
0,2
zawartość ditlenku węgla
% mol/mol
≤ 3,0
≤
3,0
≤
3,0
zawartość par rtęci
µg/m
3
≤ 30,0
≤
30,0
≤
30,0
temperatura punktu rosy wody
dla 5,5 MPa od 1 kwietnia do
30 września
ºC
≤ +3,7
≤
+3,7
≤
+3,7
temperatura punktu rosy wody
dla 5,5 MPa od 1 października
do 31 marca
ºC
≤ -5,0
≤
-5,0
≤
-5,0
temperatura punktu rosy
węglowodorów
ºC
0
0
0
zawartość węglowodorów
mogących ulec kondensacji
w temp. -5ºC przy ciśnieniu
panującym w gazociągu
mg/m
3
≤ 30,0
≤
30,0
≤
30,0
zawartość pyłu o średnicy
cząstek większej niż 5 µm
mg/m
3
≤ 1,0
≤
1,0
≤
1,0
zawartość siarki
merkaptanowej
mg/m
3
≤ 16,0
≤
16,0
≤
16,0
zawartość siarki całkowitej
mg/m
3
≤ 40,0
≤
40,0
≤
40,0
Wyszukiwarka
Podobne podstrony:
Oznaczanie ciepła spalania i wartości opałowej paliw gazowych
3 Spalanie paliw gazowych
Oznaczanie ciepła spalania i obliczanie wartości opałowej
Oznaczanie ciepła spalania węgla
Spalanie paliw gazowych
3 Spalanie paliw gazowych
Pomiary ciepła spalania i wartości opałowej paliw gazowych
wyznaczanie ciepla spalania i wartosci opalowej paliw cieklych i gazowych
Pomiary ciepła spalania i wartości opałowej paliw gazowych
Oznaczanie kaloryczności paliw gazowych MBM2N32006A
Spalanie paliw wymiana ciepła
16 Spalanie w turbinach gazowych paliw alternatywnych
15 wyznaczanie ciepła spalania, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy, Chem
Spalanie paliw 2012
Oznaczenia w projektach wewnętrznych instalacji gazowych 2013
więcej podobnych podstron