
1
ĆWICZENIA Z GEOLOGII ZŁÓŻ
METODYKA BADAŃ W GEOLOGII ZŁÓŻ
SEMESTR ZIMOWY 2006/2007
BLOK: „WYKORZYSTANIE BADAŃ TRWAŁYCH IZOTOPÓW
W GEOLOGII ZŁÓŻ (I NIE TYLKO)”
PROWADZĄCY:
DR MACIEJ BOJANOWSKI
1
&
DR MAŁGORZATA STRENGEL-MARTINEZ
2
„Ostrzeżenie!!! – Wyniki badań trwałych izotopów mogą powodować poważne i zaraźliwe bóle
brzucha, jeśli przyjmowane są indywidualnie. Aby uniknąć zaniepokojenia żołądka własnego i
recenzentów, zażyj wyniki badań trwałych izotopów ze zdrową dawką innych informacji
hydrologicznych, geologicznych i geochemicznych. Przekonasz się wtedy, że dane uzyskane z
badań trwałych izotopów są bardzo zbawienne.” (Marvin O. Fretwell, pers. comm. 1983 –
cytowane za: http://www.rcamnl.wr.usgs.gov)
1
Zakład Geologii Złożowej i Gospodarczej; e-mail:
mcbojan@uw.edu.pl
; tel.: 022 554 03 28; dyżur: środa 11-13;
pokój 2083
2
Zakład Geologii Złożowej i Gospodarczej; e-mail:
m.strengel-martinez@uw.edu.pl
; tel.: 022 554 04 25;
dyżur: czwartek 11-12; pokój 2035;
2
INFORMACJE PODSTAWOWE
Atomy składają się z protonów (o ładunku +), neutronów i elektronów (o ładunku
). Protony i
neutrony zawarte są w jądrze, które skupia niemal całą masę atomu, a elektrony występują na
powłokach elektronowych.
Liczba atomowa (Z) + liczba neutronowa (N) = l. masowa (A)
liczba atomowa to liczba protonów zawartych w jądrze atomu – opisuje ona z jakim
pierwiastkiem mamy do czynienia
liczba neutronowa to liczba neutronów w jądrze atomu.
Poszczególne rodzaje atomów nazywane są nuklidami i mogą się różnić wartościami liczby
neutronowej, atomowej lub masowej.
Nuklidy o tej samej Z to pierwiastki.
Nuklidy danego pierwiastka o różnej N, więc także o różnej A – to izotopy (
16
8
O,
17
8
O,
18
8
O).
Nuklidy dwóch pierwiastków, więc o różnej Z, ale o takiej samej A to izobary (
3
1
H,
3
2
He).
Nuklidy o różnych Z i A, ale o takiej samej N to izotony (
14
6
C,
16
8
O).
Izotopy to atomy, których jądra zawierają tę samą liczbę protonów, ale różną liczbę neutronów.
Czyli, izotopy danego pierwiastka mają tę samą liczbę atomową, a różną liczbę masową. Termin
izotopy pochodzi z greki i oznacza „równe miejsce”, co bierze się z faktu, że są to wprawdzie różne
nuklidy, ale które zajmują w układzie okresowym to samo miejsce.
Sposób zapisu: zwykle izotopy zapisuje się podając tylko liczbę masową w górnym lewym rogu
symbolu pierwiastka – np.
18
O lub podając nazwę pierwiastka jako pierwszą a następnie myślnik i
liczbę masową – np. „tlen-18”.
Symbol chemiczny
pierwiastka
Liczba masowa =
A = Z + N
Liczba atomowa =
liczba protonów
N
= Liczba neutronowa

3
Podział izotopów na trwałe i nietrwałe (promieniotwórcze) oraz na pierwotne (przejęte z materii
kosmicznej) i wtórne (powstałe w wyniku przemian promieniotwórczych). Istnieje 300 trwałych i
1200 nietrwałych izotopów. Czyli większość naturalnie występujących izotopów to izotopy
nietrwałe, które ulegają rozpadowi promieniotwórczemu w wyniku, którego powstają inne izotopy.
Podczas rozpadu, izotopy promieniotwórcze emitują cząstki alfa lub beta i czasami również
promienie gamma. Izotopy promieniotwórcze używa się między innymi do radiometrycznych
metod datowania. Jedynie 21 pierwiastków ma tylko 1 izotop. Przeważnie jeden izotop, w składzie
danego pierwiastka, wybitnie przeważa ilościowo nad pozostałymi (wyjątek np.
63
Cu – 69%, a
65
Cu – 31%).
Nie bardzo wiadomo, jaka jest częstość występowania poszczególnych pierwiastków, ale
podejmowano próby jej obliczania na podstawie analizy składu meteorytów oraz atmosfery Słońca i
gwiazd. W próbach tych określono względne stosunki atomowe poszczególnych pierwiastków
przyjmując umownie, że częstość pierwiastka referencyjnego ma określoną wartość, np. przyjmuje
się, że krzem ma częstość 10
6
i częstości atomowe innych pierwiastków porównuje się z tą
wartością. Charakterystyczne jest, że częstość pierwiastków maleje wraz z wzrastającą l. atomową,
przy czym spadek jest gwałtowny tylko na początku układu okresowego, czyli że pierwiastki
lekkie, zwłaszcza H, są wielokrotnie częstsze niż ciężkie. Pewne pierwiastki odbiegają jednak od
tego trendu i mogą być anomalnie mniej częste (deficytowe, np. Li, Be) lub bardziej częste (np. O i
Fe). Dodatkowo pierwiastki o l. atomowych parzystych są częstsze od o l. atomowej nieparzystej.
Wychodząc od znanych częstości atomowych i znając procentowy udział poszczególnych izotopów
danego pierwiastka, można ustalić częstości jego izotopów. Nuklidy o parzystych liczbach
protonów lub neutronów są częstsze od nieparzystych. Co ciekawe, zauważono, że wyższą częstość
mają nuklidy mające pewne liczby protonów lub neutronów. te liczby to: 2, 8, 20, 28, 50, 82, 126 i
nazywa się je liczbami magicznymi. Oprócz tego jeśli dwa izobary różnią się od siebie liczbą
protonów o 1, to jeden z nich jest promieniotwórczy (np.
3
1
H –
3
2
He;
14
6
C –
14
7
N).
METODY BADAWCZE
Do podstawowych zadań geochemii izotopów należy poznanie składu izotopowego pierwiastków
występujących w przyrodzie oraz śledzenie jego zmienności. Używa się do tego przeważnie metod
fizycznych, np. określania ciężaru właściwego fluidów czy analizy widma masowego. Aby zbadać
skład izotopowy danego pierwiastka należy oznaczyć jego l. masową i określić stosunki izotopowe.
Służą do tego spektrografy i spektrometry mas. Różnią się od siebie konstrukcją, ale i
przeznaczeniem. Spektrografy mas pozwalają dokładnie określić liczby masowe poszczególnych
izotopów, natomiast słabiej oznaczają względną ich częstość występowania. W geochemii izotopów

4
trwałych używa się najczęściej spektrometrów mas, które wykrywają różnice przebiegu przez pole
magnetyczne jonów o różnym stosunku masy do ładunku zwanym widmem masowym. Służą
głównie do oznaczania stosunków izotopowych. Próbki należy przygotować w postaci zmielonej –
proszku, z którego najczęściej w wyniku zastosowania odpowiednich odczynników wydziela się
badany pierwiastek w postaci gazu, np. CO
2
dla potrzeb zbadania trwałych izotopów węgla czy
tlenu.
W ostatnich latach coraz szerzej w naukach geologicznych znajduje zastosowanie mikrosonda
jonowa i ablacja laserowa. Mikrosonda jonowa przeprowadzana jest na płytkach cienkich
odkrytych i pozwala na zbadanie stosunków izotopowych w poszczególnych kryształach i ziarnach
lub nawet w poszczególnych ich partiach, a ablacja laserowa przeprowadzana jest na odłamkach
skały w świetle odbitym.
SPOSOBY WYRAŻANIA SKŁADU IZOTOPOWEGO PIERWIASTKÓW
Skład izotopowy pierwiastka wyraża się najczęściej jako stosunek dwóch wybranych izotopów
rozpatrywanego pierwiastka. Wyraża się to: A
1
/A
2
= R, gdzie A
1
i A
2
to zawartość izotopów 1
(cięższy) i 2 (lżejszy) w próbce, np.
18
O/
16
O. Stosunek ten mierzony jest względem ustalonych,
powszechnie uznanych wzorców. Różnicę zmierzonej wartości stosunku izotopowego do wzorca
wyraża się a pomocą parametru δ w promilach (Załącznik 1). Jeżeli δ > 0, to oznacza, że badana
próbka jest wzbogacona w cięższy izotop w stosunku do wzorca. Jeżeli δ < 0, to oznacza, że badana
próbka jest zubożona w cięższy izotop w stosunku do wzorca.
Określenie, który wzorzec jest najlepszy dla badań izotopowych jest bardzo trudne. Wzorzec
powinien spełniać następujące warunki:
1. Powinien być powszechnie używany jako punkt „0”,
2. Powinien mieć jednorodny skład izotopowy,
3. Powinien być osiągalny w dużych ilościach,
4. Powinien być łatwy do stosowania w przygotowawczych operacjach chemicznych
i pomiarach stosunków izotopowych,
5. Powinien mieć bezwzględny stosunek izotopowy R w przybliżeniu pośrodku
zmienności stosunków izotopowych danego pierwiastka w naturalnych
środowiskach.

5
Załącznik 1
SPOSOBY WYRAŻANIA ZMIENNOŚCI SKŁADU IZOTOPOWEGO
PIERWIASTKÓW
1. Skład izotopowy pierwiastka można wyrazić przez procentowy udział
poszczególnych izotopów.
2. W geochemii izotopów ograniczamy się najczęściej do zbadania stosunków
między dwoma wybranymi izotopami rozpatrywanego pierwiastka:
3. Obecnie jednak w geochemii izotopów stosowane jest powszechnie porównanie
stosunków izotopowych w badanej próbce ze stosunkiem w pewnym wzorcu.
Porównanie to określa
względne odchylenie od wzorca ( „delta value”):
1000
x
R
R
-
R
)
%
(w
wzorca
wzorca
próbk
i
A
o
,
gdzie R=A
1
/A
2
wyraża z reguły stosunek izotopu o wyższej liczbie masowej do
izotopu o liczbie masowej niższej.
Jeżeli
A
>
B
(A i B odnosi się do dwóch różnych próbek, w których oznaczamy
stosunki izotopowe badanego pierwiastka), to próbka A jest bogatsza od próbki B w
cięższy izotop badanego pierwiastka.
Przykład:
1000
x
O
O/
O
O/
-
O
O/
%
O
wzorca
16
18
wzorca
16
18
próbki
16
18
18
o
Jeżeli
18
O wynosi +10‰, to oznacza, że próbka jest wzbogacona w cięższy izotop tlenu w
stosunku do wzorca.
A
1
A
2
= R,
gdzie A
1
i A
2
to zawartość izotopów 1 i 2 w badanej próbce

6
FRAKCJONOWANIE IZOTOPOWE
Struktura elektronów determinuje własności chemiczne pierwiastka, natomiast struktura jądra
określa jego własności fizyczne. Czyli zgodnie z klasyczną chemią, własności chemiczne izotopów,
lub raczej cząsteczek zawierających różne izotopy tego samego pierwiastka (np.
13
CO
2
i
12
CO
2
) są
takie same (gdyż izotopy tego samego pierwiastka mają tę samą liczbę elektronów). I w szerokim
rozumieniu jest to prawda. Jakkolwiek, jeśli dokonujemy szczególnie precyzyjnych pomiarów (a
tak jest w przypadku stosowania nowoczesnych spektrometrów masowych), to okazuje się, że
możemy zaobserwować bardzo niewielkie różnice we własnościach chemicznych (jak również
fizycznych) cząsteczek zawierających różne izotopy tego samego pierwiastka, co spowodowane jest
różnicą mas jąder izotopowych atomów. Te różnice są szczególnie wyraźne u najlżejszych
pierwiastków, gdyż jeden neutron stanowi znaczącą część całej masy pierwiastka o niskiej liczbie
masowej. Konsekwencje tej różnicy mas są następujące:
-
Cząsteczki zawierające cięższe izotopy mają mniejszą mobilność (mniejszą prędkość
wibracji) i reagują w reakcjach chemicznych wolniej niż cząsteczki zawierające lżejsze
izotopy.
o
Przykład: Ca
12
CO
3
ulega rozpuszczeniu w kwaśnym roztworze szybciej niż
Ca
13
CO
3
;
-
Cięższe izotopy tworzą silniejsze wiązania w związku, czyli potrzeba więcej energii, aby
takie wiązanie rozbić.
o
Przykład: łatwiej jest rozbić wiązanie
1
H–
1
H niż wiązanie
2
H–
2
H
A zatem, ta różnica mas izotopów danego pierwiastka może powodować, że w reakcjach
chemicznych lub procesach fizycznych (parowanie i kondensacja, topnienie i krystalizacja, a także
dyfuzja) jeden z izotopów jest bardziej preferowany niż pozostałe, co prowadzi do zróżnicowania
składu izotopowego, czyli tzw. frakcjonowania izotopów. Tak więc, frakcjonowanie izotopowe to
wymiana izotopów danego pierwiastka pomiędzy dwie współwystępujące w danej reakcji
chemicznej lub procesie fizycznym substancje prowadząca do zróżnicowania stosunków
izotopowych pomiędzy tymi substancjami. Ta wymiana izotopów następuje między różnymi
fazami tego samego związku chemicznego, bądź też między różnymi związkami chemicznymi, np.:
12
CO
2
+
13
CO
2
13
CO
2
+
12
CO
2
gaz roztwór
gaz roztwór
12
CO
2
+
13
CH
4
13
CO
2
+
12
CH
4
Frakcjonowanie izotopowe pomiędzy substancje A i B jest określone współczynnikiem
frakcjonowania izotopowego alfa (
), (Załącznik 2), np. zmiana stosunku izotopów węgla

7
Załącznik 2
FRAKCJONOWANIE IZOTOPOWE
To wymiana izotopów tego samego pierwiastka pomiędzy dwie współwystępujące
substancje, charakteryzujące się różnymi stosunkami izotopowymi.
Frakcjonowanie izotopu tego samego pierwiastka pomiędzy dwie substancje A i B
jest zdefiniowane przez współczynnik frakcjonowania izotopowego
:
B
A
AB
R
R
Między wartościami
A
,
B
i
AB
istnieją zależności:
B
A
B
A
1000
1000
/1000
1
/1000
1
AB
W przypadku reakcji wymiany izotopowej:
C
mA
B
nA
C
mA
B
nA
1
2
2
1
Pomiędzy stałą równowagi takiej reakcji K a współczynnikiem frakcjonowania
izotopowego
istnieje zależność:
n
1
K
, gdzie n - maksymalna liczba rodzajów izotopów biorących
udział w wymianie izotopowej. Ponieważ często n=1, dlatego też
=K

8
w czasie utleniania metanu. Gdy
= 1, frakcjonowanie nie zachodzi (obie substancje mają taki sam
stosunek izotopowy). Gdy alfa > 1, A wzbogacona jest w cięższy izotop lub zubożona w lżejszy w
stosunku do B i odwrotnie. Im bardziej alfa odbiega od jedności, tym większy jest stopień
rozdzielenia izotopów w danej reakcji i tym bardziej obie substancje różnią się składem
izotopowym.
Zarówno w procesach chemicznych, jak i fizycznych frakcjonowanie izotopów może odbywać się
wskutek wymiany izotopów w warunkach równowagi lub też na zasadzie efektu kinetycznego, przy
braku równowagi. Możemy, zatem wyróżnić dwa podstawowe typy frakcjonowania:
1. Równowagowe frakcjonowanie izotopowe wynikające z różnic we własnościach
termodynamicznych cząsteczek zawierających różne izotopy danego pierwiastka.
2. Kinetyczne frakcjonowanie izotopowe wynikające z różnic szybkości reakcji chemicznych lub
procesów fizycznych.
Ad. 1. Równowagowe frakcjonowanie izotopowe - może mieć miejsce w konwencjonalnej reakcji
wymiany izotopowej, w której, na przykład tlen podlega wymianie pomiędzy kwarcem i
magnetytem:
2Si
16
O
2
+ Fe
3
18
O
4
2Si
18
O
2
+ Fe
3
16
O
4
Przez reakcję wymiany izotopowej rozumie się taką reakcję chemiczną, w czasie której izotopowe
atomy określonego pierwiastka zamieniają się miejscami pomiędzy dwiema lub więcej
cząsteczkami, w których występuje ten pierwiastek. Wymiana izotopowa nie prowadzi do
zwykłych, chemicznych zmian układu.
Co ważne, reakcje wymiany izotopowej to reakcje, w których substraty i produkty reakcji pozostają
ze sobą w kontakcie w dobrze wymieszanym, zamkniętym układzie, w którym mogą mięć
miejsce reakcje odwracalne i w którym równowaga chemiczna zostaje osiągnięta.
Równowagowe frakcjonowanie izotopowe może również mieć miejsce w odwracalnym procesie
fizycznym jak parowanie/kondensacja:
H
2
16
O (gaz) + H
2
18
O (ciecz)
H
2
18
O (gaz) + H
2
16
O (ciecz)
Gdy w wymianie izotopowej osiągnięty zostanie stan równowagi, skład izotopowy składników
uczestniczących w tej wymianie będzie różny. Pomiędzy stałą równowagi takiej reakcji K a

9
współczynnikiem frakcjonowania
istnieje zależność: = K
1/n
(Załącznik 2). Stała równowagi K
wymiany izotopowej zależy od temperatury, w której zachodzi reakcja wymiany. Zatem
współczynnik frakcjonowania izotopowego
również zależny jest od temperatury (wraz z jej
wzrostem jego wartość zbliża się do 1, tak że procesy przebiegające w wyższych temperaturach nie
powodują zróżnicowania izotopowego). Alfa oznaczany jest doświadczalnie i badana jest jego
zależność od temperatury dla wielu reakcji zachodzących w naturze, dzięki czemu uzyskujemy
podstawę do metod geotermometrii izotopowej (Załącznik 3).
Dla pierwiastków, które mogą uczestniczyć w reakcjach wymiany izotopowej w różnych
wartościowościach (np. C, S), obserwuje się, że do związku o wyższym stopniu utlenienia wchodzi
w wyższej proporcji izotop o większej masie. Na przykład, siarczan jest wzbogacony w cięższy
izotop siarki
34
S w stosunku do siarczku.
Ad. 2. Kinetyczne frakcjonowanie izotopowe (przy braku równowagi). Frakcjonowanie
izotopowe kontrolowane kinetycznie odzwierciedla chęć jednego z izotopów do reakcji. Bierze się
to z faktu, że lżejszy izotop reaguje szybciej niż izotop o wyższej liczbie masowej. Efekty
kinetyczne są obserwowane jedynie w przypadku, kiedy reakcja nie przebiega do końca lub
przebiega w jednym kierunku, np. proces rozkładu substancji organicznej. Inne przykłady
kinetycznego frakcjonowania to bardzo szybkie strącanie się kalcytu czy parowanie wody z
natychmiastowym odprowadzeniem pary wodnej.
Kinetyczne frakcjonowanie izotopowe jest spowodowane różnicami szybkości reakcji, w których
uczestniczą cząsteczki, zawierające różne izotopy pewnego pierwiastka, np.:
34
SO
4
2-
H
2
34
S
32
SO
4
2-
H
2
32
S
gdzie stała szybkości reakcji k
1
jest większa od stałej szybkości k
2
.
Szybkość reakcji, w której uczestniczy lżejszy izotop jest większa, dlatego też produkt tej reakcji
wzbogaca się w jej trakcie w lżejszy izotop w stosunku do związku wyjściowego, w którym z
kolei koncentruje się rezydualnie cięższy izotop.
Jeśli jednak reakcja przebiegnie do końca i osiągnięty zostanie stan równowagi, stosunki izotopowe
mogą się wyrównać. Zatem frakcjonowanie izotopowe spowodowane efektami kinetycznymi
zachodzi wyłącznie, gdy stan równowagi nie zostaje osiągnięty lub, gdy reakcje przebiegają tylko w
jednym kierunku.
k
2
k
1

10
Załącznik 3
Co ważne, współczynnik frakcjonowania izotopowego jest funkcją temperatury, i
stanowi to podstawę w geotermometrii izotopowej (temperatura może być
wyliczona z frakcjonowania izotopowego pomiędzy dwoma fazami będącymi w
układzie równowagi):
1000ln
B
T
A
2
6
10
AB
wzór dla środowiska wyżejtemperaturowego,
gdzie A i B to stałe wyznaczane eksperymentalnie; T – temperatura w skali Kelvina
T[K] = t[C
o
] + 273
Warto wprowadzić jeszcze inny termin, duża delta
- jest to różnica pomiędzy
wartościami
pomierzonymi dla substancji A i B:
AB
=
A
–
B
Pomiędzy tą wartością a współczynnikiem frakcjonowania izotopowego
istnieje
również matematyczna zależność:
AB
=
A
–
B
(
AB
– 1)10
3
lub
AB
1000ln
AB
Wzór ten jest dość praktyczny, ponieważ pozwala obliczyć (przy założeniu, iż fazy A
i B tworzyły się w równowadze) przybliżoną wartość 1000ln
AB
przez proste
odjęcie pomierzonych wartości
dla faz A i B. Warto jednak pamiętać, że takie
przybliżenie jest właściwe, gdy pomierzone wartości
< 10‰, ale jeśli wartości
> 10‰ wówczas należy dokonać precyzyjnego obliczenia według wzoru
1000ln
B
T
A
2
6
10
AB
.

11
GEOCHEMIA TRWAŁYCH IZOTOPÓW
OGÓLNE INFORMACJE O ZASTOSOWANIU BADAŃ TRWAŁYCH IZOTOPÓW W
GEOLOGII
Do podstawowych pierwiastków, stanowiących zainteresowanie w geochemii trwałych izotopów
należą H, Li, B, C, N, O, Si, S i Cl. Z tych pierwiastków wykorzystywane są przede wszystkim O,
H, C i S. Dlaczego? Po pierwsze, pierwiastki te zawierają co najmniej dwa trwałe izotopy o
stosunkowo dużej częstości występowania, ułatwiając tym samym dokładne pomiary. Po drugie,
wielkość frakcjonowania podczas reakcji jest funkcją względnej różnicy mas pomiędzy izotopami, i
te różnice w stosunkach izotopowych są większe dla lżejszych pierwiastków (i dlatego są łatwiejsze
do pomiarów). Po trzecie i na szczęście, pierwiastki te (O, H, C i S) są głównymi składnikami
systemów geologicznych i biologicznych, i biorą udział w większości reakcji geochemicznych.
Co ciekawe, nowe techniki badawcze oferują teraz większą czułość pomiarów i większą ich
precyzję, co przyczyniło się do rozpoczęcia badań zmienności składu izotopowego takich metali jak
Mg, Ca, Ti, Cr, Fe, Zn, Cu, Ge, Se, Mo i Tl. Zmienność składu izotopowego wymienionych metali
jest zasadniczo całkiem niewielka. Niezależnie od tego, z badań izotopowych tych pierwiastków
można otrzymać pewne informacje, które są użyteczne geologicznie, co przyczynia się do
kontynuowania poszukiwań w tej dziedzinie.
Na naszych zajęciach będziemy jednak mówić o trwałych izotopach wodoru, tlenu, węgla i siarki,
które to izotopy mają największe znaczenie w geologii (i nie tylko):
1.
Geologia złóż - badania trwałych izotopów H, O, S i C dostarczają bardzo ważnych danych
w geologii złożowej, np. na temat źródła metali, siarki i węgla uwięzionych w złożach rud,
na temat warunków fizyko-chemicznych (w tym temperatur, ciśnienia) i mechanizmów
transportu rud i ich akumulacji podczas procesów hydrotermalnych, a czasem także ich
datowania. Grupa tych lekkich pierwiastków jest trudna do zbadania innymi metodami.
Jednocześnie są one głównymi składnikami fluidów o ważnym znaczeniu geologicznym i
złożotwórczym, stąd duże znaczenie metod izotopowych do ich badania.
2.
Petrologia – badania trwałych izotopów tlenu wykorzystywane są przede wszystkim w
geotermometrii: np. do określenia temperatur krystalizacji skał magmowych i temperatur
powstawania skał metamorficznych, a także do rozwiązania problemów genetycznych (np.
do określenia genezy skał metamorficznych).
3.
Hydrogeologia – występujące w środowisku izotopy trwałe (
18
O,
2
H,
13
C) są
wykorzystywane w hydrogeologii m.in. do określania źródła wody w warstwie wodonośnej
oraz obszarów zasilania wód, a także ustalenia genezy wód podziemnych występujących w

12
głębszych poziomach basenów sedymentacyjnych. Analizy składu izotopowego ługów
solnych, solanek i wód kopalnianych pomagają w bieżącej ocenie zagrożeń wodnych w
kopalniach soli i węgla.
4.
Paleoklimatologia – metody izotopowe należą do najbardziej efektywnych narzędzi
używanych w paleoklimatologii. Zmiany składu izotopów trwałych pierwiastków lekkich
zachowane w różnorodnych archiwach klimatycznych wykorzystywane są jako wskaźniki
zmian parametrów środowiskowych w przeszłości (temperatura, ilość opadów, wilgotność
względna, itp.). Natomiast badania izotopów promieniotwórczych służą do określenia skali
czasu rekonstruowanych zmian. W glacjologii badania izotopowe służą np. do rozróżnienia
rocznych warstw w lodzie.
5.
Archeologia i antropologia– kości wydobyte z wykopalisk archeologicznych mogą być
badane pod względem składu izotopowego, aby uzyskać informacje dotyczące diety i
migracji wymarłych osobników. Skład izotopowy węgla i azotu jest stosowany do
rekonstrukcji diety, a izotopy tlenu są używane do określenia pochodzenia geograficznego.
W archeologii stosuje się metodę
14
C (czyli radiowęglową) do ustalania dat bezwzględnych.
6.
Również badania te znajdują szerokie zastosowanie w biologii i ekologii.
Geochemia trwałych izotopów jest wykorzystywana do rozwiązywania bardzo różnych problemów
z różnych dziedzin nauki (geologia, biologia, ekologia, archeologia i in.), ale na tych zajęciach
omówimy przede wszystkim badania trwałych izotopów wodoru, tlenu, węgla i siarki i ich
zastosowanie w geologii złóż.

13
WODÓR
Jest najpospolitszym pierwiastkiem we wszechświecie, swą częstością 10x przewyższa wszystkie
pozostałe pierwiastki razem wzięte. Choć jest najlżejszym pierwiastkiem, to i tak stanowi ¾ masy
całego wszechświata. W wodór zubożone są meteoryty i Ziemia, gdzie wodór gromadzi się w
zewnętrznych geosferach, zwłaszcza w hydrosferze, gdzie jest niemal w całości związany w wodę.
Metaliczne jądro Ziemi jest praktycznie pozbawione wodoru, krzemianowy płaszcz ma go bardzo
mało, w skorupie jest on związany z tlenem w postaci:
- grup OH (w minerałach skałotwórczych takich jak łyszczyki, chloryty i amfibole)
- jonów hydroniowych (H
3
O
+
)
- obojętnych cząsteczek wody (krystalizacyjna, zeolityczna, koloidalna, szkliw wulkanicznych,
wilgoć skalna)
oraz jako węglowodory.
Skały magmowe są uboższe niż osadowe z uwagi na występowanie wodoru w związkach
organicznych w skałach osadowych - po tlenie i węglu wodór jest najważniejszym pierwiastkiem
biofilnym.
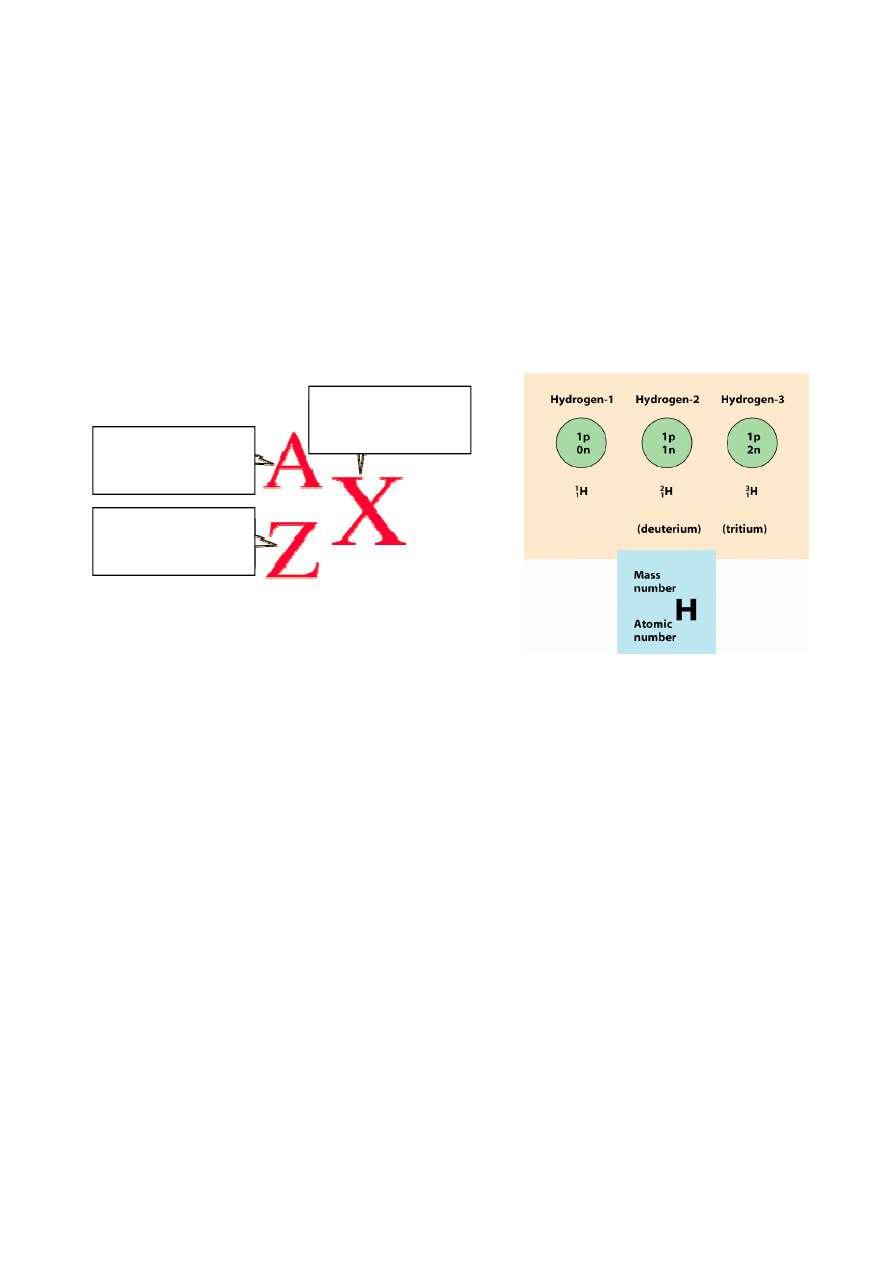
Są 2 trwałe izotopy wodoru (Załącznik 4). Tryt, izotop nietrwały, powstaje w górnych partiach
atmosfery z rozpadu
14
N pod wpływem promieniowania kosmicznego. Czas jego połowicznego
rozpadu wynosi 12,26 lat, a produktem jest trwały izotop
3
He. Wykorzystując promieniotwórczy
izotop tryt można określić wiek wody odciętej od możliwości wymiany z innymi zbiornikami wód
oraz z parą wodną atmosfery, co powszechnie wykorzystywane jest w hydrogeologii.
Zmienność stosunków izotopowych wodoru jest niezwykle duża, większa niż innych pierwiastków.
Głównym procesem powodującym takie zróżnicowanie stosunków izotopowych wodoru jest
frakcjonowanie pod wpływem czynników fizycznych, głównie parowania. Do pary łatwiej
przechodzą cząsteczki zawierające prot niż deuter. Dlatego też powierzchniowe partie wody
morskiej są wzbogacone w deuter. Cząsteczki wody wzbogacone w lżejszy izotop wodoru, które
przeszły w stan pary, skraplają się nad lądami i dlatego wody słodkie są lżejsze niż woda morska.
Zarazem morskie wody przypowierzchniowe strefy równikowej, gdzie parowanie jest bardziej
intensywne, mają mniej protu niż wody strefy umiarkowanej. Kiedy woda przechodzi w lód,
następuje wzbogacenie w go w cięższy izotop w stosunku do tej części wody, która pozostała
ciekła. Analogiczne tendencje widać w rozkładzie izotopów trwałych drugiego składnika wody –
tlenu.
Wodór obecny jest także w gazach wulkanicznych i jest tam zubożony w deuter.

14
Załącznik 4
IZOTOPY WODORU
:
Dwa trwałe izotopy
:
1
1
H (prot) - 99,9844%
2
1
H (
2
1
D - deuter) - 0,0156%
Jeden izotop promieniotwórczy:
3
1
H (
3
1
T - tryt) - częstość trytu jest znikoma
Stosunki izotopowe w wodorze określane są zazwyczaj jako
D
w
stosunku do
wzorca SMOW
i mierzone w
‰:
1000
x
D/H
D/H
-
D/H
wzorca
wzorca
próbki
D
Oznaczenia D/H prowadzi się zwykle w gazowym H
2
, otrzymywanym
dzięki redukcji wody w wysokiej temperaturze (ok. 750
o
C),
przepuszczając ją nad rozgrzanym uranem.

15
TLEN
Po wodorze i helu trzeci z kolei najpospolitszy pierwiastek we wszechświecie. W składzie ziemi
odgrywa dużą rolę jako składnik atmosfery, hydrosfery oraz skorupy i płaszcza. Tlen posiada trzy
naturalne trwałe izotopy (Załącznik 5)
Wartości δ
18
O zmieniają się w przedziale blisko 100‰. Około połowa tego przedziału występuje w
wodzie meteorycznej. Większość skał jest wzbogacona w cięższy izotop, podczas gdy woda morska
i meteoryczna w lżejszy.
Zastosowanie badań zmienności składu izotopowego tlenu
Jednym z pierwszych zastosowań badań izotopów tlenu do rozwiązywania problemów
geologicznych była geotermometria. Zauważono bowiem, że wzbogacenie w
18
O węglanów
wapnia wytrąconych z wody morskiej w stosunku do tejże wody jest uzależnione od temperatury.
Obserwacja ta została szybko wykorzystania do określenia paleotemperatur mórz późnokredowych
półkuli północnej. Równocześnie metoda ta została rozwinięta w celu zastosowania jej dla
systemów wyżejtemperaturowych, w oparciu o rozdział izotopów tlenu pomiędzy parę minerałów
współwystępującą w danym środowisku skalnym. Tak więc są dwa podstawowe zastosowania
termometrii izotopowej: termometria nisko- i wysokotemperaturowa.
Geotermometria niskotemperaturowa (inaczej metoda paleotemperatur) stosowana jest do
określania temperatur w morzach ubiegłych okresów geologicznych. Stosuje się do tego ustalony
empirycznie wzór Epstein’a (Załącznik 6). δ
c
w tym wzorze to skład izotopowy badanej próbki, a
δ
w
to skład izotopowy CO
2
rozpuszczonego w wodzie morskiej (występującego jako jony HCO
3
─
),
w której próbka powstała. Skład izotopów tlenu jonów HCO
3
─
z danego okresu geologicznego
określa się na podstawie badań składu izotopowego węglanowych szkieletów organizmów, które w
niej żyły. Metoda ta oczywiście zakłada równowagę izotopową pomiędzy muszelkami a wodą
morską, czyli że nie dochodziło do frakcjonowania izotopów podczas ich wymiany pomiędzy
muszelką a wodą. Jednak nie wszystkie muszelki nadają się do tego celu:
-
jest wykluczone, aby ich metabolizm powodował frakcjonowanie izotopowe
-
organizmy powinny mieć zdolność rejestracji całej skali zmian temperatury wody
-
stosunki izotopowe utrwalone za ich życia, nie mogą ulec zmianie po ich śmierci
-
musi być znane ich środowisko bytowania: bentos, nekton, plankton itp.

16
Załącznik 5
IZOTOPY TLENU
Tlen posiada trzy naturalne, trwałe izotopy:
16
O - 99,763%
17
O - 0,0375%
18
O - 0,1995%
Stosunki izotopowe w tlenie określane są jako
18
O
bądź to w stosunku do
wzorca SMOW
lub, jak w przypadku pomiarów geotermometrycznych
niskotemperaturowych, w stosunku
do wzorca PBD
i mierzone w
‰:
1000
x
O
O/
O
O/
-
O
O/
wzorca
16
18
wzorca
16
18
próbki
16
18
18
O
Dla oznaczeń składu izotopowego w spektrometrze mas tlen jest
uwalniany:
a/ z krzemianów i tlenków poprzez fluorowanie F
2
lub BrF
5
i następnie
redukowane do CO
2
w wysokiej temperaturze (500-600
o
C),
b/ w węglanach CO
2
jest uwalniane przez reakcję z kwasem fosforowym
H
3
PO
4
w temperaturze 25
o
C (dla kalcytu i dolomitu).

17
Załącznik 6
METODA PALEOTEMPERATUR
Metoda ta stosowana jest do określenia temperatur w morzach ubiegłych
okresów geologicznych.
Węglany Ca wytrącane z wody morskiej są w stosunku do niej
wzbogacone w
18
O, gdyż zachodzi reakcja wymiany izotopowej:
)
O
C
(
3
1
O
H
)
O
C
(
3
1
O
H
2
-
3
16
16
2
2
-
3
16
18
2
Ponieważ istnieje zależność pomiędzy stałą równowagi tej reakcji k
(zależna od temperatury) a współczynnikiem frakcjonowania izotopowego
, można znając skład izotopowy tlenu w węglanie oraz skład izotopowy
tlenu wody, z której ten węglan się wytrącał, określić temperaturę, w
której to wytrącenie nastąpiło.
Stosuje się do tego wzór Epstein’a (1953) ustalony empirycznie:
T
o
C = 16.5 - 4.3(
c - w) + 0.14(c - w)
2
gdzie
c i w są odpowiednio
18
O CO
2
uzyskanego z węglanu i
18
O CO
2
znajdującego się w równowadze z wodą morską.
Metoda ta zakłada równowagę izotopową pomiędzy muszelkami
węglanowymi
morskich
organizmów
a
wodą
morską.

18
Do takich celów szczególnie przydatne są belemnity oraz małże i ramienionogi gruboskorupowe.
Obecnie coraz częściej przydatne są również otwornice. Znając zatem skład izotopowy tlenu w
badanej próbce oraz skład izotopowy jonów HCO
3
-
wody morskiej, z której próbka się wytrąciła,
możemy wyliczyć paleotemperaturę zgodnie ze wzorem Epstein’a.
Ponieważ temperatura przydennych wód oceanu zmienia się jako funkcja głębokości, jest również
możliwe wykorzystanie tlenowej geotermometrii izotopowej do oszacowania głębokości zbiornika
na podstawie analizy składu izotopowego skorupek organizmów bentonicznych, o ile spełniają
wyżej wymienione warunki. Geotermometria izotopowa tlenu jest też stosowana do określenia
temperatur precypitacji cementów, a więc rekonstrukcji temperatur krążących wód porowych.
Pomaga także oszacować temperatury aktywnych systemów geotermalnych oraz nawet temperatury
metamorfizmu niskiego stopnia.
Geotermometria wysokotemperaturowa tlenu stosowana jest w celu poznania temperatur
krystalizacji skał magmowych i temperatur przemian metamorficznych. Opiera się ona na
dystrybucji izotopów tlenu pomiędzy parę minerałów współwystępujących w skale. Jeśli dla
określonej pary minerałów posiadamy empiryczne wykresy zależności pomiędzy temperaturą a
współczynnikiem rozdziału izotopów tlenu między te minerały, to możemy je wykorzystać jako
geotermometry izotopowe. Takie pary minerałów muszą jednak spełniać szereg warunków
(Załącznik 7)
Wysokotemperaturowa geotermometria izotopowa tlenu jest również wykorzystywana do
określania temperatur powstawania niektórych typów złóż rud. Najlepszymi parami minerałów do
tych celów są pary kwarc – tlenki Fe (np. magnetyt lub hematyt), gdyż często one występują w
takich złożach (Załącznik 8).
Izotopy wodoru bywały także używane do metod geotermometrii, jednak z kiepskim skutkiem,
choć współwystępowanie dwóch lub więcej minerałów zawierających H w swoim składzie jest
dość powszechne w złożach rud i w skałach otaczających. Powodem tego jest słaba wrażliwość
izotopów wodoru na temperaturę, przy ich dużej czułości na zmiany składu chemicznego. Ponadto,
izotopy wodoru zawarte w minerałach mogą dość łatwo ulegać wymianie z fluidami krążącymi w
skale już po powstaniu złoża.
Poza zastosowaniem izotopów tlenu do metod geotermometrycznych, możemy również dzięki
nim określić jakiego rodzaju skała była protolitem dla skały metamorficznej. Możemy także dość
łatwo odróżnić węglany słodkowodne od morskich oraz ziarna detrytyczne od autigenicznych (np.
cementy). Analiza składu izotopów tlenu cementów może dać nam informacje o temperaturze ich

19
Załącznik 7
GEOTERMOMETRIA IZOTOPOWA WYSOKOTEMPERATUROWA
Stosowana jest w celu poznania temperatur krystalizacji skał magmowych
i temperatur powstania skał metamorficznych i opiera się na dystrybucji
18
O pomiędzy parę minerałów współwystępujących w pewnej skale.
Para minerałów przydatna dla celów geotermometrii izotopowej powinna
mieć następujące właściwości:
1. Muszą to być pospolite minerały skałotwórcze, występujące zwykle
razem,
2. Powinny być one wspólnie trwałe w szerokim zakresie temperatur i
ciśnień,
3. Powinny wykazywać niewielką zmienność składu chemicznego, gdyż
rozdział izotopów tlenu między dwa minerały zależy od ich składu.
Warunkiem przydatności izotopów tlenu jako geotermometrów jest
istnienie równowagi izotopowej między rozpatrywanymi minerałami.
Z różnych par minerałów najbardziej przydatna dla geotermometrii
izotopowej jest para
kwarc-magnetyt
. Inne stosowane pary minerałów to:
kwarc-adular, skaleń-magnetyt, piroksen-magnetyt.

20
Załącznik 8
Przykład obliczania temperatury przy wykorzystania badań trwałych
izotopów tlenu
Dane:
Dla pary współwystępujących minerałów kwarcu i ortopiroksenu z facji granulitowej
metapelitów pomierzono δ
18
O (dane z: Huebner et al. 1986, próbka Bb25c):
δ
18
O
kwarc
= 10.2 ‰
δ
18
O
ortopiroksen
= 7.9 ‰
Teoria:
Temperaturowa zależność frakcjonowania
18
O pomiędzy kwarc i piroksen została
obliczona eksperymentalnie przez Chiba et al. (1989) i Javoy (1977) i wyrażona
wzorem:
1000ln
2
6
10
75
.
2
AB
T
Wyliczenie temperatury:
W tym przypadku nie możemy zastosować przybliżenia
AB
=
A
–
B
(
AB
– 1)10
3
lub
AB
1000ln
AB
ponieważ wartość
dla kwarcu jest > 10.0, dlatego też musimy użyć następującego
wzoru na współczynnik frakcjonowania izotopowego:
B
1000
A
1000
B/1000
1
A/1000
1
AB
Czyli:
kwarc-px
= 1010.2/1007.9 = 100228
1000ln
= 2.279
Z eksperymentalnie wyznaczonego wzoru dla pary kwarc-piroksen:
2.279 = 2 750 000/T
2
T = 1098 K = 825
o
C

21
krystalizacji. Jednak często obliczone temperatury w sposób jasny i drastyczny nie zgadzają się z
innymi, pewniejszymi danymi, np. płynącymi z analizy inkluzji fluidalnych. Świadczy to wówczas
o tym, że macierzyste cementom roztwory porowe uległy już wcześniej frakcjonowaniu
izotopowemu w wyniku pewnych procesów. W takim wypadku użycie izotopów tlenu jako
geotermometra jest wykluczone, ale często możliwe jest określenie pochodzenia tych roztworów
porowych, np. dopływ wody meteorycznej zubożonej w cięższy izotop tlenu może powodować
zawyżenie wartości paleotemperatury.
Badania izotopów tlenu w połączeniu z izotopami wodoru udowodniły, że są one bardzo
ważnym narzędziem przy badaniu procesów geologicznych, w których bierze udział woda.
Szczególne znaczenie ma możliwość identyfikacji źródeł i genezy fluidów złożotwórczych, np. wód
hydrotermalnych generujących złoża rud kruszców. Można wyróżnić 6 typów naturalnie
występujących wód złożotwórczych. Okazuje się, że wody te mają bardzo różny skład izotopów
wodoru i tlenu.
1. Wody meteoryczne wykazują największe wahania składu izotopowego tlenu i wodoru ze
wszystkich typów wód. Ta znaczna zmienność wywołana jest przez procesy frakcjonowania
izotopowego natury fizycznej: parowania, skraplania, zamarzania. Istnieje liniowa zależność
między δ
18
O a δD. Izotopy obu pierwiastków w obiegu wody meteorycznej zachowują się bardzo
podobnie. Parowanie wzbogaca parę w lżejsze, a wodę w cięższe izotopy. Proces skraplania
prowadzi do frakcjonowania w odwrotnym kierunku. Skład izotopowy wody deszczowej zależy od
temperatury powietrza – im niższa temperatura, tym opady zubożone w cięższe izotopy. Stąd też im
wyższa szerokość geograficzna oraz wysokość nad poziom morza, tym bardziej ujemne wartości
delta. Opady letnie w podobny sposób również są izotopowo „cięższe” od zimowych, co znajduje
zastosowanie w glacjologii do rozróżnienia rocznych warstw lodu. Wykorzystano skład izotopowy
tlenu w badaniach czapy lodowej Grenlandii do uchwycenia holoceńskich zmian klimatycznych.
2. Woda morska współczesna jest jednorodna pod względem składu izotopowego H i O, co przy
tak łatwej i szerokiej dostępności czyni ją doskonałym materiałem referencyjnym. Bardzo silne
parowanie lub silne wysłodzenie zbiorników morskich o utrudnionym połączeniu z oceanami może
jednak prowadzić odpowiednio do wzbogacenia (M. Czerwone) lub zubożenia (M. Bałtyckie) w
cięższe izotopy. Skład izotopowy wody morskiej w przeszłości ulegał zmianom prawdopodobnie w
związku ze zlodowaceniami, bo zamarzanie prowadzi do związania cięższych izotopów w lodzie i
wzbogaceniu w lżejsze izotopy wody. W czasie zlodowaceń izotopowo „ciężka” woda zamknięta
była w postaci lodu, a woda morska miała ujemne wartości delta, a przy zaniku lądolodów
uwalniana była izotopowo „ciężka” woda do oceanów prowadząc do podwyższenia ich
współczynników delta.

22
3. Wody geotermalne gorących źródeł, gejzerów itp. są obecnie najczęściej pochodzenia
meteorycznego, ale nieco wzbogacone w cięższe izotopy H i O w związku z wymianą izotopową ze
skałami otaczającymi o dodatnich delta. Możliwe jest często dokładne określenie pochodzenia tych
wód, np. okazało się, że Wielki Gejzer na Islandii zasilany jest wodami wytapianymi z lodowca
Langjökull oddalonego o 20 km.
4. Wody formacyjne pochodzą bezpośrednio z basenów sedymentacyjnych i wykazują szeroki
zakres stosunków izotopowych H i O. Na ich skład izotopowy mogą mieć wpływ nie tylko wody
meteoryczne, ale także z innego źródła, np. ze skał otaczających lub przechwycona woda morska w
czasie sedymentacji (wody opadowe w czasie sedymentacji lądowej czy woda morska w czasie
sedymentacji morskiej). Dodatkowo tryt dzięki relatywnie krótkiemu okresowi połowicznego
rozpadu znajduje zastosowanie w hydrogeologii do datowania wód podziemnych, a dzięki temu do
określania szybkości zasilania, szybkości przepływu oraz dróg przepływu wód podziemnych.
5. Wody magmowe mają skład izotopów H i O trudny do ustalenia, ponieważ wiele magm
współdziała z wodami gruntowymi. Różni badacze uzyskali bardzo różne rezultaty, które trudno
poddać interpretacji.
6. Wody metamorficzne mają dość szeroki zakres stosunków izotopowych H i O, ale podobnie jak
wody magmowe, są trudne do jednoznacznej interpretacji. Analizy obu tych typów wód muszą
zatem być uzupełniane innymi badaniami, np. badaniami składu izotopowego roztworów z inkluzji
fluidalnych lub też badaniami grup hydroksylowych minerałów uwodnionych.
W związku z tym, że wody z różnych środowisk geologicznych mają różny skład izotopowy,
zostało to wykorzystane przede wszystkim do określenia pochodzenia fluidów złożotwórczych.
Badając złoża rud kruszców analizujemy skład izotopowy roztworów kopalnych przechwyconych
w inkluzji fluidalnych, bądź dokonujemy pomiarów stosunków izotopowych grup hydroksylowych
bezpośrednio w minerałach.

23
SIARKA
Siarka ma 4 trwałe izotopy (Załącznik 9)
Skład izotopowy siarki w meteorytach wykazuje niewielkie wahania i dla wzorcowego troilitu z
meteorytu z kanionu Diablo wynosi około 0‰. Skały magmowe poza granitami mają skład
izotopowy o niewielkich odchyleniach od wzorca, czyli od meteorytów, a także bazaltów
księżycowych. Przypuszcza się, że odpowiadają one swoim składem izotopów siarki górnemu
płaszczowi. Granity wykazują większe zróżnicowanie izotopów siarki i większość z nich jest
wzbogacona w cięższy izotop z uwagi na złożoną ewolucję stopów granitoidowych. Znacznie
większa zmienność stosunków izotopów siarki występuje w siarce kruszcowych złóż
hydrotermalnych. Tę zmienność można wykorzystać do rozwiązywania wielu problemów
złożowych (Załącznik 10)
Termometria izotopowa siarki opiera się na eksperymentalnie oznaczonych współczynnikach
frakcjonowania izotopów siarki pomiędzy współwystępujące pary minerałów zawierających siarkę.
Najbardziej wiarygodną jest para sfaleryt-galena. Oczywiście musi być spełniony warunek, że w
czasie tworzenia się złoża panowały warunki równowagi izotopowej. Jeśli mamy dwa oznaczenia
temperatury z dwóch par minerałów i oba rezultaty są zgodne, to oznacza, że taka równowaga
izotopowa istniała.
W środowiskach hipergenicznych obserwuje się największe zróżnicowanie stosunków izotopowych
siarki. Skały osadowe mogą mieć więc bardzo różne wartości delta. Wymiana izotopowa zachodzi
w środowiskach wodnych w wyniku przemian nieorganicznych i biochemicznych, ale znacznie
mocniejsze frakcjonowanie zachodzi przy procesach biochemicznych. Polegają one na redukcji
jonów siarczanowych, które są powszechnie obecnie w wodach przez bakterie anaerobowe do
siarczków. W wyniku późniejszych przemian może dojść do powstania złóż siarki rodzimej.
Generalnie stosunki izotopowe S maleją wraz ze stopniem utlenienia S.
Siarczany rozpuszczone są w wodzie morskiej w znacznych ilościach i we wszystkich oceanach
mają niezwykle stabilny skład – około +20‰. Procesy wytrącania siarczanów z wody morskiej nie
powodują jakiegokolwiek frakcjonowania, a więc możemy poznać także skład izotopów siarki
dawnych oceanów oznaczając skład izotopowy siarki w złożach solnych o różnym wieku
geologicznym. Posiadając już krzywą zmienności składu izotopowego siarki w wodzie morskiej
dawnych okresów geologicznych, możemy wykorzystać skład izotopów siarki badanego złoża do
jego wydatowania.

24
Załącznik 9
IZOTOPY SIARKI
Siarka ma cztery trwałe izotopy:
32
S - 95,02%
33
S - 0,75%
34
S - 4,21%
36
S - 0,02%
Dwa izotopy promieniotwórcze to
31
S i
35
S.
Stosunek dwóch najczęściej występujących izotopów
34
S/
32
S jest używany
w geochemii izotopów i wyrażany jako
34
S
w
‰
w stosunku do wzorca,
którym jest
troilit (FeS)
z meterorytu metalicznego Canyon Diablo:
1000
x
S
S/
S
S/
-
S
S/
wzorca
32
34
wzorca
32
34
próbki
32
34
34
S
Oznaczenia stosunków izotopowych siarki dokonuje się najczęściej
przeprowadzając różne chemiczne postacie siarki w gaz SO
2
.
Czyste siarczki utlenia się do SO
2
rozmaitymi utleniaczami, jak CuO lub
O
2
. Analiza in situ drobnych przerostów siarczków jest obecnie
wykonywana przy zastosowaniu mikrosondy jonowej i mikrosondy
laserowej.

25
Załącznik 10
Badania izotopowe siarki złóż hydrotermalnych pozwalają:
1. Określić źródło siarki obecnej w złożu w postaci siarczków i
siarczanów,
2. Określić temperatury precypitacji siarczków i temperatury fluidów
złożotwórczych,
3. Określić osiągnięty stopień równowagi,
4. Skonstruować ogólny model powstania złoża.
A/ Złoża, w których
34
S nieznacznie odbiega od 0‰ - w nich siarka
pochodzi najprawdopodobniej ze źródeł magmowych (źródło pierwotne
siarki to górny płaszcz).
B/ Złoża o wartości
34
S ponad +20‰ - siarka tych złóż pochodzi z
siarczanowej siarki wody morskiej lub z morskich ewaporatów. Przykład
złoże Kuroko (masywnych siarczków Pb-Zn) - wysokotemperaturowa
redukcja siarczanów wody morskiej.
C/ Złoża o pośrednich wartościach
34
S (+5 do +15‰) - siarka tych złóż
może być różnego pochodzenia, np. z otaczających skał, mieszanina siarki
ewaporatów i skał osadowych.
D/ Ujemne wartości wskazują na procesy mikrobialne prowadzące do
redukcji siarki do H
2
S i S
2
.

26
WĘGIEL
Węgiel jest najpospolitszym po H, He i O pierwiastkiem we wszechświecie. Ma on dwa trwałe
izotopy (Załącznik 11)
Węgiel w przyrodzie występuje w różnych formach: utlenionej (CO
2
, węglany), zredukowanej
(metan, węgiel organiczny), oraz jako grafit i diament. Analiza składu izotopowego węgla daje nam
głównie informacje o pochodzeniu tego węgla oraz w ograniczonym zakresie służy nam jako
geotermometr. Zależność składu izotopów węgla od temperatury została wykorzystana do
oszacowania temperatur metamorfizmu. Stosuje się do tego termometr kalcytowo-grafitowy, który
rejestruje temperatury powyżej 600ºC.
W skałach magmowych i w gazach wulkanicznych wartości δ
13
C mieszczą się w dość wąskich
zakresach, a węgiel w nich zawarty ma pochodzenie nieorganiczne. Daje to ograniczone
możliwości interpretacji i użycia izotopów węgla.
Inaczej jest w skałach węglanowych. Jony HCO
3
–
w wodzie morskiej mają skład 0‰, a muł
węglanowy z niej wytrącony będzie miał skład zbliżony do tej wartości (od -1 do +2‰). Szkielety
węglanowe bioklastów zawartych w skałach węglanowych mogą być już bardziej frakcjonowane w
wyniku rozmaitych procesów metabolicznych, ale wartości δ
13
C nie będą wykraczać poza przedział
od -15 do +5‰. Większe odchylenia od średniego składu HCO
3
–
wody morskiej są możliwe
jedynie w przypadku zajścia późniejszej wymiany izotopowej pomiędzy węglanami a otoczeniem,
np. w wyniku ich rekrystalizacji. Dlatego właśnie im starsze skały węglanowe, tym bardziej ich
skład odbiega od średniego składu HCO
3
–
wody morskiej.
Węgiel organiczny ze skał osadowych ma stosunek izotopów węgla około -30‰. W czasie
diagenezy węgiel organiczny ulega utlenianiu w związku z rozkładem materii organicznej. W ten
sposób do wód porowych dostarczany jest CO
2
o składzie izotopów węgla odpowiadającym
wyjściowemu węglowi organicznemu (może zajść jedynie bardzo słabe frakcjonowanie). Cementy
węglanowe wytrącone z tych wód porowych będą także miały skład izotopów węgla około -30‰ i
będą łatwo odróżnialne od węglanowych składników allogenicznych (detrytycznych i
biogenicznych). W głębszych strefach diagenetycznych zachodzi fermentacja, w wyniku czego
generowane są węglowodory (głównie metan) o składzie izotopów węgla silnie zubożonym w
13
C
(zmiana δ
13
C o 45‰ do około -75‰), oraz CO
2
odpowiednio wzbogacony w
13
C, co daje mu skład
około +15‰. Jeżeli następnie metan ulegnie migracji do płytkich stref diagenetycznych, wówczas
zostanie utleniony do CO
2
– proces ten powoduje dalsze frakcjonowanie izotopów węgla nawet do
wartości -100‰, które mogą zostać zarejestrowane w krystalizujących cementach węglanowych.

27
W bardzo głębokich strefach diagenezy w wyniku podwyższonej temperatury dochodzi do
dekarboksylacji i generacji węglowodorów (ropy i gazu) termogenicznych, których δ
13
C będzie
wyższe ~ -45‰ niż metanu biogenicznego.
Podsumowanie. Połączone badania izotopów węgla i tlenu węglanów pozwalają na rozróżnienie
węglanów różnego pochodzenia. Badania trwałych izotopów węgla pozwalają na określenie źródła
węgla w węglanach i dzięki nim można odróżnić między węglem morskim, organicznym i
pochodzącym z węglowodorów biogenicznych bądź termogenicznych. Badania izotopów tlenu w
węglanach osadowych mogą być z kolei użyte do określenia genezy fluidów, z których się
wytrącały, oraz do wyliczenia temperatury tej reakcji używając termometru Epstein’a.

28
Załącznik 11
IZOTOPY WĘGLA
Węgiel ma dwa trwałe izotopy:
12
C - 98,89%
13
C - 1,11%
oraz jeden izotop promieniotwórczy
14
C, którego udział w węglu ziemskim
jest znikomy.
Skład izotopowy węgla wyrażany jest zwykle jako
13
C
w
‰
w stosunku
do
wzorca PBD
. Obecnie wzorzec ten jest wyczerpany i używa się
dlatego nowego wzorca -
wapieni z Solnhofen, Bawaria:
1000
x
C
C/
C
C/
-
C
C/
wzorca
12
13
wzorca
12
13
próbki
12
13
13
C
Oznaczenia stosunku
13
C/
12
C przeprowadza się w spektrometrze mas na
gazowym CO
2
:
a/ w węglanach pomiary wykonywane są na CO
2
uwalnianym podczas
reakcji węglanu z kwasem fosforowym H
3
PO
4
.
b/ składniki organiczne utlenia się w bardzo wysokiej temperaturze (900-
1000
o
C) w strumieniu tlenu, przy dodatkowym zastosowaniu CuO jako
katalizatora.

29
CO DAJĄ BADANIA TRWAŁYCH IZOTOPÓW WODORU, TLENU, WĘGLA I SIARKI
W GEOLOGII ZŁÓŻ?
Kiedy badania trwałych izotopów są uzupełnione innymi badaniami geochemicznymi i
mineralogicznymi (np. badaniami paragenez mineralnych i reakcji fazowych minerałów, badaniami
pierwiastków śladowych oraz inkluzji fluidalnych), analizowanymi z uwzględnieniem ram
ustalonych w trakcie badań geologicznych (np. paleogeograficzne i strukturalne położenie złoża),
wówczas na ich podstawie możemy skonstruować model genetyczny złoża rud.
Badania trwałych izotopów H, O, C i S pozwalają przede wszystkim:
określić warunki fizyko-chemiczne powstawania złoża
(zwłaszcza temperaturę).
określić źródło niektórych składników złoża: zwłaszcza źródło
S, C i metali.
określić źródło fluidów złożotwórczych, ich skład chemiczny,
pH itp.
określić mechanizmy transportu metali i siarki oraz mechanizmy
depozycji rud.
W szczególnych przypadkach nadają się do datowania złóż (S).

30
Skrypt przygotowano korzystając z następujących źródeł:
Polański, A (1979) – Izotopy w geologii. Wydawnictwa Geologiczne, Warszawa, 337 str.
Hoefs, J. (1973 & 1987) – Stable isotope geochemistry. Springer-Verlag, Berlin, Heidelberg, 208
str.
Rollinson, H (1994) – Using stable isotope data. In: Using geochemical data: evaluation,
presentation, interpretation. Longman Scientific & Technical, str. 266-315.
Ohmoto, H (1986) – Stable isotope geochemistry of ore deposits. In: Reviews in Mineralogy, vol.
16 – Stable isotopes in high temperature geological processes, str. 491-559.
White, W. M. (2005) – Stable isotope geochemistry. Chapter 9 in: Geochemistry, str. 358-414
Wyszukiwarka
Podobne podstrony:
Geologia złóż (projekt) - Adrian Banaś, agh, geologia złóż
GEOLOGIA ZŁÓŻ, Ściąga z geologii złóż, ściąga
GEOLOGIA ZŁÓŻ Ściąga z geologii złóż
Geologia złóż - pytania egzaminacyjne (02) - opracowanie, Ochrona Środowiska studia, 4 rok (2009-201
pierwsza praca], Materiały, Geologia, Geologia złóż
Geologia złóż - pytania egzaminacyjne (01), Ochrona Środowiska studia, 4 rok (2009-2010), Semestr VI
tekst, Materiały, Geologia, Geologia złóż
Bryk2, Materiały, Geologia, Geologia złóż
SUROWCE MÓRZ I OCEANÓW, Materiały, Geologia, Geologia złóż
Geologia złóż - pytania egzaminacyjne (02), Ochrona Środowiska studia, 4 rok (2009-2010), Semestr VI
Pytania ze złóż 2007, Materiały, Geologia, Geologia złóż
Temat 1-2 konspekt, Studia Inżynierskie - Geodezja AGH, Podstawy geotechniki i geologii złóż
GEOLOGIA ZŁÓŻ, G. Z. dopisane, Złoże metamorficzne - forma złoża jest zazwyczaj pokładowa, niekiedy
Projekt geologia złóż Wskazówki
więcej podobnych podstron