
1.
Wstęp teoretyczny.
Metody spektroskopowe są to metody opierające się na oddziaływaniu
promieniowania elektromagnetycznego z
materią. Polegają na absorpcji lub emisji
promieniowania
elektromagnetycznego przez próbkę badanej substancji. W
metodach spektroskopowych dokonuje
się pomiaru natężenia promieniowania
przechodzącego w funkcji długości fali. Stanowią one zespół technik
in
strumentalnych, w których do celów analitycznych wykorzystuje się przejścia
energetyczne
zachodzące w cząsteczkach na skutek oddziaływania promieniowania
elektromagnetycznego.
P
romieniowanie elektromagnetyczne przechodzące przez dany ośrodek może
ulec absorpcji, odbiciu i rozproszeniu. W metodach spektrofotometrycznych
wykorzystuję się zjawisko absorpcji promieniowania. Zarówno zjawiska odbicia jak i
rozproszenia
mogą zostać wyeliminowane podczas porównywania próbki badanej z
próbką odniesienia. W metodach spektrofotometrycznych wykorzystuje się zjawisko
absorpcji promieniowania. Warunkiem wystąpienia tego zjawiska jest, aby energia
padającego promieniowania odpowiadała różnicy energii poziomów energetycznych
elektronów w absorbującej cząsteczce lub jonie, tzn. aby elektrony mogły być
przeniesione ze stanu podstawowego do stanu wzbudzonego.
Absorpcjometria wykorzystuje zdolno
ść substancji chemicznych pozostających w
roztworze do pochłaniania światła całą swą objętością. Zwykle różne substancje
pochłaniają promieniowanie świetlne o odmiennej długości fali. Jeśli jednak
pochłaniają fale tej samej długości, to z różną intensywnością. Absorpcję światła w
zakresie widzialnym wykazuj
ą związki nieorganiczne, przede wszystkim jony mające
niecałkowicie zapełniony orbital d osłonięty wyższymi orbitalami zapełnionymi
elektronami, zwi
ązki kompleksowe wszystkich pierwiastków przejściowych z
niecałkowicie zapełnionym orbitalem d oraz barwne związki organiczne, np.
wska
źniki pH stosowane w alkacymetrycznej analizie miareczkowej. Absorpcję
światła w zakresie ultrafioletu wykazują bezbarwne związki organiczne, zawierające
np. wi
ązania podwójne. Wielkością pozwalającą ocenić spadek natężenia wiązki
światła po przejściu przez warstwę roztworu substancji pochłaniającej światło jest
absorbancja. Krzywa, okre
ślająca zależność absorpcji promieniowania od długości
fali, stanowi widmo absorpcyjne. Widmo absorpcyjne danej substancji pozwala
okre
ślić długości fal promieniowania, które są przez nią absorbowane, oraz długość
fali, przy której absorbancja ma największą wartość (Amax). Następnie przy tej
długości fali mierzy się zarówno absorbancję wzorcowych roztworów danej substancji
o znanych st
ężeniach , jak również absorbancję roztworu oznaczanego o nieznanym
st
ężeniu.
Najwi
ększą zaletą absorbancji jest jej wprost proporcjonalna zależność od
st
ężenia. Wykres zależności absorbancji od stężenia w dostatecznie szerokim
zakresie ma kształt krzywej logarytmicznej. Prawo Bouguera-Lamberta-Beera stosuje
si
ę tylko do początkowego odcinka wykresu, który jest prostoliniowy i nazywa się
wykresem kalibracyjnym. Mo
żna z niego odczytać szukane stężenie roztworu po
zmierzeniu warto
ści jego absorbancji. W wykresie kalibracyjnym mogą zdarzać się
ujemne lub dodatnie odchylenia od prostoliniowej zale
żności. Odchylenia od prawa
Lamberta-Beera mog
ą być spowodowane zbyt wysokim stężeniem substancji, które
powoduje,
że jedne cząsteczki są „przesłaniane” przez inne, co daje efekt
zmniejszonego pochłaniania światła. Innymi przyczynami odchyleń od tego prawa

mog
ą być takie zjawiska, jak: dysocjacja lub asocjacja związków chemicznych, które
wpływają na ich własności optyczne. Metodą kolorymetryczną można oznaczać
ilo
ściowo substancje barwne, których stężenie w 1 ml roztworu jest rzędu kilkunastu
nanomoli.
2.
Cel ćwiczenia.
Celem ćwiczenia było przygotowanie i wykreślenie krzywej A(c), czyli zależności
absorbancji o
d stężenia czynnika w roztworze, wyznaczenie próbki, dla której
długości fali będzie jak największa oraz określenie stężenia Cr
6+
w trzech roztworach.
3.
Przebieg ćwiczenia.
Na początku ćwiczenia przygotowano roztwory wzorcowe. Trzy probówki z
odpowiednio 0,5; 3 i 7 ml badanego roztworu dopełniono wodą destylowaną do 10
ml, a następnie dodano po 1 ml difenylokarbazydu do każdej, zachowując
szczególną ostrożność, aby nie zanurzyć pipety w roztworze. Kolejnym etapem było
mierzenie długości fali światła absorbowanego dla substancji wzorcowych za pomocą
spektrofotometru. W wyniku pomiarów powstała krzywa Gaussa, z której odczytano λ
dla każdej substancji. Równolegle przygotowano roztwory o nieznanym stężeniu do
kolejnych badań. Do każdej z trzech wybranych przez nas zlewek (ZAD1, ZAD2,
ZAD3) o objętości 10ml dodano 1 ml difenylokarbazydu. Roztwór wlano do
próbników i umieszczono kolejno w spektrofotometrze. Postępując zgodnie z
instrukcją odczytano stężenia badanych substancji.
4. Obliczenia.
Obliczenia stechiometryczne
stężenia roztworów próbek wzorcowych 0,5; 3 i 7 ml:
1) 0,5 ml Cr
1ml
– 0,002 mg Cr
0,5ml
– X mg Cr
X = 0,5*0,002 = 0,001 mg Cr
10 ml
– 0,001 mg Cr
1000 ml
– c
1
Cr
c
1
= 1000*0,001/10 = 0,1 mg/l
2) 3 ml Cr
1ml
– 0,002 mg Cr
3 ml
– X mg Cr
X = 3*0,002 = 0,006 mg Cr
10 ml
– 0,006 mg Cr
1000 ml
– c
2
Cr
c
2
= 1000*0,006/10 = 0,6 mg/l
3) 7 ml Cr
1ml
– 0,002 mg Cr
7 ml
– X mg Cr
X = 7*0,002 = 0,014 mg Cr
10 ml
– 0,014 mg Cr
1000 ml
– c
3
Cr
c
3
= 1000*0,014/10 = 1,4 mg/l
5.
Wyniki i wnioski z przeprowadzonych badań laboratoryjnych.
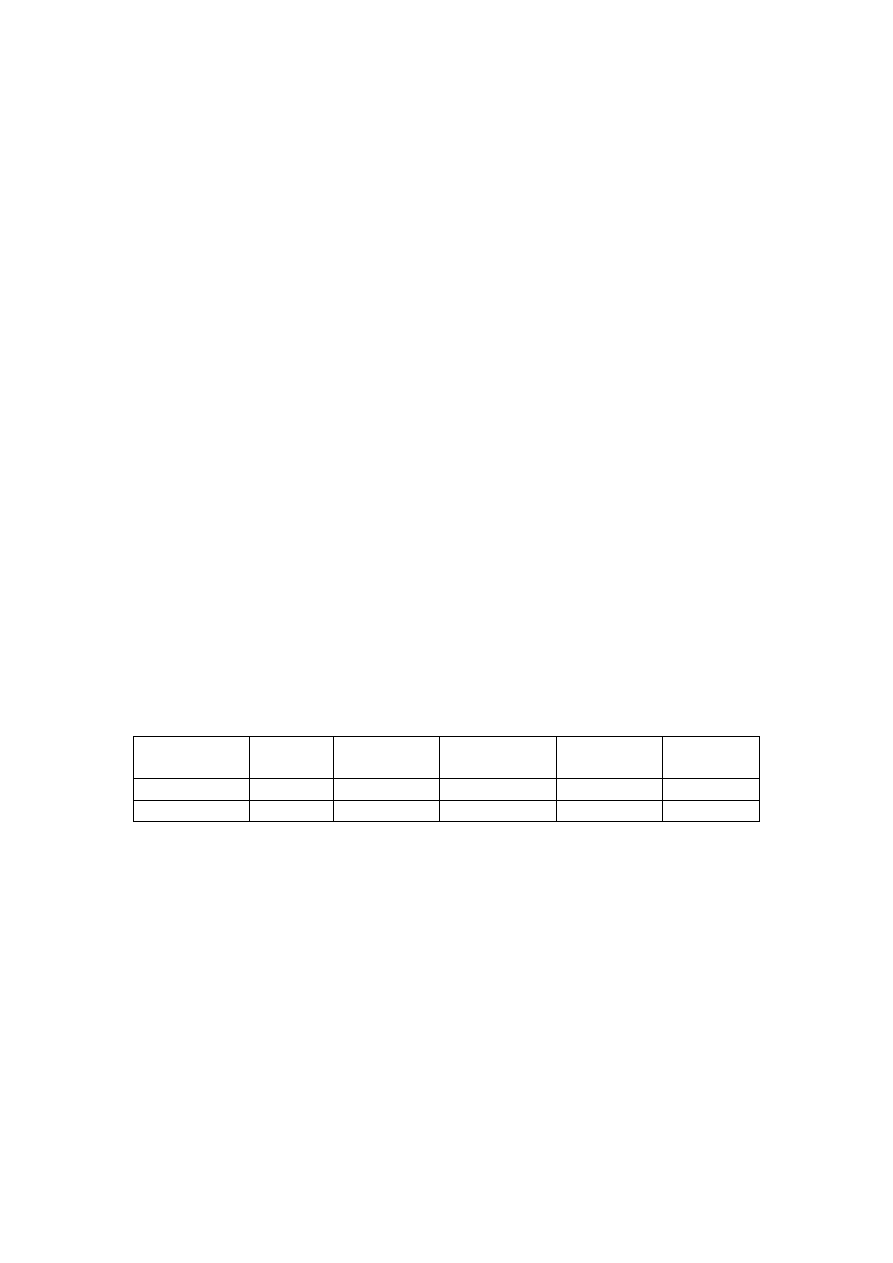
Wyniki przedstawione
w tabeli są rezultatem obliczeń oraz odczytu wskazań
spektrofotometru:
Parametr
Symbol Jednostka
Roztwór
0,5 ml
Roztwór
3 ml
Roztwór
7ml
Stężenie Cr
c
mg/l
0,1
0,6
1,4
Absorbancja
Abs
-
0,105
0,735
1,699
Równanie krzywej:
c = a + bA + cA’ + dA
3
b = 0,8231; r
2
= 1
Na podstawie powyższej analizy przy użyciu spektrofotometru uzyskano największą
długość fali „λ” dla próbki z 3 ml roztworem Cr:
λ
max
= 543 nm
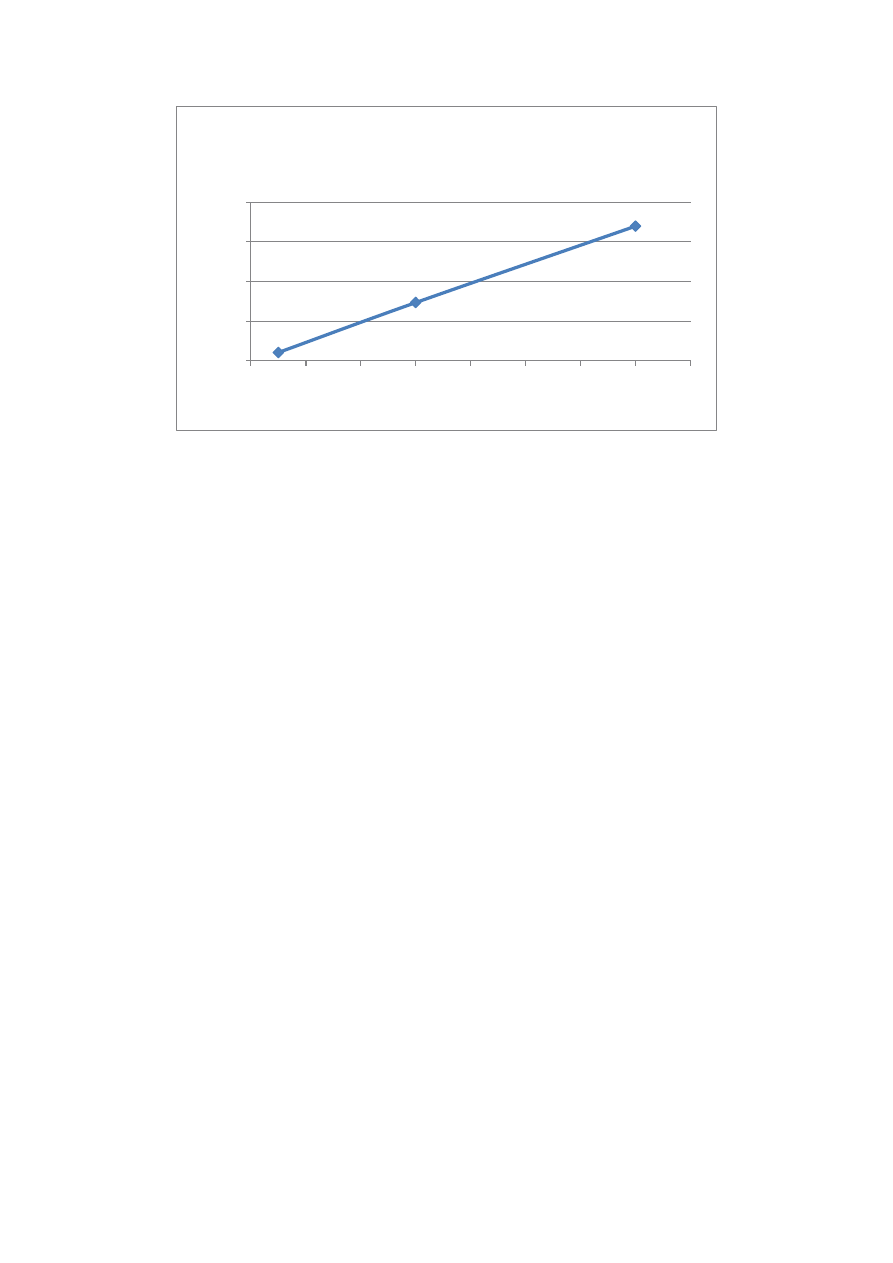
Absorbancja jest wprost proporcjonalna do stężęnia, dzięki czemu możliwe jest
określenie stężeń roztworów dysponując wartością absorbancji.
Na podstawie wypracowanej krzywej
określiliśmy stężenia czynnika we wcześniej
przygotowanych roztworach ZAD1, ZAD2 i ZAD3
przy użyciu spektrofotometru:
ZAD1
– 1,35 mg/l
ZAD2
– 0,04 mg/l
ZAD3
– 0,02 mg/l
Spektrofotometr pozwala z powodzeniem określić nieznane stężenia roztworów, w
określonym zakresie długości fali, mierząc absorbancję roztworów wzorcowych o
znanych stężeniach.
0
0,5
1
1,5
2
0
0,2
0,4
0,6
0,8
1
1,2
1,4
1,6
A
b
sor
an
cja "
A
b
s"
Stężenie "c" [mg/l]
Zależność absorbancji od stężenia
A(c)
Wyszukiwarka
Podobne podstrony:
Ćw 1 Pomiar strumienia objętości i masy płynu przy użyciu rurek spiętrzających
Wykonywanie robót ziemnych przy użyciu koparek
Oznaczanie filtracji przy stałym i zmiennym gradiencie hydraulicznym
Cele nauczania wyrażone przy użyciu czasowników operacyjnych, edukacja specjalna
1 Wyznaczanie wartości przyspieszenia ziemskiego g przy użyciu wahadła matematycznego instr przys
Pomiary wykonaliśmy przy użyciu suwmiarki oraz mikrometru
Sprawko w11 Mis, MIBM WIP PW, fizyka 2, laborki fiza(2), 51-Badanie własności promieniowania gamma
Metoda mostkowa przy użyciu technicznego mostka Wheatstone
BADANIE WIDM OPTYCZNYCH PRZY POMOCY SPEKTROMETRU2, Sprawozdania - Fizyka
Programowanie sieciowe przy użyciu gniazdek w?lphi 3 MPLMRFGCOQC4VOMKHU5DAT5YKUDWUHLWUTINXRI
Badanie widm optycznych przy pomocy spektroskopu
BOHR43, WYZNACZANIE D˙UGO˙CI FALI ˙WIETLNEJ PRZY POMOCY SPEKTROSKOPU PRYZMATYCZNEGO.
BOHR43, WYZNACZANIE D˙UGO˙CI FALI ˙WIETLNEJ PRZY POMOCY SPEKTROSKOPU PRYZMATYCZNEGO.
Cw 4 Karta Pomiary temperatury przy uzyciu
ABC zasad bezpieczenstwa przetwarzania danych osobowych przy uzyciu systemow
Identyfikacja miejskiej przestrzeni publicznej przy użyciu alternatywnych form oświetlenia
2006 06 RSA w PHP chronimy nasze dane przy użyciu kryptografii asymetrycznej [Kryptografia](1)
27 Wyznaczanie prędkości dźwięku w powietrzu w oparciu o efekt Dopplera i przy użyciu oscyloskopu
więcej podobnych podstron