1
Fale materii
FALE MATERII
W 1924 r. de Broglie zapostulował,
ż
e skoro
ś
wiatło ma
dwoist
ą
, falowo-cz
ą
stkow
ą
, natur
ę
, to tak
ż
e materia mo
ż
e
mie
ć
tak
ą
natur
ę
.
Klasyczna teoria elektromagnetyzmu
ś
wiatło o energii
E
ma p
ę
d
p = E/c
f
h
p
λ
=
Hipoteza
długo
ść
przewidywanych fal materii jest okre
ś
lona tym samym zwi
ą
zkiem, który
stosuje si
ę
do
ś
wiatła
p
h
=
λ
Wyra
ż
enie to wi
ąż
e p
ę
d cz
ą
stki materialnej z długo
ś
ci
ą
przewidywanych fal materii
Hipoteza de Broglie’a (1924, Nagroda Nobla w 1929)
2
Przykład: Jaka długo
ść
fal materii odpowiada
„masywnym”
obiektom np. piłce, o masie
1 kg, poruszaj
ą
cej si
ę
z pr
ę
dko
ś
ci
ą
10 m/s, a jaka
„lekkim”
elektronom przyspieszonych
napi
ę
ciem 100 V?
Dla
piłki
p = mv = 1 kg·10 m/s = 10 kg m/s
m
10
6
.
6
kgm/s
10
Js
10
6
.
6
35
34
−
−
⋅
=
⋅
=
=
p
h
λ
λ ≅
0 (w porównaniu z rozmiarami obiektu)
do
ś
wiadczenia prowadzone na takim obiekcie
nie pozwalaj
ą
na rozstrzygni
ę
cie czy materia wykazuje własno
ś
ci falowe.
Elektrony
przyspieszone napi
ę
ciem
100 V uzyskuj
ą
energi
ę
kinetyczn
ą
E
k
= eU = 100 eV = 1.6·10
-17
J
s
m
.
kg
.
J
.
6
31
17
10
9
5
10
1
9
10
6
1
2
2
⋅
=
⋅
⋅
⋅
=
=
−
−
m
E
k
v
nm
12
.
0
m
10
2
.
1
s
m
kg
10
9
.
5
10
1
.
9
Js
10
6
.
6
v
10
6
31
34
=
⋅
=
⋅
⋅
⋅
⋅
=
=
=
−
−
−
m
h
p
h
λ
Jest to wielko
ść
rz
ę
du odległo
ś
ci mi
ę
dzyatomowych w ciałach stałych.
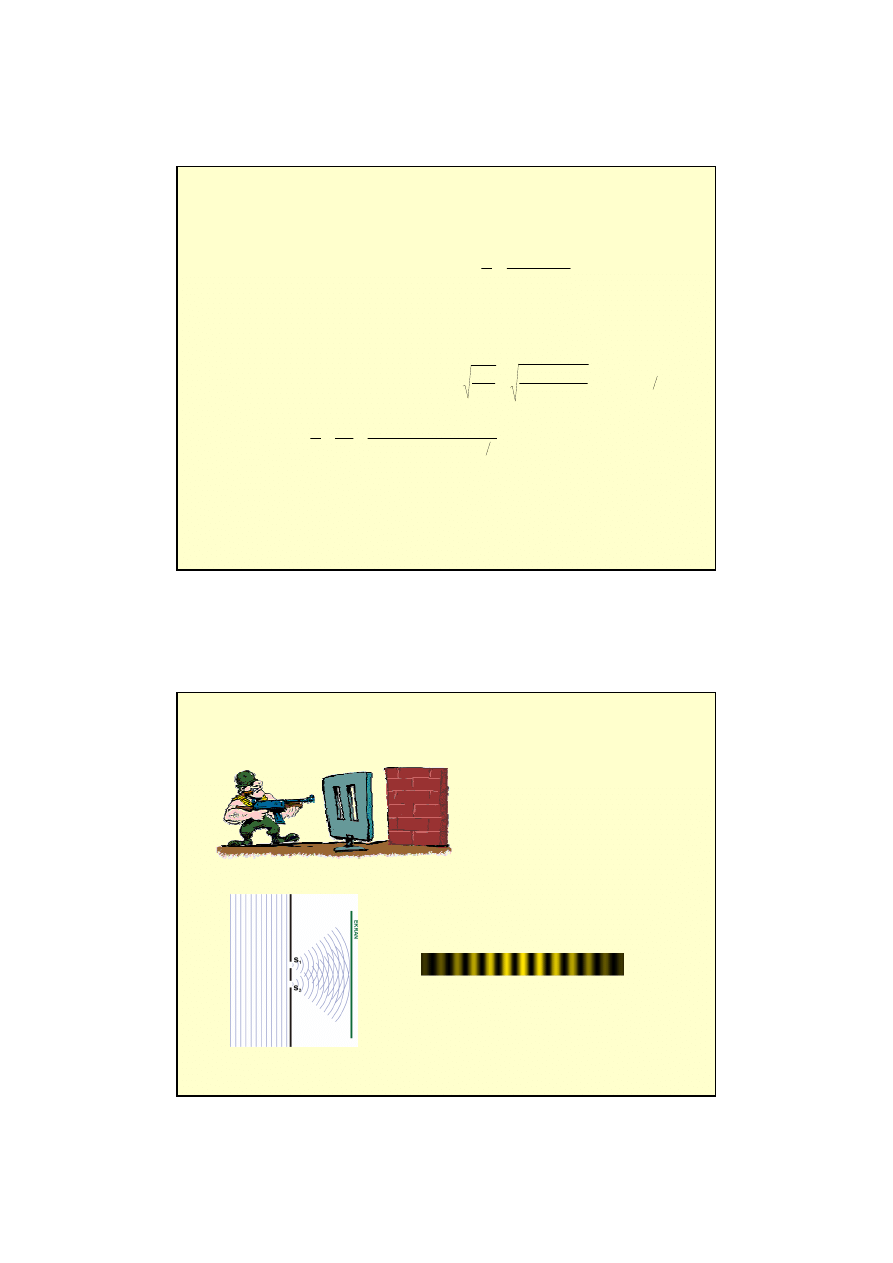
Jak zbada
ć
falow
ą
natur
ę
materii? Mo
ż
e zbada
ć
obraz po przej
ś
ciu przez szczeliny ?
obraz dla cz
ą
stek
obraz dla fal
3
5
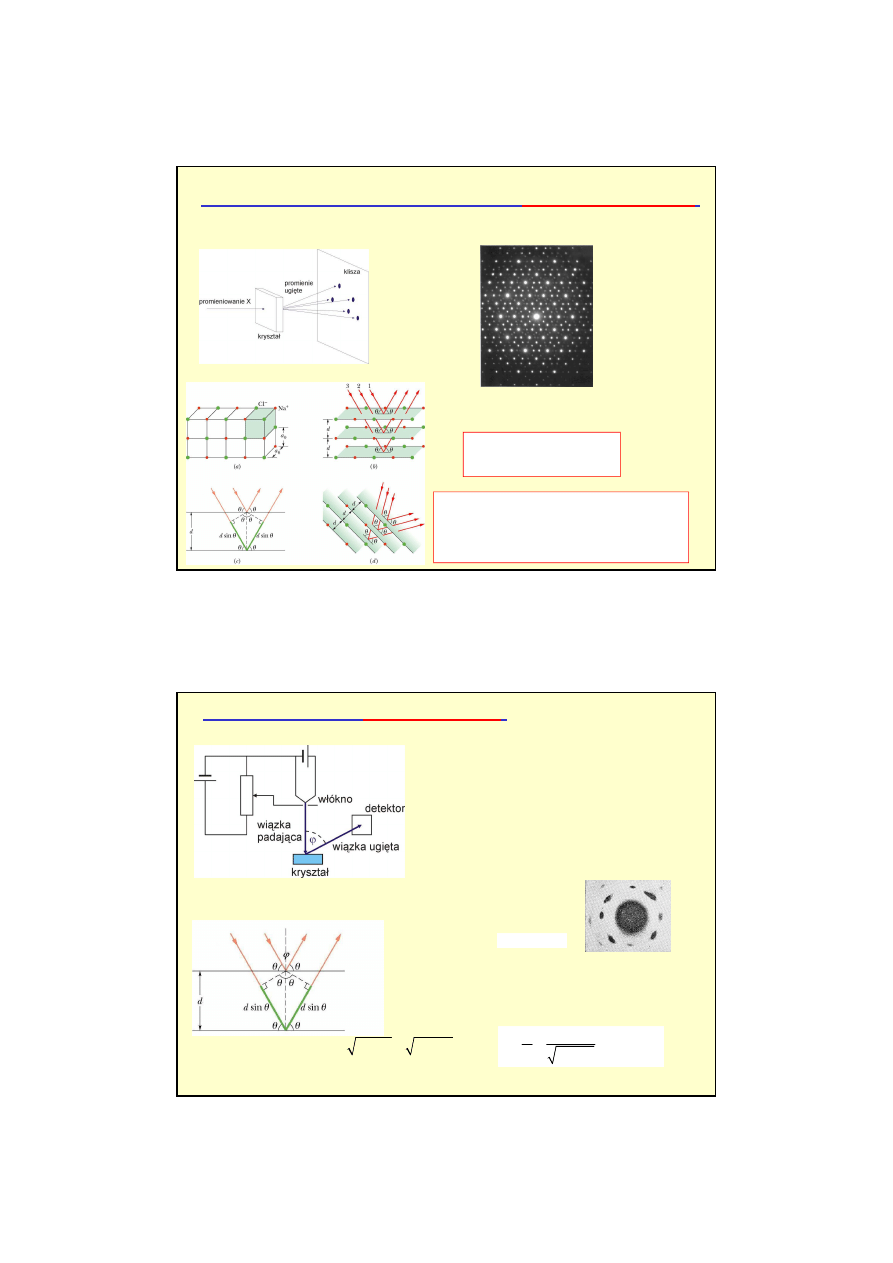
PRZYPOMNIENIE:
Dyfrakcja promieni Roentgena (promienie X-
fale elektromagnetyczne
)
Kryształ – „naturalna siatka dyfrakcyjna”
Dyfrakcja Lauego
2 sin
,
1, 2, 3,.....(maksima)
d
m
m
θ
λ
=
=
prawo Bragga
Pomiar dyfrakcja promieni X jest
do
ś
wiadczaln
ą
metod
ą
badania
rozmieszczenia atomów w
kryształach.
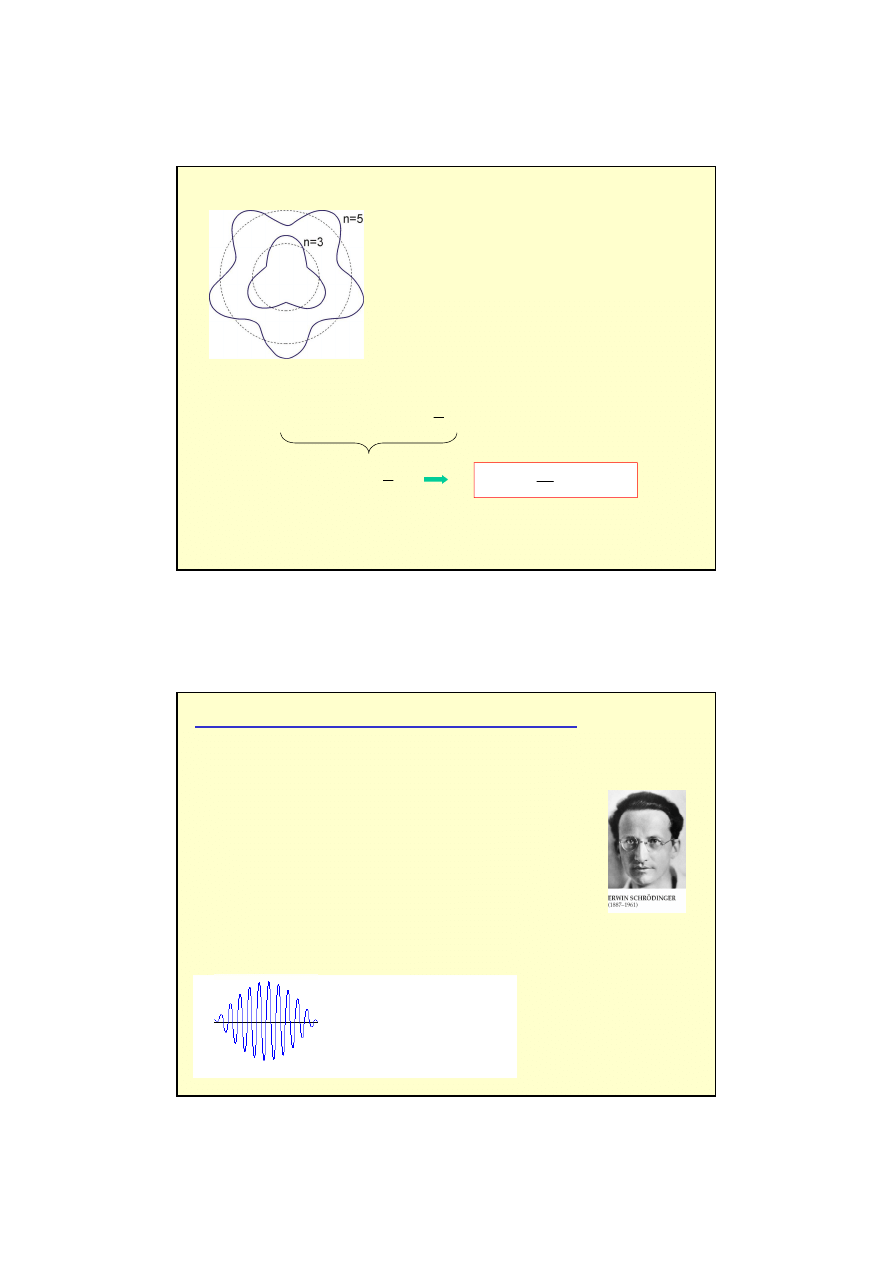
Do
ś
wiadczenie Davissona i Germera (1927)
Elektrony przyspieszane s
ą
napi
ę
ciem U
Wi
ą
zka pada na kryształ niklu, a detektor
jest ustawiony pod zmiennym k
ą
tem
ϕ
Rejestrowane jest nat
ęż
enie wi
ą
zki
ugi
ę
tej na krysztale dla ró
ż
nego U.
Maksimum dyfrakcyjne rejestrowane jest dla
ϕ
= 50° przy
U
= 54 V.
θ
= 90°
−
ϕ
/2 = 65 °
λ
θ
=
sin
2d
dla niklu (d = 0.091 nm)
λ
= 0.165 nm
0.165 nm
2
e
h
h
p
eUm
λ
= =
=
2
2
e
k
e
m E
m eU
=
=
p
długo
ść
fali de Broglie’a
Dyfrakcja elektronów (
elektrony to cz
ą
stki
)
4
Orbita musi na swym obwodzie mie
ś
ci
ć
całkowit
ą
liczb
ę
długo
ś
ci fal de Broglie'a
λ
π
n
r
=
2
p
h
n
r
=
π
2
p
h
=
λ
,.....
2
,
1
2
=
=
=
n
h
n
pr
L
π
Struktura atomu i fale materii
Ruch fal jest ograniczony przez nało
ż
enie warunków
fizycznych, analogicznie jak dla drga
ń
struny zamocowanej
na obu ko
ń
cach.
Mamy wtedy do czynienia z fal
ę
stoj
ą
c
ą
(a nie bie
żą
c
ą
)
w strunie mog
ą
wyst
ę
powa
ć
tylko pewne długo
ś
ci fal.
Mamy do czynienia z kwantyzacj
ą
długo
ś
ci fal wynikaj
ą
c
ą
z
ogranicze
ń
nało
ż
onych na fal
ę
.
Warunek Bohra kwantyzacji momentu p
ę
du jest konsekwencj
ą
przyj
ę
cia zało
ż
enia,
ż
e elektron jest reprezentowany przez fal
ę
materii.
Postulat de Broglie'a wi
ąż
e elektron ze stoj
ą
ca fal
ą
materii.
ELEMENTY MECHANIKI KWANTOWEJ
Postulat de Broglie'a wi
ąż
e elektron ze stoj
ą
ca fal
ą
materii ale....
• nie daje informacji o sposobie rozchodzenia si
ę
fal materii,
• nie odpowiadał na pytanie jak
ą
posta
ć
mo
ż
e mie
ć
funkcja opisuj
ą
ca fale materii, jak j
ą
wyznaczy
ć
oraz jaka jest jej interpretacja.
W 1926 roku E. Schrödinger sformułował mechanik
ę
falow
ą
(jedno ze sformułowa
ń
fizyki kwantowej) zajmuj
ą
c
ą
si
ę
opisem
falowych
własno
ś
ci
materii
–
uogólnienie
postulatu
de
Broglie'a.
E. Schrödinger (Nagroda Nobla 1933)
pakiet falowy
interferencja
wielu fal o ró
ż
nych p
ę
dach
(analogia do dudnie
ń
)
5
•Fale mechaniczne np. w strunie s
ą
opisywane przez
równania mechaniki Newtona (równanie falowe
d'Alamberta):
•Fale EM s
ą
opisywane przez równania Maxwella
(równanie falowe d'Alamberta):
•Fale materii s
ą
opisywane przez równanie Schrödingera:
Równanie Schrödingera (1926)
2
2
2
2
2
1
t
y
x
y
∂
∂
∂
∂
v
=
2
2
2
2
2
1
t
c
x
∂
∂
∂
∂
B
B
=
2
2
2
2
2
1
t
c
x
∂
∂
∂
∂
E
E
=
i
równanie w jednym wymiarze:
t
t
x
i
t
x
x
U
x
t
x
m
∂
∂
=
+
∂
∂
−
)
,
(
)
,
(
)
(
)
,
(
2
2
2
2
Ψ
Ψ
Ψ
ℏ
ℏ
π
2
h
=
ℏ
dla stanu stacjonarnego U (x) jej energią potencjalną zależną tylko od jej położenia
(dla uproszczenia rozważamy równanie jednowymiarowe, zależne od x)
t
i
e
x
t
x
ω
ψ
Ψ
−
⋅
=
)
(
)
,
(
modulacja
przestrzenna
zmienność
w czasie
rozwi
ą
zanie - fala materii:
ℏ
E
=
ω
(
)
(
)
0
0
:
e
,
e
;
/
i kx
t
i kx
t
y
y
z
z
rozwiazania E
E
B
B
c
k
ω
ω
ω
−
−
=
=
=
(
)
0
:
e
v
/
i kx
t
rozwiązanie
y
y
k
ω
ω
−
=
=
E
jest energi
ą
całkowit
ą
cz
ą
stki,
U (x)
jej energi
ą
potencjaln
ą
zale
ż
n
ą
od jej poło
ż
enia
Rozwi
ą
zanie równania Schrödingera polega na znalezieniu
funkcji falowej
ψ(
x)
i warto
ś
ci
energii cz
ą
stki
E
przy znanej działaj
ą
cej na cz
ą
stk
ę
sile zadanej poprzez energi
ę
potencjaln
ą
U (x)
.
Równanie Schrödingera (1926)
t
t
x
i
t
x
x
U
x
t
x
m
∂
∂
=
+
∂
∂
−
)
,
(
)
,
(
)
(
)
,
(
2
2
2
2
Ψ
Ψ
Ψ
ℏ
ℏ
Rozwi
ą
zanie (podobnie jak dla linii długiej):
równanie w jednym wymiarze:
)
(
)
(
)
(
)
(
2
2
2
2
x
E
x
x
U
x
x
m
ψ
ψ
ψ
=
+
∂
∂
−
ℏ
?
)
(
=
x
ψ
t
i
e
x
t
x
ω
ψ
Ψ
−
⋅
=
)
(
)
,
(
ostateczne rozwi
ą
zanie:
ℏ
E
gdzie
e
x
t
x
t
i
=
⋅
=
−
ω
ψ
Ψ
ω
:
)
(
)
,
(
6
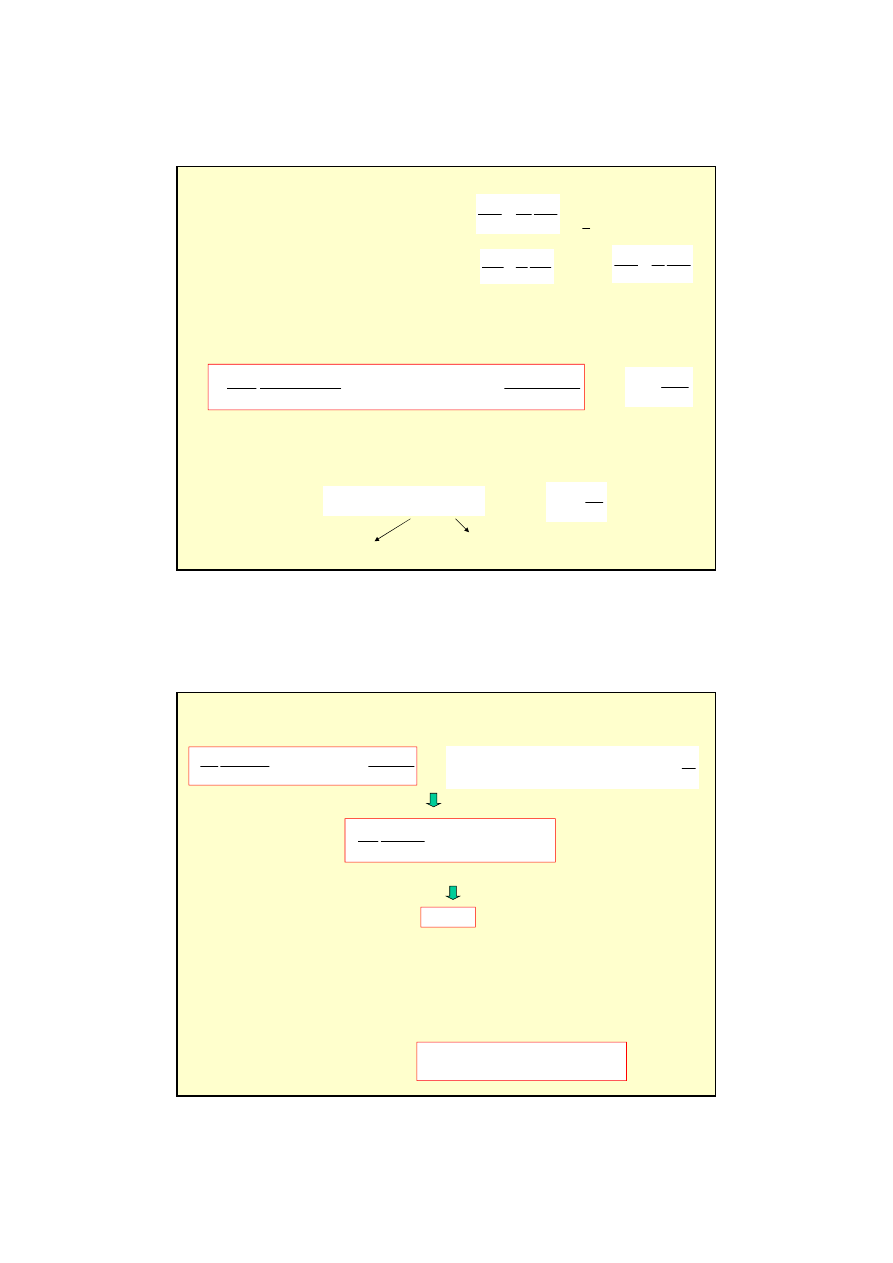
Przykład 1
:
elektron w
∞
studni potencjału spełnia
równanie Schrödingera dla U=0:
x < 0
x > L
U (x)
∞
Poza studni
ą
prawdopodobie
ń
stwo znalezienia
cz
ą
stki = 0
ψ
(0) = 0
i
ψ
(L) = 0
Analogia do struny umocowanej
na obu ko
ń
cach.
...
,
2
,
1
;
lub
2
2
=
=
=
⇒
=
n
L
n
k
n
L
n
L
π
λ
λ
długo
ść
fali jest skwantowana
......
,
2
,
1
,
sin
)
(
=
=
n
L
x
n
A
x
π
ψ
równanie fali stoj
ą
cej:
Dla cz
ą
stki zwi
ą
zanej wyst
ę
puje
kwantyzacja energii !!
......
,
2
,
1
,
2
2
)
/
(
2
2
2
2
2
2
2
=
=
=
=
n
mL
n
m
h
m
p
E
ℏ
π
λ
lub inaczej z relacji de Broglie’a:
0
≤
x
≤
L
U (x) = 0
)
(
)
(
2
2
2
2
x
E
x
x
m
ψ
ψ
=
∂
∂
−
ℏ
λ
π
ψ
2
:
)
sin(
)
(
=
=
k
gdzie
kx
A
x
......
,
2
,
1
,
2
2
2
2
2
=
=
n
mL
n
E
ℏ
π
spełnia równanie
Schrödingera
dla energii:
rozwi
ą
zanie równania Schrödingera to funkcja falowa fali stojacej – cz
ą
stka jest zwi
ą
zana
(uwi
ę
ziona) w studni potencjału ! :
UWAGA: Opisuj
ą
c zachowanie cz
ą
stki funkcj
ą
falow
ą
(spełniaj
ą
c
ą
równania Schrödingera) wyja
ś
nili
ś
my przyczyn
ę
kwantyzacji energii !!
......
,
2
,
1
,
8
2
2
2
=
=
n
mL
h
n
E
......
,
2
,
1
,
sin
)
(
2
2
2
=
=
n
L
x
n
A
x
π
ψ
L
x
n
A
x
π
ψ
sin
)
(
=
Interpretacja M. Borna: wielko
ść
I
ψ
I
2
w dowolnym punkcie
przedstawia tzw. g
ę
sto
ść
prawdopodobie
ń
stwa,
ż
e cz
ą
stka
znajdzie si
ę
w pobli
ż
u tego
punktu. Prawdopodobie
ń
stwo,
ż
e
znajdziemy cz
ą
stk
ę
w przedziale
[x, x+dx] wynosi I
ψ
(x)I
2
dx.
Nagroda Nobla 1954
7
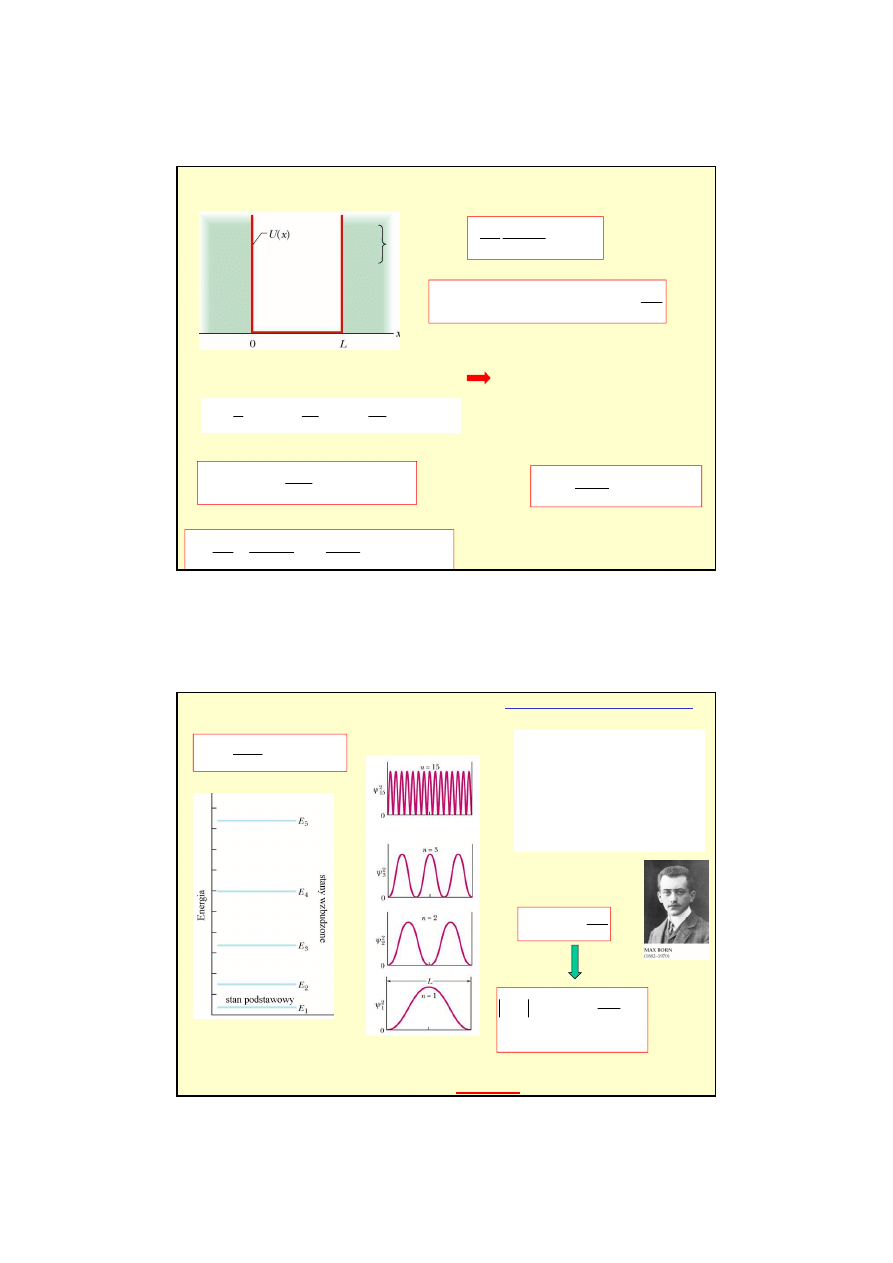
Przykład 2
: elektron w sko
ń
czonej studni potencjału
Elektronowe fale materii
przenikaj
ą
do obszaru o U (x) = U
0
niedost
ę
pnego według klasycznej
mechaniki Newtona
)
(
)
(
)
(
)
(
2
2
2
2
x
E
x
x
U
x
x
m
ψ
ψ
ψ
=
+
∂
∂
−
ℏ
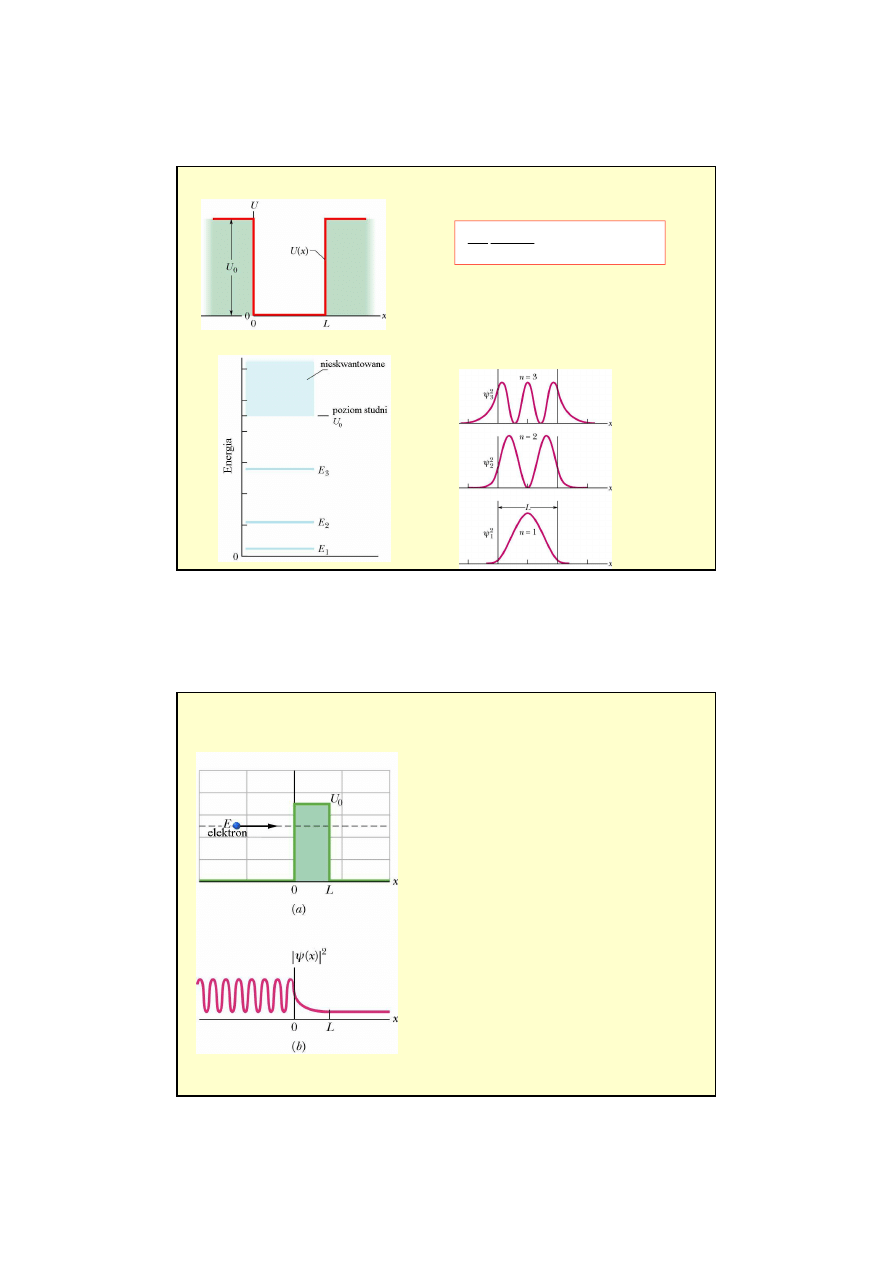
Przykład 3
: tunelowanie elektronu przez barier
ę
potencjału
E < U
0
!!!
klasycznie
elektron
odbije si
ę
od bariery
kwantowo
istnieje prawdopodobie
ń
stwo,
ż
e elektron przeniknie (przetuneluje) przez
barier
ę
dla x < 0 obserwujemy fal
ę
stoj
ą
c
ą
powstał
ą
w wyniku nało
ż
enia si
ę
elektronowej fali
padaj
ą
cej i odbitej od bariery
Elektron mo
ż
e przej
ść
przez „
ś
cian
ę
” mimo,
ż
e
jego energia, z pozoru, na to nie pozwala

8
Atomy - równanie Schrödingera
Orbitale mo
ż
na traktowa
ć
jako rozkłady ładunku elektronu wokół j
ą
dra.
n=1, l=0, m=0
n=2, l=1, m=0
n=2, l=1, m=1
n=3, l=2, m=1
n=3, l=2, m=2
n=4, l=2, m=2
n=2, l=1, m=0
n=1, l=0, m=0 n=2, l=0, m=0
Rozwiązanie równania Schrödingera dla atomu wodoru
Szukamy funkcji falowych spełniaj
ą
cych równanie Schrödingera dla elektronu zwi
ą
zanego w polu
elektrycznym j
ą
dra. Energia potencjalna dla takiego elekronu dana jest wzorem:
r
e
r
U
0
2
4
)
(
πε
−
=

9
Rozwi
ą
zanie równania Schrödingera dla atomu wodoru dostarcza oprócz funkcji
falowych równie
ż
warto
ś
ci
energii elektronu
zwi
ą
zanego w atomie.
,.....
2
,
1
8
2
1
2
2
2
0
4
=
=
−
=
n
n
E
n
h
me
E
n
ε
Warto
ś
ci zgodne z do
ś
wiadczalniem
weryfikacja teorii Schrödingera.
Teoria Schrödingera atomu jednoelektronowego
obraz struktury atomu
podstawy kwantowego
opisu atomów wieloelektronowych, cz
ą
steczek oraz
j
ą
der atomowych.
Opis falowy mikro
ś
wiata jest ju
ż
dzisiaj dobrze
ugruntowan
ą
teori
ą
.
Energia elektronu
Sens fizyczny liczb kwantowych
n – główna liczba kwantowa
Orbitalny moment p
ę
du
Mechanika klasyczna
p
r
v
r
L
×
=
×
=
e
m
•
Dla elektronu kr
ążą
cego wokół j
ą
dra mo
ż
na dokładnie
wyznaczy
ć
długo
ść
L oraz warto
ść
jednej jego składowej
np. L
z
.
•
Pozostałe składowe L
x
i L
y
maj
ą
warto
ś
ci nieokre
ś
lone.
•
Warto
ś
ci L oraz L
z
s
ą
skwantowane
l
z
m
L
l
l
L
ℏ
ℏ
=
+
=
,
)
1
(
l = 0, 1, 2, ..(n-1);
m
l
= 0, ±1, ±2, ±3, ...., ± l
Warto
ść
orbitalnego momentu p
ę
du elektronu w atomie i jego rzut na o
ś
z przyjmuj
ą
ś
ci
ś
le okre
ś
lone warto
ś
ci zale
ż
ne od liczb kwantowych:
l (pobocznej liczby kwantowej) i m
l
(magnetycznej liczby kwantowej).
10
Spin elektronu
Do
ś
wiadczenie Sterna-Gerlacha
Elektrony posiadaj
ą
wewn
ę
trzny moment p
ę
du
spinowy moment p
ę
du (spin).
Spin jest skwantowany przestrzennie
dla danego stanu orbitalnego s
ą
mo
ż
liwe
dwa kierunki spinu
rzut wektora spinu na o
ś
z mo
ż
e przyjmowa
ć
tylko dwie
warto
ś
ci
magnetyczna spinowa liczba kwantowa m
s
, która mo
ż
e przyjmowa
ć
dwie warto
ś
ci m
s
= ± ½.
Moment p
ę
du atomu jest sum
ą
momentów p
ę
dów orbitalnych i spinów
wszystkich elektronów w atomie i jest te
ż
skwantowany przestrzennie.
W atomie srebra na zewnętrznej powłoce znajduje
się pojedynczy elektron, którego spin nie jest
"równoważony" przez elektron ze spinem
przeciwnym.
Sens fizyczny liczb kwantowych - podsumowanie
•
Funkcja falowa elektronu zale
ż
y od trzech liczb kwantowych n, l,
m
l
otrzymanych z równania Schroedingera oraz liczby m
s
wynikaj
ą
cej z efektów relatywistycznych.
•
Główna liczba kwantow
ą
n jest zwi
ą
zana z kwantowaniem energii
całkowitej elektronu w atomie wodoru.
•
Liczby kwantowe l, m
l
opisuj
ą
warto
ść
i rzut wektora momentu
p
ę
du elektronu (obie wielko
ś
ci s
ą
skwantowane) .
•
Spinowa liczba kwantowa m
s
, która mo
ż
e przyjmowa
ć
dwie
warto
ś
ci m
s
= ± ½ opisuje rzut wektora spinu na o
ś
z.
11
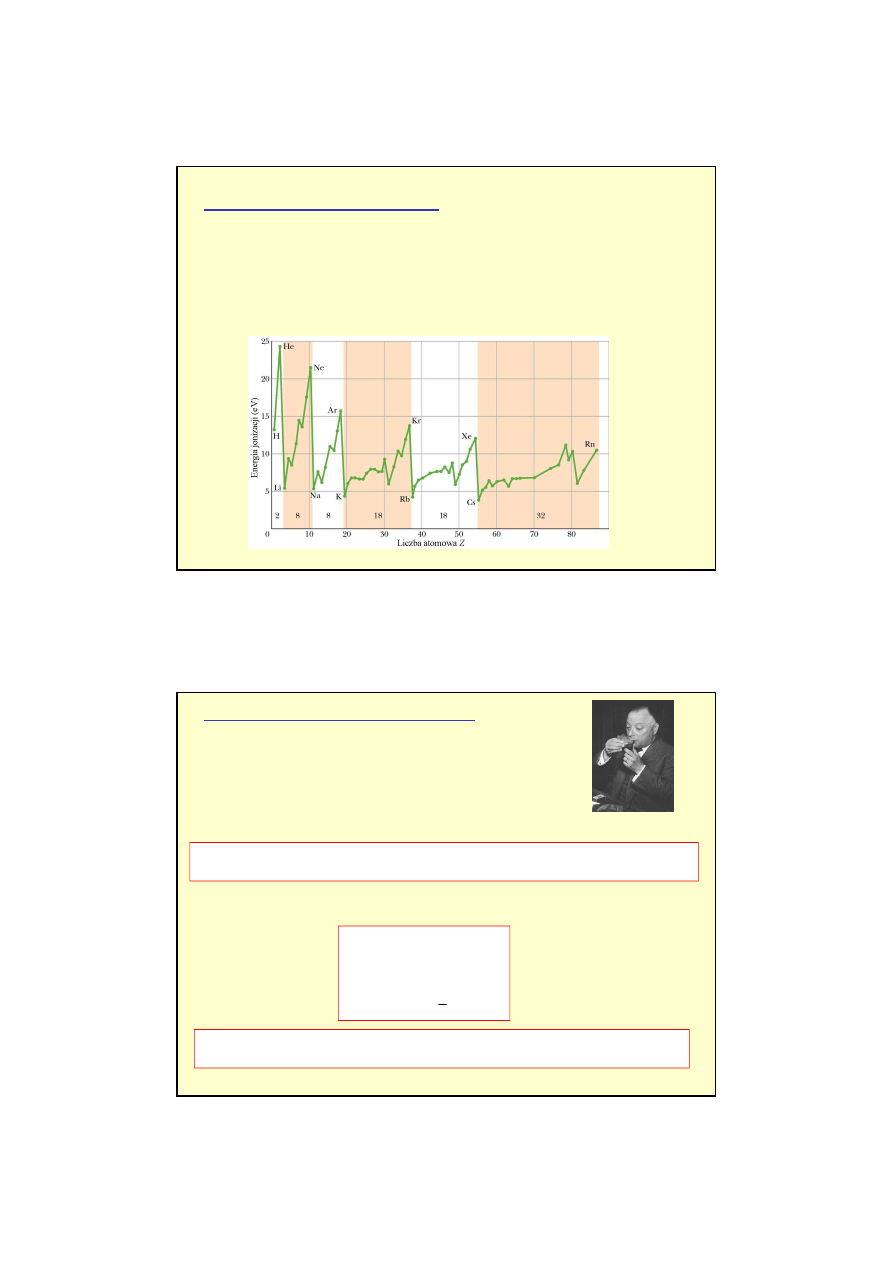
Mendelejew (1869 r.)
wi
ę
kszo
ść
własno
ś
ci pierwiastków chemicznych jest
okresow
ą
funkcj
ą
liczby atomowej Z (liczba elektronów w atomie)
układ
okresowy pierwiastków.
Wła
ś
ciwo
ś
ci chemiczne i fizyczne pierwiastków powtarzaj
ą
si
ę
je
ż
eli zebra
ć
je w
grupy zawieraj
ą
ce 2, 8, 8, 18, 18, 32 elementów.
Atom wieloelektronowy
W 1925 r. Pauli podał zasad
ę
(nazywan
ą
zakazem
Pauliego), dzi
ę
ki której automatycznie s
ą
generowane
grupy o liczebno
ś
ci 2, 8, 18, 32.
Stan kwantowy charakteryzuje zespół czterech liczb kwantowych:
2
1
),
1
(
,
.....
,
2
,
1
,
0
1
,
......
,
2
,
1
,
0
.....
,
3
,
2
,
1
±
=
±
−
±
±
±
=
−
=
=
s
l
m
l
l
m
n
l
n
Zasada Pauliego - nagroda Nobla 1945
W atomie wieloelektronowym elektrony musz
ą
si
ę
ró
ż
ni
ć
przynajmniej jedn
ą
liczb
ą
kwantow
ą
.
W atomie wieloelektronowym w tym samym stanie kwantowym, mo
ż
e znajdowa
ć
si
ę
co najwy
ż
ej jeden elektron.
Wolfgang Pauli
12
Przykład:
Na orbicie pierwszej n = 1 mog
ą
znajdowa
ć
si
ę
tylko dwa elektrony bo
dla n = 1 odpowiednie liczby kwantowe wynosz
ą
(n, l, m
l
, m
s
) = (1,0,0,± ½)
dla n = 2
(n, l, m
l
, m
s
) = (2,0,0,± ½)
(2,1,1,± ½), (2,1,0,± ½), (2,1,-1,± ½)
w stanie n = 2 mo
ż
e by
ć
8 elektronów
(n, l, m
l
, m
s
)= (3,0,0,± ½)
(3,1,1,± ½), (3,1,0,± ½), (3,1,-1,± ½)
(3,2,2,± ½), (3,2,1,± ½), (3,2,0,± ½), (3,2,-1,± ½), (3,2,-2,± ½)
dla n = 3
w stanie n = 3 mo
ż
e by
ć
18 elektronów
Zasada (zakaz) Pauliego obowi
ą
zuje dla ka
ż
dego układu zawieraj
ą
cego elektrony,
nie tylko dla elektronów w atomach.
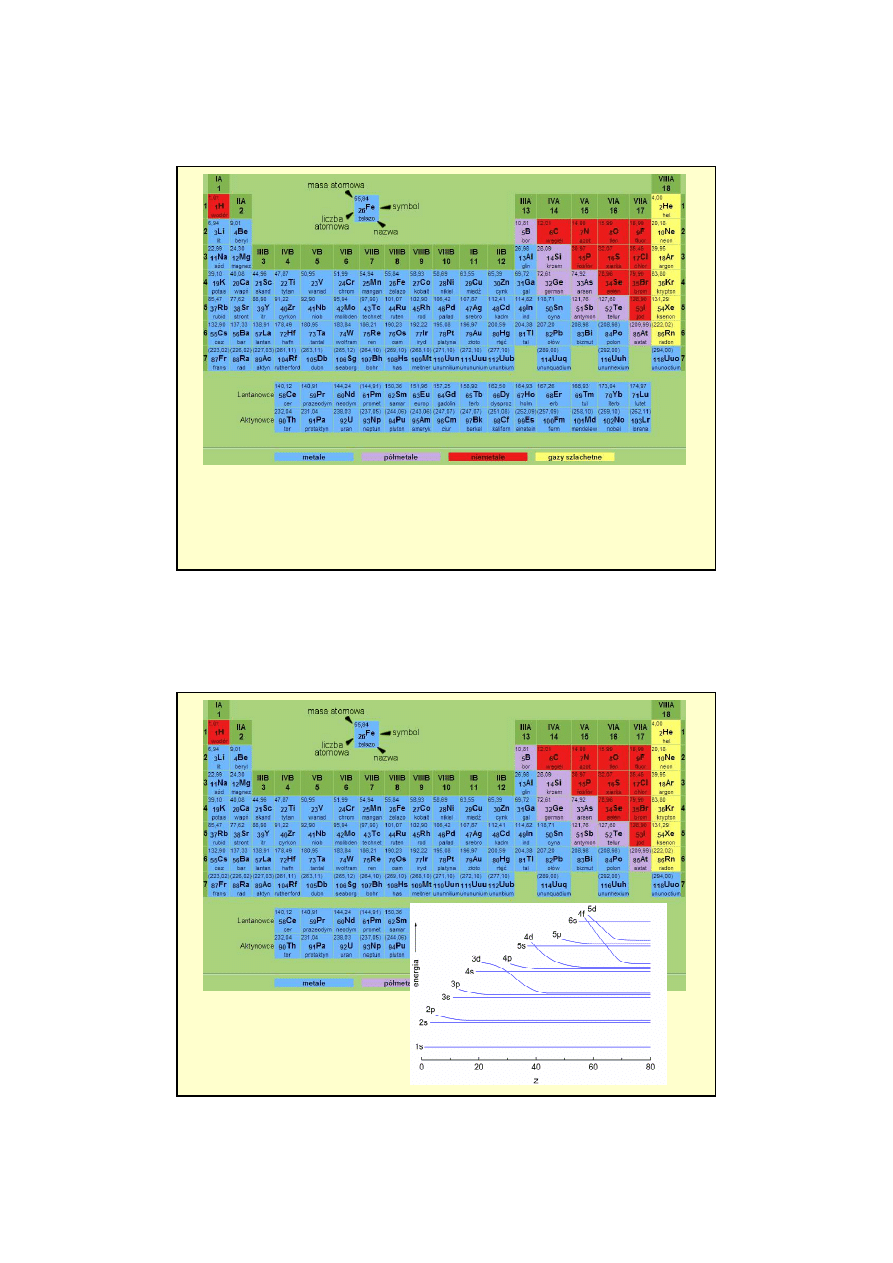
Układ okresowy pierwiastków
•
Korzystamy z zasady Pauliego
•
Konwencja: numer powłoki (n) piszemy cyfr
ą
, natomiast podpowłoki (orbitale):
l = 0, 1, 2, 3, oznaczmy literami s, p, d, f itd.
•
Wska
ź
nik górny przy symbolu podpowłoki
liczba znajduj
ą
cych si
ę
w niej
elektronów, wska
ź
nik dolny przy symbolu chemicznym pierwiastka
warto
ść
Z.
Wodór (Z = 1)
→
1
H : 1s
1
Lit (Z = 3)
→
3
Li : 1s
2
2s
1
Beryl (Z = 4)
→
4
Be : 1s
2
2s
2
Od boru (Z = 5) do neonu (Z = 10)
bor (Z = 5)
→
5
B :
1s
2
2s
2
2p
1
w
ę
giel (Z = 6)
→
6
C :
1s
2
2s
2
2p
2
azot (Z = 7)
→
7
N :
1s
2
2s
2
2p
3
tlen (Z = 8)
→
8
O :
1s
2
2s
2
2p
4
fluor (Z = 9)
→
9
F :
1s
2
2s
2
2p
5
neon (Z = 10)
→
10
Ne :
1s
2
2s
2
2p
6
Hel (Z = 2)
→
2
He : 1s
2
13
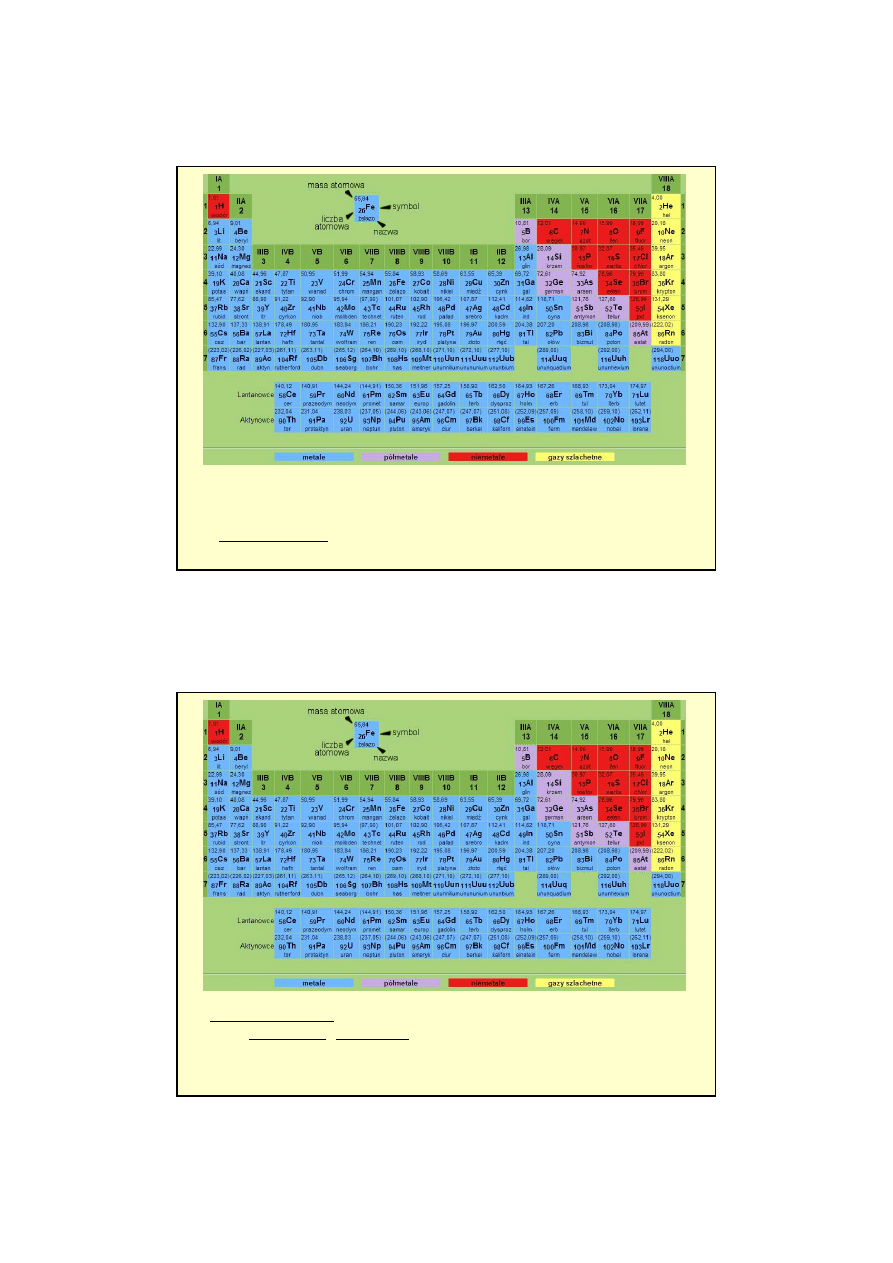
• W obrębie jednego
okresu
powłoka walencyjna jest zajmowana przez kolejne elektrony. Po zapełnieniu
całej powłoki następuje przejście do nowego okresu i powstanie kolejnej powłoki elektronowej.
• Można więc powiedzieć, że atomy występujące w tych samych okresach mają taką samą liczbę powłok
elektronowych, a występujące w tych samych grupach mają taką samą liczbę elektronów na powłokach
walencyjnych (tzn. zewnętrznych).
Ró
ż
nice energii pomi
ę
dzy
niektórymi podpowłokami s
ą
tak
małe,
ż
e mo
ż
e zosta
ć
odwrócona kolejno
ść
ich
zapełniania.
14
Grupy
zazwyczaj wypisuje się w kolumnach, a
okresy
w rzędach. Grupy dzieli się
na grupy główne i grupy poboczne.
W grupach głównych (A) elektrony z powłoki walencyjnej zajmują orbitale s i p (na
powłokach tego typu mieści się dokładnie 8 elektronów)
W grupach pobocznych (B) elektrony z powłoki walencyjnej zajmują orbitale s i d, a
w grupie lantanowców i aktynowców orbitale: s, d i f.
Układ okresowy dzielimy na bloki: s i p (grupy główne), d (grupy poboczne) oraz f
(lantanowce i aktynowce).
15
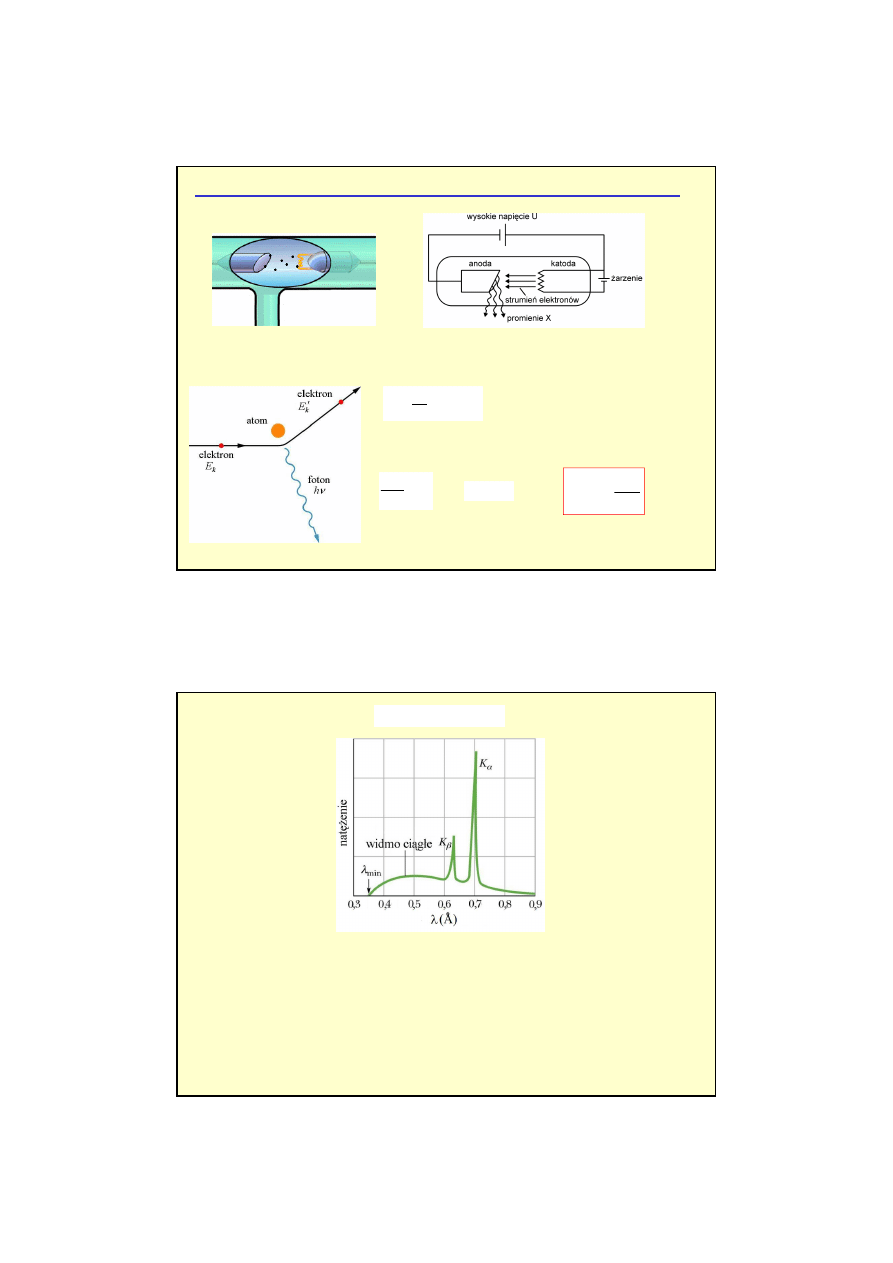
1) Promienie X
Elektrony przyspieszane przez wysokie napięcie rzędu 10
4
V uderzają w anodę (tarczę).
W anodzie elektrony są hamowane aż do ich całkowitego zatrzymania. Zgodnie z fizyką
klasyczną, występuje emisja promieniowania elektromagnetycznego o
widmie ciągłym
.
Promieniowanie atomów wieloelektronowych - przykłady
'
k
k
E
E
hc
hv
−
=
=
λ
Gdy elektron traci całą energię w jednym procesie zderzenia
E
k
' = 0
k
E
hc
=
min
λ
eU
E
k
=
eU
hc
min
=
λ
λλλλ
min
zależy jedynie od napięcia U, a nie zależy np. od materiału z jakiego zrobiono tarczę.
•
Istnieje dobrze okre
ś
lona
minimalna długo
ś
ci fali
λ
min
widma ci
ą
głego
.
•
Warto
ść
λ
min
zale
ż
y jedynie od napi
ę
cia U
i jest taka sama dla wszystkich
materiałów, z jakich wykonana jest anoda.
•
Obserwuje si
ę
charakterystyczne linie widmowe
(maksima nat
ęż
enia)
wyst
ę
puj
ą
ce dla
ś
ci
ś
le okre
ś
lonych długo
ś
ci fal.
•
Zaobserwowano,
ż
e
widmo liniowe zale
ż
y od materiału
(pierwiastka) anody.
Widmo rentgenowskie
16
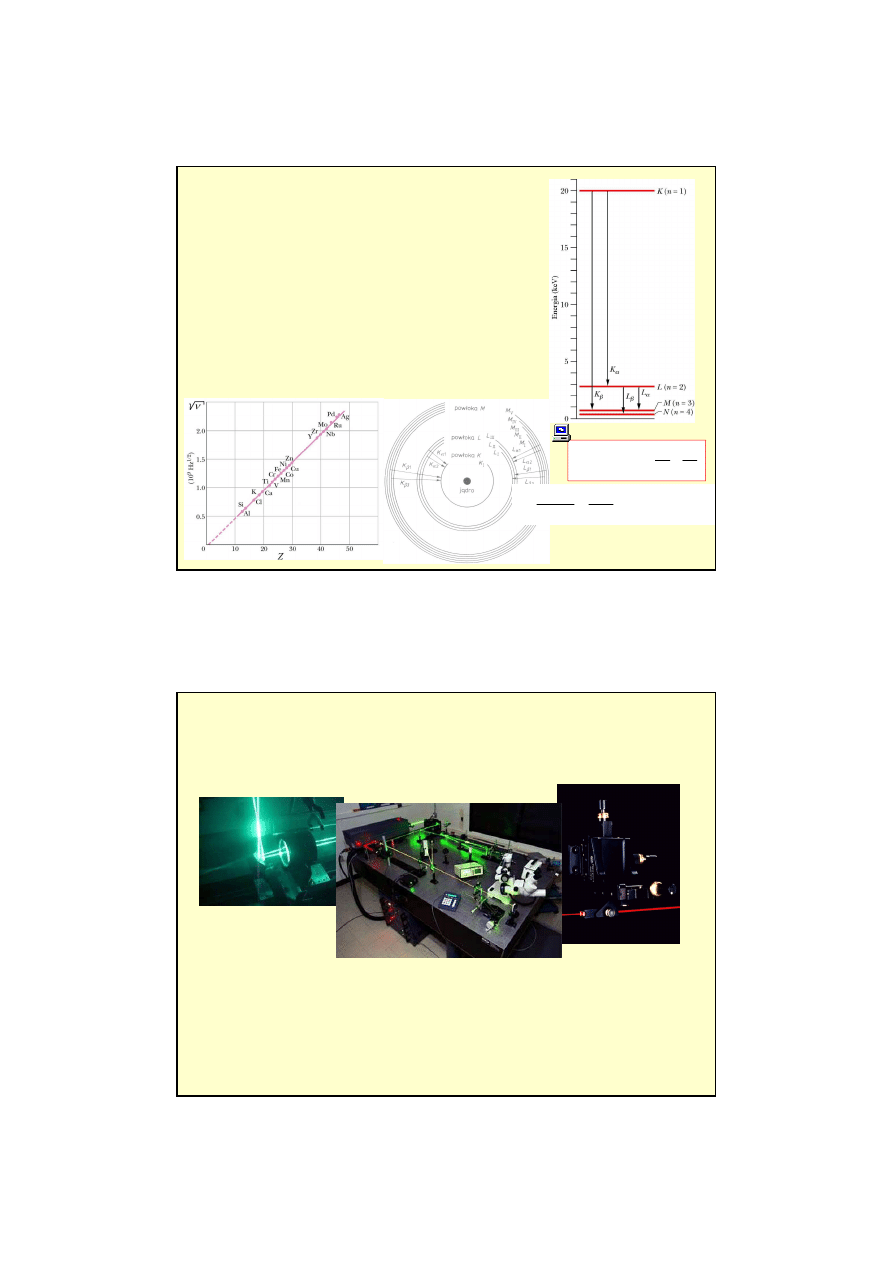
Na gruncie
fizyki kwantowej
można wyjaśnić powstawanie
widma liniowego (charakterystycznego).
•
Elektron przelatuj
ą
c przez atom anody mo
ż
e
wybi
ć
elektrony z ró
ż
nych powłok atomowych
.
•
Na opró
ż
nione miejsce (po wybitym elektronie) mo
ż
e
przej
ść
elektron z wy
ż
szych powłok
emisja fotonu o
ś
ci
ś
le okre
ś
lonej energii.
•
Zazwyczaj proces powrotu atomu do stanu
podstawowego składa si
ę
z kilku kroków przy czym
ka
ż
demu towarzyszy emisja fotonu.
W ten sposób powstaje
widmo liniowe
- charakterystyczne
dla atomów pierwiastka anody.
−
−
=
2
2
2
1
1
j
k
Rc
a
Z
)
(
v
Prawo Moseleya
eV
E
h
E
c
h
me
R
6
.
13
|
|
|
|
8
0
0
3
2
0
4
=
=
=
ε
a
- stała ekranowania
(zale
ż
y od serii tj. K, L, M...)
- stała Rydberga
Wykorzystanie zjawisk kwantowych w praktyce:
kwantowy generator
ś
wiatła
- laser.
Laser - Light Amplification by Stimulated Emission of Radiation
Ś
wiatło laserowe
•
monochromatyczno
ść
i mała szeroko
ść
linii emisyjnej
du
ż
a moc w wybranym
obszarze widma,
•
spolaryzowanie wi
ą
zki
ś
wiatła,
•
spójno
ść
wi
ą
zki w czasie i przestrzeni,
•
bardzo mał
ą
rozbie
ż
no
ść
2) Lasery
17
0
x
hv
E
E
=
−
W
emisji spontanicznej
mamy do czynienia z fotonami, których fazy
i kierunki s
ą
rozło
ż
one przypadkowo. Natomiast foton wysyłany w
procesie
emisji wymuszonej
ma tak
ą
sam
ą
faz
ę
oraz taki sam kierunek
ruchu jak foton wymuszaj
ą
cy.
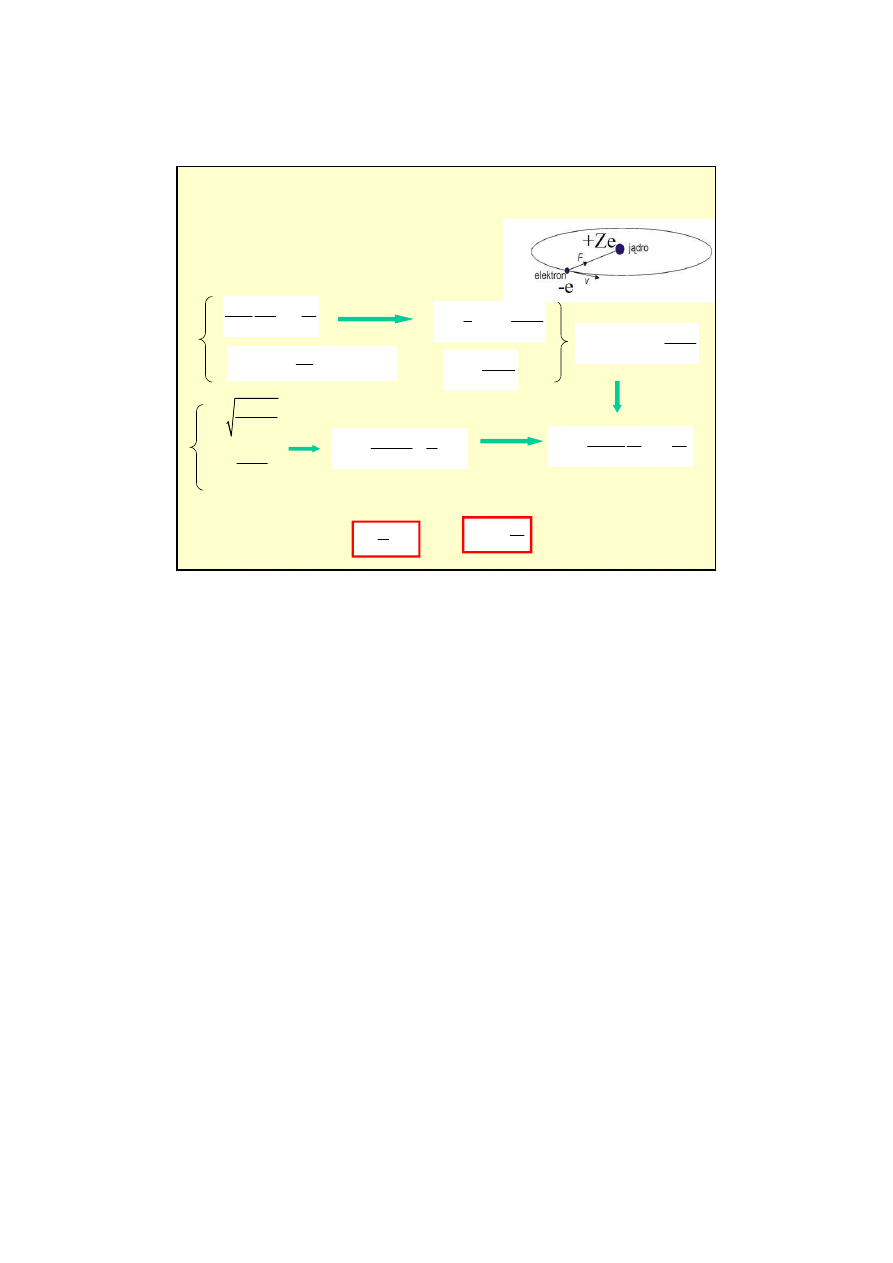
Emisja spontaniczna i wymuszona
emisja wymuszona
przyspieszenie emisji energii
przez o
ś
wietlenie atomów
wzbudzonych odpowiednim
promieniowaniem.
okre
ś
la ile atomów jest w
stanie podstawowym
(stanie o
najni
ż
szej energii), a ile w
stanach wzbudzonych
(o wy
ż
szych
energiach) w danej temperaturze
Rozkład Boltzmana
kT
E
Ae
E
N
−
=
)
(
W danej temperaturze
liczba atomów w stanie podstawowym jest wi
ę
ksza ni
ż
liczba atomów w stanach o wy
ż
szej energii
.
W takim układzie atomów (cz
ą
steczek)
obserwujemy
absorpcj
ę
promieniowania
,
emisja wymuszona jest znikoma
.
Ż
eby w układzie
przewa
ż
ała emisja wymuszona
,
to w wy
ż
szym stanie
energetycznym powinno znajdowa
ć
si
ę
wi
ę
cej atomów (cz
ą
steczek) ni
ż
w stanie
ni
ż
szym. Mówimy,
ż
e rozkład musi nast
ą
pi
ć
inwersja obsadze
ń
.

18
Inwersj
ę
obsadze
ń
mozna wywoła
ć
na kilka sposobów min. za pomoc
ą
zderze
ń
z innymi atomami
lub za pomoc
ą
tzw.
pompowania optycznego
czyli
wzbudzania atomów na wy
ż
sze poziomy energetyczne przez ich o
ś
wietlanie.
Przepływ pr
ą
du przez
mieszanin
ę
He – Ne
zderzenia elektronów
z atomami He
wzbudzenia He
do stanu E
3
Zderzenia He (E
3
) – Ne
wzbudzenia
Ne do stanu E
2
Inwersja obsadze
ń
stan E
2
obsadzony liczniej ni
ż
stan E
1
Przej
ś
cie na poziom E
1
zachodzi
wskutek emisji wymuszonej
Inny sposób „odwrócenia” rozkładu boltzmanowskiego jest wykorzystany w
laserze rubinowym.
Rubin
Laser zbudowany na ciele
stałym składa si
ę
z pr
ę
ta
wykonanego
z kryształu Al
2
O
3
, w którym
jonami czynnymi s
ą
atomy
domieszki np. atomy chromu.
Promieniowanie "pompuj
ą
ce" jest wytwarzane przez lamp
ę
błyskow
ą
umieszczon
ą
wokół kryształu. Absorbuj
ą
c
ś
wiatło z lampy błyskowej atomy chromu przechodz
ą
do stanu wzbudzonego.
Obecnie działaj
ą
zarówno lasery impulsowe jak i lasery o pracy ci
ą
głej.
O
ś
rodkami czynnymi w laserach s
ą
gazy, ciała stałe i ciecze, a zakres długo
ś
ci fal
jest bardzo szeroki; od podczerwieni przez obszar widzialny a
ż
do nadfioletu.
19
2
p
0
4
Ze
E
r
πε
= −
2
2
k
0
1
2
8
Ze
E
m
r
πε
=
=
v
2
2
2
0
1
v
4
Ze
m
r
r
πε
=
,.....
2
,
1
,
2
v
=
=
=
n
h
n
r
m
L
π
energia
całkowita < 0
2
0
8
k
p
Ze
E
E
E
r
πε
=
+
= −
Pojedynczy elektron porusza si
ę
po orbitach
kołowych o promieniu r pod wpływem siły
Coulomba. W j
ą
drze jest Z protonów.
2
0
v
4
Ze
mr
πε
=
mr
h
n
π
2
v
=
2
2
2
0
1
2
1
n
h
r
n
n r
Z me
Z
ε
π
=
=
,....
2
,
1
=
n
2
4
2
1
2
2
2
2
0
1
8
n
E
Z me
E
Z
h n
n
ε
= −
=
,....
2
,
1
=
n
E
1
= −13.6 eV
wartości energii dozwolonych stanów
stacjonarnych
DODATEK: Jon wodoropodobny
2
1
1
n
r
n r
Z
=
2
1
2
n
E
E
Z
n
=
Wyszukiwarka
Podobne podstrony:
20 Schrodinger atom 2010skrót [tryb zgodności]
20 19 05 2014 Ćwiczenie 13 GARAŻ W KOSZTOWEJ wprowadzenieid 21323 ppt
20 19 05 2014 Ćwiczenie 13B GARAŻ W KOSZTOWEJ rozwiązanieid 21324 ppt
21 Schrodinger atom
21 Schrodinger atom [tryb zgodności]
20 19 05 2014 Ćwiczenie 13 GARAŻ W KOSZTOWEJ wprowadzenieid 21323 ppt
npa 20 2014
2013 2014 ZARZADZANIE ZASOBAMI LUDZKIMI wyklad 7 20 11
Isotrexin zel (20 mg 0,5 mg) g Ulotka 14 05 2014
3. Wykład z teorii literatury - 20.10.2014, Teoria literatury, Notatki z wykładu dr hab. Skubaczewsk
2014 05 20
20 Rownanie Schrodingeraid 2144 Nieznany
OiS Wykład 8 (20 11 2014)
OK 33 09 1014 TPiO klientow indywidualnych 20 10 2014
Motywowanie materiały na 20 12 2014
Ostrzeżenie 2 03 2014 20 14(1)
DGP 2014 01 20 rachunkowosc i audyt
DGP 2014 03 20 auto w firmie
więcej podobnych podstron