
1

•
Elektron na najniższej orbicie w atomie wodoru posiada energię
-13.6eV.
•
Kolejnym orbitom przypisane są główne liczby kwantowe n.
•
Orbitalna liczba kwantowa l opisuje kształt orbity.
•
Magnetyczna liczba kwantowa m opisuje orientację
przestrzenną orbity.
•
Wewnętrzny moment pędu (ruch wirowy) elektronu opisuje
liczba spinowa s.
•
Liczby l, m i s przyczyniają się do rozszczepienia poziomów
energetycznych określonych przez główną liczbę kwantową
(każdemu zestawowi liczb n, l, m i s odpowiada inna energia)
2

Wolfgang Pauli (1900-1958)
Nagroda Nobla z fizyki 1945
Stan elektronu w atomie jest określony przez cztery
liczby kwantowe: główną (n), orbitalną (l),
magnetyczną (m) oraz spinową (s).
Zakaz Pauliego (zasada Pauliego): W atomie nie
W atomie nie
W atomie nie
W atomie nie
mogą istnieć dwa elektrony o identycznych
mogą istnieć dwa elektrony o identycznych
mogą istnieć dwa elektrony o identycznych
mogą istnieć dwa elektrony o identycznych
wszystkich liczbach kwantowych (tylko jeden
wszystkich liczbach kwantowych (tylko jeden
wszystkich liczbach kwantowych (tylko jeden
wszystkich liczbach kwantowych (tylko jeden
elektron może przebywać w danym stanie
elektron może przebywać w danym stanie
elektron może przebywać w danym stanie
elektron może przebywać w danym stanie
kwantowym)
kwantowym)
kwantowym)
kwantowym)
Ogólna postać zakazu Pauliego: Dwa fermiony (cząstki o spinie
Dwa fermiony (cząstki o spinie
Dwa fermiony (cząstki o spinie
Dwa fermiony (cząstki o spinie
połówkowym: 1/2,3/2, itd.) nie mogą przebywać w jednym stanie
połówkowym: 1/2,3/2, itd.) nie mogą przebywać w jednym stanie
połówkowym: 1/2,3/2, itd.) nie mogą przebywać w jednym stanie
połówkowym: 1/2,3/2, itd.) nie mogą przebywać w jednym stanie
kwantowym.
kwantowym.
kwantowym.
kwantowym.
3

Po włoka
Po włoka
Po włoka
Po włoka
Po dpowłoka
Po dpowłoka
Po dpowłoka
Po dpowłoka
Ilo ść elektronów
Ilo ść elektronów
Ilo ść elektronów
Ilo ść elektronów
na wypełnionej
na wypełnionej
na wypełnionej
na wypełnionej
po dpowłoce
po dpowłoce
po dpowłoce
po dpowłoce
Ilo ść elektronów
Ilo ść elektronów
Ilo ść elektronów
Ilo ść elektronów
na wypełnionej
na wypełnionej
na wypełnionej
na wypełnionej
po włoce
po włoce
po włoce
po włoce
4
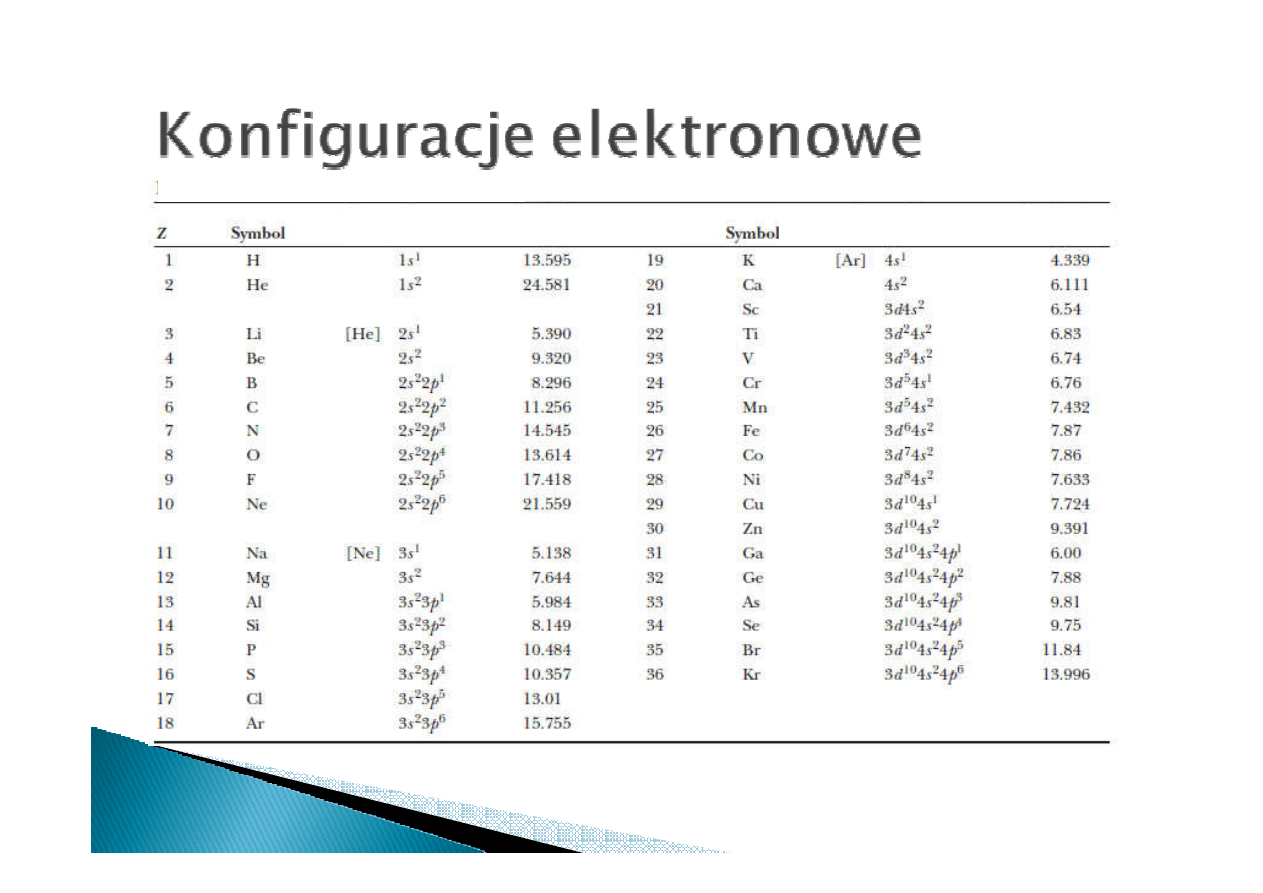
Elektrony wypełniają podpowłoki zaczynając od tych o
najniższej energii
5
konfiguracja
konfiguracja
konfiguracja
konfiguracja e ne rgia jonizacji [eV]
e ne rgia jonizacji [eV]
e ne rgia jonizacji [eV]
e ne rgia jonizacji [eV]
konfiguracja
konfiguracja
konfiguracja
konfiguracja e ne rgia jonizacji [eV]
e ne rgia jonizacji [eV]
e ne rgia jonizacji [eV]
e ne rgia jonizacji [eV]

6

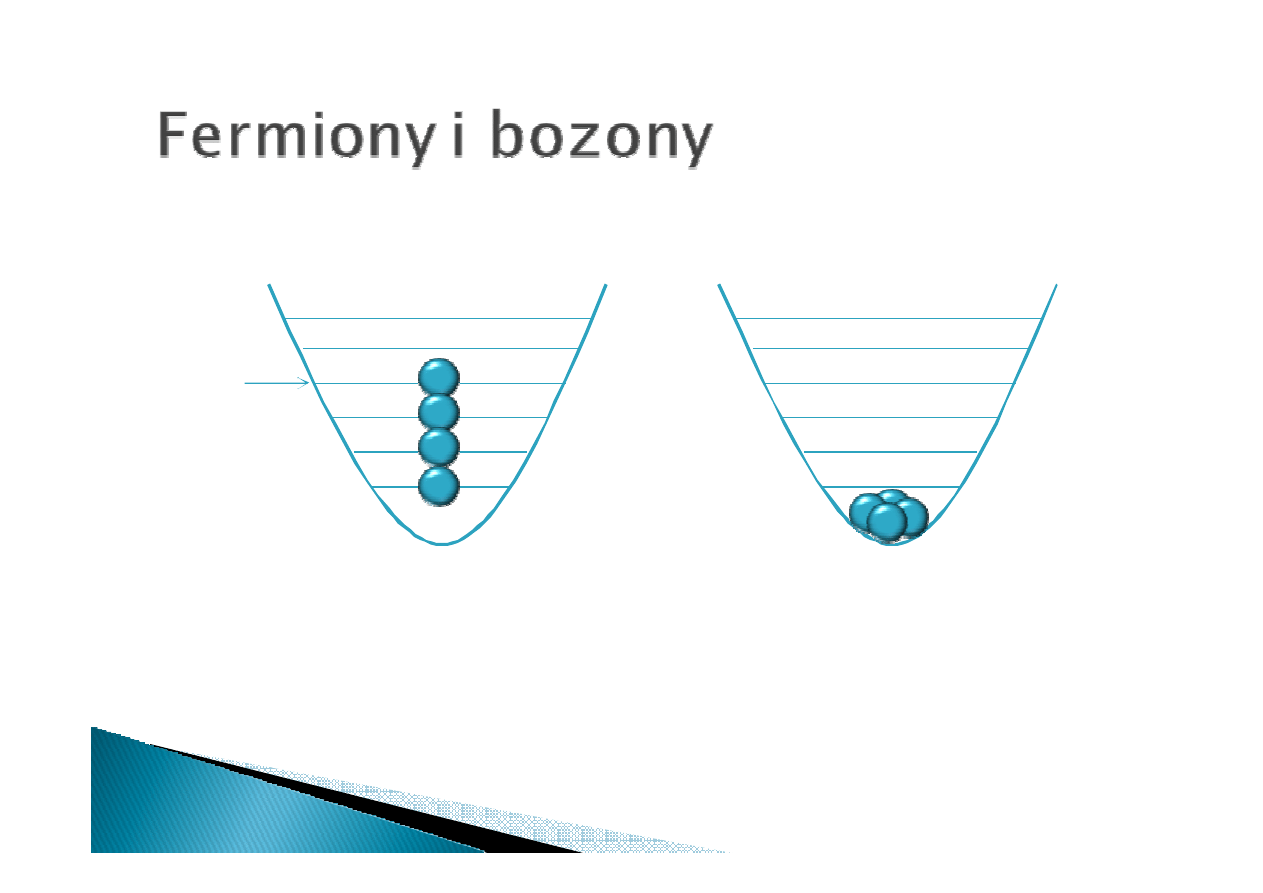
Fermiony
Fermiony
Fermiony
Fermiony – cząstki o spinie połówkowym. Przykłady fermionów:
elektron, proton, neutron. Podlegają zakazowi Pauliego (tylko
jeden fermion na jednym poziomie energetycznym)
Bozony
Bozony
Bozony
Bozony – cząstki o spinie całkowitym. Przykłady bozonów:
foton, mezon. Nie podlegają zakazowi Pauliego (wiele bozonów
może przebywać na tym samym poziomie energetycznym)
7
8
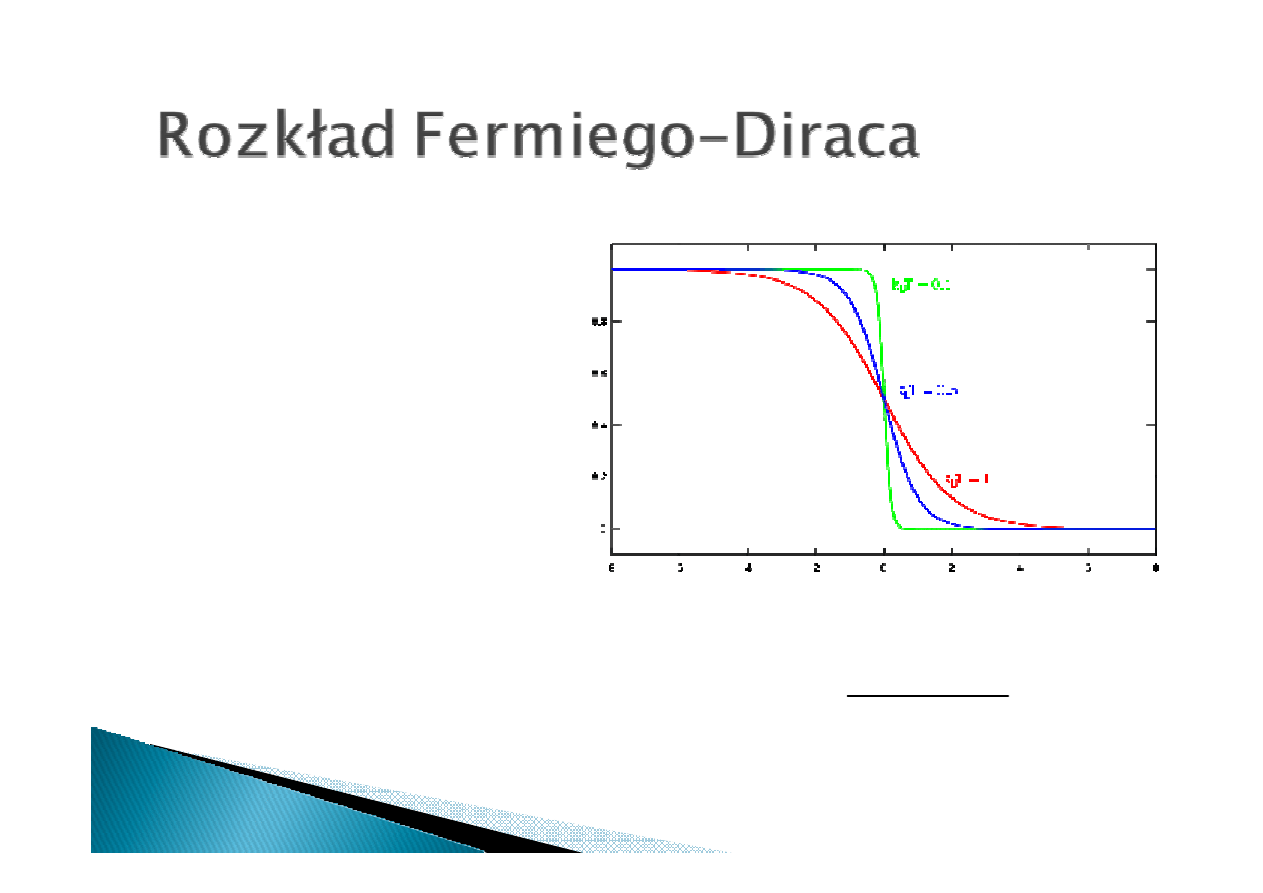
Rozkład Fermiego Diraca
określa prawdopodobieństwo
prawdopodobieństwo
prawdopodobieństwo
prawdopodobieństwo
obsadzenia pozimów
energetycznych przez elektrony
(fermiony).
E
f
– energia Fermiego
energia Fermiego
energia Fermiego
energia Fermiego:
maksymalna energia elektronów
w temperaturze 0K (zera
bezwzględnego)
−
−
=
T
k
E
E
f
B
f
exp
9
Fermiony
Bozony
Energia
Fermiego
10
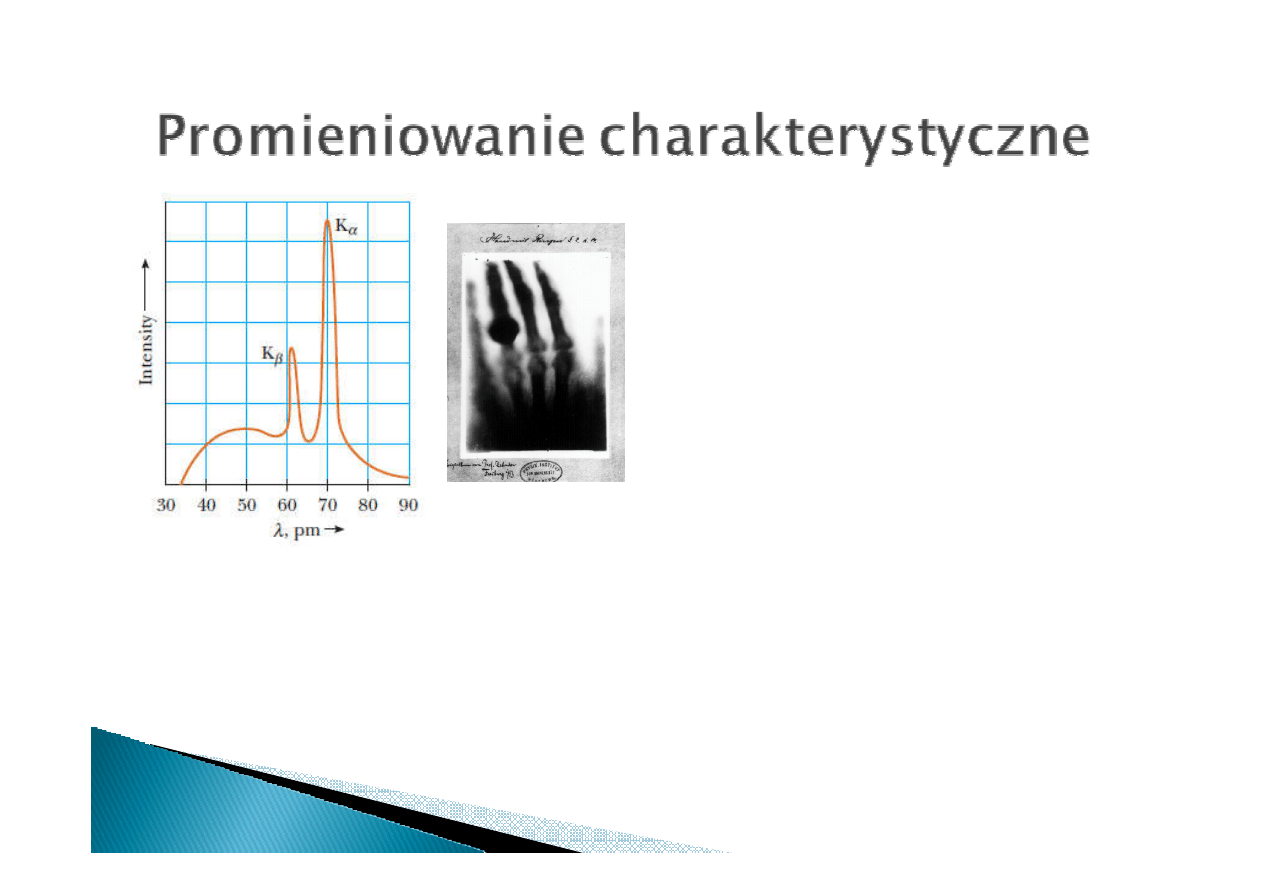
Promieniowanie charakterystyczne
Promieniowanie charakterystyczne
Promieniowanie charakterystyczne
Promieniowanie charakterystyczne
powstaje w wyniku wybicia elektronu z
głębokich poziomów energetycznych,
a następnie powrotu elektronu na
poziom niższy.
Przejście L
→
K linia K
α
Przejście M
→
K linia K
β
Promieniowanie charakterystyczne X
Promieniowanie charakterystyczne X
Promieniowanie charakterystyczne X
Promieniowanie charakterystyczne X
(rentgenowskie) – promieniowanie
elektromagnetyczne o długości fali
10pm-10nm. Występuje w przypadku
ciężkich pierwiastków (np. Cu, Mo)
Widmo promieniowania molibdenu
K
α
, K
β
- promieniowanie charakterystyczne
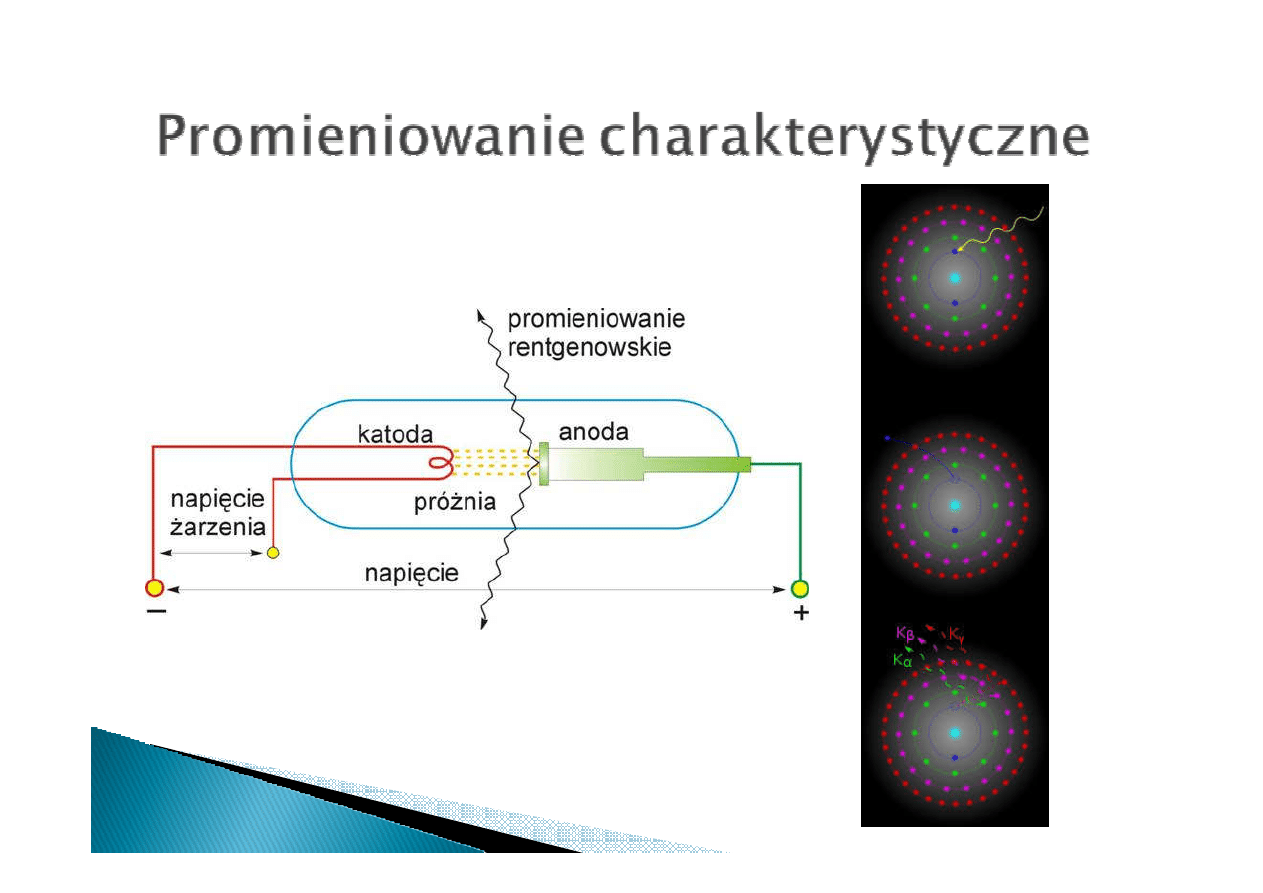
11
Atom w stanie
wzbudzonym
Atom w stanie
wzbudzonym
Atom w stanie
podstawowym
Atom w stanie
podstawowym
12
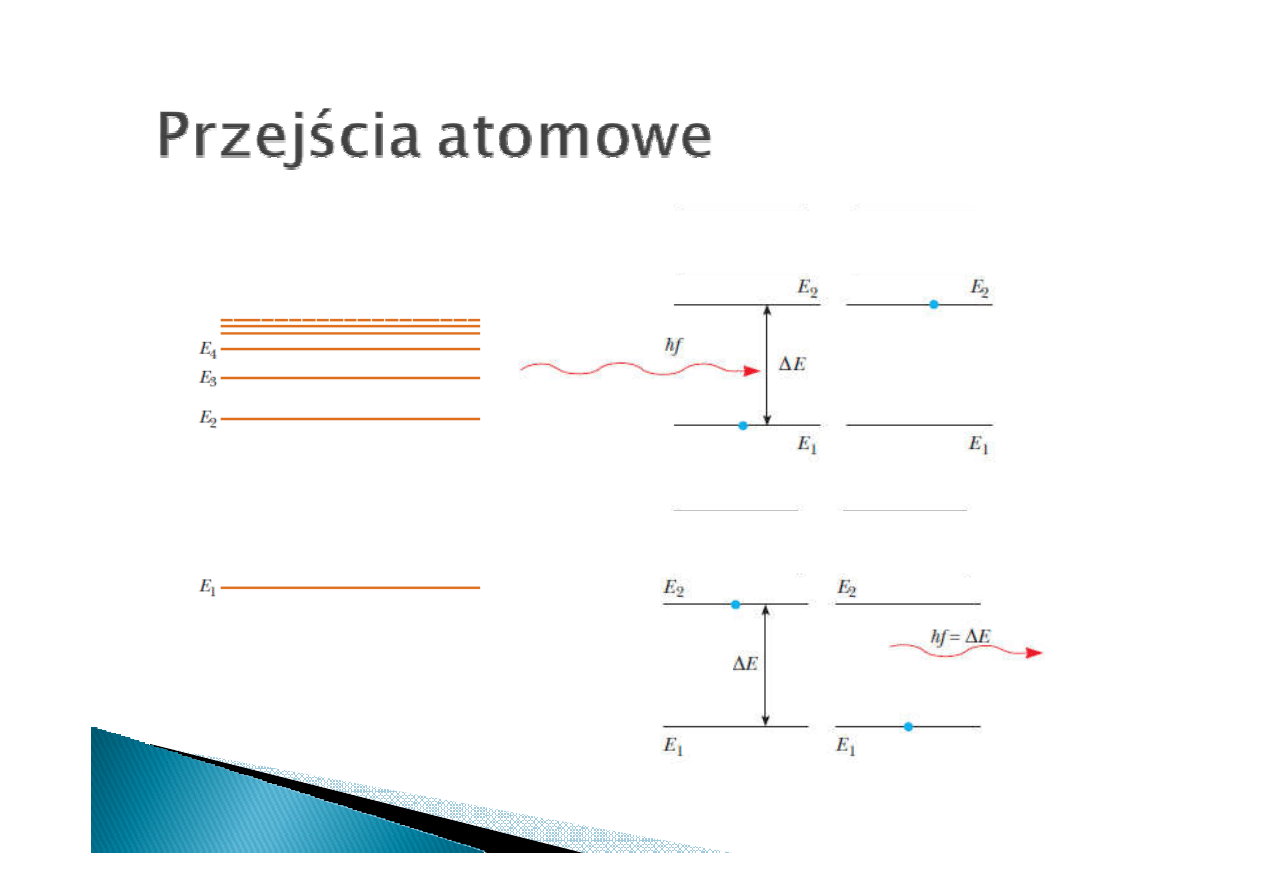
Absorpcja fotonu
Absorpcja fotonu
Absorpcja fotonu
Absorpcja fotonu
Emisja spontaniczna
Emisja spontaniczna
Emisja spontaniczna
Emisja spontaniczna
Atom w stanie
wzbudzonym
Atom w stanie
podstawowym
13
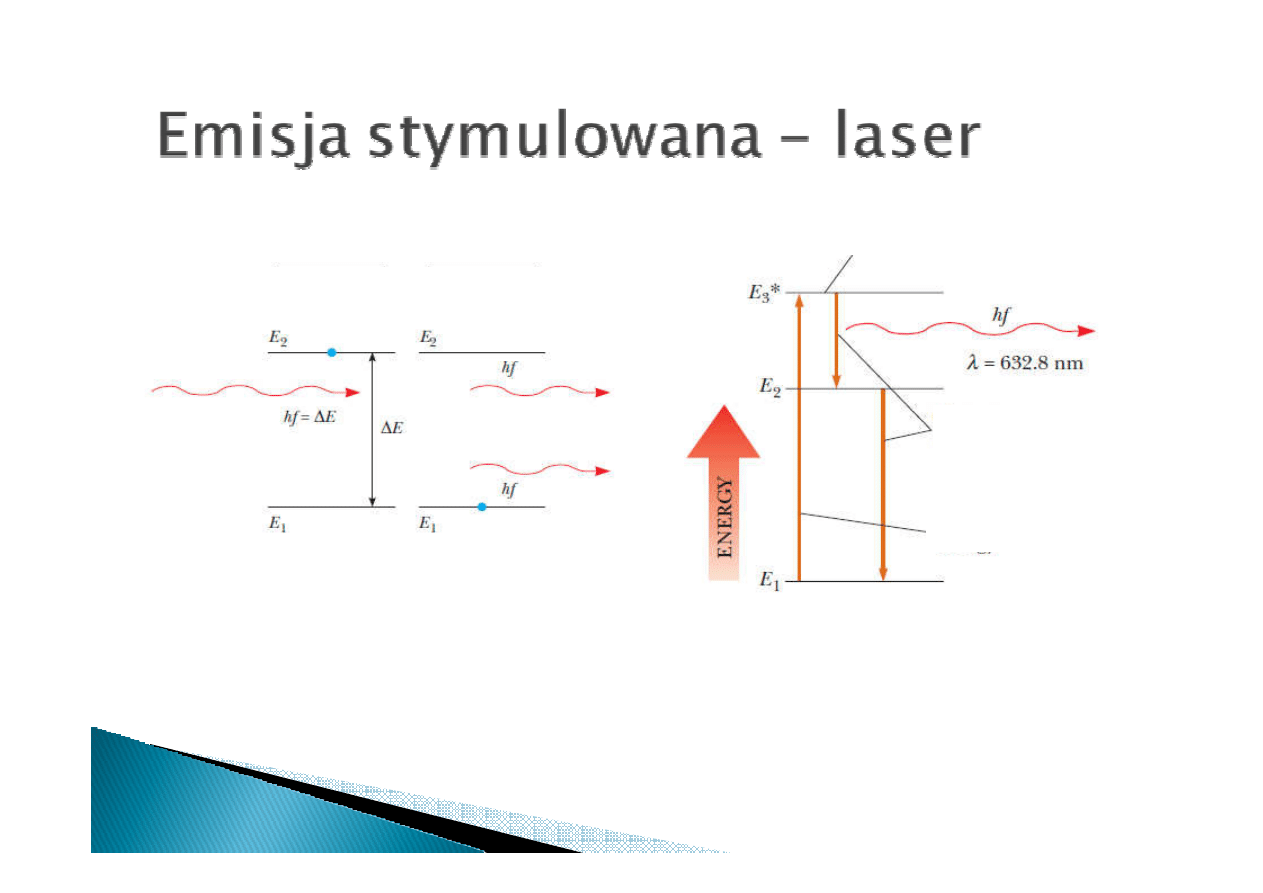
stan metastabilny
energia
wyjściowa
energia
wejściowa
Emisja wymuszona
Emisja wymuszona
Emisja wymuszona
Emisja wymuszona
Foton emitowany ma taką samą fazę
jak foton padający – powstaje wiązaka
światła spójnego
Inwersja obsadzeń
Inwersja obsadzeń
Inwersja obsadzeń
Inwersja obsadzeń – więcej elektronów
jest w stanie wzbudzonym niż w stanie
podstawowym
Wyszukiwarka
Podobne podstrony:
Chemia II Budowa atomu
Chemia II Budowa atomu
Wykład 1, budowa atomu, wiązania chemiczne
chemia budowa atomu
LABMETS1, AGH IMIR Mechanika i budowa maszyn, II ROK, Metrologia Tyka Haduch, Metrologia, Metrologia
Metro ćw 4, AGH IMIR Mechanika i budowa maszyn, II ROK, Metrologia Tyka Haduch, Metrologia, Metrolog
BUDOWA ATOMU teoria
budowa atomu(1)
budowa atomu zadania
budowa atomu I
Budowa atomu ćwiczenie 5
budowa atomu
7 BUDOWA ATOMU I PROMIENIOTW ôRCZO Ü ć zadania maturalne
LABMETS4, AGH IMIR Mechanika i budowa maszyn, II ROK, Metrologia Tyka Haduch, Metrologia, Metrologia
KUK-METRO-7, AGH IMIR Mechanika i budowa maszyn, II ROK, Metrologia Tyka Haduch, Metrologia, Metrolo
METmar9, AGH IMIR Mechanika i budowa maszyn, II ROK, Metrologia Tyka Haduch, Metrologia, Metrologia,
Prezentacja o budowach atomu id Nieznany
Zestaw zadań rachunkowych - światło i budowa atomu, kl 1 fizyka
więcej podobnych podstron