
1
Budowa atomu i promieniotwórczość
Poziom podstawowy
Informacja do zadań 1 i 2.
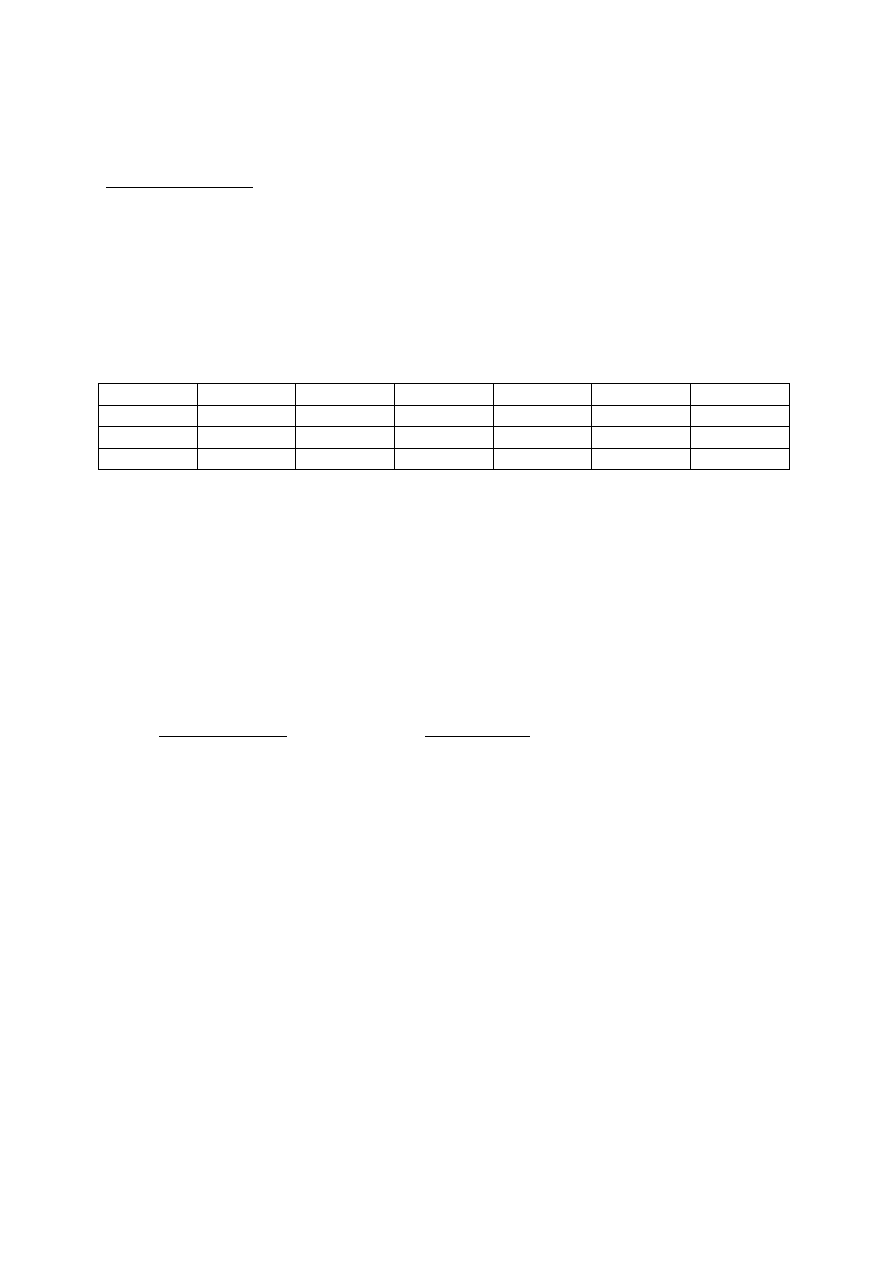
Konfigurację elektronową atomu glinu w stanie podstawowym można przedstawić
następująco:
1s
2
2s
2
2p
6
3s
2
3p
1
(K
2
L
8
M
3
)
1.
Przepisz ten fragment konfiguracji elektronowej atomu glinu, który odnosi się do
elektronów walencyjnych.
2.
Podaj trwały stopień utlenienia, który glin przyjmuje w związkach chemicznych.
3.
Dane są indywidua chemiczne:
E
23
11
,
+
E
39
19
,
−
2
79
34
E
. Określ liczbę cząstek elementarnych
[protonów, neutronów i elektronów], które je tworzą.
4.
Pierwiastek X ma konfigurację 1s
2
2s
2
2p
5
. Można o nim powiedzieć, że:
a)
Jest położony w układzie okresowym w ….. grupie i w …… okresie.
b)
Jest ………….. .
c)
Jego maksymalny stopień utlenienia wynosi ….., a najniższy ….. .
d)
Tworzy trwały jon prosty o symbolu ….. .
e)
Ma charakter …………. .
f)
Tworzy tlenek o wzorze sumarycznym …….. i wodorek o wzorze sumarycznym ….. .
5.
Spośród podanych niżej jonów wybierz te, które posiadają identyczną konfigurację
elektronową: Ca
2+
, Al
3+
, S
2─
, B
3+
, Cl
─
.
6.
Przedstaw konfigurację elektronową atomu, który składa się z 34 cząstek elementarnych,
w tym 12 neutronów.
7.
Przedstaw konfigurację elektronową Si, F
─
i Al
3+
za pomocą liczb kwantowych.
8.
Brom występuje w postaci dwóch izotopów: Br
79
35
i
Br
81
35
. Wybierz zawartość procentową
każdego z nich w ogólnej masie bromu, jeśli jego masa atomowa wynosi 79,9 u.
a)
%
55
79
35
=
Br
i
%
45
81
35
=
Br
b)
%
6
,
50
79
35
=
Br
i
%
4
,
49
81
35
=
Br
c)
%
3
,
52
79
35
=
Br
i
%
7
,
47
81
35
=
Br
d)
%
2
,
49
79
35
=
Br
i
%
8
,
50
81
35
=
Br
9.
Rdzeń atomowy nuklidu krzemu Si
28
14
składa się z:
a) 38 cząstek elementarnych
b) 28 cząstek elementarnych
c) 42 cząstek elementarnych
d) 10 cząstek elementarnych
10. Prawidłowy zapis konfiguracji walencyjnej tlenu w stanie wzbudzonym przedstawiony
jest schematem:
a) 2s
2
2p
3
3d
1
b) 2s
1
2p
3
3d
2
c) obydwie konfiguracje podane w punktach a i b są prawidłowe.
d) tlen nie może ulegać wzbudzeniu, ponieważ w powłoce walencyjnej nie ma wolnej
podpowłoki, na którą mogłyby być przeniesione elektrony.
11. Która seria promieniowania doprowadzi do powstania tego samego pierwiastka, który
został poddany promieniowaniu? Promieniowanie:
a) α, β
─
, β
─
b) β
─
, α, α
c) α, β
─
, γ
d) α, β
─
, bombardowanie neutronami
12. Ustal, jaki trwały izotop powstanie, jeżeli
Bi
212
83
ulegnie kolejno przemianom α i β
─
.
Zapisz równania reakcji.
13. Okres półtrwania
Ra
224
88
wynosi 3,6 dnia. Oblicz ile gramów izotopu ulegnie rozpadowi
po upływie 18 dni, jeśli pierwotna masa próbki wynosiła 160 g.
2
14. Okres połowicznego rozpadu pewnego pierwiastka wynosi 5 lat. Próbka tego pierwiastka
po 15 latach przemian miała masę 0,05 g. Jaka była masa tej próbki w stanie
początkowym?
Poziom rozszerzony
1.
Dokonaj przyporządkowania podanych niżej par nuklidów, przedstawionych wzorami
ogólnymi do odpowiedniej grupy izotopów, izobarów i izotonów.
a)
X
30
14
i Y
32
16
b) E
35
17
i E
37
17
c) Z
32
18
i E
32
17
2. Podaj trzy drobiny (atom, anion i kation) o następującej konfiguracji elektronowej:
1s
2
2s
2
2p
6
3s
2
3p
6
.
3. Konfiguracja elektronów walencyjnych w atomie jest następująca: 3d
2
4s
2
. Podaj wartości
liczb kwantowych (n, l, m i m
s
) opisujących stany kwantowe tych elektronów.
4. Podane wartości liczb kwantowych charakteryzują elektrony walencyjne atomu pewnego
pierwiastka:
n
3
3
3
3
3
4
l
2
2
2
2
2
0
m
-2
-1
0
1
2
0
m
s
½
½
½
½
½
½
Ustal przynależność pierwiastka do bloku konfiguracyjnego oraz określ jego położenie w
układzie okresowym.
5. Ustal, ile neutronów znajduje się w cząsteczce ciężkiej wody o wzorze DTO i masie
cząsteczkowej M = 21u.
6. Określ przynależność pierwiastków do bloku konfiguracyjnego, wiedząc, że ich atomy
mają następującą konfigurację elektronów walencyjnych: X – ns
2
np
3
i Y – (n-1)d
5
ns
1
.
7. Napisz, jakie główne czynniki decydują o trwałości jąder atomowych.
8. Przedstaw konfigurację elektronową atomu manganu
25
Mn. Podaj możliwe stopnie
utlenienia manganu w związkach chemicznych.
9. Przedstaw konfiguracje elektronowe jonów: Na
+
, Ca
2+
, Al
3+
, Cl
─
, S
2─
, Fe
3+
, Cr
3+
i Cu
2+
i
porównaj je z konfiguracjami odpowiednich atomów.
10. Przyporządkuj liczbie kwantowej cechę orbitalu, jaką określa:
Liczba kwantowa
Cecha orbitalu
1. główna
I. orientacja przestrzenna
2. orbitalna
II. wielkość konturu
3. magnetyczna
III. kształt konturu
11. Ustal, wykonując obliczenia, ile razy zmalała zawartość izotopu węgla C-14 w drewnie,
które pochodzi z drzewa obumarłego przed 11460 laty. Okres półtrwania tego izotopu
węgla wynosi 5730 lat.
12. Schemat ilustruje fragment torowego szeregu promieniotwórczego. Jakim przemianom
ulegają jądra kolejnych pierwiastków ? Zapisz reakcje rozpadu.
Th
232
90
→
Ra
228
88
→
Ac
228
89
→
Th
228
90
→
Ra
224
88
→
Rn
220
86
13. Przemiana uranu jest przykładem procesu rozszczepienia jądra:
U
235
92
+ n
1
0
→
Ba
141
56
+ 3 n
1
0
+ E
A
Z
Określ E
A
Z
.
14. Podaj, ile cząstek α i β
─
wyemituje atom ołowiu
Pb
208
82
, przemieniając się w atom rtęci
Hg
200
80
. Przedstaw kolejne etapy schematycznym równaniem.
15.
Pierwiastek A ma konfigurację elektronową: [Ar]3d
10
4s
2
4p
5
. Dwudodatni jon pierwiastka B ma
taką samą konfigurację elektronową jak jednoujemny jon pierwiastka A. Napisz wzór chemiczny
związku utworzonego z tych dwóch pierwiastków.
16. Pewien izotop ma liczbę masową 196, a 60,2% nukleonów stanowią neutrony. Ile elektronów
znajduje się w dwudodatnim kationie tego pierwiastka
Wyszukiwarka
Podobne podstrony:
7 BUDOWA ATOMU PROMIENIOTW ôRCZO Ü ć
8. budowa atomu pow+éoki i elektrony zadania maturalne, Chemia
4 6 budowa atomu,promieniotwórczosc izotopy
budowa atomu zadania
budowa atomu przykładowe zadania(1)
BUDOWA ATOMU, WIĄZANIA zadania
atom - budowa i przemiany zadania2 , Budowa atomu
atom - budowa i przemiany zadania , Budowa atomu
zadania dodatkowe - budowa atomu, ……………………&h
budowa atomu zadania
Wykład 1, budowa atomu, wiązania chemiczne
chemia budowa atomu
BUDOWA ATOMU teoria
Chemia II Budowa atomu
budowa atomu(1)
budowa atomu I
więcej podobnych podstron