Zestaw zadań nr 5
1.
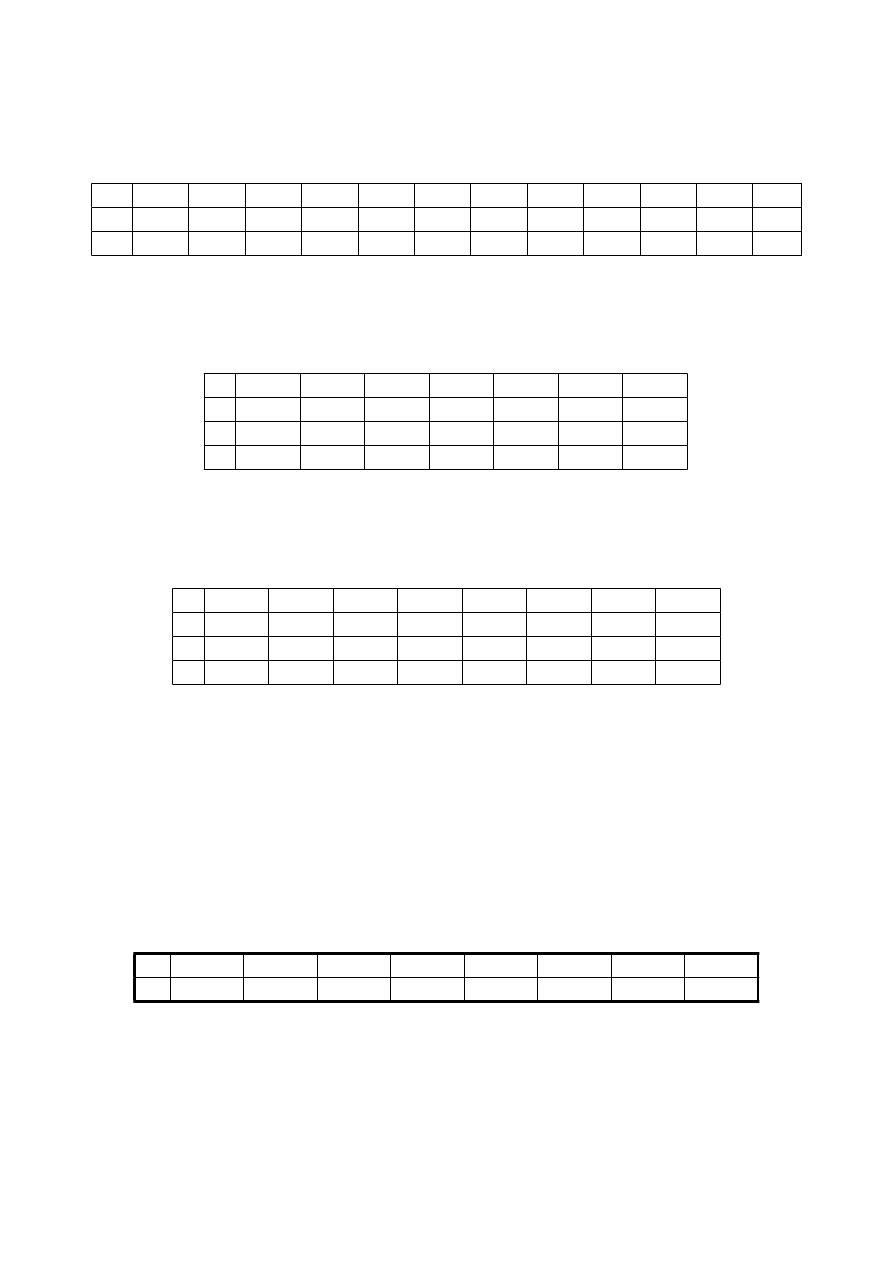
Obliczyć początkową i końcową temperaturę wrzenia roztworu n-heksanu i n-oktanu zawierającego 40% molowych
składnika lotniejszego pod ciśnieniem 2026 hPa. Prężności pary nasyconej w funkcji temperatury podano w tabeli
t
93,3
99
104,5
110
115,5
121
126
132,2
137,8
143
149,8
154,5
P
heksan
2026
2229
2533
3039
3546
4052
4559
5065
5673
6483
7294
8104
P
oktan
375
446
527
628
739,5
871
1013
1165
1317
1520
1722
2026
2.
Pod ciśnieniem 1013 hPa w procesie destylacji równowagowej z 10 kmoli/h mieszaniny zawierającej 40% mol.
benzenu i 60% mol. kwasu octowego otrzymuje się destylat zawierający 65% mol. benzenu. Obliczyć strumień
destylatu i skład cieczy wyczerpanej. Zależność równowagowa dla układu benzen - kwas octowy pod ciśnieniem
1013 hPa (wyrażona w ułamkach molowych) podana jest w poniższej tabeli:
x
0,00
0,05
0,10
0,20
0,30
0,40
0,50
y*
0,00
0,337
0,465
0,615
0,679
0,728
0,774
x
0,60
0,70
0,80
0,90
0,95
0,97
0,99
y*
0,815
0,854
0,895
0,942
0,970
0,982
0,992
3.
Jakie będzie stężenie cieczy pozostającej po destylacji i stężenie destylatu, jeżeli ze strumienia 25 kmol/h
mieszaniny zawierającej 15% mol. etanolu i 85% mol. trichloroetylenu w procesie destylacji równowagowej pod
ciśnieniem 1013 hPa uzyska się 5 kmol/h destylatu? Zależność równowagowa dla etanol - trójchloroetylen pod
ciśnieniem 1013 hPa (wyrażona w ułamkach molowych) podana jest w poniższej tabeli:
x
0,01
0,03
0,05
0,10
0,20
0,30
0,40
0,50
y*
0,125
0,241
0,292
0,374
0,457
0,489
0,560
0,522
x
0,60
0,70
0,80
0,85
0,90
0,95
0,97
0,99
y*
0,539
0,570
0,634
0,683
0,763
0,861
0,905
0,962
4.
Doskonały roztwór cieczy A i B poddano destylacji kotłowej. Zawartość składnika lotniejszego (składnik A) w
surowcu wynosi 15% mol. Jaki będzie skład pozostałości oraz średni skład destylatu, jeżeli w trakcie trwania
procesu destylacji odparowuje 30% surowca. Założyć, że współczynnik równowagi międzyfazowej jest stały i
wynosi
k
A
= 2,2.
5.
35,25 kmol (1000 kg) mieszaniny dwuskładnikowej etanol – woda o stężeniu 37% mol. etanolu należy poddać
destylacji różniczkowej pod ciśnieniem atmosferycznym tak, aby ciecz pozostająca w kotle zawierała 2% mol.
etanolu. Obliczyć ilość cieczy wyczerpanej, ilość destylatu i jego średni skład. Określić także ile kilogramów
etanolu traci się w cieczy wyczerpanej. Zależność równowagową (wyrażoną w ułamkach molowych) podano w
poniższej tabeli:
x
0,01
0,03
0,05
0,10
0,20
0,30
0,40
0,50
y*
0,114
0,241
0,322
0,438
0,529
0,583
0,617
0,652

6.
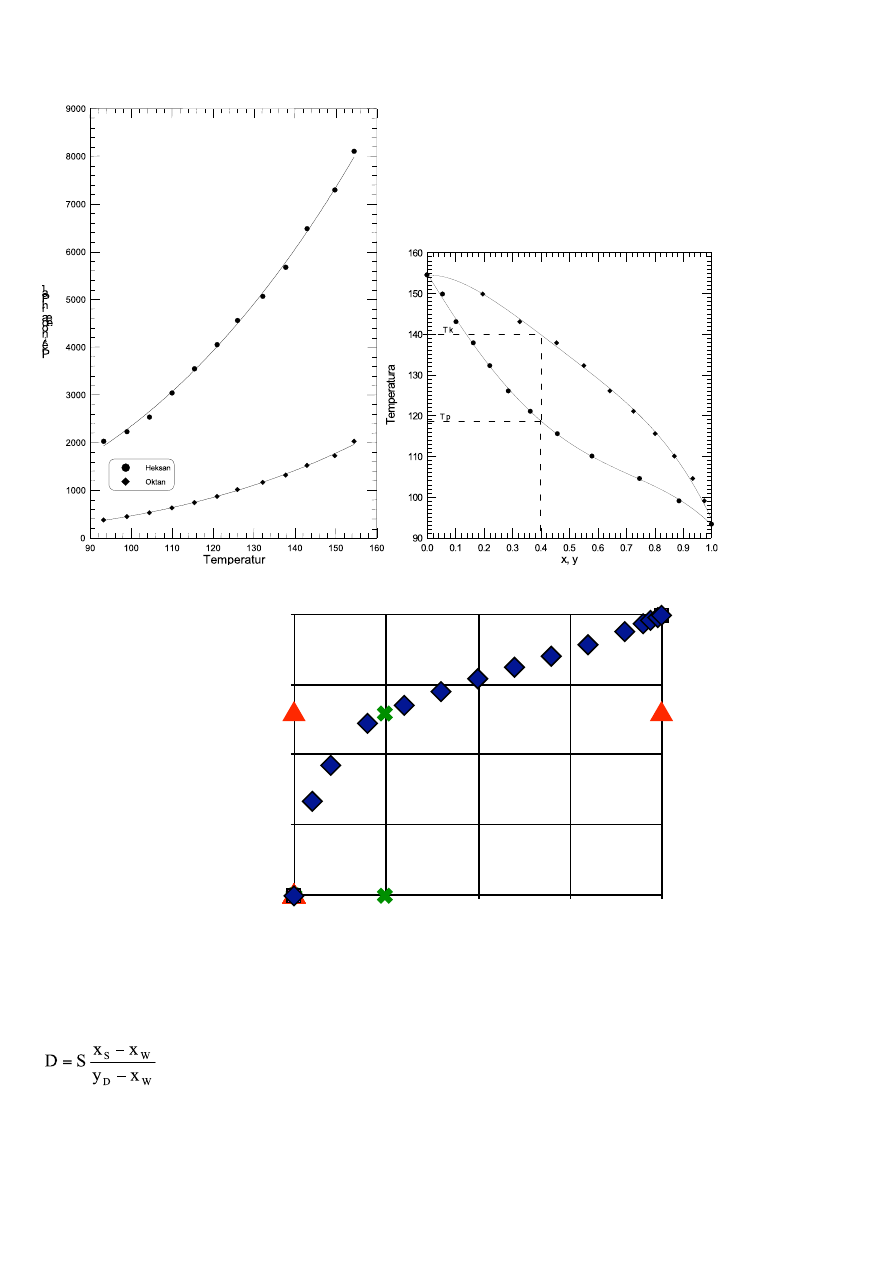
Zadanie 1
Zadanie 2
0
0,25
0,50
0,75
1,00
0
0,25
0,50
0,75
1,00
y
x
Dla x
D
= 0,65 odczytuje się z wykresu wartość
x
W
=0,2473 na linii równowagi
S = D+W
S x
S
= D y
D
+ W x
W
S x
S
= D y
D
+ (S-D) x
W
D=
3,792 kmol/h
W
=
6,208 kmol/h
Zadanie 3
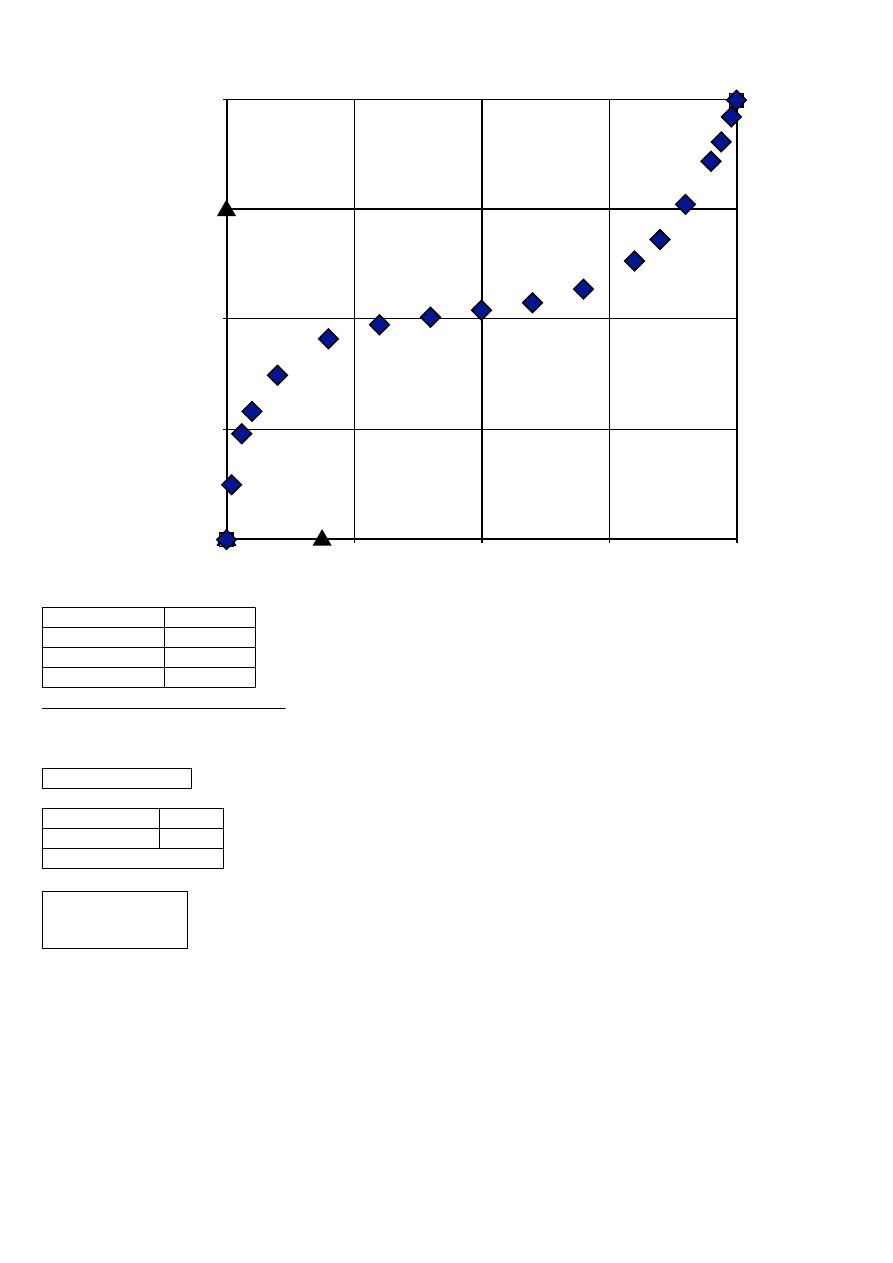
0
0,25
0,50
0,75
1,00
0
0,25
0,50
0,75
1,00
y
x
S=
25
xS=
0,15
D=
5
W=
20
Wyprowadzewnie linii operacyjnej
S xS=D y+W x
y=S/D xS - W/D x
S/D *xS=
0,75
W/D=
4
y=-4*x+0,75
Dane do linii operacyjnej
x
y
0
0,75
0,1875
0
x
W
=
0,0953
y
D
=
0,3687
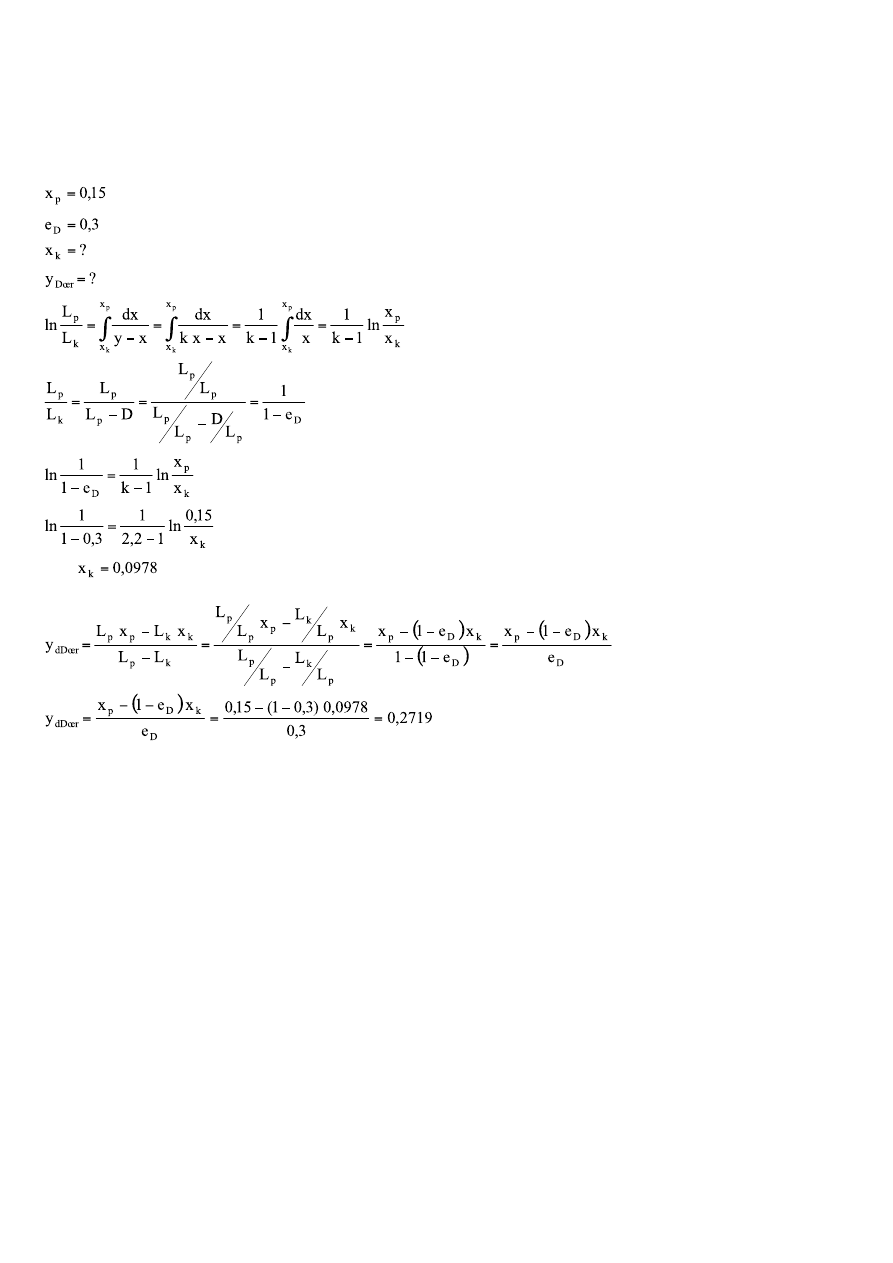
7.
Doskonały roztwór cieczy A i B poddano destylacji kotłowej. Zawartość składnika lotniejszego (składnik A) w
surowcu wynosi 15% mol. Jaki będzie skład pozostałości oraz średni skład destylatu, jeżeli w trakcie trwania
procesu destylacji odparowuje 30% surowca. Założyć, że współczynnik równowagi międzyfazowej jest stały i
wynosi
k
A
= 2,2.
stąd
Zadanie 5
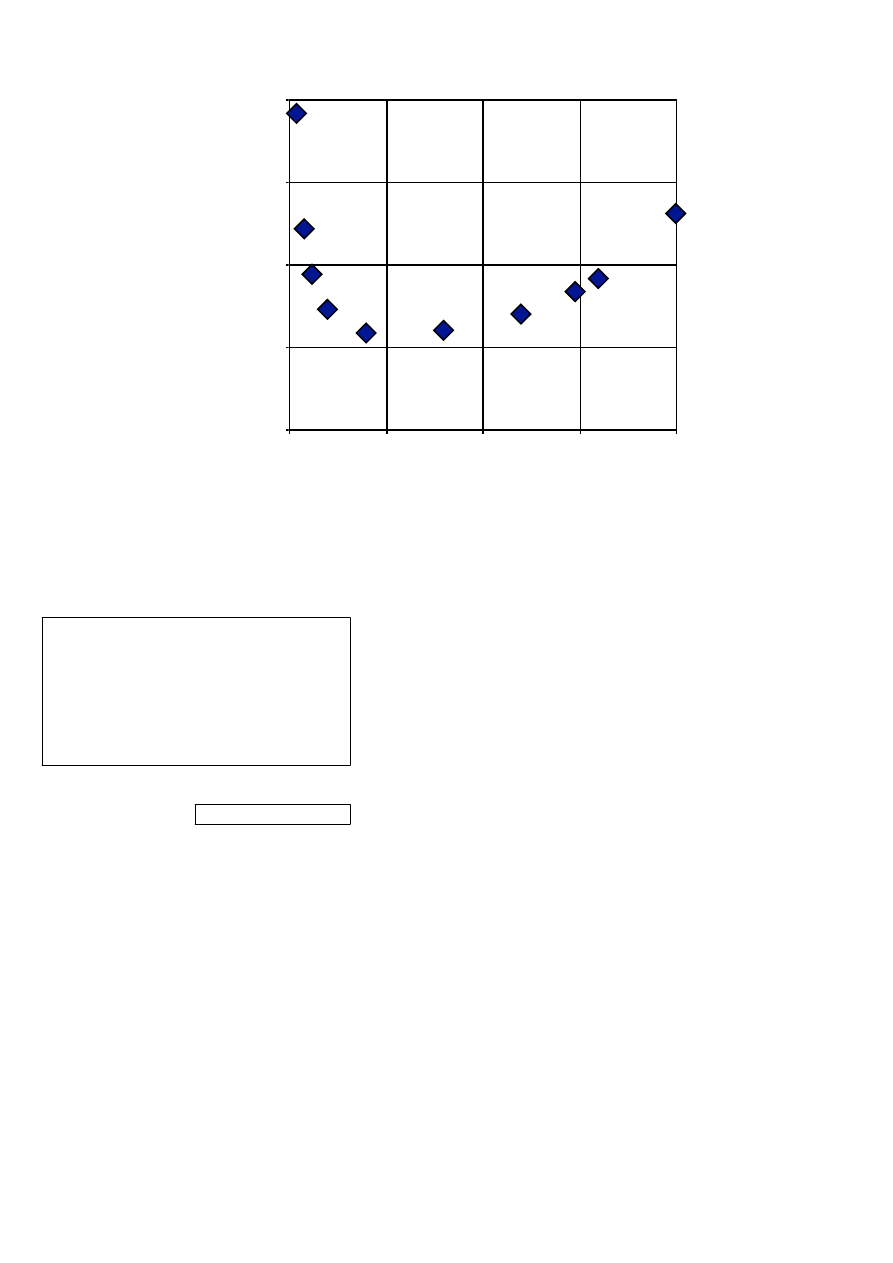
0
2,5
5,0
7,5
10,0
0
0,125
0,250
0,375
0,500
1/(y-x)
x
Lp=
35,25kmol
x
y*
1/(y-x)=
Pola=
0
0
0,01
0,114 9,615385
0,02
0,1835 6,116208
0,03
0,241 4,739336 0,054278
0,05
0,322 3,676471 0,084158
0,1
0,438 2,95858 0,165876
0,2
0,529 3,039514 0,299905
0,3
0,583 3,533569 0,328654
0,37 0,60737 4,212832 0,271124
0,4
0,617 4,608295
0,5
0,652 6,578947
Suma pól= 1,203995
Dla
xp=
0,37
y*=
0,60737
xk=
0,02
y*=
0,1835
Całka Rayghleya=
1,203995
ln (Lp/Lk)=
1,203995
Lp/Lk=
3,333407
Lk=
10,57477kmol
yD śr=
0,520
Zadanie 6
Roztwór ciekły zawierający 10%mol. propanu (C3), 65% mol. n-butanu (C4) i 25% mol. n-pentanu (C5) jest
destylowany rzutowo w temperaturze 40
o
C pod ciśnieniem całkowitym 600 mmHg. Obliczyć ilość i skład powstającej
fazy ciekłej i parowej zakładając, że układ podlega prawu Raoulta. Prężności pary nasyconej w temperaturze procesu
wynoszą odpowiednio: C3 - 3800 mmHg, C4 - 820 mmHg, C5 - 190 mmHg.
x
AS
= 0,10
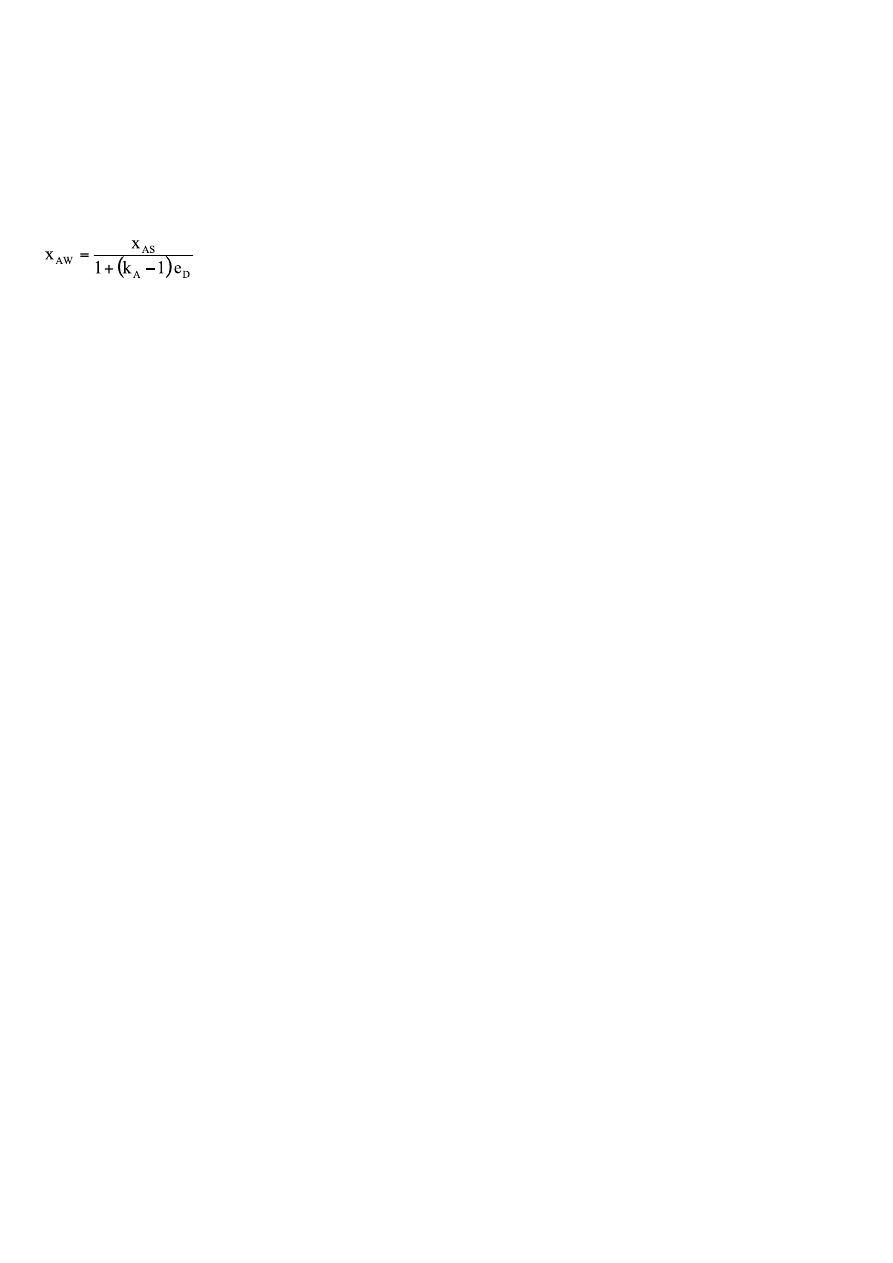
x
BS
= 0,65
x
CS
= 0,25
p = 600 mm Hg
P
A
= 3800 mm Hg
P
B
= 820 mm Hg
P
C
= 190 mm Hg
x
AS
=
0,1
x
BS
=
0,65
x
CS
=
0,25
p =
600mm Hg
P
A
=
3800mm Hg
kA=
6,333333
P
B
=
820mm Hg
kB=
1,366667
P
C
=
190mm Hg
kC=
0,316667
xAW=
xBW=
xCW=
Suma
0,038462 0,585586 0,314465 0,938513
0,3
0,036946 0,581742 0,319966 0,938654
0,32
0,035545 0,577949 0,325662 0,939156
0,34
0,034247 0,574205 0,331565 0,940017
0,36
0,03304 0,570509 0,337686 0,941234
0,38
0,031915
0,56686 0,344037 0,942812
0,4
0,030864 0,563258 0,350631 0,944754
0,42
0,02988 0,559701 0,357483 0,947065
0,44
0,028958 0,556189 0,364609 0,949756
0,46
0,02809 0,552721 0,372024 0,952835
0,48
0,027273 0,549296 0,379747 0,956315
0,5
0,026502 0,545913 0,387797 0,960212
0,52
0,025773 0,542571 0,396197 0,964541
0,54
0,025084
0,53927 0,404968 0,969321
0,56
0,02443 0,536009 0,414136 0,974575
0,58
0,02381 0,532787 0,423729 0,980325
0,6
0,02322 0,529603 0,433777
0,9866
0,62
0,022659 0,526458 0,444313 0,993429
0,64
0,0221760,5236590,4542431,000077
0,658
0,022124 0,523349 0,455373 1,000847
0,66
Wyszukiwarka
Podobne podstrony:
Kapłon, inżynieria chemiczna Ć, Lista 1
Kapłon, inżynieria chemiczna Ć, Lista 2(1)
Zagadnienia do egzaminu - lista, Biotechnologia PWR, Semestr 3, Inżynieria Chemiczna - wykład (Nowor
inzynieria chemicza 1 17
Zagadnienia do kolokwium zaliczeniowego 2013-2014, Inżynieria materiałowa pwr, Inżynieria chemiczna
Witaminy są związkami organicznymi, uniwersytet warmińsko-mazurski, inżynieria chemiczna i procesowa
zadanie1 3, uniwersytet warmińsko-mazurski, inżynieria chemiczna i procesowa, rok II semestr 3, tran
Wyniki egzamin IIIrok-inż.chem., III rok semestr letni, inżynieria chemiczna
pytania operacje, uniwersytet warmińsko-mazurski, inżynieria chemiczna i procesowa, rok II semestr 4
Inżynieria chemiczna 3
Stechiometria, Inżynieria chemiczna i procesowa
D III rokBiopreparatywykłady 1-3fermenty, uniwersytet warmińsko-mazurski, inżynieria chemiczna i pro
więcej podobnych podstron