Obliczenia stechiometryczne
Obliczenia chemiczne przeprowadzane na podstawie wzorów chemicznych substancji oraz równań reakcji chemicznych.
Obliczenia na podstawie wzorów chemicznych
Wzory chemiczne substancji podają:
- pierwiastki składowe, z których zbudowany jest dany związek,
- liczbę atomów pierwiastków składowych w cząsteczce związku.
Wzory chemiczne mogą służyć do obliczania ilościowej zawartości składników (pierwiastków lub grup pierwiastków) w związku chemicznym.
Przykład 1. Obliczyć masę chromu zawartego w 15,0 g chromianu(VI) ołowiu(II).
MPb = 207,2 u; MCr = 51,996 u; MO = 15,999 u;
Wzór chemiczny chromianu(VI) ołowiu(II): PbCrO4
czyli: w 1 molu związku zawarty jest 1 mol chromu
1 mol związku: 1 207,2 g + 1 51,996 g + 4 15,999 g = 307,193 g
liczba moli związku:
![]()
liczba moli chromu = 0,0488
masa chromu = 0,048851,996 g = 2,5374 g
Przykład 2. Obliczyć procentową zawartość ołowiu w chromianie(VI) ołowiu(II)
masa molowa chromianu(VI) ołowiu(II): 307,193 g
w 1 molu związku zawarty jest 1 mol ołowiu czyli 207,2 g ołowiu
zawartość procentowa:
![]()
lub
mol PbCrO4 = 307,193 g stanowi 100 %
mol Pb = 207,2 g stanowi x %
![]()
Przykład 3. Obliczyć procentową zawartość wapnia w dolomicie (CaCO3MgCO3) zawierającym 10 % masowych złoża.
MCa = 40,078 u; MMg = 24,305 u; MC = 12,011 u; MO = 15,999 u;
masa molowa węglanu magnezu i wapnia jest równa:
1 MCa + 1 MMg + 2 MC + 6 MO =
1 40,078 g/mol + 1 24,305 g/mol + 2 12,011 g/mol + 6 15,999 g/mol = 184,345 g/mol
czyli:
184,345 g CaMg(CO3)2 stanowi 90 % dolomitu
a
40,078 g wapnia stanowi x % dolomitu
zatem:
![]()
Przykład 4. Jeden z tlenowych kwasów arsenu ma następujący skład ilościowy:
H - 2,13 %, As - 52,78 % , O - 45,09 %.
Podać najprostszy wzór empiryczny tego kwasu.
MH = 1,008 u; MAs = 74,922 u; MO = 15,999 u
Ogólny wzór tlenowego kwasu arsenu: HxAsyOz
założenie: 100 g związku
czyli: procentowa zawartość poszczególnych pierwiastków w związku wynosi:
![]()
stąd, liczba moli wodoru w związku:
![]()
analogicznie:
![]()
![]()
wzór miałby zatem postać: H2,113As0,704O2,818
We wzorach związków chemicznych unika się niecałkowitych współczynników stechiometrycznych, zatem po podzieleniu otrzymanych wartości współczynników przez najmniejszą z nich:
x = 2,113 : 0,704 = 3
y = 0,704 : 0,704 = 1
z = 2,818 : 0,704 = 4
czyli najprostszy, empiryczny wzór kwasu arsenowego: H3AsO4.
Obliczenia na podstawie równań reakcji chemicznych
Równanie reakcji chemicznej dostarcza informacji o składzie chemicznym (jakościowym i ilościowym) substratów i produktów.
Na podstawie prawidłowo napisanych równań reakcji chemicznych przeprowadza się obliczenia o praktycznym znaczeniu, np. oblicza się:
- ilości substratów potrzebne do otrzymania żądanej ilości produktów,
- wydajność procesów chemicznych.
Przykład 5. Obliczyć masę i objętość (zmierzoną w warunkach normalnych) wodoru otrzymanego w wyniku reakcji 4,861 g metalicznego magnezu z roztworem kwasu solnego.
MMg = 24,305 u; MH = 1,008 u;
Reakcja zachodzi wg równania:
Mg + 2 HCl = MgCl2 + H2
stosunek molowy rozważanych reagentów:
1 mol : 1 mol
liczba moli wydzielonego wodoru = liczbie moli magnezu użytego w reakcji:
![]()
zatem:
- masa otrzymanego wodoru:
m = 0,2 mola × 2,016 g/mol = 0,4032 g
- objętość otrzymanego wodoru:
V = 0,2 mola 22,415 dm3/mol = 4,483 dm3
Przykład 6. W wyniku redukcji tlenku glinu wodorem otrzymuje się metaliczny glin i wodę. Obliczyć masę otrzymanego glinu, jeżeli w reakcji uzyskano 10,809 g wody.
MAl = 26,982 u; MH = 1,008 u; MO = 15,999 u;
Równanie zachodzącej reakcji:
Al2O3 + 3 H2 = 2 Al + 3 H2O
stosunek molowy produktów:
2 mole : 3 mole
liczba moli wody otrzymanej w reakcji:
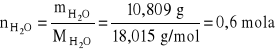
zatem liczba moli otrzymanego glinu na = 0,4 mola
masa glinu = nAl MAl = 0,4 mola 26,982 g/mol = 10,7928 g
Przykład 7. W celu otrzymania siarczku cynku zmieszano 15,0 g cynku i 6,4 g siarki. Który z substratów i w jakiej ilości został użyty w nadmiarze?
MZn = 65,39 u; MS = 32,066 u;
Równanie zachodzącej reakcji:
Zn + S = ZnS
stosunek molowy substratów:
1 mol : 1 mol
liczba moli cynku użytego do reakcji:
![]()
liczba moli siarki użytej do reakcji:
![]()
zatem:
w nadmiarze użyto 0,029 mola cynku
masa cynku wziętego w nadmiarze: mZn = nZn MZn = 0,029 65,39 g/mol = 1,89631 g
Przykład 8. Przez roztwór zawierający 20,0 g siarczanu(VI) miedzi(II) przepuszczano gazowy siarkowodór. Masa wytrąconego osadu siarczku miedzi(II), po odsączeniu i wysuszeniu, wynosiła 11,75 g. Obliczyć wydajność (w %) reakcji.
MS= 32,066 u; MCu = 63,546 u; MO = 15,999 u;
Równanie zachodzącej reakcji:
CuSO4 + H2S = CuS + H2SO4
stosunek molowy rozważanych reagentów:
1 mol : 1 mol
stosunek wagowy rozważanych reagentów:
159,608 g : 95,612 g
zatem:
z 159,608 g CuSO4 winno się otrzymać 95,612 g CuS
czyli:
z 20,0 g CuSO4 " x g CuS
stąd:
![]()
Wydajność (w %) jest to stosunek (wyrażony w procentach) ilości (np. masy lub objętości) substancji otrzymanej rzeczywiście do teoretycznie obliczonej ilości substancji otrzymywanej w danej reakcji.
![]()
Przykład 9. W wyniku reakcji 44,0 g siarczku żelaza(II) z roztworem kwasu solnego otrzymano 10,087 dm3 siarkowodoru (zmierzonego w warunkach normalnych). Obliczyć stopień czystości użytego siarczku żelaza(II).
MFe = 55,845 u; MS = 32,066 u;
Równanie zachodzącej reakcji:
FeS + 2 HCl = H2S + FeCl2
stosunek molowy rozważanych reagentów:
1 mol : 1 mol
liczba moli otrzymanego siarkowodoru:
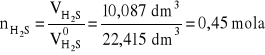
liczba moli czystego siarczku żelaza(II) zawartego w analizowanej próbce = 0,45 mola
masa czystego FeS zawartego w próbce:
mFeS = nFeS × MFeS = 0,45 mola × 87,911 g/mol = 39,556 g
zatem stopień czystości użytego FeS:
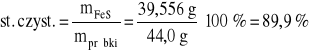
Przykład 10. Obliczyć masę 90 % koksu, którą należy użyć do wytopu metalicznego cynku z 500 kg blendy cynkowej, zawierającej 80 % składnika podstawowego (ZnS).
MZn = 65,39 u; MS = 32,066 u; MC = 12,011 u;
Równanie zachodzącej reakcji:
ZnS + 2 C + 2 O2 = Zn + 2 CO + SO2
stosunek liczby moli rozważanych reagentów:
1 mol : 1 mol
masa czystego ZnS w blendzie cynkowej:
mZnS = 500 kg 0,8 = 400 kg
liczba moli ZnS:
![]()
liczba kilomoli C konieczna do przeprowadzenia wytopu = 4,10 kmola
masa czystego węgla = 4,10 kmola 12,011 kg/kmol = 49,245 kg
W użytym do procesu koksie:
masa węgla = 49,245 kg stanowi 90 %
masa koksu = x " 100 %
![]()
Zadania
1. Wyprowadzić wzór empiryczny i podać nazwę związku zawierającego: 44,87 % potasu, 18,40 % siarki i 36,73 % tlenu.
2. Wyprowadzić wzór empiryczny i podać nazwę związku zawierającego: 23,09 % żelaza, 17,37 % azotu i 59,54 % tlenu.
3. Wyprowadzić wzór empiryczny i podać nazwę soli o składzie: 5,03 % berylu, 10,04 % glinu, 31,35 % krzemu i 53,59 % tlenu.
4. Tlenosól ma skład: 81,96 % bizmutu, 2,36 % węgla, 15,68 % tlenu. Wyprowadzić wzór empiryczny i podać nazwę soli.
5. Wyprowadzić wzór empiryczny i podać nazwę wodorosoli zawierającej: 28,71 % potasu; 23,55 % siarki; 47,00 % tlenu i 0,74 % wodoru.
6. Wyprowadzić wzór empiryczny i podać nazwę wodorosoli zawierającej: 17,12 % wapnia, 26,47 % fosforu, 54,69 % tlenu i 1,72 % wodoru.
7. Wyprowadzić wzór empiryczny i podać nazwę wodorosoli zawierającej: 27,95 % żelaza, 23,25 % fosforu, 48,04 % tlenu i 0,76 % wodoru.
8. Wyprowadzić wzór empiryczny i podać nazwę hydroksysoli o składzie: 50,81 % cynku, 19,41 % arsenu, 29,01 % tlenu i 0,77 % wodoru.
9. Hydroksysól zawiera: 31,50 % chromu, 19,43 % siarki, 48,46 % tlenu i 0,61 % wodoru. Wyprowadzić wzór empiryczny i podać nazwę związku.
10. Hydroksysól zawiera: 21,94 % glinu, 11,39 % azotu, 65,03 % tlenu i 1,64 % wodoru. Wyprowadzić wzór empiryczny i podać nazwę związku.
11. Hydroksysól zawiera: 32,41 % żelaza, 20,58 % chloru, 46,43 % tlenu i 0,58 % wodoru. Wyprowadzić wzór empiryczny i podać nazwę związku.
12. Hydroksysól zawiera: 50,21 % miedzi, 11,07 % azotu, 37,92 % tlenu i 0,80 % wodoru. Wyprowadzić wzór empiryczny i podać nazwę.
13. Hydroksysól zawiera: 24,88 % miedzi, 49,68 % jodu, 25,05 % tlenu i 0,39 % wodoru. Wyprowadzić wzór empiryczny i podać nazwę.
14. Uwodniona sól zawiera: 66,66 % ołowiu, 6,96 % boru, 20,59 % tlenu i 5,79 % wody. Wyprowadzić wzór empiryczny i podać nazwę soli.
15. Uwodniona sól zawiera: 24,24 % strontu, 44,22 % bromu, 26,56 % tlenu i 4,98 % wody. Wyprowadzić wzór empiryczny i podać nazwę soli.
16. Uwodniona sól zawiera: 10,89 % wapnia, 29,86 % manganu, 34,79 % tlenu i 24,46 % wody. Wyprowadzić wzór empiryczny i podać nazwę soli.
17. Uwodniona sól zawiera: 31,74 % cynku, 24,25 % arsenu, 20,71 % tlenu i 23,30 % wody. Wyprowadzić wzór empiryczny i podać nazwę soli.
18. Uwodniona sól zawiera: 7,27 % chromu, 5,47 % potasu, 8,97 % siarki, 17,89 % tlenu i 60,40 % wody. Wyprowadzić wzór empiryczny i podać nazwę soli.
19. Uwodniona sól zawiera: 49,71 % baru, 25,67 % chloru, 11,58 % tlenu i 13,03 % wody. Wyprowadzić wzór empiryczny i podać nazwę soli.
20. Analiza uwodnionej soli wykazała: 5,69 % glinu, 8,24 % potasu, 13,52 % siarki, 27,00 % tlenu i 45,55 % wody. Wyprowadzić wzór empiryczny i podać nazwę soli.
21. Tlenek wodorotlenek metalu ma skład: 80,94 % ceru, 18,48 % tlenu i 0,58 % wodoru. Wyprowadzić wzór empiryczny i podać nazwę związku.
22. Uwodniona sól zawiera: 14,74 % sodu, 19,85 % fosforu, 61,53 % tlenu i 3,88 % wodoru. Wyprowadzić wzór empiryczny i podać nazwę soli.
23. Wyprowadzić wzór empiryczny i podać nazwę uwodnionej wodorosoli zawierającej: 8,37 % magnezu, 25,81 % arsenu, 22,05 % tlenu i 0,34 % wodoru i 43,42 % wody.
24. Wyprowadzić wzór empiryczny i podać nazwę uwodnionej wodorosoli zawierającej: 31,04 % sodu, 43,29 % siarki, 1,36 % wodoru i 24,31 % wody.
25. Uwodniona hydroksysól zawiera: 51,27 % kobaltu, 5,22 % węgla, 34,80 % tlenu i 0,88 % wodoru i 7,83 % wody. Wyprowadzić wzór empiryczny i podać nazwę związku.
26. Wyprowadzić wzór empiryczny i podać nazwę uwodnionej hydroksysoli zawierającej: 24,72 % magnezu, 6,11 % węgla, 40,69 % tlenu, 1,02 % wodoru i 27,46 % wody.
27. Dwunastowodny siarczan(VI) sodu po ogrzewaniu w 70ºC traci 58,33 % wody. Obliczyć liczbę moli wody związanej w powstałej soli uwodnionej.
28. Obliczyć masę naturalnego kamienia wapiennego, zawierającego 74 % mas. węglanu wapnia, potrzebną do otrzymania, w wyniku wyprażenia, 500 kg tlenku wapnia. Napisać równanie zachodzącej reakcji.
29. 100 g metalicznej miedzi ogrzewano z 100 g siarki. W wyniku reakcji powstał siarczek miedzi(I). Napisać równanie zachodzącej reakcji. Który z substratów i w jakiej ilości wzięto w nadmiarze ?
30. Obliczyć procentowy ubytek masy wodorowęglanu sodu, który podczas ogrzewania przechodzi w węglan sodu. Napisać równanie zachodzącej reakcji.
31. Obliczyć procentowy przyrost masy metalicznego żelaza po utlenieniu do:
a) tlenku żelaza(II),
b) tlenku żelaza(III).
32. W wyniku prażenia węglanu żelaza(II) w obecności tlenu otrzymuje się tlenek żelaza(III). Napisać równanie zachodzącej reakcji. Obliczyć masę węglanu żelaza(II) konieczną do otrzymania 100 kg tlenku żelaza(III).
33. Tlenek diazotu otrzymuje się podczas ostrożnego ogrzewania azotanu(V) amonu. Napisać równanie zachodzącej reakcji. Napisać równanie reakcji. Obliczyć masę azotanu(V) amonu konieczną do otrzymania 3 moli tlenku diazotu, jeżeli wydajność procesu wynosi 80 %.
34. W wyniku działania stężonego roztworu kwasu siarkowego(VI) na 6,0 g chlorku sodu otrzymano 2,016 dm3 gazowego chlorowodoru (zmierzonego w warunkach normalnych). Napisać równanie zachodzącej reakcji. Obliczyć wydajność reakcji. Obliczyć masę powstałego dziesięciowodnego siarczanu(VI) sodu.
35. Obliczyć objętość gazowego chloru (zmierzoną w warunkach normalnych) konieczną do przeprowadzenia 20,0 g trójchlorku fosforu w pięciochlorek fosforu. Napisać równanie zachodzącej reakcji.
36. Obliczyć masę tlenku rtęci(II) potrzebną do otrzymania 3 dm3 tlenu (zmierzonego w warunkach normalnych), jeżeli wydajność reakcji wynosi 75 %. Napisać równanie zachodzącej reakcji.
37. Siarczek żelaza(II) zawiera 8 % mas. zanieczyszczeń (produkt techniczny). Obliczyć masę tego siarczku konieczną do otrzymania, w wyniku działania kwasem solnym, 3,5 dm3 siarkowodoru, zmierzonego w warunkach normalnych. Napisać równanie zachodzącej reakcji.
38. Obliczyć masę bromu jaka wydzieli się przy przepuszczaniu gazowego chloru przez roztwór zawierający 30 g bromku potasu, jeżeli wydajność reakcji wynosi 80 %. Napisać równanie zachodzącej reakcji.
39. Fosfor otrzymuje się w procesie ogrzewania w piecu elektrycznym mieszaniny fosforytu z węglem i piaskiem (SiO2). Napisać równanie zachodzącej reakcji (produktami ubocznymi są metakrzemian wapnia i dwutlenek węgla). Do procesu użyto 1 tonę fosforytu zawierającego 64 % mas. czystego ortofosforanu(V) wapnia. Obliczyć masę otrzymanego fosforu.
40. Stwierdzono, że 1 dm3 wody deszczowej zawiera średnio 6 mg kwasu azotowego(V). Obliczyć ile gramów azotu, związanego w postaci kwasu azotowego(V), dostarczy powierzchni 1 hektara (10 000 m2) opad 30 mm deszczu.
41. Z roztworu zawierającego 3,2 g chlorku arsenu(III) działaniem gazowego siarkowodoru wytrącono osad siarczku arsenu(III). Napisać równanie zachodzącej reakcji. Obliczyć objętość (zmierzoną w warunkach normalnych) koniecznego do reakcji siarkowodoru, jeżeli wydajność reakcji wynosi 75 %.
42. Obliczyć masę tlenku żelaza(III), którą można otrzymać po wyprażeniu, w obecności powietrza, 10 g węglanu żelaza(II), zawierającego 10 % mas. zanieczyszczeń. Napisać równanie reakcji.
43. 22 g siarczku żelaza(II), zawierającego 3,5 % mas. metalicznego żelaza, roztworzono w kwasie solnym. Napisać równania zachodzących reakcji. Obliczyć objętość (zmierzoną w warunkach normalnych) gazów wydzielonych w trakcie reakcji.
44. Po spaleniu 2,672 g koksu otrzymano 4,45 dm3 dwutlenku węgla zmierzonego w warunkach normalnych. Obliczyć zawartość czystego węgla w analizowanej próbce koksu.
45. Na2O⋅CaO⋅6 SiO2 to wzór tlenkowy tzw. szkła butelkowego. Obliczyć masy bezwodnej sody (węglan sodu), piasku (dwutlenek krzemu) i kredy (węglan wapnia), jakie należy użyć do wyprodukowania 500 kg szkła butelkowego.
46. Metaliczny cynk wytapia się redukując blendę cynkową (siarczek cynku) koksem (węglem) przy dostępie powietrza. Obliczyć masę koksu, zawierającego 90 % mas. węgla, którą należy użyć, do wytopu 500 kg metalicznego cynku z blendy cynkowej, zawierającej 72 % składnika podstawowego.
47. Działaniem nadmiaru roztworu kwasu siarkowego(VI) na stop cynku z arsenem wydzielono wodór i arsan. Otrzymane gazy przepuszczono przez ogrzaną rurę, na której ściankach wydzieliło się 0,095 g metalicznego arsenu, natomiast zebrany wodór zajął objętość 76 cm3 (zmierzoną w warunkach normalnych). Obliczyć skład analizowanego stopu.
48. Do 100 kg salmiaku zawierającego 90 % chlorku amonu wprowadzono wapno gaszone (wodorotlenek wapnia). Wydzielony w reakcji amoniak wprowadzano do wody otrzymując 98 kg roztworu amoniaku (woda amoniakalna). Obliczyć stężenie procentowe amoniaku w otrzymanym roztworze.
49. 0,8 g pyłu cynkowego (sproszkowany metaliczny cynk z domieszką tlenku cynku) roztworzono w roztworze kwasu siarkowego(VI). Wydzielony wodór zajął objętość 210 cm3 (zmierzoną w warunkach normalnych). Obliczyć zawartość metalicznego cynku w analizowanej próbce.
50. W wyniku działania roztworu kwasu solnego na roztwór zawierający 25,0 g azotanu(V) ołowiu(II) wytrącono trudno rozpuszczalny osad chlorku ołowiu(II). Napisać równanie zachodzącej reakcji. Obliczyć masę otrzymanej soli, jeżeli wydajność reakcji wynosi 80 %.
51. Działaniem wodnego roztworu kwasu azotowego(V) na 3,25 g tlenku magnezu otrzymano 7,86 g azotanu(V) wodorotlenku magnezu. Napisać równanie zachodzącej reakcji. Obliczyć wydajność reakcji.
52. Działaniem wodnego roztworu wodorotlenku sodu na 2,916 g chlorku chromu(III) otrzymano 2,541 g chlorku wodorotlenku chromu(III). Napisać równanie zachodzącej reakcji. Obliczyć wydajność reakcji.
53. W wyniku prażenia węglanu wapnia, będącego głównym składnikiem kamienia wapiennego, otrzymuje się dwutlenek węgla i tlenek wapnia. Napisać równanie zachodzącej reakcji. Obliczyć objętość dwutlenku węgla, zmierzoną w warunkach normalnych, otrzymanego w wyniku wyprażenia 10 ton kamienia wapiennego zawierającego 73 % składnika podstawowego.
54. Siedmiowodny siarczan(VI) żelaza(III) otrzymuje się działaniem wodnego roztworu kwasu siarkowego(VI) na tlenek żelaza(III). Napisać równanie zachodzącej reakcji. Obliczyć masę tlenku żelaza(III), jaką należy użyć, aby otrzymać 150 g wymaganej soli, jeżeli reakcja przebiega z wydajnością 75 %.
55. 2,5 g metalicznego żelaza poddano działaniu rozcieńczonego wodnego roztworu kwasu siarkowego(VI). Po odparowaniu nadmiaru kwasu i wody otrzymano 10,112 g wodorosiarczanu(VI) żelaza(II). Napisać równanie zachodzącej reakcji. Obliczyć wydajność reakcji.
56. W wyniku reakcji utleniania dwusiarczku żelaza(II), będącego głównym składnikiem pirytu, otrzymuje się dwutlenek siarki i tlenek żelaza(III). Napisać równanie zachodzącej reakcji. Obliczyć objętość dwutlenku siarki, zmierzoną w warunkach normalnych, otrzymanego w wyniku utlenienia 10 ton pirytu zawierającego 80 % składnika podstawowego.
57. Dwunastowodny siarczan(VI) chromu(III) otrzymuje się działaniem wodnego roztworu kwasu siarkowego(VI) na tlenek chromu(III). Napisać równanie zachodzącej reakcji. Obliczyć masę tlenku chromu(III) jaką należy użyć, aby otrzymać 150 g wymaganej soli, jeżeli reakcja przebiega z wydajnością 85 %.
58. 2,5 g metalicznego cynku poddano działaniu wodnego roztworu kwasu chlorowodorowego. Po odparowaniu nadmiaru kwasu i wody otrzymano 4,141 g chlorku wodorotlenku cynku. Napisać równanie zachodzącej reakcji. Obliczyć wydajność reakcji.
59. Podczas niecałkowitego spalania (utleniania) amoniaku otrzymano 1,121 g azotu. Napisać równanie zachodzącej reakcji. Obliczyć objętość tlenu, zmierzoną w warunkach normalnych, zużytego w tej reakcji, wiedząc, że straty tlenu wynoszą 15 %.
60. 25 g metalicznego magnezu, o stopniu czystości 80 % mas., wprowadzono do roztworu kwasu chlorowego(VII). Napisać równanie zachodzącej reakcji. Obliczyć masę otrzymanego chloranu(VII) magnezu.
61. Do roztworu kwasu ortofosforowego(V) wprowadzono 100 g wodorotlenku baru o stopniu czystości 90 % mas. Obliczyć masę otrzymanego wodoroortofosforanu(V) baru. Napisać równanie zachodzącej reakcji.
62. Do 150 g wodorotlenku wapnia, o czystości 75% dodano roztwór kwasu siarkowego(VI). Obliczyć masę powstałego wodorosiarczanu(VI) wapnia. Napisać równanie zachodzącej reakcji.
63. 0,98 g dwuwodnego chlorku baru rozpuszczono w wodzie, a następnie do powstałego dodano roztwór azotanu(V) srebra. Otrzymano 1,1 g chlorku srebra. Obliczyć stopień czystości wziętego do reakcji chlorku baru.
64. Z naważki 1,02 g stali otrzymano, drogą odpowiednich operacji chemicznych, 0,08 g wyprażonego tritlenku wolframu. Obliczyć procentową zawartość wolframu w analizowanej stali.
65. Z gazami odlotowymi rocznie uchodzi do atmosfery około 3 miliony ton dwutlenku siarki. Obliczyć masę 96 % roztworu kwasu siarkowego(VI), którą można by otrzymać z tej ilości dwutlenku siarki, jeżeli wydajność procesu wynosi 90 %.
66. Chlor na skalę laboratoryjną otrzymuje się działając stężonym roztworem kwasu solnego na stały manganian(VII) potasu. Obliczyć masę manganianu(VII) potasu konieczną do uzyskania 10 dm3 chloru, zmierzonego w warunkach normalnych.
67. Wodór na skalę laboratoryjną otrzymuje się działając wodą na wodorek wapnia. Obliczyć masę wodorku wapnia konieczną do uzyskania 20 dm3 wodoru, zmierzonego w warunkach normalnych, jeżeli straty wodoru wynoszą 10%.
68. W wyniku termicznego rozkładu chloranu(V) potasu otrzymuje się gazowy tlen i chlorek potasu. Obliczyć objętość tlenu, zmierzoną w warunkach normalnych, uzyskanego z rozłożenia 25,0 g chloranu(V) potasu.
69. Mieszanina tlenku i węglanu wapnia traci po wyprażeniu 10,5 % swojej masy. Napisać równanie zachodzącej reakcji. Obliczyć skład procentowy mieszaniny.
70. Na próbkę o masie 2,475 g mieszaniny węglanu sodu i węglanu potasu działano roztworem kwasu siarkowego(VI). Po odparowaniu nadmiaru kwasu i wody otrzymano 3,139 g mieszaniny siarczanów(VI) sodu i potasu. Obliczyć skład procentowy analizowanej mieszaniny.
71. W wyniku wyprażenia, z dostępem powietrza, 2,0 g stopu cyny z ołowiem otrzymano 2,346 g mieszaniny tlenków cyny(IV) i ołowiu(II). Obliczyć skład procentowy stopu.
72. Rudę tytanową, zawierającą rutyl (ditlenek tytanu) poddano chlorowaniu w obecności węgla. Otrzymany czterochlorek tytanu zredukowano stopionym magnezem. Napisać równania zachodzących reakcji. Obliczyć masę otrzymanego tytanu, jeżeli w procesie chlorowania zużyto 25 dm3 chloru zmierzonego w warunkach normalnych, a wydajność procesu chlorowania, względem zużycia chloru, wynosi 80 %, natomiast wydajność redukcji czterochlorku tytanu wynosi 92 %.
73. 200 kg rudy niklu, zawierającej 24,8 % mas. millerytu (siarczek niklu) prażono w strumieniu powietrza. Otrzymany tlenek niklu poddano redukcji gazem wodnym (mieszanina tlenku węgla i wodoru). Napisać równania zachodzących reakcji. Obliczyć masę otrzymanego niklu, jeżeli wydajność procesu pierwszego wynosi 95 %, a drugiego 97 %.
74. Mieszanina bromku i chlorku srebra zawiera 71,3 % mas. srebra. Obliczyć skład mieszaniny.
75. Z 100 cm3 roztworu, zawierającego chlorki miedzi(II) i niklu(II), otrzymano 14,18 g mieszaniny siarczków. W drugiej takiej samej porcji roztworu wytrącono odpowiednie wodorotlenki, po wyprażeniu których otrzymano 11,78 g mieszaniny tlenków. Obliczyć stężenia molowe obu soli w analizowanym roztworze.
76. Próbkę kamienia wapiennego o masie 12,0 g (składnik główny - węglan wapnia), zanieczyszczonego krzemionką (ditlenek krzemu) wyprażono do stałej masy. Masa otrzymanego produktu stałego wynosi 7,08 g. Obliczyć procentową zawartość ditlenku krzemu w badanym kamieniu wapiennym.
77. Próbkę stopu srebra z miedzią o masie 0,900 g roztworzono w kwasie azotowym(V). W otrzymanym roztworze, działaniem roztworu kwasu solnego, wytrącono chlorek srebra, którego masa po odsączeniu i wysuszeniu była równa 0,7114 g. Obliczyć skład procentowy stopu.
78. Działaniem gazowego siarkowodoru, w obecności kwasu solnego, na roztwór zawierający 3,25 g metaarsenianu(III) sodu wytrącono osad siarczku arsenu(III). Obliczyć masę siarczku żelaza(II) potrzebną do rozłożenia, celem uzyskania siarkowodoru koniecznego do reakcji wytrącania siarczku arsenu(III). Wydajność rozkładu siarczku żelaza(II) wynosi 85 %.
79. Próbkę stopu glinu z krzemem o masie 2,35 g poddano działaniu roztworu kwasu solnego. W wyniku reakcji otrzymano 2,73 dm3 wodoru zmierzonego w warunkach normalnych. Obliczyć skład procentowy stopu.
80. Próbkę stopu żelaza, cynku i miedzi o masie 7,0 g roztworzono w kwasie solnym i otrzymano 1,917 dm3 gazowego wodoru (warunki normalne). Masa nie roztworzonej pozostałości wynosiła 2,0 g. Obliczyć skład procentowy stopu.
81. Do naczynka o masie 16,5 g wprowadzono 10,0 g stężonego roztworu kwasu solnego i 2,75 g sproszkowanego marmuru. Po zakończeniu reakcji masa naczynka z zawartością wynosiła 28,30 g. Obliczyć procentową zawartość węglanu wapnia w badanym marmurze.
82. Do roztworu zawierającego 0,001 mola wodorotlenku baru wprowadzono roztwór zawierający 0,147 g kwasu siarkowego(VI). Napisać równanie zachodzącej reakcji. Który z reagentów i w jakiej ilości (masa) został użyty w nadmiarze?
83. Działaniem wodnego roztworu wodorotlenku sodu na 7,92 g chlorku chromu(III) otrzymano 5,85 g chlorku diwodorotlenku chromu(III). Napisać równanie zachodzącej reakcji. Obliczyć wydajność reakcji.
84. Węglik glinu pod wpływem wody rozkłada się dając metan i wodorotlenek glinu. W wyniku rozkładu 10,0 g węgliku glinu otrzymano 4,0 dm3 metanu zmierzonego w warunkach normalnych. Obliczyć procentową zawartość zanieczyszczeń w analizowanej próbce.
85. Przez roztwór zawierający 1,7 g chlorku cynku przepuszczono 250 cm3 siarkowodoru (zmierzonego w warunkach normalnych). Czy w tych warunkach wszystkie jony cynku mogły zostać wytrącone w postaci osadu siarczku cynku? Obliczyć masę wydzielonego siarczku cynku.
86. Tlenek azotu(I) otrzymuje się przez ostrożny rozkład termiczny azotanu(V) amonu. Napisać równanie reakcji. Obliczyć masę soli, którą należy poddać rozkładowi, aby otrzymać 25 g tlenku azotu(I), jeżeli wydajność reakcji wynosi 80 %.
87. 12,0 g stopu zawierającego 30% magnezu i 70% glinu roztworzono w roztworze kwasu solnego. Napisać równania zachodzących reakcji. Obliczyć objętość wydzielonego wodoru (zmierzoną w warunkach normalnych).
88. Dwunastowodny siarczan(VI) glinu otrzymuje się działaniem roztworu kwasu siarkowego(VI) na tlenek glinu. Napisać równanie zachodzącej reakcji. Obliczyć masę tlenku glinu, jaką należy użyć, aby otrzymać 150 g wymaganej soli, jeżeli reakcja przebiega z wydajnością 75 %.
89. Wodoroortoarsenian(V) ołowiu(II) podczas ogrzewania przechodzi w diarsenian(V) ołowiu(II). Napisać równanie zachodzącej reakcji. Obliczyć procentowy ubytek masy towarzyszący tej reakcji.
90. 2,5 g metalicznego żelaza poddano działaniu rozcieńczonego roztworu kwasu siarkowego(VI). Po odparowaniu nadmiaru kwasu i wody otrzymano 10,112 g wodorosiarczanu(VI) żelaza(II). Napisać równanie zachodzącej reakcji. Obliczyć wydajność reakcji.
91. 8,0 g węglanu wapnia ogrzewano, a wydzielający się gaz zbierano w odpowiednim naczyniu. Proces przerwano, gdy gaz zajmował objętość 1,12 dm3 (warunki normalne). Obliczyć masę nie rozłożonego węglanu wapnia.
92. Do syntezy amoniaku użyto mieszaniny zwierającej 75 dm3 wodoru i 25 dm3 azotu. W wyniku reakcji otrzymano 24 dm3 amoniaku. Napisać równanie zachodzącej reakcji. Obliczyć % objętościowy azotu w mieszaninie poreakcyjnej. (Uwaga - objętości gazów mierzono w jednakowych warunkach)
93. Na skalę laboratoryjną brom otrzymuje się działając gazowym chlorem na roztwór bromku potasu, natomiast chlor - działając stężonym roztworem kwasu solnego na stały manganian(VII) potasu (produktem ubocznym jest chlorek manganu(II). Napisać równania zachodzących reakcji. Obliczyć masę manganianu(VII) potasu, którą należy użyć, aby wydzielonym chlorem otrzymać brom z roztworu zawierającego 5,95 g bromku potasu.
94. Obliczyć masę glinu niezbędną do zredukowania 30 g mieszaniny zawierającej tlenek manganu(II) i tlenek żelaza(III), zmieszanych w stosunku masowym 1 : 4.
95. Obliczyć objętość acetylenu (C2H2) zmierzoną w warunkach normalnych, powstałego w reakcji 100 kg karbidu (główny składnik węglik wapnia - CaC2) z wodą, jeżeli wydajność reakcji wynosi 85%, a karbid zawiera 15% mas. tlenku wapnia. Napisać równanie zachodzącej reakcji.
96. 250 g pyłu cynkowego, zawierającego 20% mas. tlenku cynku, rozpuszczono w roztworze kwasu siarkowego(VI). Obliczyć objętość wydzielonego wodoru (w przeliczeniu na warunki normalne), jeżeli wydajność reakcji względem wodoru wynosi 85%. Napisać równanie zachodzącej reakcji.
97. Jednym z produktów rozkładu termicznego ortofosforanu(V) amonu i magnezu jest difosforan(V) magnezu. Napisać równanie reakcji. Obliczyć masę difosforanu(V) magnezu powstałą w reakcji rozkładu 200 g ortofosforanu(V) amonu i magnezu, jeżeli wydajność reakcji wynosi 90%. Obliczyć objętość wydzielonych gazów (w warunkach normalnych).
98. W reakcji 40 g węglika glinu (Al4C3) z wodą wydzieliło się 15,6 dm3 metanu (warunki normalne). Napisać równanie zachodzącej reakcji. Obliczyć wydajność reakcji.
99. Podczas ogrzewania mieszaniny tlenku magnezu i węglanu magnezu traci ona 12,6% początkowej masy. Obliczyć skład mieszaniny.
Odpowiedzi
1. K2SO4 siarczan(VI) potasu
2. Fe(NO3)3 azotan(V) żelaza(III)
3. Al2Be3(SiO3)6 metakrzemian triberylu i diglinu
4. BiO2CO3 tlenek węglan bizmutu(V)
5. KHSO4 wodorosiarczan(VI) potasu
6. Ca(H2PO4)2 diwodoroortofosforan(V) wapnia
7. Fe2(HPO4)3 wodoroortofosfornan(V) żelaza(III)
8. (ZnOH)3AsO4 arsenian(V) wodorotlenek cynku
9. Cr(OH)SO4 siarczan(VI) wodorotlenek chromu(III)
10. Al(OH)2NO3 azotan(V) diwodorotlenek glinu
11. Fe(OH)ClO4 chloran(VII) wodorotlenek żelaza(II)
12. Cu(OH)NO2 azotan(III) wodorotlenek żelaza(II)
13. Cu(OH)IO3 jodan(V) wodorotlenek miedzi(II)
14. Pb(BO2)2·H2O jednowodny metaoksoboran ołowiu(II)
15. Sr(BrO3)2·H2O jednowodny bromian(V) strontu
16. Ca(MnO4)2·5 H2O pięciowodny manganian(VII) wapnia
17. Zn3(AsO4)2·8 H2O ośmiowodny ortoarsenian(V) cynku
18. CrK(SO4)2·24 H2O dwudziestoczterowodny siarczan(VI) chromu i potasu
19. Ba(ClO)2·2 H2O dwuwodny chloran(I) baru
20. AlK(SO4)212 H2O dwunastowodny siarczan(VI) glinu i potasu
21. Ce(OH)O tlenek wodorotlenek ceru(III)
22. Na3PO3·3 H2O trójwodny metafosforan(V) sodu
23. MgHAsO4·7 H2O siedmiowodny wodoroarsenian(V) magnezu
24. NaHS·H2O jednowodny wodorosiarczek sodu
25. (CoOH)2CO3·H2O jednowodny węglan wodorotlenek kobaltu(II)
26. (MgOH)2CO3·3 H2O trójwodny węglan wodorotlenek magnezu
27. 7
38. 1207 kg
29. w nadmiarze wzięto 74,8 g S
30. 2 NaHCO3 = Na2CO3 + CO2 + H2O
ubytek masy = 36,9 %
31. a) 28,65 %
b) 42,98 %
32. 4 FeCO3 + O2 = 2 Fe2O3 + 4 CO2
145 kg
33. NH4NO3 = N2O + 2 H2O
34. H2SO4 + 2 NaCl + 10 H2O = Na2SO4·10 H2O + 2 HCl
300 g
W = 88 %
masa Na2SO4·10 H2O = 16,5 g
35. PCl3 + Cl2 = PCl5
3,26 dm3
36. 2 MgO = 2 Mg + O2
77,3 g
37. FeS + 2 HCl = H2S + FeCl2
14,9 g
38. 2 KBr + Cl2 = Br2 + 2 KCl
16,1
39. 2 Ca3(PO4)2 + 5 C + 6 SiO2 = 4 P + 6 CaSiO3 + 5 CO2
128 kg
40. 400 g
41. 2 AsCl3 + 3 H2S = As2S3 + 6 HCl
0,79 dm3
42. 4 FeCO3 + O2 = 2 Fe2O3 + 4 CO2
6,2 g
43. FeS + 2 HCl = H2S + FeCl2
0,308 dm3
44. 89,2 %
45. m Na2CO3 = 110,9 kg; m CaCO3 = 104,6 kg; m SiO2 = 376,6 kg
46. 49,4 kg
47. zaw. As = 29,97 %; zaw. Zn = 70,03 %
48. 29,2 %
49. 76,65 %
50. Pb(NO3)2 = 2 HCl = PbCl2 + 2 HNO3
16,8 g
51. MgO + HNO3 = Mg(OH)NO3
94,4 %
52. CrCl3 + NaOH = Cr(OH)Cl2 + NaCl
98,8 %
53. CaCO3 = CaO + CO2
1,635·106 dm3
54. Fe2O3 + 3 H2SO4 + 4 H2O = Fe2(SO4)3·7 H2O
60,84 g
55. Fe + 2 H2SO4 = Fe(HSO4)4 + H2
90,6 %
56. 4 FeS2 + 11 O2 = 2 Fe2O3 + 8 SO2
3·106 dm3
57. Cr2O3 + 3 H2SO4 + 9 H2O = Cr2(SO4)3·12 H2O
32,075 g
58. Zn + HCl + H2O = Zn(OH)Cl + H2
91,8 %
59. 4 NH3 + 3 O2 = 2 N2 + 6 H2O
1,58 dm3
60. Mg + 2 HClO4 = Mg(ClO4)2 + H2
183,8 g
61. H3PO4 + Ba(OH)2 = BaHPO4 + 2 H2O
122,6 g
62. Ca(OH)2 + 2 H2SO4 = Ca(HSO4)2 + 2 H2O
355,7 g
63. 95,65 %
64. 6,18 %
65. 4,3·106 ton
66. 2 KMnO4 + 16 HCl = 5 Cl2 + 2 MnCl2 + 2 KCl + 8 H2O
28,2 g
67. 20,8 g
68. 6,86 g
69. zaw. CaCO3 = 23,86 %; zaw. CaO = 76,14 %
70. zaw. K2CO3 = 90,6 %; zaw. Na2CO3 = 9,4 %
71. zaw. Pb = 50,2 %; zaw. Sn = 49,8 %
72. 19,73 g
73. 2 NiS + 3 O2 = 2 NiO + 2 SO2
2 NiO + CO + H2 = 2 Ni + CO2 + H2O
29,58 kg
74. zaw. AgCl = 94,7 %; zaw. AgBr = 5,3 %
75. ![]()
= 0,302 mol/dm3; ![]()
= 1,198 mol/dm3
76. 4,35 %
77. zaw. Ag = 59,5 %; zaw. Cu = 40,5 %
78. 4,106 g
79. zaw. Al = 93,35 %; zaw. Si = 6,65 %
80. zaw. Cu = 28,57 %; zaw. Zn = 20,51 %; zaw. Fe = 50,91 %
81. 78,5 %
82. Ba(OH)2 + H2SO4 = BaSO4 + 2 H2O
0,049 g H2SO4 w nadmiarze
83. CrCl3 + 2 NaOH = Cr(OH)2Cl + 2 NaCl
96,4 %
84. 14,35 %
85. nie; masa ZnS = 1,091 g
86. NH4NO3 = N2O + 2 H2O
56,82 g
87. Mg + 2 HCl = MgCl2 + H2
2 Al + 6 HCl = 2 AlCl3 + 3 H2
13,76 dm3
88. Al2O3 + 3 H2SO4 + 9 H2O = Al2(SO4)3·12 H2O
27,42 g
89. 2 PbHAsO4 = Pb2As2O7 + H2O
4,33 %
90. Fe + 2 H2SO4 = Fe(HSO4)2 + H2
90,6 %
91. 3,0 g
92. N2 + 3 H2 = 2 NH3
17,1 %
93. 2 KMnO4 + 16 HCl = 2 MnCl2 + 5 Cl2 + 2 KCl + 8 H2O
Cl2 + 2 KBr = Br2 + 2 KCl
6,32 g
94. mAl = 5,54 g
95. Vacetylenu = 25,29 m3
96. Wwodoru = 58,225 dm3
97. mdifosforanu magnezu = 145,8 g; Vproduktów gazowych = 49,04 dm3
98. 83,6%
1
Wyszukiwarka
Podobne podstrony:
Witaminy są związkami organicznymi, uniwersytet warmińsko-mazurski, inżynieria chemiczna i procesowa
zadanie1 3, uniwersytet warmińsko-mazurski, inżynieria chemiczna i procesowa, rok II semestr 3, tran
pytania operacje, uniwersytet warmińsko-mazurski, inżynieria chemiczna i procesowa, rok II semestr 4
D III rokBiopreparatywykłady 1-3fermenty, uniwersytet warmińsko-mazurski, inżynieria chemiczna i pro
Staliwa węglowe i konstrukcyjne stopowe, Inżynieria chemiczna i procesowa, Materiało- i maszynoznaws
Przykładowa analiza AWZ, politechnika łódzka, inżynieria chemiczna i procesowa, rok I semestr 1, bez
mikro3, uniwersytet warmińsko-mazurski, inżynieria chemiczna i procesowa, rok II semestr 3, mikrobio
biotechnologia2, uniwersytet warmińsko-mazurski, inżynieria chemiczna i procesowa, rok III semestr 6
allbiochemia, uniwersytet warmińsko-mazurski, inżynieria chemiczna i procesowa, rok I semestr 2, bio
mikrokapsułkowanie aromatów, uniwersytet warmińsko-mazurski, inżynieria chemiczna i procesowa, rok I
egz mikro, uniwersytet warmińsko-mazurski, inżynieria chemiczna i procesowa, rok II semestr 3, mikro
Tabelka do zadania, uniwersytet warmińsko-mazurski, inżynieria chemiczna i procesowa, rok II semestr
2012 - Pytania do kol wyk, politechnika łódzka, inżynieria chemiczna i procesowa, rok I semestr 2, d
Strona 1 cw2 tytulowa, politechnika łódzka, inżynieria chemiczna i procesowa, rok I semestr 1, dynam
zagadnienia fermenty, uniwersytet warmińsko-mazurski, inżynieria chemiczna i procesowa, rok III seme
ZAGADNIENIA TEORETYCZNE DO SAMODZIELNEGO PRZYGOTOWANIA NA KOLOKWIUM 20, uniwersytet warmińsko-mazurs
więcej podobnych podstron