Politechnika Wrocławska
Laboratorium Chemii Fizycznej (I-30)
13
Potencjometryczny pomiar stałej dysocjacji
Data
Nazwisko i imię
Grupa, zespół
Kolokwium
Zaliczenie
Kolumna
Stanowisko
Stężenia reagentów
Słaby kwas:
c
k
= 0,05 mol·dm
–3
f
k
=…………………...
Słaba zasada
c
z
= 0,05 mol·dm
–3
f
z
=……………………
HCl
c
HCl
= 0,05 mol·dm
–3
f
HCl
=…………………
.
NaOH
c
NaOH
= 0,05 mol·dm
–3
f
NaOH
=………………..
Pomiar stałej dysocjacji słabego kwasu
Objętość kwasu wziętego do doświadczenia V
k
=
..................................
cm
3
Temperatura pomiaru T= ……………..K
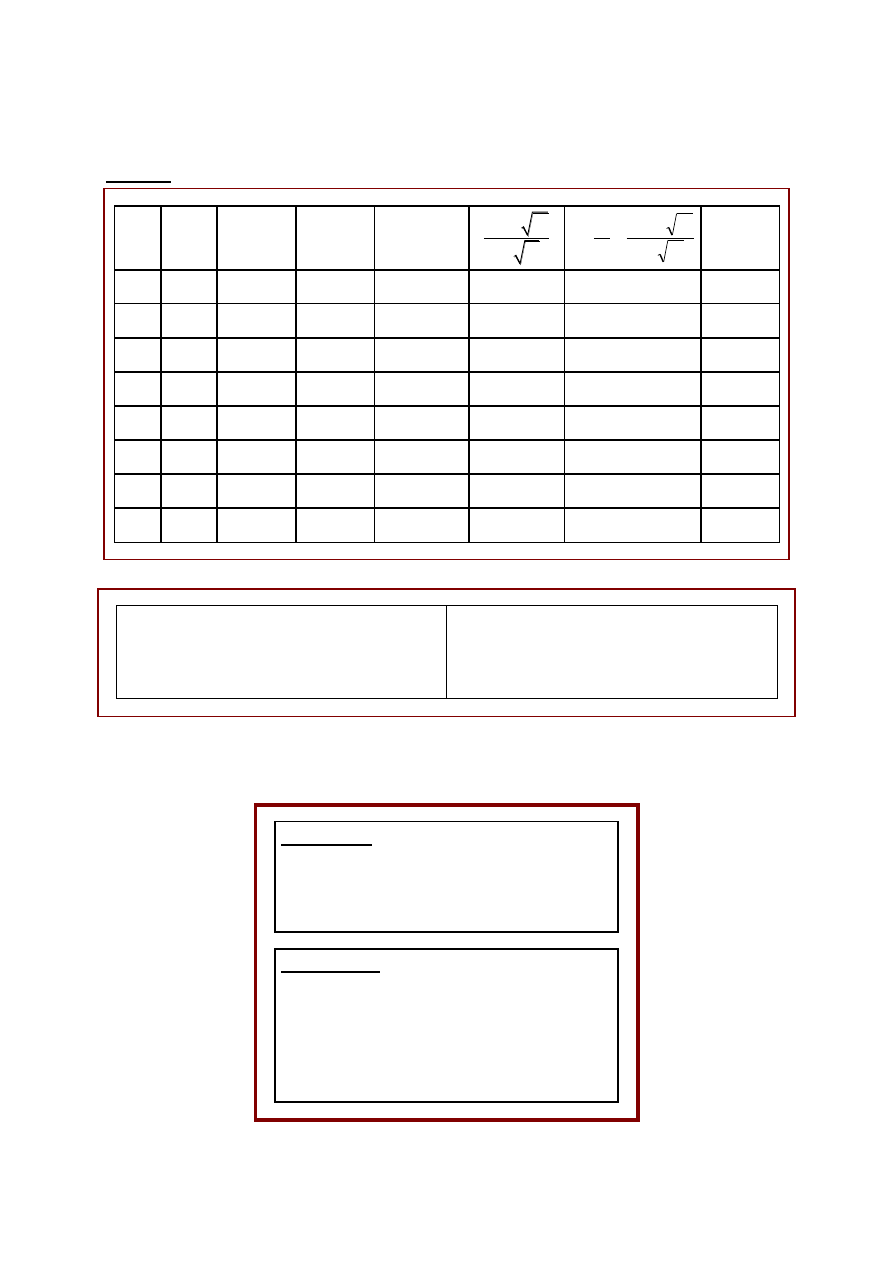
Tabela 1. Pomiary o obliczenia stałej dysocjacji słabego kwasu
V
NaOH
cm
3
pH
c
z
mol·dm
–3
c
k
mol·dm
–3
log(c
z
/c
k
)
0, 509
1
z
z
c
c
0, 509
1
log
z
z
z
k
c
c
c
c
pK
Wyniki obliczeń stałej dysocjacji słabego kwasu
Wynik otrzymany metodą wykreślną
pK
K(wykr)
=
………….……….
.……….
Wyniki obliczony numerycznie
pK
K(num)
=
………….……….
.……….
Pomiar stałej dysocjacji słabej zasady
Objętość zasady wziętej do doświadczenia V
z
=
..................................
cm
3
Tabela 2. Pomiary o obliczenia stałej dysocjacji słabej zasady
V
HCl
cm
3
pH
c
k
mol·dm
–3
c
z
mol·dm
–3
log(c
z
/c
k
)
0, 509
1
k
k
c
c
k
k
k
z
c
c
c
c
1
509
,
0
log
pK
Wyniki obliczeń stałej dysocjacji słabej zasady
Wynik otrzymany metodą wykreślną
pK
K(wykr)
=
………….……….
.……….
pK
Z(wykr)
=
………….……….
.……….
Wyniki obliczony numerycznie
pK
K(num)
=
………….……….
.……….
pK
Z(num)
=
………….……….
.……….
Wyniki
(średnie z wartości pK odczytanych z wykresów i obliczonych numerycznie)
Słaby kwas
pK
K(śr)
=
…………….…
…………….…
K
K(śr)
=
……………..…
…………….…
Słaba zasada
pK
K(śr)
=
…………….…
…………….…
pK
Z(śr)
=
…………….…
…………….…
K
Z
=
…………….…
…………….…
Do sprawozdania należy dołączyć wykresy:
1) pH od log(c
z
/c
k
) + log
dla miareczkowania słabego kwasu roztworem NaOH
2) pH od log(c
z
/c
k
) - log
dla miareczkowania słabej zasady roztworem HCl
Wyszukiwarka
Podobne podstrony:
Cwiczenie 17 Wzor sprawozdania id 125192
Cwiczenie 20 wzor sprawozdania id 125264
Cwiczenie 19 z 3 wzor sprawozdania id 125202
Cwiczenie 24 wzor sprawozdania id 125277
Cwiczenie 15 wzor sprawozdania id 125183
Cwiczenie 19 z 2 wzor sprawozdania id 125201
Cwiczenie 22 wzor sprawozdania id 125275
Cwiczenie 17 Wzor sprawozdania id 125192
Cwiczenie 7 wzor sprawozdania id 125545
Cwiczenie 8 wzor sprawozdania id 125600
Cwiczenie 25 wzor sprawozdania
EiE wzor sprawozdania id 154403 Nieznany
Cwiczenie 18 z. 1-2, wzor sprawozdania
Cwiczenie 19 z 1 wzor sprawozdania 2014
Cwiczenie 20 wzor sprawozdania
więcej podobnych podstron