2010-01-22
1
Chemia XI
Stan skupienia - ciecz
Roztwory rzeczywiste
powstają:
• w wyniku rozproszenia substancji dążącej do
osiągnięcia stanu o maksymalnym uporządkowaniu,
-
rozproszenie substancji następuje przy całkowitym
braku współdziałania pomiędzy cząsteczkami
rozpuszczalnika a substancji rozproszonej.
• w wyniku reakcji chemicznej danej substancji z
rozpuszczalnikiem, zwanej
solwatacją
,
następuje
rozerwaniu wiązań istniejących pomiędzy
cząsteczkami lub atomami substancji rozpuszczonej
i izolowaniu ich od siebie przez cząsteczki
rozpuszczalnika.
2010-01-22
2
Reakcja solwatacji
w przypadku wody jako rozpuszczalnika
nosi
nazwę reakcji
hydratacji
i polega na
tym,
że cząsteczki wody będące dipolami
otaczają
cząsteczkę
rozpuszczonego
związku.
Roztwory
W roztworach substancja
znajdująca się w przewadze
nazywana jest
rozpuszczalnikiem
a
substancja występująca w
mniejszej ilości
substancją
rozpuszczaną
.
2010-01-22
3
Stężenia roztworu
• Ilościowo skład roztworu określa się za
pomocą stężenia. Do najczęściej
stosowanych zalicza się:
• procent wagowy
-
podaje się liczbę gramów
substancji zawartej w 100 g roztworu.
Np.
w 100 g roztworu NaCl znajduje się 10g
NaCl i 90 g H
2
O.
Dla roztworów cieczy w cieczy często stosuje
się procent objętościowy, który określa liczbę
cm
3
substancji zawartej w 100 cm
3
roztworu.
stężenie molowe (molowość)
-
określa liczbę moli danej substancji znajdującej się
w 1 dm
3
roztworu.
C = n/V
[mol/dm
3
]
n = m
s
/M
gdzie: m
s
– masa subst, M – masa molowa
mol- ilość materii zawierająca taka sama liczbę cząstek jaka
liczbę atomów zawiera 0,012 kg izotopu węgla 12 C
Na przykład roztwór o stężeniu 1 mola NaOH zawiera
40 g NaOH 1 dm
3
roztworu.
2010-01-22
4
stężenie normalne (normalność)
• określa liczbę gramorównoważników
substancji zawartej w 1 dm
3
roztworu.
Np.
roztwór 1 normalny H
2
SO
4
zawiera
98,08 : 2 = 49,04 g H
2
SO
4
w 1 dm
3
roztworu.
Stężenia normalne najczęściej stosowane są w
alkali- i acydymetrii. Roztwory o jednakowej
normalności zobojętniają się w jednakowej
objętości
np. 100 cm
3
1 n H
2
SO
4
zoboj
ętnia 100 cm
3
1 n
KOH.
stężenie molarne (molarność)
i
ułamek molowy
• określa liczbę moli substancji rozpuszczonej w 1000g
rozpuszczalnika (
NIE roztworu
!)
.
• oznacza względną zawartość substancji A w
roztworze zawierającym m
A
moli substancji A i m
B
substancji B. Ułamki molowe składnika A i B są
równe:
• x
A
= m
A
/(m
A
+ m
B
),
x
B
= m
B
/(m
A
+ m
B
)
• Suma ułamków molowych w roztworze zawsze
równa się jedności.
x
A
+ x
B
= 1
2010-01-22
5
Roztwory ciał stałych w cieczy
powstają w wyniku:
• rozproszenia substancji - dążąc do osiągnięcia stanu
o maksymalnym uporządkowaniu, dzięki czemu
rozproszenie substancji następuje przy braku
współdziałania cząsteczkami rozpuszczalnika a
substancji rozproszonej.
• reakcji chemicznej danej substancji z
rozpuszczalnikiem, zwanej
solwatacją, polegającej na
rozerwaniu wiązań istniejących pomiędzy
cząsteczkami substancji rozpuszczonej i izolowaniu
ich od siebie przez cząsteczki rozpuszczalnika.
mechanizm tworzenia roztworów podczas substancji o
budowie polarnej w rozpuszczalnikach polarnych.
W wyniku rozpuszczenia substancji ciał
stałych w rozpuszczalnikach obserwuje
się następujące zmiany
-
obniżenie temperatury krzepnięcia
-
podwyższenie temperatury wrzenia
-
obniżenie prężności par rozpuszczalnika nad
roztworem
Temperatura wrzenia roztworu jest wyższa niż
temperatura wrzenia czystego rozpuszczalnika. Jest
to spowodowane obniżeniem prężności par
rozpuszczalnika nad roztworem a to oznacza, że
moment w którym prężność pary nasyconej nad
cieczą zrówna się ciśnieniu zewnętrznemu wymaga
wyższej temperatury.
2010-01-22
6
Woda jako rozpuszczalnik
• Badając proces rozpuszczania różnych soli w
wodzie -
jedne rozpuszczają się bardzo łatwo i
szybko,
inne z trudnością lub wcale nie
ulegają rozpuszczeniu.
• w określonej ilości wody można w danej
temperaturze rozpuścić ograniczoną ilość soli.
(nie dowolną)
• W zależności od rodzaju soli, różna jest ilość
rozpuszczonej soli.
Rozpuszczalność
• Jest to wielkość, którą wyznacza się
doświadczalnie
• wyraża ona masę substancji rozpuszczonej w
gramach rozpu
szczoną w 100 gramach
rozpuszczalnika z utworzeniem roztworu
nasyconego. Inaczej jest to stężenie substancji
rozpuszczonej w jej roztworze nasyconym.
• Roztwór nasycony
to roztwór pozostający w
równowadze z substancją rozpuszczaną, która
więcej się już w nim nie rozpuszcza.
2010-01-22
7
Dla wody
• kryterium rozpuszczalności jest liczba gramów
substancji rozpuszczona w 100 g wody
• Substancje dobrze rozpuszczalne to substancje,
których można w 100 g wody rozpuścić więcej niż
1 g
Substancje słabo rozpuszczalne to substancje,
których można w 100 g wody rozpuścić od 0,1 do
1 g
Substancje nierozpuszczalne to substancje,
których można w 100 g wody rozpuścić mniej
niż 0,1 g
Miarą zdolności substancji do
rozpuszczania się w wodzie jest
• Przykłady
• sól kuchenna (NaCl) bardzo dobrze rozpuszcza
się w wodzie
• wodorotlenek cynku (Zn(OH)
2
) w wodzie
słabo
• rozpuszcza się
• kreda (CaCO
3
) i gips (CaSO
4
) praktycznie nie
rozpuszczają się w wodzie
• Najwięcej w określonej ilości wody rozpuści się
soli kuchennej (NaCl), a najmniej kredy i gipsu.

2010-01-22
8
Przykłady – ciecz w cioeczy
• wodę z octem możemy mieszać ze sobą bez
ograniczeń.
• rozpuszczania alkoholu w wodzie jest
nieograniczone.
• rozpuszczając sole w wodzie - w pewnym
momencie w czasie rozpuszczania na dnie naczynia
pojawia się osad, który nie chce dalej rozpuszczać
się mimo intensywnego mieszania.
NH
4
+
Na
+
K
+
Mg
2+
Ca
2+
Ba
2+
Cr
3+
Mn
2+
Fe
2+
Fe
3+
Co
2+
Ni
2+
Cu
2+
Ag
+
Au
3+
Zn
2+
Cd
2+
Hg
2+
Al
3+
Sn
2+
Pb
2+
Bi
3+
OH
-
R
R
R
NR
TR
R
NR
NR
NR
NR
NR
NR
NR
&&
NR
NR
NR
NR
NR
NR
NR
NR
F
-
R
R
R
NR
NR
NR
NR
TR
TR
NR
R
TR
NR
R
R
NR
TR
R
TR
R
NR
R
Cl
-
R
R
R
R
R
R
R
R
R
R
R
R
R
NR
R
R
R
R
R
R
TR
R
Br
-
R
R
R
R
R
R
R
R
R
R
R
R
R
NR
R
R
R
TR
R
R
TR
R
I
-
R
R
R
R
R
R
R
R
R
&&
R
R
&&
NR
TR
R
R
NR
R
TR
NR
NR
S
2-
R
R
R
&&
TR
R
NR
NR
NR
NR
NR
NR
NR
NR
NR
NR
NR
NR
&&
NR
NR
NR
SO
3
2-
R
R
R
R
NR
NR
R
NR
NR
&&
NR
NR
&&
TR
NR
TR
TR
&&
&&
TR
NR
TR
SO
4
2-
R
R
R
R
TR
NR
R
R
R
R
R
R
R
TR
R
R
R
R
R
R
NR
R
NO
2
-
R
R
R
R
R
R
R
R
R
NR
R
R
R
TR
&&
R
R
R
R
TR
R
NR
NO
3
-
R
R
R
R
R
R
R
R
R
R
R
R
R
R
R
R
R
R
R
R
R
R
PO
4
2-
R
R
R
NR
NR
NR
NR
NR
NR
NR
NR
NR
NR
NR
NR
NR
NR
NR
NR
NR
NR
NR
CO
3
2-
R
R
R
NR
NR
NR
NR
NR
NR
&&
NR
NR
&&
NR
NR
NR
NR
NR
&&
NR
NR
NR
SiO
3
2-
R
R
R
NR
NR
NR
&&
NR
NR
NR
NR
NR
&&
&&
&&
NR
NR
&&
NR
&&
NR
&&
MnO
4
2-
R
R
R
R
R
R
R
&&
&&
R
R
R
R
R
&&
R
R
&&
R
&&
R
R
CrO
4
2-
R
R
R
R
TR
NR
NR
NR
&&
R
NR
NR
R
NR
&&
TR
NR
TR
NR
NR
NR
NR
octan
R
R
R
R
R
R
R
NR
R
R
R
R
R
R
R
R
R
R
R
R
R
R
2010-01-22
9
Grupa substancji rozpuszczalnych
• wszystkie azotany są rozpuszczalne
• wszystkie octany są rozpuszczalne
• wszystkie chlorki, bromki i jodki są rozpuszczalne w
wyjątkiem srebrowych, rtęci(I) i ołowiu(II)
• wszystkie siarczany są rozpuszczalne z wyjątkiem
siarczanów baru, strontu i ołowiu;
CaSO
4
, Ag
2
SO
4
i
Hg
2
SO
4
są słabo rozpuszczalne
• wszystkie sole sodowe, potasowe i amonowe są
rozpuszczalne z wyjątkiem
NaSb(OH)
6
, K
2
PtCl
6
,
KClO
4
Grupa substancji praktycznie
nierozpuszczalnych
wszystkie wodorotlenki z wyjątkiem metali alkalicznych,
amonowego i barowego są nierozpuszczalne;
Ca(OH)
2
i Sr(OH)
2
są słabo rozpuszczalne
wszystkie obojętne węglany i fosforany są
nierozpuszczalne z wyjątkiem węglanów i
fosforanów amonowych oraz metali alkalicznych
wszystkie siarczki są nierozpuszczalne z wyjątkiem
siarczków amonowych, siarczków metali
alkalicznych i metali ziem alkalicznych
2010-01-22
10
R
ozpuszczalność substancji
zależy od;
• temperatury
• stopnia rozdrobnienia substancji
• szybkości mieszania
W każdym przypadku wzrost wymienionych
parametrów zwiększa rozpuszczalność
substancji.
Zależność rozpuszczalności
od temperatury
• Rozpuszczalność substancji może wzrastać
albo maleć ze wzrostem temperatury, a
wpływ na to ma energia oddziaływania
substancja rozpuszczona-rozpuszczalnik.
• Dla gazów wzrost temperatury zmniejsza
rozpuszczalność
2010-01-22
11
zgodnie
z regułą przekory
• proces egzotermiczny - dostarczenie ciepła poprzez
zwiększenie temperatury spowoduje przesunięcie
równowagi w kierunku mniejszej
rozpuszczalności.
• proces endotermiczny - rozpuszczalność będzie
rosła wraz z temperaturą.
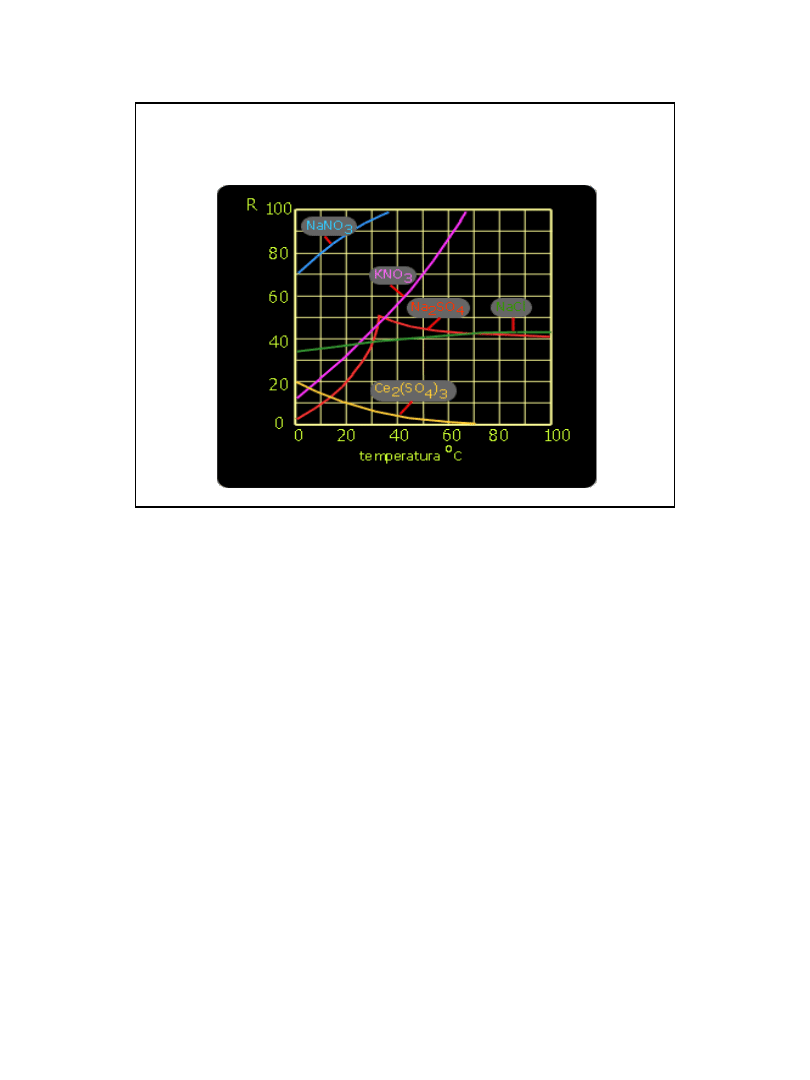
• Sole wykazują przeważnie rozpuszczalność rosnącą
ze wzrostem temperatury;
• znaczna liczba soli (NaCl, K
2
CrO
4
) przejawia
niewielkie zmiany rozpuszczalności ze wzrostem
temperatury;
• niektóre mają rozpuszczalność malejącą (Na
2
SO
4
,
FeSO
4
*H
2
O).
• Rozpuszczalność siarczanu sodu osiąga
maksimum przy temperaturze około 32,4
o
C.
• Powyżej tej temperatury rozpuszczalność
spada.
• Zjawisko to, związane jest ze zmianą
struktury substancji ulegającej
rozpuszczaniu. W temperaturach niższych
jak 32,4
o
C mamy do czynienia z siarczanem
uwodnionym Na
2
SO
4
*10H
2
O .
2010-01-22
12
Krzywe rozpuszczalności niektórych soli
Wyszukiwarka
Podobne podstrony:
CHEMIA X Stan skupienia gaz
Stan skupienia gaz
Stan skupienia materii, technika grzewcza
Stan skupienia gaz
Odkryto drugi stan skupienia ciekłej wody
biologia 17 XI 09, Chemia, Podstawy biologi, 1kolokwium
biologia 3 XI 09, Chemia, Podstawy biologi, 1kolokwium
Chemia Fizyczna - dokumenty, wyk%B3ad 8, Układy dwuskładnikowe - równowaga ciecz - para
ćw. 8 - Adsorpcja na granicy faz ciało stałe-ciecz, Chemia fizyczna
Ciecz-cia-o sta-e, technologia chemiczna, chemia fizyczna, srawozdania
Sprawozdanie 12 do druku, Studia, Chemia fizyczna, Laborki, 12 - Równowaga fazowa ciecz-para
Wyklad XI, chemia ogólna
więcej podobnych podstron