
GEOCHEMIA
WYBRANYCH PIERWIASTKÓW

Pierwiastki w minerałach i skałach
W zależności od zawartości pierwiastków
w minerale czy w skale mówimy o:
pierwiastkach głównych
(występują w ilościach
większych niż 1% wag.)
pierwiastkach śladowych
(występują w ilościach
mniejszych niż 0,1% wag.)
To rozróżnienie nie jest ścisłe, raczej zwyczajowe.
Pierwiastek może być uznany za śladowy w
jednym minerale a główny w innym minerale czy
w skale.

Pierwiastki w minerałach i skałach
Chemicznie minerały są naturalnie występującymi
pierwiastkami (pierwiastki rodzime) lub związkami
chemicznymi np. tlenki, siarczki i siarkosole, halogenki,
węglany, siarczany, azotany, fosforany, arseniany,
wanadany, krzemiany i glinokrzemiany i wiele innych:
CaMg[CO
3
]
2
dolomit
Ca
5
[OH|(PO
4
)
3
]
hydroksylapatyt
(Fe, Mg)
2
[SiO
4
]
oliwin
Al
2
[(OH)
4
|Si
2
O
5
]
kaolinit
(Na,Ca)[(Al,Si)
4
O
8
] labrador
(grupa plagioklazów)
NaCa
2
(Mg
4
Al)[(OH)
2
|Al
2
Si
6
O
22
] pargasyt
(grupa
amfiboli)
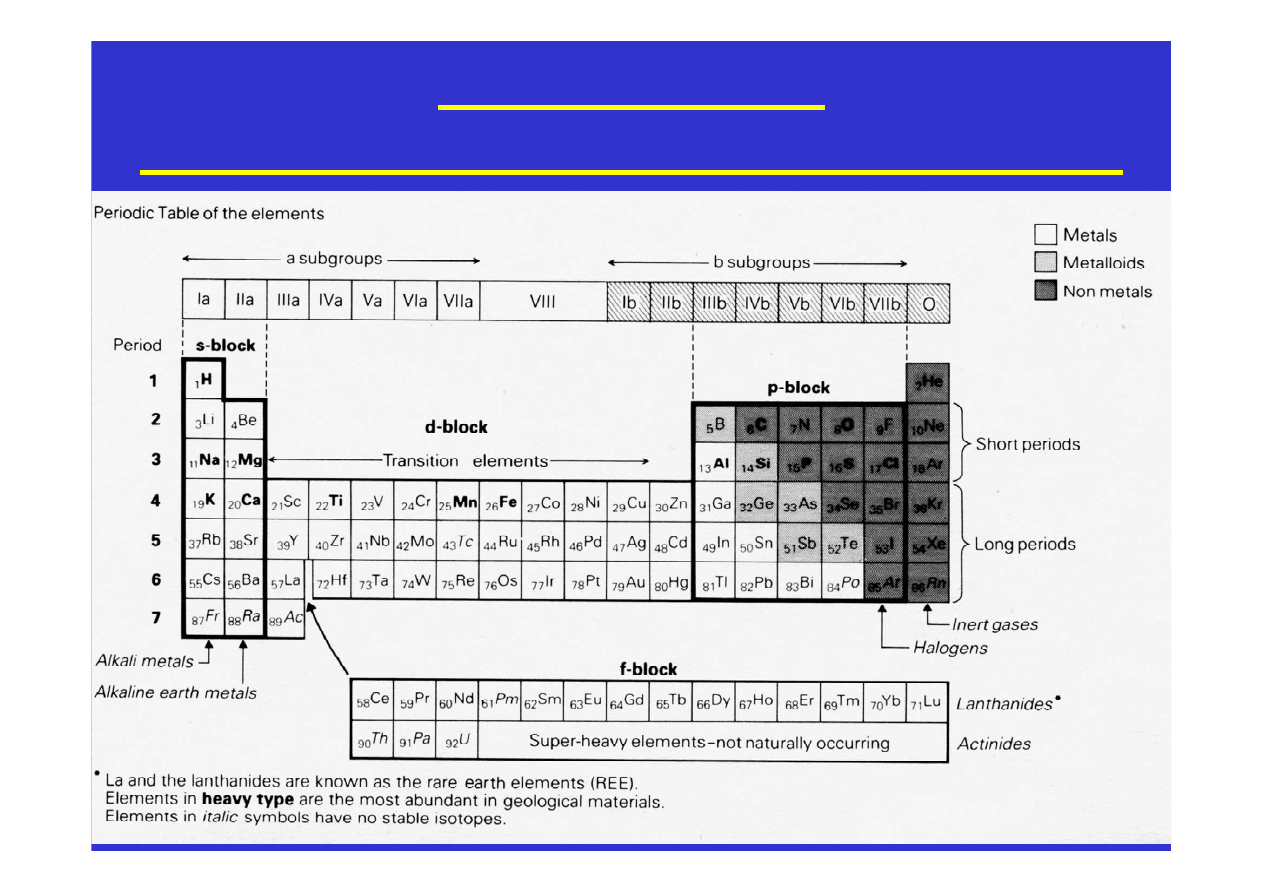
Układ okresowy.
Grupy pierwiastków według ich własności
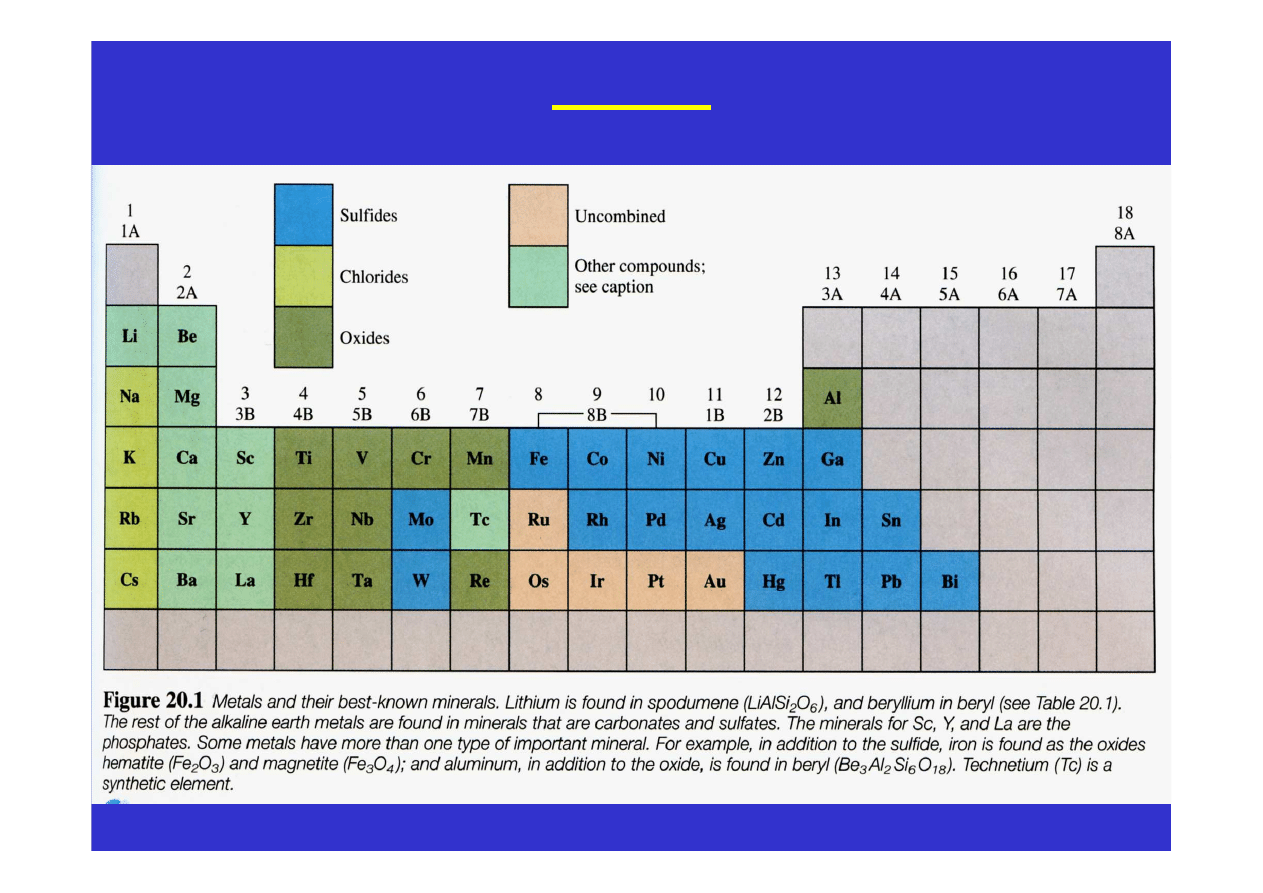
Metale

Na, K i inne metale alkaliczne
• silnie elektrododatnie metale o dużych promieniach jonowych
tworzące jony +1 i wiązania w przewadze jonowe
• sód i potas są składnikami minerałów skałotwórczych, pozostałe
litowce występują jako podstawiające się pierwiastki śladowe
• są niekompatybilne i koncentrują się w kwaśnych magmach i
pegmatytach
• ok. 15% ciepła powstającego w skorupie ziemskiej i
opóźniającego stygnięcie naszego globu pochodzi z rozpadu
radioaktywnego
40
K
• izotopowe analizy potasu i rubidu oraz produktów ich rozpadu
znajdują znakomite wykorzystanie w geochronologii i w
petrologii
• halit NaCl czy sylwin KCl doskonale rozpuszczają się w wodzie
• halit jest eksploatowany głównie na potrzeby przemysłu
chemicznego a sylwin i inne sole potasowe na potrzeby nawozów
rolniczych

Na, K i inne metale alkaliczne
• Które z metali alkalicznych tworzą izotopy promieniotwórcze
istotne geologicznie? Jakie to izotopy i jakie mają znaczenie?
• Dlaczego Li ma właściwości geochemiczne nieco odmienne od
pozostałych metali alkalicznych?



Mg, Ca i inne metale ziem alkalicznych
• są to elektrododatnie metale tworzące jony +2
• podobieństwo promienia jonowego pomiędzy Mg
2+
i Fe
2+
powoduje,
ż
e pierwiastki te często współwystępują w wielu minerałach
skałotwórczych na przykład w oliwinach, granatach, piroksenach i
amfibolach, biotycie, chlorytach itd.
• magnez jest jednym z głównych kationów wody morskiej
• wapń też jest istotnym składnikiem wody morskiej i to właśnie
węglany i siarczany wapnia stanowią istotny składnik ewaporatów.
Kalcyt jest zdecydowanie najpowszechniejszym minerałem wapnia
a większość Ca związana jest w skałach osadowych: wapieniach,
dolomitach, marmurach i łupkach węglanowych
• Mg jest też nadzwyczaj ważnym biopierwiastkiem wchodząc w
skład chlorofilu
• przemysłowo minerały i związki wapnia to składniki surowców
budowlanych: wapna, cementu itp. Magnez jako metal zużywany
jest głównie do produkcji lekkich stopów

Glin Al
• Najpowszechniejszy metaliczny pierwiastek w skorupie
ziemskiej
• Tlenek Al
2
O
3
ma właściwości amfoteryczne
(co to znaczy?)
• Tlenek Al
2
O
3
jako minerał korund jest też jednym z
twardszych minerałów, a zabarwione odmiany stanowią
kamienie szlachetne (rubiny, szafiry).
• Glin wchodzi w skład wielu podstawowych minerałów
skałotwórczych z grupy glinokrzemianów
• Główną rudą Al jest boksyt, produkt wietrzenia w warunkach
tropikalnych
(jak otrzymuje się metaliczny glin z rudy?)
• Selektywne wietrzenie jest też odpowiedzialne za powstawanie
bogatych w Al złóż minerałów ilastych (np. kaolinit)
wykorzystywanych do produkcji wyrobów ceramicznych
• Selektywne wymywanie prowadzi też do powstawania gleb
bielicowych

KAlSi
3
O
8
+ 2H
2
O ⇒
⇒
⇒
⇒
Al(OH)
3
+ 3SiO
2
+ KOH
NaAlSi
3
O
8
+ 2H
2
O ⇒
⇒
⇒
⇒
Al(OH)
3
+ 3SiO
2
+ NaOH
Glin Al
• intensywne wietrzenie w klimacie tropikalnym powoduje, że
powstają boksyty: zwietrzelina wzbogacona w tlenki i wodorotlenki
albit
albit
ortoklaz
ortoklaz
gibbsyt
gibbsyt
gibbsyt
gibbsyt
• aluminium znajduje zastosowanie w budownictwie i technice
niemal wyłącznie jako stop z odpowiednimi dodatkami co daje
lekki, wytrzymały i odporny na korozję materiał konstrukcyjny
wyśmienicie przewodzący ciepło i elektryczność

Metale przejściowe
• Tworzą blok d w układzie okresowym np. w okresie 4 od Sc
do Cu.
(dlaczego Zn, Cd czy Hg nie należą do metali bloku d?)
• W większości tworzą
związki i stopy o pożądanych
właściwościach mechanicznych i elektrycznych i znajdują
liczne zastosowanie przez co są poszukiwanymi surowcami
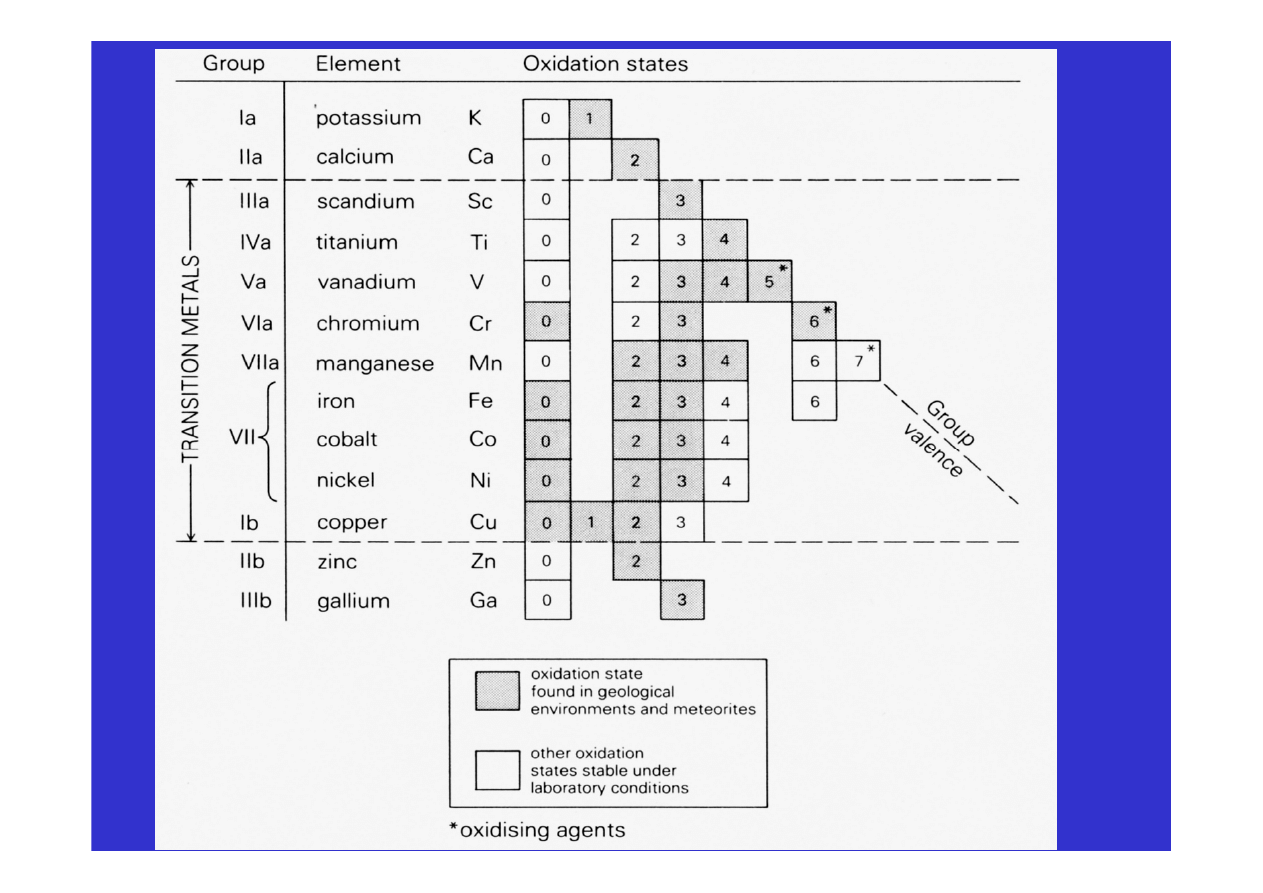
• W większości mogą występować na różnych stopniach
utlenienia wchodzą więc w reakcje redoks w środowisku
• Jeśli posiadają niesparowane elektrony na podpoziomie d to
są odpowiedzialne za właściwości magnetyczne minerałów
(np. Fe, Co, Ni): nawet jeśli taki atom utworzy związek
chemiczny to niesparowane elektrony d nie biorą udziału w
tworzeniu wiązań i pozostają niesparowane
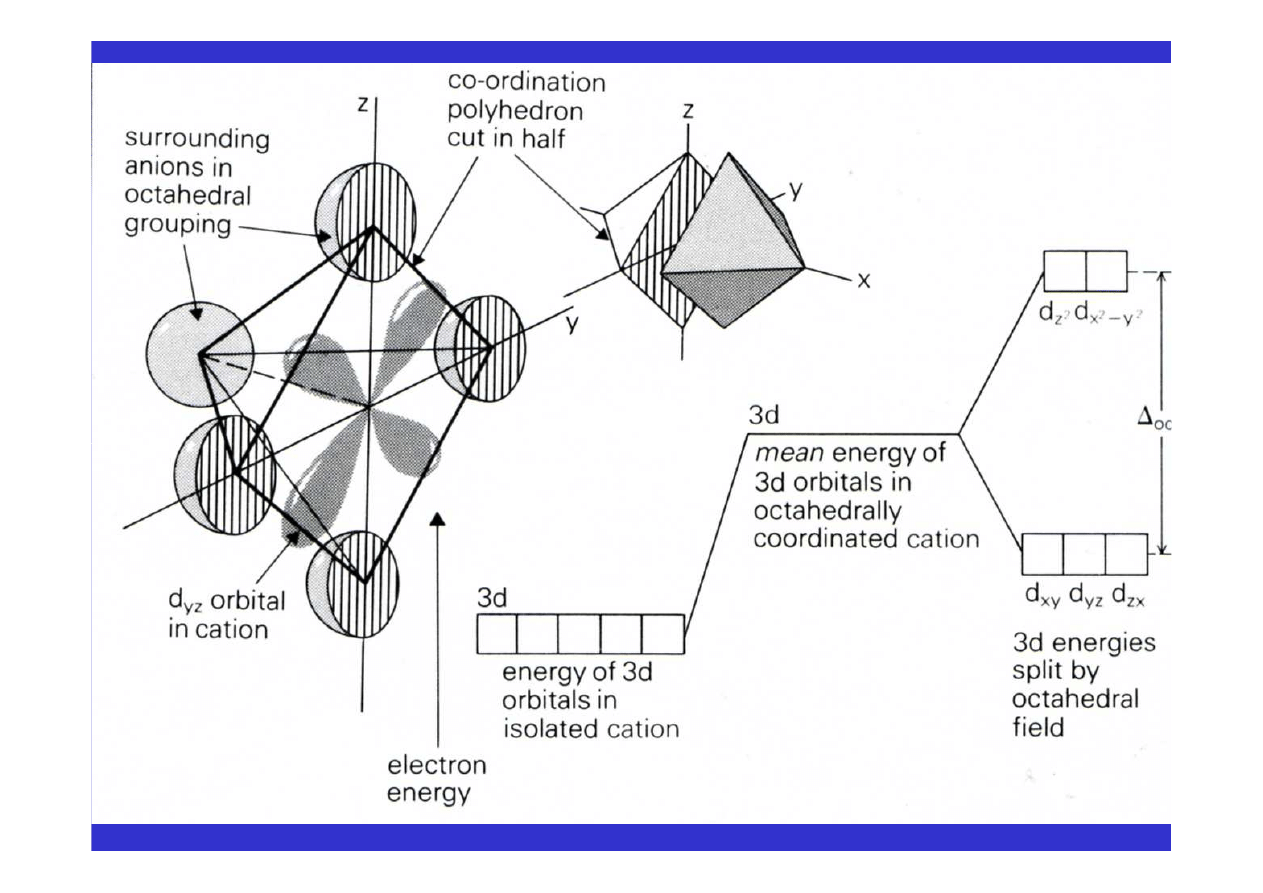
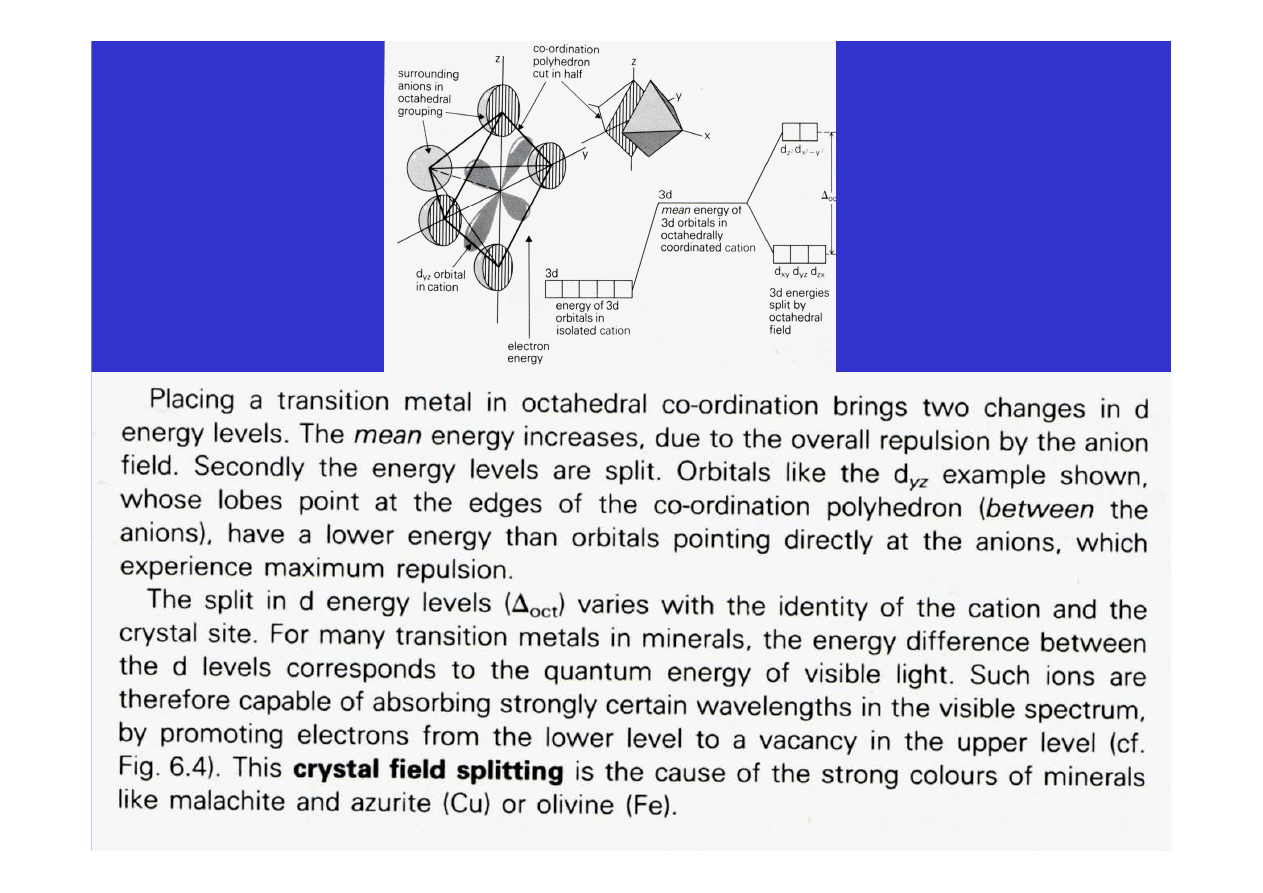
• tworzą związki kompleksowe i w wielu wypadkach wywołują
barwę
w
minerałach
(rozszczepienie
poziomów
energetycznych w polu krystalicznym, efekt Jahna-Tellera)


Rudy i hutnictwo
• Jakie związki/minerały stanowią składniki najważniejszych
rud żelaza?
• Na czym polega hutnicze wytapianie żelaza? Na czym polega
produkcja stali i żeliwa? Na czym polega hartowanie stali?
• W jaki sposób przerabia się rudę miedzi? Gdzie w Polsce
występuje miedź?
• W jaki sposób przerabia się rudy Zn i Pb? Gdzie w Polsce
występują rudy tych metali?
• Z jakich surowców w Polsce odzyskuje się Ag i Au?
• Przykłady szkodliwości tzw. metali ciężkich dla środowiska

Krzem i krzemiany
• krzem leży w czwartej głównej grupie układu okresowego: ma
4 elektrony walencyjne i pośrednią elektroujemność, wiązania
mają w przewadze charakter kowalencyjny, nie jonowy
• w minerałach krzemianowych (i w stopach magmowych)
podstawowymi cegiełkami chemicznymi są
przestrzenne
formy, w kształcie tetraedrów, z atomem Si
w środku i czterema atomami tlenu w narożach
• dlatego krzem określa się angielskim terminem „network
former”, czyli pierwiastek tworzący szkielet, sieć krystaliczną
minerału, w przeciwieństwie do jonów Mg
2+
, Fe
2+
i in.
nazywanych
„network
modifiers”
czyli
pierwiastki
modyfikujące sieć. W ten sposób powstają różne struktury
minerałów krzemianowych i glinokrzemianowych.
Krzem i krzemiany
Wielokrotne łączenie się tetraedrów krzemianowych w wielkie
struktury przestrzenne przypomina polimeryzację organicznych
związków
węgla.
Wiązanie
kowalencyjne
powstaje
przez
uwspólnienie elektronów.
W tetraedrze SiO
4
każdy atom tlenu tworzy wiązanie wykorzystując
jeden swój elektron i jeden elektron atomu krzemu. A więc
wszystkie elektrony krzemu są wykorzystane, ale każdy atom tlenu
ma jeszcze jeden elektron do wykorzystania do utworzenia dalszych
wiązań.

Krzem i krzemiany
Polimeryzacja wszystkich dostępnych tetraedrów krzemotlenowych
ze sobą prowadzi do powstania przestrzennej struktury kwarcu,
którego wzór można by zapisać jako (SiO
4
)n. Tetraedry łączą się ze
sobą silnymi wiązaniami atomowymi, przez co kwarc ma dość dużą
twardość a ponieważ wszystkie wiązania mają tą samą siłę kwarc nie
wykazuje łupliwości.
Krzem i krzemiany
W kwarcu atomy połączone są wiązaniami atomowymi. Gdy podczas
krystalizacji stopu krzemianowego znajdują się w nim w dużej ilości
jony elektrododatnich pierwiastków metalicznych (np. Mg
2+
, Fe
2+
) to
mogą one utworzyć z tetraedrami SiO
4
(o nominalnym ładunku 4-)
wiązanie o bardziej jonowym charakterze. Tak powstają
oliwiny np. forsteryt Mg
2
SiO
4
,
granaty np. almandyn Fe
3
Al
2
(SiO
4
)
3
czy
cyrkony ZrSiO
4
.
W minerałach tych nie ma bezpośredniego wiązania pomiędzy
poszczególnymi tetraedrami, cegiełki SiO
4
spojone są jonami metalu
i w efekcie, podobnie jak w przypadku kwarcu, oliwiny czy granaty
nie wykazują łupliwości.
oliwin
granat
cyrkon

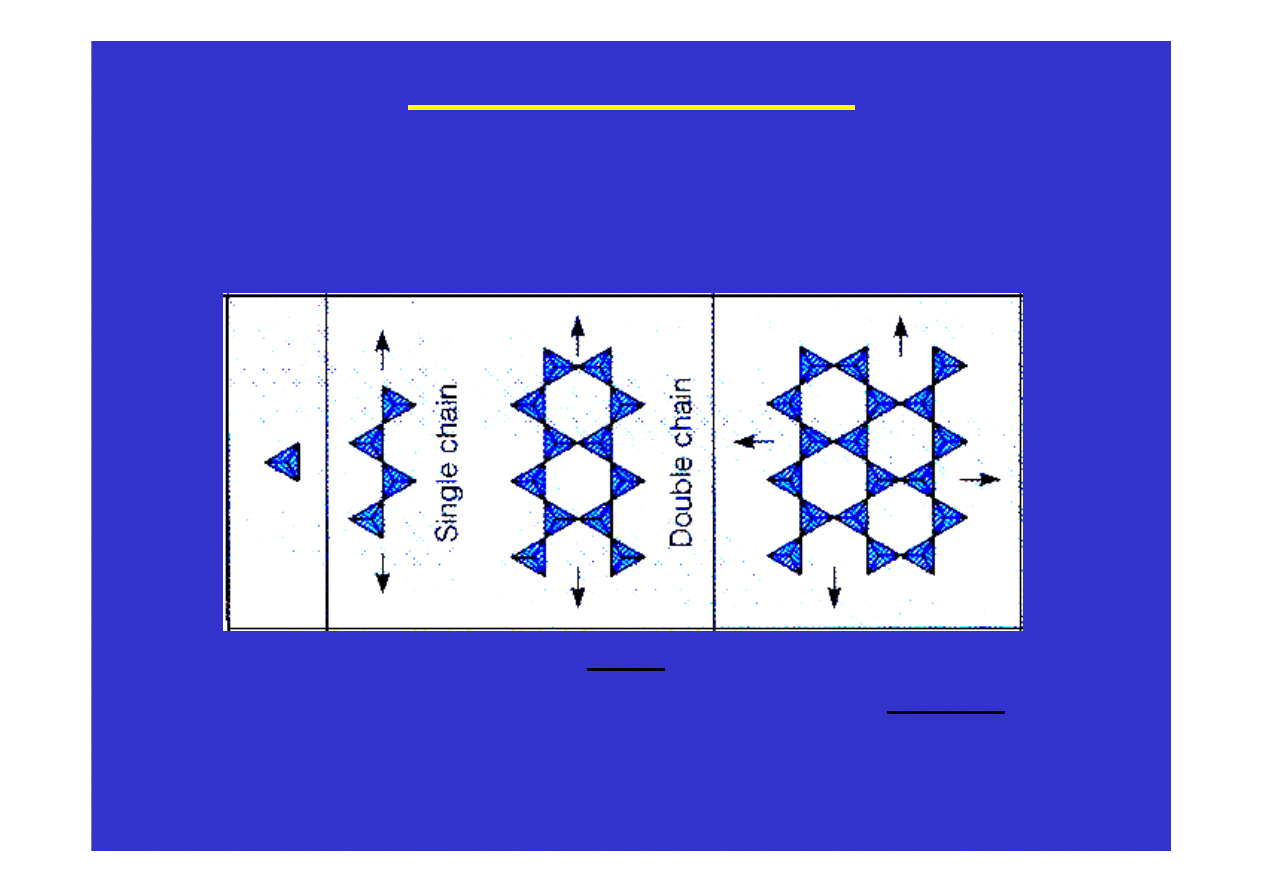
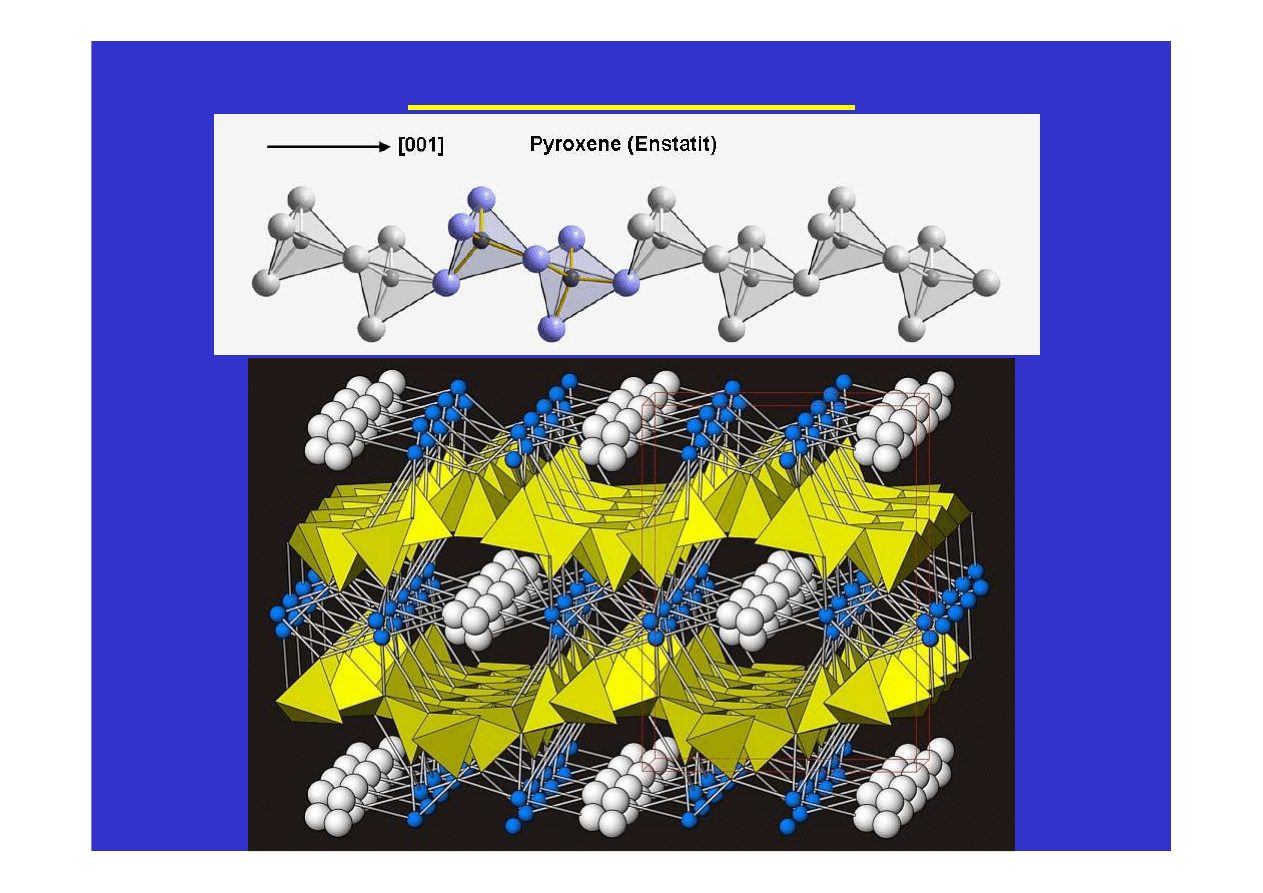
Krzem i krzemiany
Częściowa polimeryzacja powoduje, że tetraedry SiO
4
tworzą
łańcuchy i warstwy, które spojone są
bardziej jonowymi
oddziaływaniami w obecności jonów Na
+
, K
+
, Mg
2+
, Ca
2+
, Fe
2+
, Fe
3+
,
Mn
2+
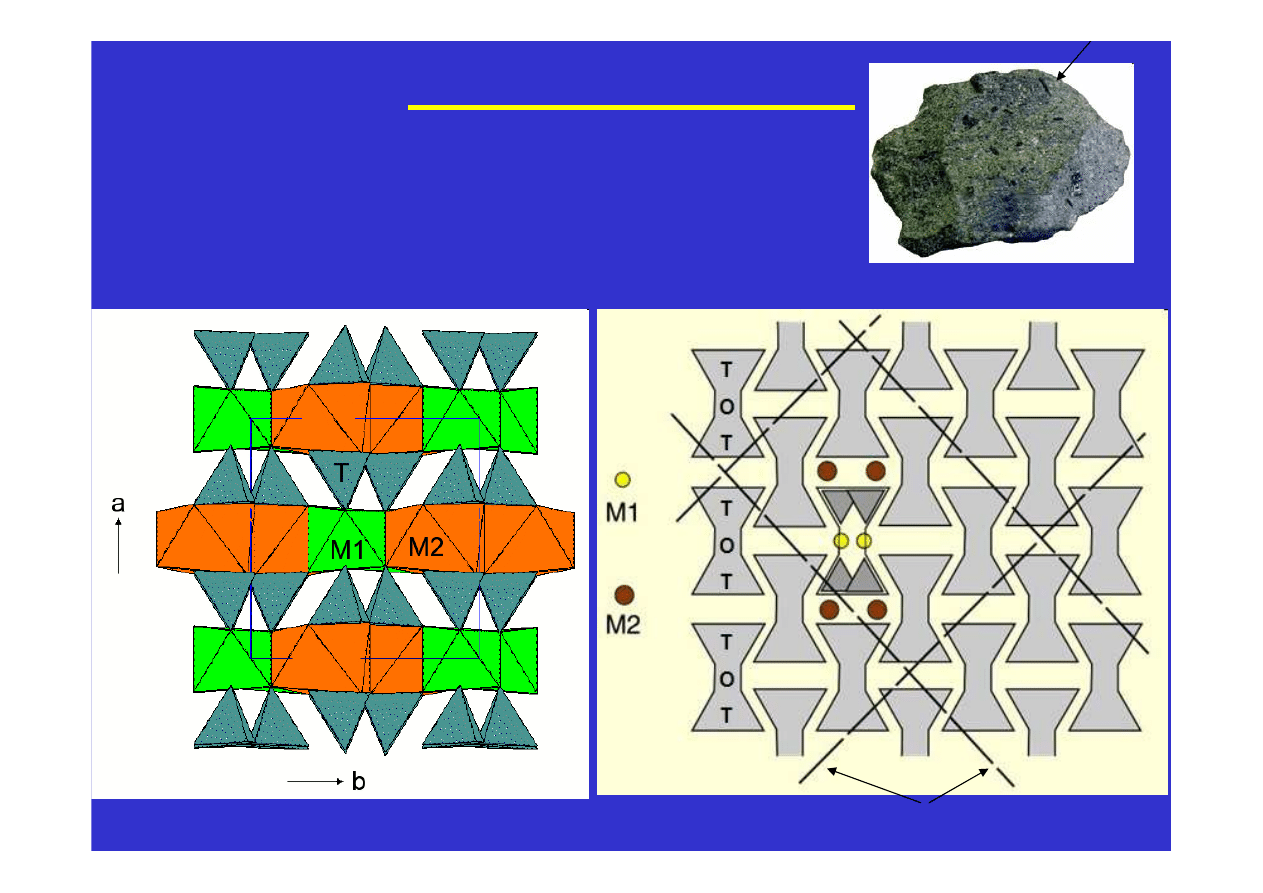
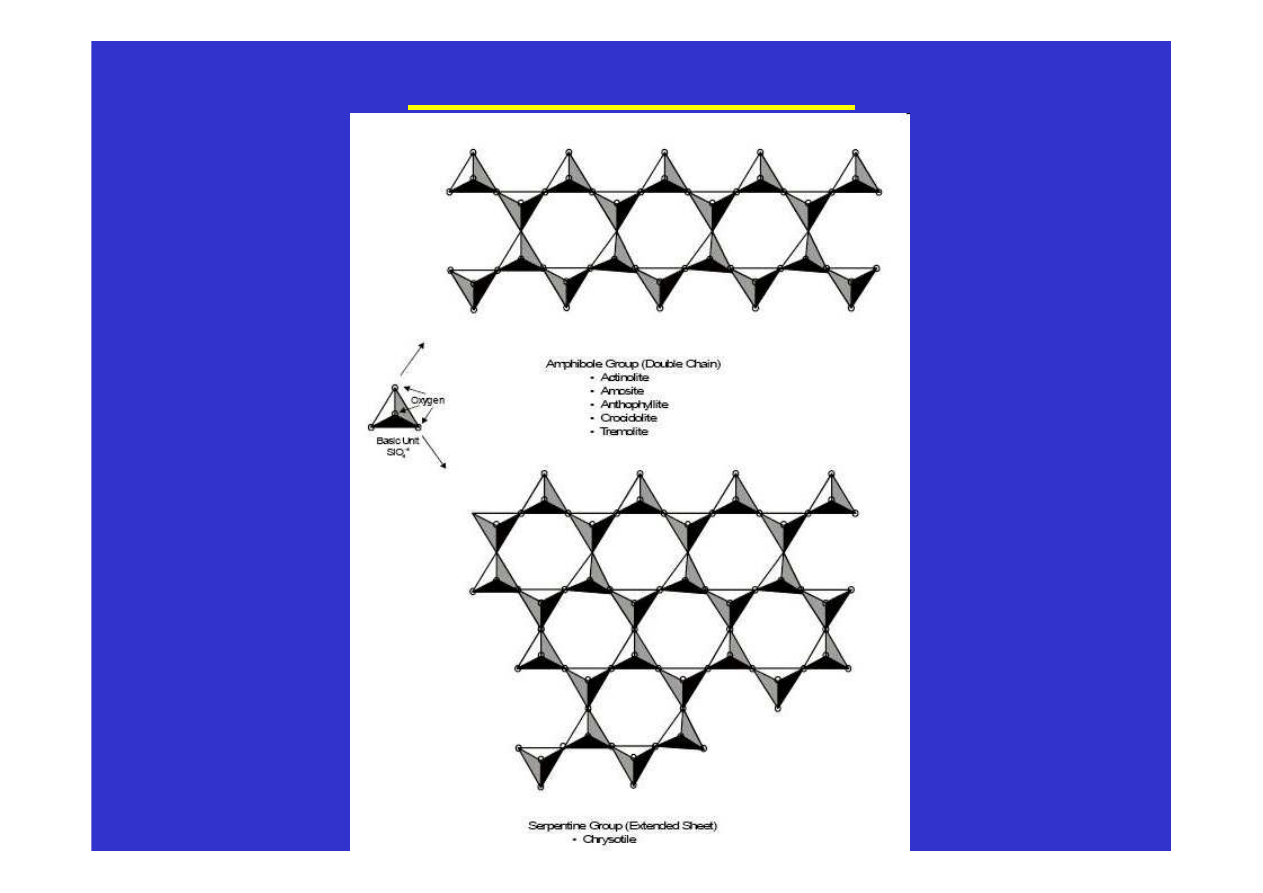
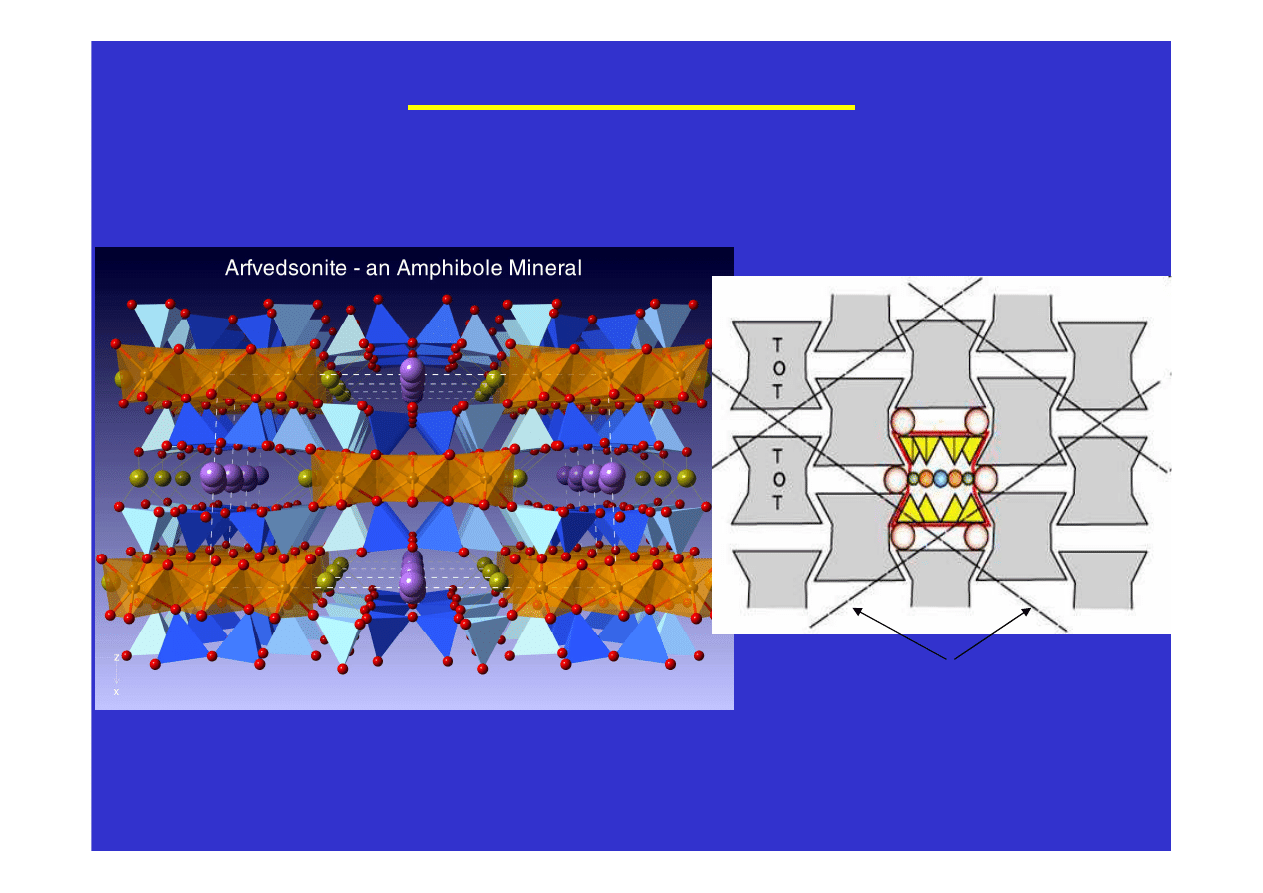
i innych. Tak powstają na przykład struktury piroksenów i
amfiboli. Długie łańcuchy ułożone są równolegle do wydłużenia
kryształów powodując, że pirokseny i amfibole mają pokrój
słupkowy i igiełkowy. A ponieważ łatwiej jest rozerwać jonowe
oddziaływania pomiędzy łańcuchami niż silne atomowe wiązania
wzdłuż łańcuchów, więc płaszczyzny łupliwości w tych minerałach
biegną równolegle do łańcuchów a więc i równolegle do wydłużenia
kryształów.
Krzem i krzemiany
Krzem i krzemiany
pirokseny widziane w dół wydłużenia słupa
kierunki łupliwości
Krzem i krzemiany
Krzem i krzemiany
amfibole widziane w dół wydłużenia słupa
kierunki łupliwości
Krzem i krzemiany
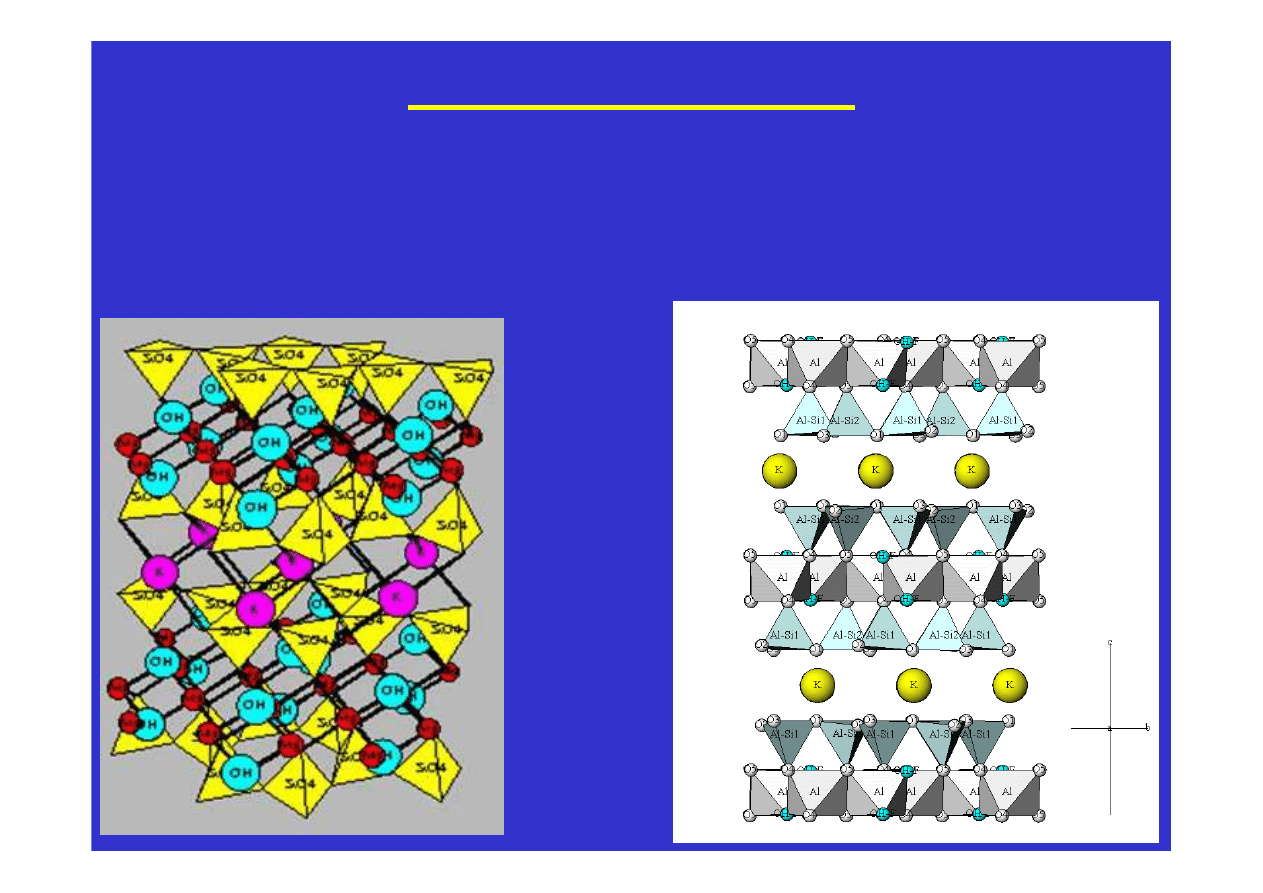
W krzemianach warstwowych tetraedry połączone są trzema
narożami tworząc warstwy. Wiązania w obrębie warstw są znacznie
silniejsze niż
oddziaływania pomiędzy warstwami: powstaje
łupliwość jednokierunkowa równolegle do ułożenia warstw.
muskowit
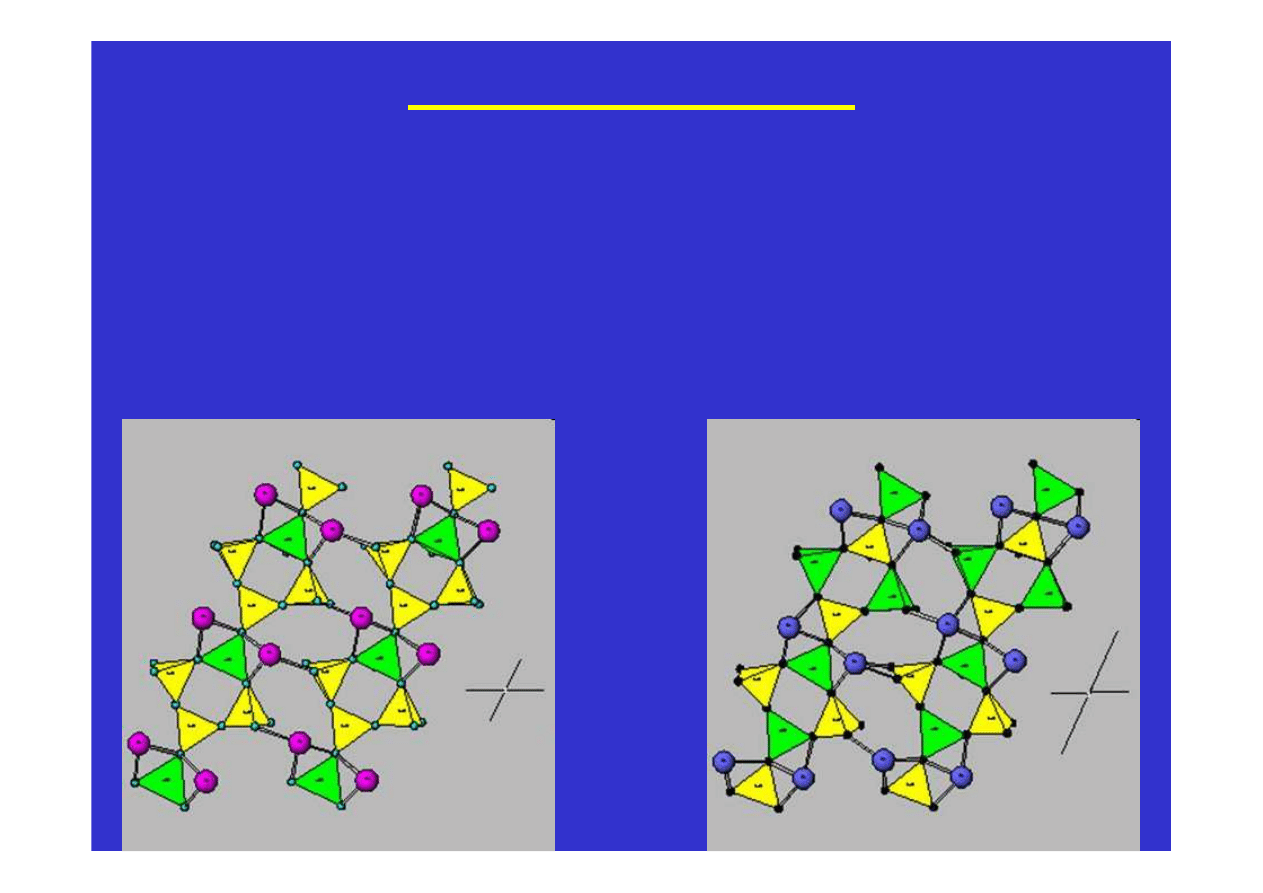
Krzem i krzemiany
Możliwa jest częściowa substytucja atomów glinu Al za atomy
krzemu Si w strukturze krzemianów. Podstawienie trójwartościo-
wego
jonu Al
3+
za czterowartościowy Si
4+
wymaga jednak
skompensowania niedoboru ładunku dodatniego i pozwala na
przyjęcie kationów metali, tak jak to ma miejsce na przykład
w skaleniach potasowych KAlSi
3
O
8
czy
w plagioklazach NaAlSi
3
O
8
i CaAl
2
Si
2
O
8
.
albit
anortyt
Wyszukiwarka
Podobne podstrony:
Geochemiczna klasyfikacja pierwiastków, chemia, Geochemia
Biologiczne działanie wybranych pierwiastków, szkola
Funkcje biologiczne wybranych pierwiastków i ich
13-DIAGNOSTYKA WYBRANYCH SCHORZEŃ, Wykłady-Ronikier, Ronikier1
PORÓWNANIE BUDOWY ATOMÓW wybranych pierwiastków
13 KOŚCIÓŁ JEDNOCZY PIERWIASTKI BOSKIE I LUDZKIE
JAKOŚCIOWE OZNACZANIE WYBRANYCH PIERWIASTKÓW W ZWIĄZKACH ORGANICZNYCH
13 Patofizjologia wybrane choroby infekcyjne 2011id 14478 ppt
MODELE ATOMÓW WYBRANYCH PIERWIASTKÓW
Porównanie zawartości wybranych pierwiastków w biomasie Borkowska
reakcje chemiczne wybranych pierwiastków
13 Ocen doswiadczenia wybranych krajow w przystepowaniu do unii walutowej cz 1
13 Pies andaluzyjski – omów film, przedstaw wybraną interpretację
więcej podobnych podstron