
R
EAKCJE
CHEMICZNE
WYBRANYCH
PIERWIASTKÓW
CZĘŚĆ TEORETYCZNA
Tlen
Z = 8; M.at. = 15.9994
Położenie w układzie okresowym: 16 grupa, 2 okres
Konfiguracja elektronowa: 1s
2
2s
2
2p
4
Stopnie utlenienia: -2, -1, 0, +2
Tlen jest najbardziej rozpowszechnionym pierwiastkiem w skorupie ziemskiej. Stanowi palny
składnik powietrza (ok. 21%). Z wyjątkiem niektórych gazów szlachetnych tlen tworzy
związki ze wszystkimi pierwiastkami układu okresowego. Rozpada się on częściowo pod
wpływem wyładowań elektrycznych na wolne atomy, które reagując z cząsteczkami tlenu
tworzą ozon O
3
, alotropową odmianę tlenu.
Azot
Z = 7; M.at. = 14.0067
Położenie w układzie okresowym: 15 grupa, 2 okres
Konfiguracja elektronowa: 1s
2
2s
2
2p
3
Stopnie utlenienia: -3, -2, -1, 0, +1, +2, +3, +4, +5
Azot jest typowym niemetalem i tworzy bezwodniki kwasowe na wyższych stopniach
utlenienia, a w atmosferze występuje jako dwuatomowy gaz N
2
. Wskutek bardzo dużej
energii wiązania azot jest gazem obojętnym, niechętnie wchodzi w reakcje chemiczne. Na
niższych stopniach utlenienia tworzy tlenki, które są gazami obojętnymi. Jednymi z
najważniejszych związków azotu są: amoniak, kwas azotowy(III) i kwas azotowy(V).
Siarka
Z = 16; M.at. = 32.066
Położenie w układzie okresowym: 16 grupa, 3 okres
Konfiguracja elektronowa: 1s
2
2s
2
2p
6
3s
2
3p
4
Stopnie utlenienia: -2, -1, 0, +1, +2, +4, +6
Siarka występuje w skorupie ziemskiej głównie w postaci siarczanów i siarczków. W
temperaturze pokojowej ma budowę rombową (siarka
α
). W temperaturze ok.100˚C zmienia
strukturę i przechodzi w siarkę jednoskośną (siarka b). Ważniejsze związki siarki to kwas
siarkowy(VI), kwas siarkowy(IV), siarkowodór oraz ich sole, tlenek siarki(IV) i tlenek
siarki(VI).
Jod
Z = 53; M.at. = 126.9045
Położenie w układzie okresowym: 17 grupa, 5 okres
Konfiguracja elektronowa: 1s
2
2s
2
2p
6
3s
2
3p
6
4s
2
3d
10
4p
6
5s
2
4d
10
5p
5
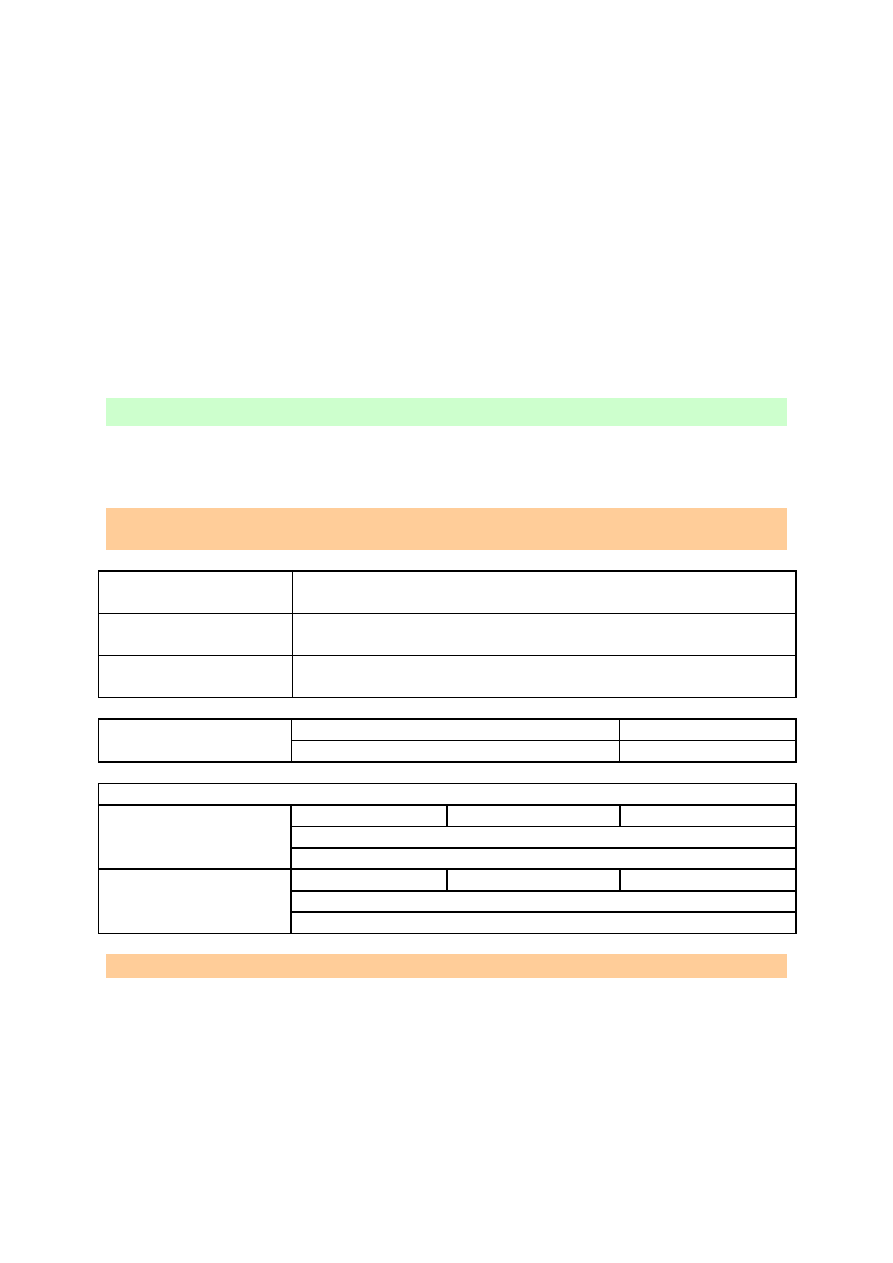
Stopnie utlenienia: -1, 0, +1, +3, +5, +7
Jod w temperaturze pokojowej występuje w postaci stałej, jako połyskliwa, niebiesko-czarna
substancja krystaliczna sublimująca po podgrzaniu i dająca fioletowe opary o
charakterystycznej drażniącej woni. Pary jodu można łatwo zestalić na chłodniejszej
powierzchni w procesie resublimacji. Słabo rozpuszcza się w wodzie, ale jest dobrze
rozpuszczalny w wodnym roztworze jodku potasu. Jod jest podobnie do innych chlorowców
bardzo reaktywny, szczególnie wobec metali, z którymi daje jodki. W reakcji z amoniakiem
tworzy wybuchowy jodek azotu. Najważniejsze nieorganiczne związki jodu to: jodek potasu,
jodowodór, jodany.
Ć
WICZENIE
1: O
TRZYMYWANIE
TLENU
PRZEZ
ROZKŁAD
CHLORANU
(
V
)
POTASU
Cel doświadczenia: Pokazanie wpływu katalizatora na ogrzewanie chloranu(V) potasu w
celu otrzymania tlenu.
2KClO
3
→
2
MnO
2KCl + 3O
2
↑
Poziom i skala
trudności(1-3)
1
Czas wykonania
ćwiczenia
20 minut
Sprzęt laboratoryjny
probówka, palnik, statyw do probówek, łyżeczka metalowa,
łuczywko, waga, szkiełko zegarkowe
Odczynniki
chloran(V) potasu KClO
3
0,5 g
tlenek manganu(IV) MnO
2
0,1 g
WYCIĄG Z KART CHARAKTERYSTYKI SUBSTANCJI NIEBEZPIECZNYCH
chloran(V) potasu
KClO
3
R: Nie dotyczy
S: Nie dotyczy
tlenek manganu(IV)
MnO
2
R: Nie dotyczy
S: Nie dotyczy
CZĘŚĆ DOŚWIADCZALNA
Do probówki wprowadzić 0,5 g chloranu(V) potasu oraz 0,1 g tlenku manganu(IV) i ostrożnie
ogrzewać ją w płomieniu palnika do całkowitego stopienia się soli. Następnie wprowadzić do
probówki łuczywko i obserwować zmiany.
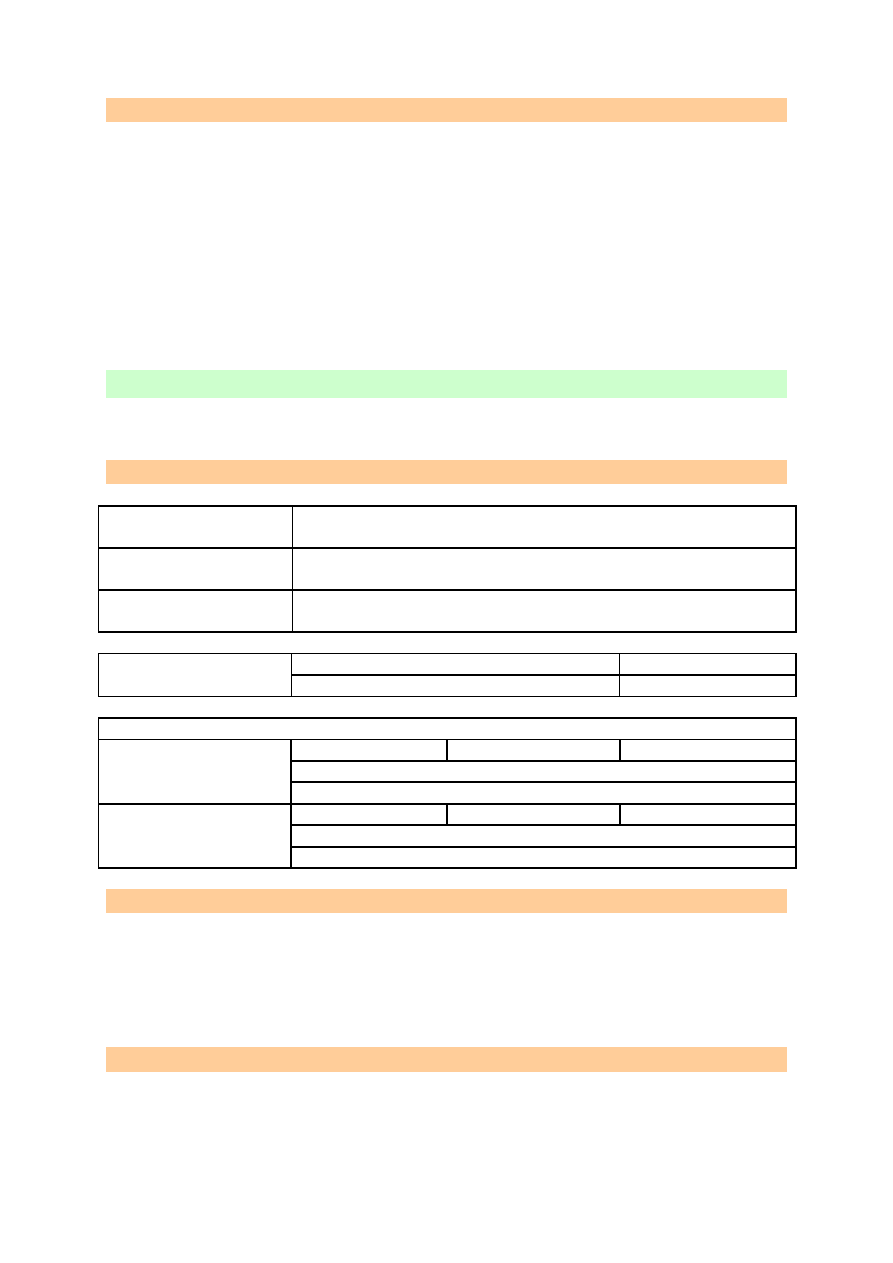
OBSERWACJE I WNIOSKI
Po wprowadzeniu do chloranu(V) potasu tlenku manganu(IV) i ogrzaniu obserwujemy
żarzenie się łuczywka. Oznacza to, iż tlen się wydzielił. Tlenek manganu(IV) pełni tutaj rolę
katalizatora. Prócz tlenu w probówce pojawił się chlorek potasu. Jest to reakcja redoks, w
której chlor jest utleniaczem, a tlen reduktorem.
2KClO
3
→ 2KCl + 3O
2
↑
Cl
+V
+6e → Cl
-I
2O
-II
-4e → O
2
0
Ć
WICZENIE
2: W
ŁASNOŚCI
UTLENIAJĄCE
SIARKI
Cel doświadczenia: Pokazanie siarki jako utleniacza w jego reakcji syntezy z żelazem.
Fe + S → FeS
Poziom i skala
trudności(1-3)
1
Czas wykonania
ćwiczenia
20 minut
Sprzęt laboratoryjny
probówka, palnik, moździerz z pastelem, łyżeczka metalowa,
waga, szkiełko zegarkowe
Odczynniki
siarka (pył)
0,32 g
żelazo (pył)
0,56 g
WYCIĄG Z KART CHARAKTERYSTYKI SUBSTANCJI NIEBEZPIECZNYCH
siarka S
R: Nie dotyczy
S: Nie dotyczy
żelaza Fe
R: Nie dotyczy
S: Nie dotyczy
CZĘŚĆ DOŚWIADCZALNA
W moździerzu zmieszać ze sobą dokładnie pył siarkowy z pyłem żelazowym. Przenieść
mieszaninę do probówki i ogrzewać w płomieniu palnika, aż do zmiany koloru zawartości
probówki.
OBSERWACJE I WNIOSKI
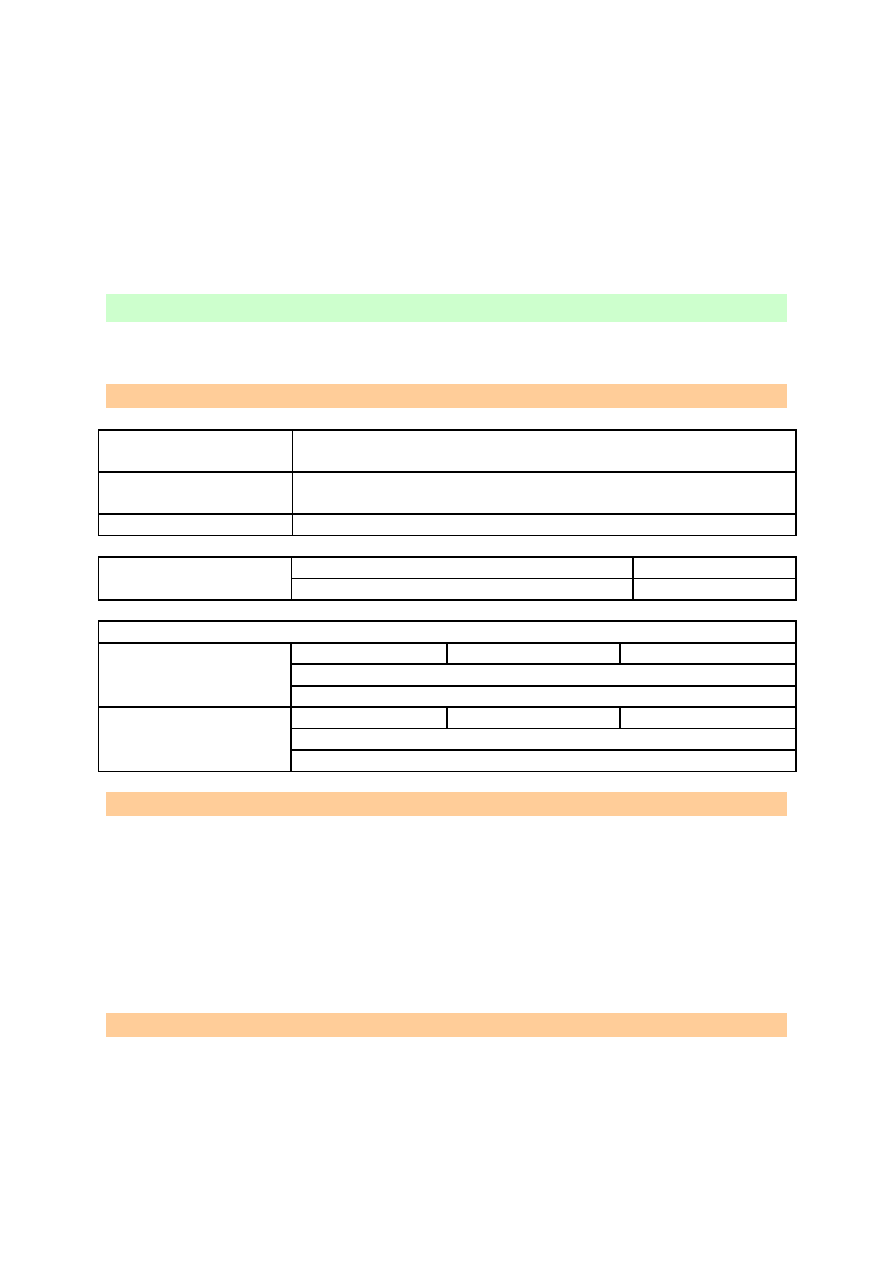
W rozżarzonej mieszaninie zachodzi synteza pierwiastków, siarki i żelaza, z utworzeniem
czarnego siarczku żelaza(II). Jest to reakcja redoks, w której siarka pełni rolę utleniacza,
jednocześnie się redukując, a żelazo jest reduktorem.
Fe +S → FeS
Fe
0
-2e → Fe
+II
S
0
+2e → S
-II
Ć
WICZENIE
3: O
TRZYMYWANIE
AZOTU
Cel doświadczenia: Pokazanie reakcji otrzymywania azotu.
NaNO
2
+NH
4
Cl → N
2
↑ + NaCl + 2H
2
O
Poziom i skala
trudności(1-3)
1
Czas wykonania
ćwiczenia
15 minut
Sprzęt laboratoryjny
probówka, palnik, łuczywko, 2x pipeta 5 mL
Odczynniki
nasycony roztwór chlorku amonu NH
4
Cl
3 mL
nasycony roztwór azotanu(III) sodu NaNO
2
3 mL
WYCIĄG Z KART CHARAKTERYSTYKI SUBSTANCJI NIEBEZPIECZNYCH
chlorek amonu NH
4
Cl
R: Nie dotyczy
S: Nie dotyczy
azotan(III) sodu
NaNO
2
R: Nie dotyczy
S: Nie dotyczy
CZĘŚĆ DOŚWIADCZALNA
Zmieszać w probówce 3 mL nasyconego roztworu chlorku amonu z 3 mL roztworu
azotanu(III) sodu i ostrożnie ogrzewać w płomieniu palnika. W momencie, gdy zaczną
wydzielać się pęcherzyki gazu należy zakończyć ogrzewanie, reakcja będzie przebiegać dalej
bez ogrzewania.. Po zakończeniu reakcji wprowadzić do probówki rozżarzone łuczywko i
obserwować zmiany.
OBSERWACJE I WNIOSKI
Po wprowadzeniu do probówki rozżarzonego łuczywka, gaśnie ono, co świadczy, że
wydzielającym się gazem jest azot. W pierwszej kolejności, przy ogrzewaniu, zachodzi
reakcja wymiany podwójnej:
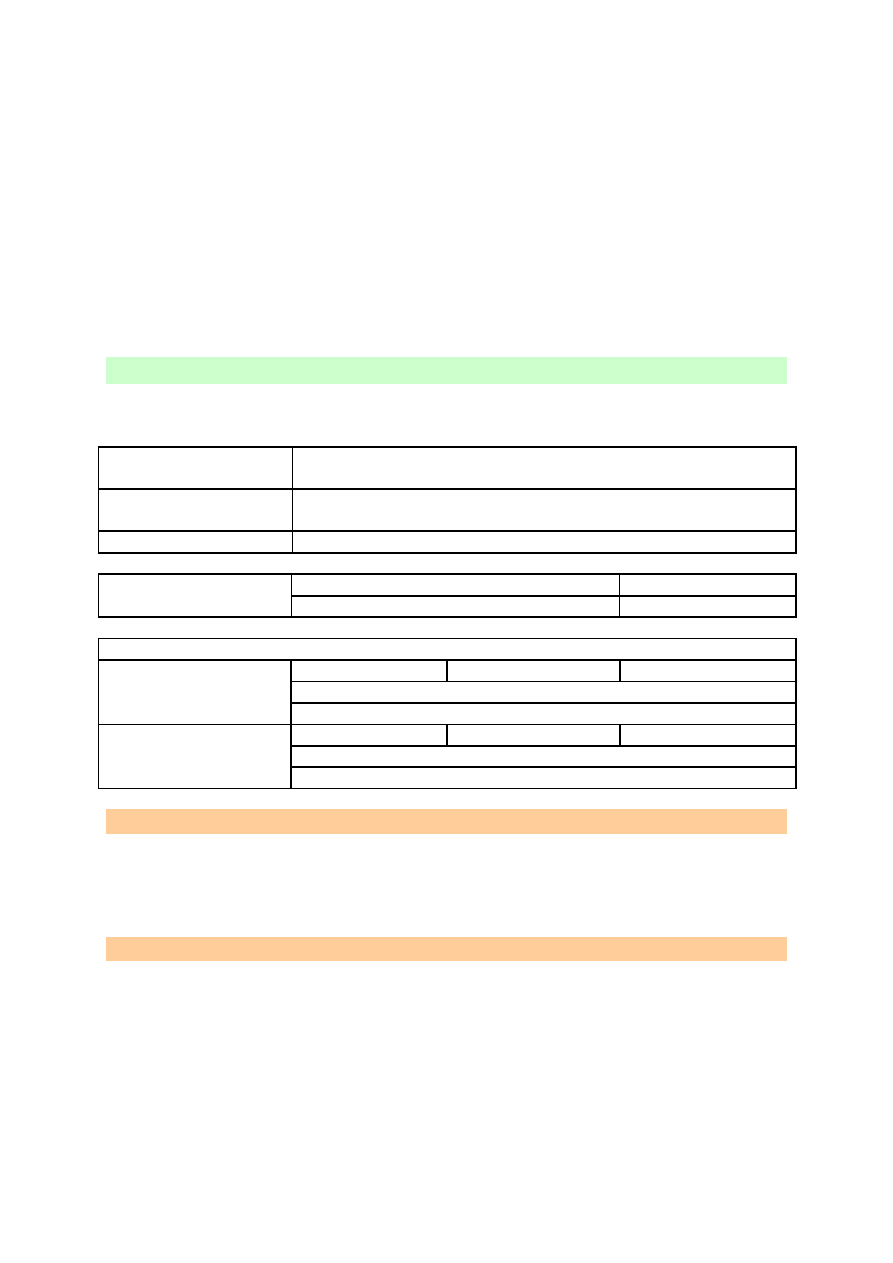
NaNO
2
+NH
4
Cl → NaCl + NH
4
NO
2
Następnie dochodzi do rozkładu powstałego wcześnie azotanu(III) amonu NH
4
NO
2
na azot i
wodę. Jest to reakcja redoks, w której azot z grupy amonowej jest utleniaczem, a azot z grupy
azotanowej(III) jest reduktorem:
NH
4
NO
2
→ N
2
+ 2H
2
O
N
-III
-3e → N
0
N
+III
+3e → N
0
Ć
WICZENIE
4: D
ZIAŁANIE
JODU
NA
ROZTWÓR
SKROBI
Cel doświadczenia: Pokazanie charakterystycznej reakcji pomiędzy jodem a skrobią.
Poziom i skala
trudności(1-3)
1
Czas wykonania
ćwiczenia
10 minut
Sprzęt laboratoryjny
probówka, 2x pipeta 1mL
Odczynniki
woda nasycona jodem
0,5 mL
świeżo sporządzony roztwór skrobi
1 mL
WYCIĄG Z KART CHARAKTERYSTYKI SUBSTANCJI NIEBEZPIECZNYCH
woda nasycona jodem
R: Nie dotyczy
S: Nie dotyczy
skrobia
R: Nie dotyczy
S: Nie dotyczy
CZĘŚĆ DOŚWIADCZALNA
W probówce umieścić 1 mL świeżo sporządzonego roztworu skrobi i dodać do niego 0,5 mL
wody nasyconej jodem. Obserwować zachodzące zmiany.
OBSERWACJE I WNIOSKI
Roztwór skrobi ma postać białej zawiesiny, natomiast woda nasycona jodem jest koloru
brązowego. Po dodaniu do roztworu skrobi wody z jodem, w probówce pojawiło się
niebieskie zabarwienie. Jest ono wynikiem reakcji pomiędzy skrobią a wolnym jodem, w
której powstaje niebieski związek kompleksowy. Roztwór skrobi służy w praktyce do
wykrywania wolnego jodu.

LITERATURA
1. L. Pajdowski. Chemia ogólna. PWN, Warszawa 1999
2. M. J. Sienko, R. A. Plane. Chemia: podstawy i zastosowania. WNT, Warszawa 1999
3. L. Jones, P. Atkins. Chemia ogólna. Cząsteczki, materia, reakcje. PWN, Warszawa
2006
TEST SPRAWDZAJĄCY
1. Wymień odmiany alotropowe siarki.
Prawidłowa odpowiedź: siarka rombowa (
α
) i jednoskośna (
β
)
2. Żarzące się łuczywko nie gaśnie, gdy wprowadzimy je do probówki zawierającej:
a) N
2
b) suchy CO
2
c) O
2
d) H
2
SO
3
Prawidłowa odpowiedź: c
Wyszukiwarka
Podobne podstrony:
Ćw.1 Wybrane reakcje chemiczne przebiegające w roztworach wodnych ćwiczenie 1, Chemia ogólna i żywno
Ćw.1 Wybrane reakcje chemiczne przebiegające w roztworach wodnych ćwiczenie 1, Chemia ogólna i żywno
w5 wzor reakcja chemiczna ilościowo
04 Kinetyka reakcji chemicznych i kataliza
BADANIE WP YWU ST ENIA NA SZYBKO REAKCJI CHEMICZNYCH
Jak w prosty sposób zapisać przebieg reakcji chemicznych
Jak uzgadniać równania reakcji chemicznych
Wykład 3. Reakcje chemiczne, chemia, CHEMIA OGÓLNA -Walkowiak- (WPC 1002w) DOC
Wybrane metody analizy jakościowej. Reakcje analityczne wybranych anionów, sprawka z chemi utp rok I
Efekty cieplne reakcji chemicznych
Aminokwasy i ich reakcje chemiczne NOTATKI Z WYKŁADÓW, Biochemia, Biochemia, aminokwasy
biochemia słowniczek, ENZYMY- to białka, ich funkcja to katalizatory, powodujące złożone reakcje che
REAKCJA CHEMICZNA, REAKCJA CHEMICZNA, przemiana chemiczna, przemiana jednych substancji, zw
reakcje chemicznew roztworach wodnych zadania
10 Typy reakcji chemicznychid 11130
2 Reakcje chemiczne sprawozdanie
Cwiczenie nr 05 Wybrane metody anlizy jakosciowej Reakcje anlityczne wybranych kationow
03 Reakcje chemiczne II, utlenianie i redukcja instrukcja
więcej podobnych podstron