
ILOŚCIOWA
INTERPRETACJA WZORU I
RÓWNANIA CHEMICZNEGO

POWTÓRKA
• Masa atomowa pierwiastka
chemicznego wskazuje ile razy atom
danego pierwiastka ma większą
masę od atomowej jednostki masy: u
czyli….???
• Musimy pamiętać, że pierwiastki
stanowią mieszaniny ….(???)
Mol, masa molowa
• MOL
– jednostka liczności materii,
która określa liczbę cząstek
(cząsteczek, jonów, elektronów,
kwantów energii itp.) dokładnie
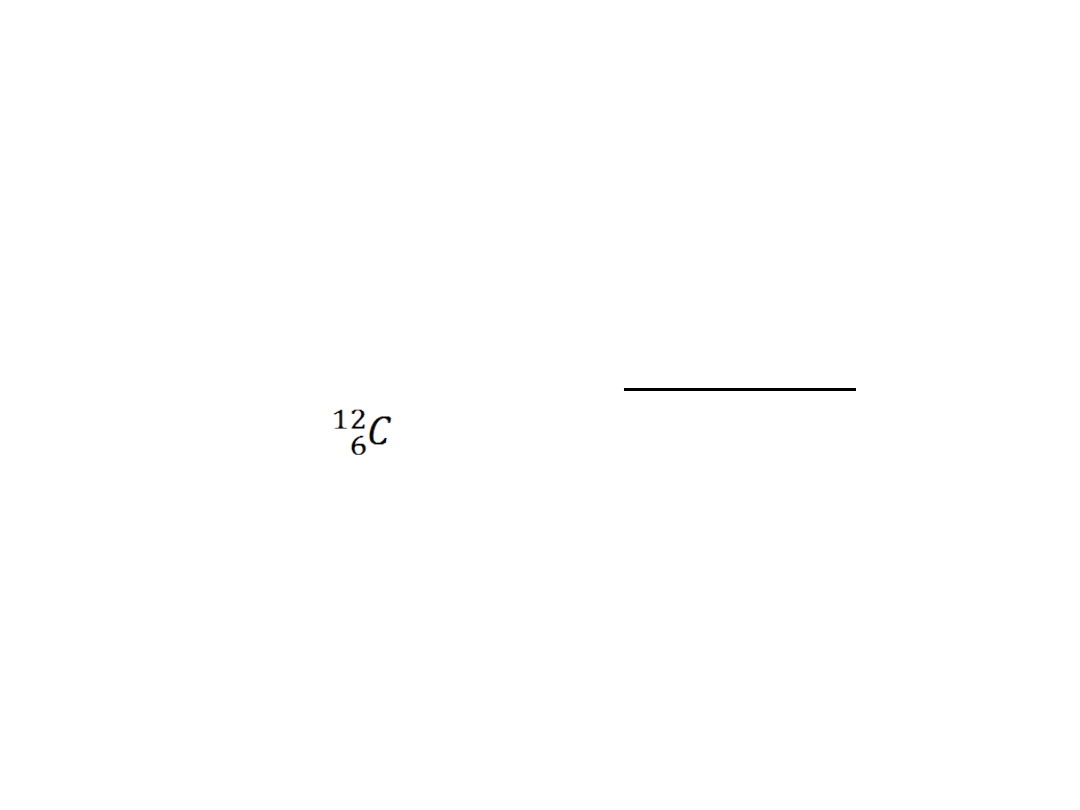
równą liczbie atomów zawartych w
12 g węgla
równą
liczbie
Avogadra
:
N = 6,0230810
23

Mol, masa molowa
m = 1,9992410
-23
g
bezwzględna masa
1,9992410
-23
g 6,0230810
23
= 12 g
Jest równa liczbowo masie atomowej węgla
MASY MOLOWE ATOMÓW
(BEZWZGLĘDNE MASY MOLI ATOMÓW WSZYSTKICH
PIERWIASTKÓW) SĄ RÓWNE LICZBOWO ICH
MASOM ATOMOWYM WYRAŻONYM W GRAMACH

Obliczenia
stechiometryczne
Obliczenia wzajemnego stosunku
ilościowego składników w
poszczególnych związkach
chemicznych oraz obliczenia
określające stosunki wagowe
pomiędzy reagującymi i
otrzymywanymi w wyniku reakcji
substancji

Obliczenia
stechiometryczne
Określanie wzoru chemicznego substancji o znanym składzie
procentowym składników
Wzory chemiczne – otrzymane bezpośrednio z obliczeń
Wzory rzeczywiste – zawierające prawdziwą liczbę atomów w cząsteczce
uwzględniające masę cząsteczkową danej substancji
PRZYKŁADY

Obliczanie przy pomocy równań
chemicznych
RÓWNANIE CHEMICZNE MA CHARAKTER
MATEMATYCZNY!!!
C + O
2
= CO
2
+ Q
1 atom 1 cząsteczka 1
cząsteczka
1 mol 1 mol 1 mol
12g 32g 44g
C + O
2
CO
2
+ Q
Obliczenia
stechiometryczne
Document Outline
Wyszukiwarka
Podobne podstrony:
w5 wzor reakcja chemiczna ilościowo
Ilościowe zależności w reakcjach chemicznych
Ćw.1 Wybrane reakcje chemiczne przebiegające w roztworach wodnych ćwiczenie 1, Chemia ogólna i żywno
04 Kinetyka reakcji chemicznych i kataliza
BADANIE WP YWU ST ENIA NA SZYBKO REAKCJI CHEMICZNYCH
Jak w prosty sposób zapisać przebieg reakcji chemicznych
Jak uzgadniać równania reakcji chemicznych
Wykład 3. Reakcje chemiczne, chemia, CHEMIA OGÓLNA -Walkowiak- (WPC 1002w) DOC
Efekty cieplne reakcji chemicznych
Aminokwasy i ich reakcje chemiczne NOTATKI Z WYKŁADÓW, Biochemia, Biochemia, aminokwasy
biochemia słowniczek, ENZYMY- to białka, ich funkcja to katalizatory, powodujące złożone reakcje che
REAKCJA CHEMICZNA, REAKCJA CHEMICZNA, przemiana chemiczna, przemiana jednych substancji, zw
reakcje chemicznew roztworach wodnych zadania
10 Typy reakcji chemicznychid 11130
2 Reakcje chemiczne sprawozdanie
03 Reakcje chemiczne II, utlenianie i redukcja instrukcja
więcej podobnych podstron