
PRÓBNY EGZAMIN MATURALNY
Z CHEMII
Arkusz egzaminacyjny II
MODEL ODPOWIEDZI
I SCHEMAT OCENIANIA
1. Punkty przyznawane są za całkowicie poprawne rozwiązanie.
2. Jeżeli do jednego polecenia podano dwie odpowiedzi –
poprawną i błędną – nie przyznaje się punktów.
3. Jeśli polecenie brzmiało „zapisz równanie reakcji” – nie
przydziela się punktów za zapisanie schematu procesu.
4. Brak jednostek w obliczeniach lub błąd rachunkowy – obniża
punktację o 1 pkt.
5. Inne niż podane w modelu, poprawne merytorycznie
rozwiązanie należy oceniać zgodnie z podaną punktacją.
ARKUSZ I
MARZEC 2002
CHEMIA
O K R Ę G O W A
K O M I S J A
EGZAMINACYJNA
w K R A K O W I E

2
Próbny egzamin maturalny z chemii
Arkusz egzaminacyjny II – Model odpowiedzi i schemat oceniania
punktacja zadań
Zadanie
Model odpowiedzi
cząstkowa
całkowita
19
Zapis wzoru do obliczeń
Obliczenie masy atomowej – 24,3 [u]
1
1
2
20
I. – [Ne]3s
2
II. – Odp. C
III. – 2
IV. – Odp. C
1
1
1
1
4
21
B
1
1
22
Zapisanie równań reakcji elektrodowych
K(-): Mg
2+
+ 2e → Mg
A(+): 2Cl
-
- 2e → Cl
2
1
1
2
23
Podanie nazw przewidywanych produktów elektrolizy
1
1
24
Podstawienie danych do wzoru
Obliczenie zmiany szybkości reakcji – wzrośnie ośmiokrotnie
1
1
2
25
Zapisanie wyrażenia na stałą równowagi
Obliczenie wartości K
c
= 3/8 (0,375)
1
1
2
26
Zapis równań reakcji:
(1) np. CrCl
3
+ 3NaOH
→ Cr(OH)
3
+ 3NaCl
(2) Cr(OH)
3
+ 3NaOH
→ Na
3
[Cr(OH)
6
]
(3) 2Cr(OH)
3
+ 3H
2
SO
4
→ Cr
2
(SO
4
)
3
+
6H
2
O
Reakcja 2 i 3 – potwierdzenie charakteru amfoterycznego
1
1
1
1
4
27
Zapis równania reakcji
4Mg + 10HNO
3
→ NH
4
NO
3
+ 4Mg(NO
3
)
2
+ 3H
2
O
Współczynniki stechiometryczne
Poprawnie zapisany bilans elektronowy np.:
III
V
II
N
e
N
e
Mg
Mg
−
−
−
→
+
+
→
8
2
0
x 4
1
1
1
3
28
Obliczenie liczby moli NaOH w 5% roztworze
Obliczenie liczby moli HCl w 0,5 molowym roztworze
Porównanie liczby moli kwasu i zasady
Wskazanie na obojętny odczyn roztworu
1
1
1
1
4
29
Obliczenie stężenia jonów wodorowych w roztworze
[H+] = 0,01 mol/dm
3
Określenie pH = 2
1
1
2
30
Schemay dwóch ogniw:
Me│Me
n+
║ Cu
2+
│Cu (E
o
Me│Me
n+
< E
o
Cu
2+
│Cu
Cu │Cu
2+
║ Me
n+
│Me (E
o
Me│Me
n+
> E
o
Cu
2+
│Cu
Zapis równań reakcji elektrodowych dla:
I ogniwa
II ogniwa
1
1
1
1
4
31
Probówka I – etan – (węglowodór nasycony nie ulega żadnej
z opisanych reakcji)
Probówka II – etyn – (węglowodór nienasycony, przyłącza 2 mole
wodoru na 1 mol gazu – alkin)
Probówka III – chloroetan (pozytywny wynik próby na obecność
halogenów
Probówka IV – etyn (węglowodór nienasycony, przyłącza 1 mole
wodoru na 1 mol gazu – alken)
1
1
1
1
4
32
Zapis równań:
C
2
H
5
Cl + Mg → C
2
H
5
MgCl
C
2
H
5
MgCl + H
2
O →C
2
H
6
+ Mg(OH)Cl
Podanie nazwy: chlorek wodorotlenek magnezu
(dopuszczalna nazwa: chlorek hydroksomagnezu)
1
1
1
3
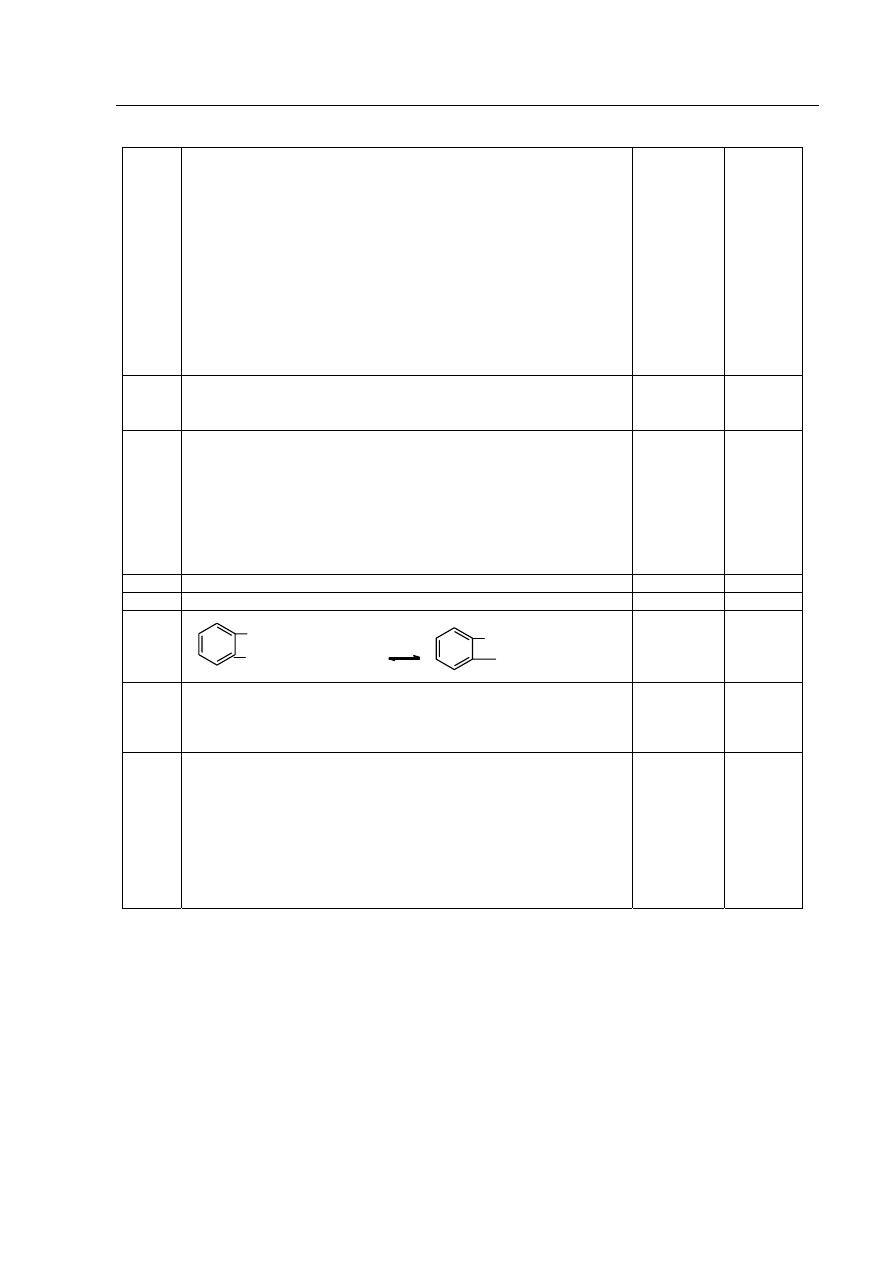
Próbny egzamin maturalny z chemii
3
Arkusz egzaminacyjny II – Model odpowiedzi i schemat oceniania
33
A. Zapis równań reakcji
COOH COOAg
+ 2AgNO
3
→ + 2HNO
3
COOH COOAg (
↓)
COO
-
COOAg
+ 2Ag
+
→
COO
-
COOAg
B. Wykonanie obliczeń:
obliczenie liczby moli (masy jonów Ag+)
obliczenie liczby moli kwasu
obliczenie objętości kwasu szczawiowego – V = 0,25 dm
3
(250 cm
3
)
1
1
1
1
1
5
34
Zapis równań:
CH
3
Cl + NH
3
→ CH
3
NH
3
Cl
CH
3
NH
3
Cl + NaOH
→ CH
3
NH
2
+ NaCl + H
2
O
1
1
2
35
Wzór i nazwa
CH
3
CH
2
−CH−COOH
kwas 2
−hydroksybutanowy
OH
CH
3
CH
2
−CHOH−COOH + NaOH → CH
3
CH
2
CHOH
−COONa + H
2
O
CH
3
−CH
2
−CHOH−COOH + 2Na → CH
3
−CH
2
−CH−COONa + H
2
ONa
1
1
1
1
4
36
B
1
1
37
C
1
1
38
COOH
OH
COOH
OCOCH
3
+
CH
3
COOH
H
2
SO
4
+
H
2
O
1
1
39
Sporządzenie wykresu
Odczytanie z wykresu masy jodu-131 pozostałego po 24 dniach – 25g
Obliczenie masy jodu-131, który uległ rozpadowi – 175g
Obliczenie procentu masy jodu – 87,5%
1
1
1
1
4
40
Podanie dwóch przykładów zastosowań izotopów
Opis przykładowych zagrożeń, np.:
−
radioaktywne skażenie środowiska związane ze składowaniem
odpadów promieniotwórczych
−
możliwość konfliktów nuklearnych
−
choroba popromienna, mutacje genetyczne, nowotwory
−
osłabienie układu immunologicznego, zakłócenie podstawowych
funkcji organizmu
−
możliwość awarii elektrowni atomowych
Po 1pkt za
każdy
przykład
zastosowania
i zagrożenia
4
Wyszukiwarka
Podobne podstrony:
2002 marzec klucz OKE Kraków
Matura historia muzyki 2002 2 arkusz klucz
gimn 2002 hum klucz
2002 rok klucz
Matura historia muzyki 2002 1 arkusz klucz
2008 marzec klucz
fizyka 2002 marzec podst
2002 maj klucz (2)
Matura - historia muzyki - 2002 - 3 arkusz, klucz
gimn 2002 mat klucz
Matura - historia muzyki - 2002 - 1 arkusz, klucz
2002 marzec (2)
2002 czerwiec klucz
więcej podobnych podstron