
Spektroskopia UV-Vis
Ultrafiolet
Widzialne
nm
100
400
750
Energia
absorpcja
Przejścia
elektronowe
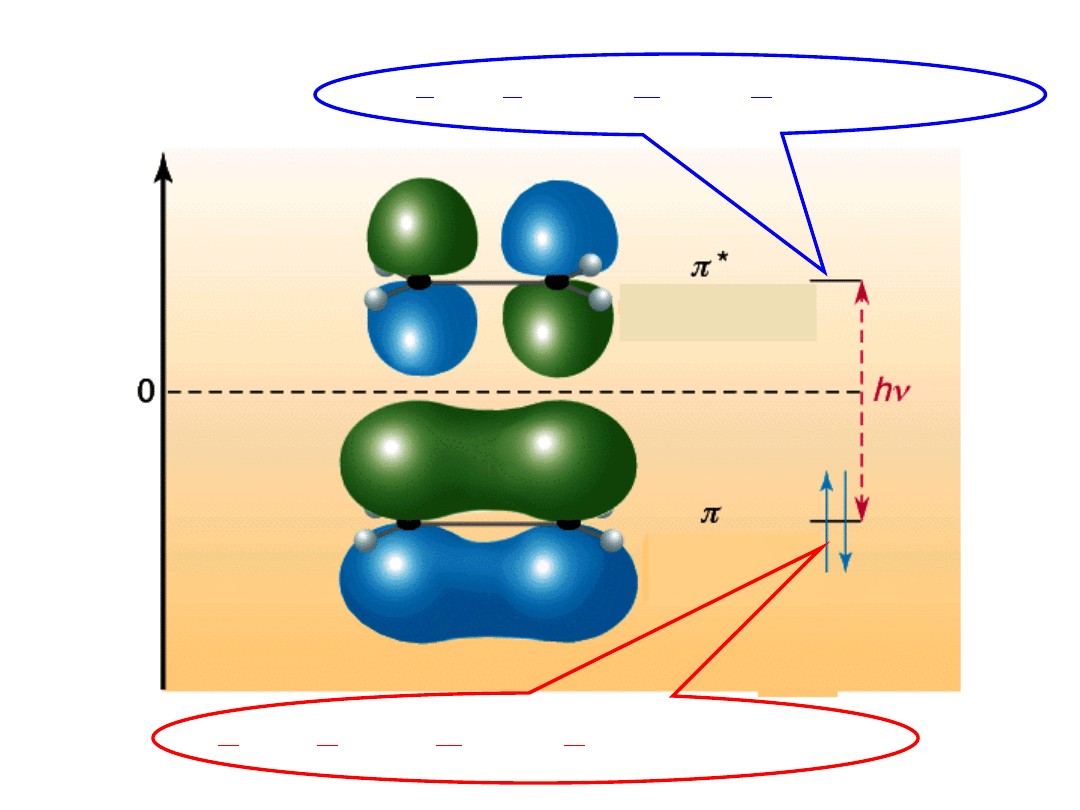
EN
ER
GIA
L
owest
U
noccupied
M
olecular
O
rbital
H
ighest
O
ccupied
M
olecular
O
rbital
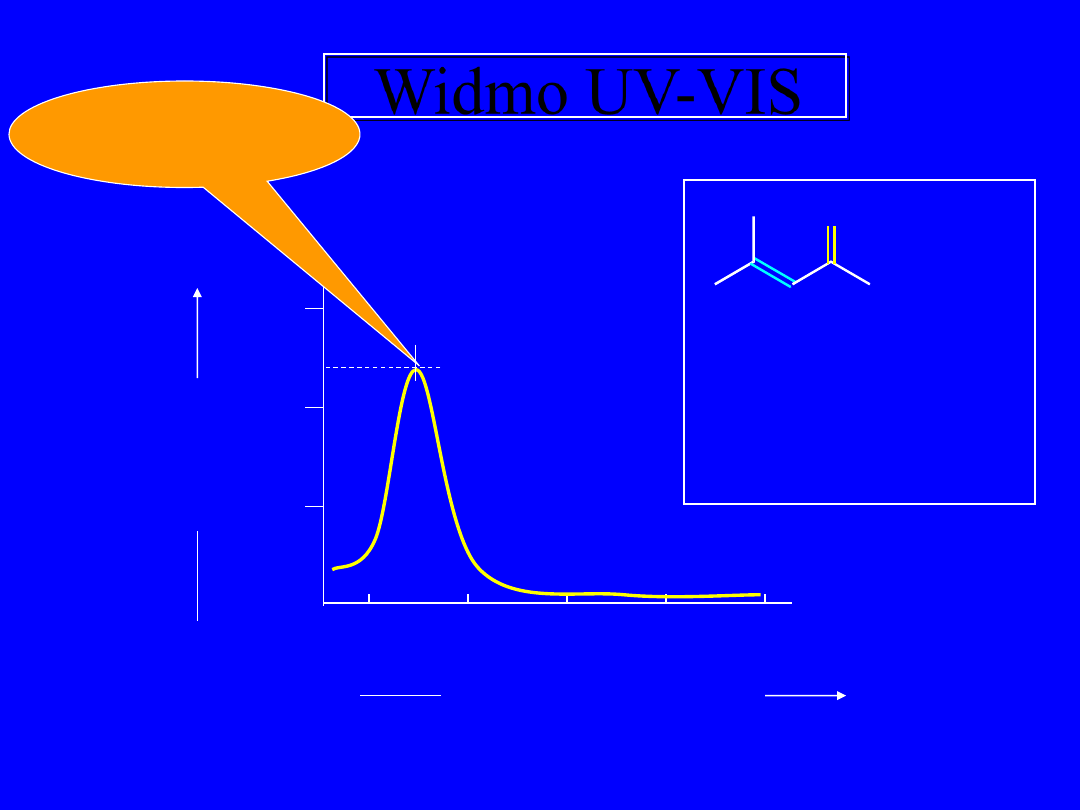
Widmo UV-VIS
200
250
300 350 400
Długość fali, nm
Absorbancja
A
0
0.5
1.0
1.5
l
ma
x
= 232 nm
O
tlenek mezytylu
c = 9.2x10
-
5
M
Długość
kuwety = 1 cm
Maksimum
absorpcji

Spektroskopia UV-VIS
e
=
A
c
l
e
= molowy współczynnik absorpcji, M
-
1
cm
-
1
A = absorbancja molowa
c = stężenie molowe, mol/l
l = długość drogi optycznej, cm
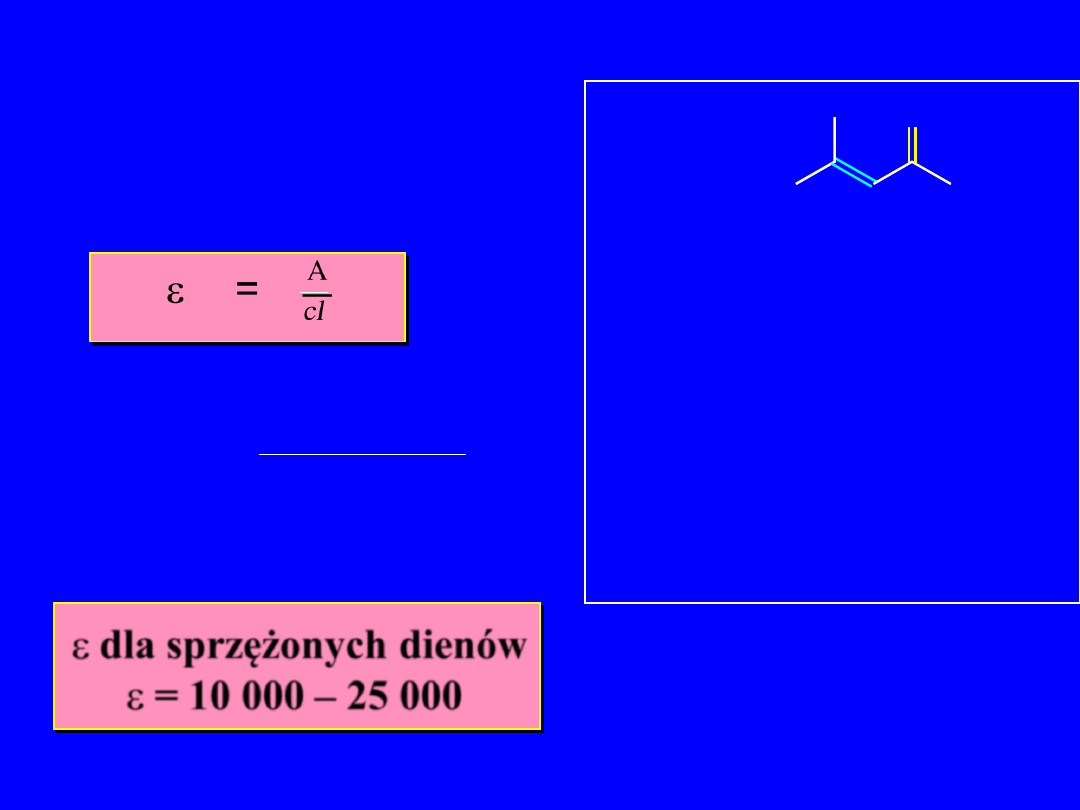
Tlenek mezytylu
Molowy współczynnik absorpcji
e
= A
cl
e
1.2
9,2 x 10
-
5
x 1.0
=
= 13 000
O
Tlenek mezytylu
c = 9,2x10
-
5
M
Długość kuwety = 1 cm
A = 1,2
e
dla sprzężonych dienów
e
= 10 000 – 25 000
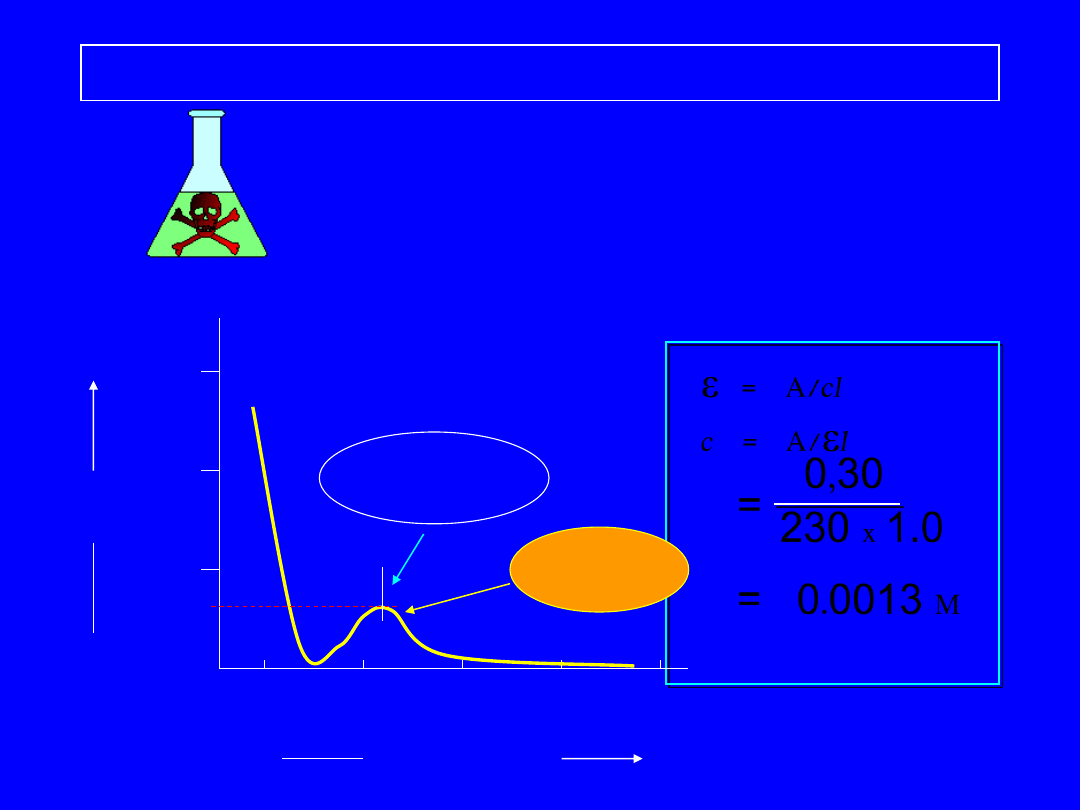
Widmo UV-VIS benzenu w etanolu ( l = 1.0 cm ).
200
250
300 350 400
Długość fali , nm
Absorbancja
A
0
0.5
1.0
1.5
A = 0.3
l
max
= 260
e
= A/cl
c = A/
e
l
=
0,30
230 x 1.0
=
0.0013 M
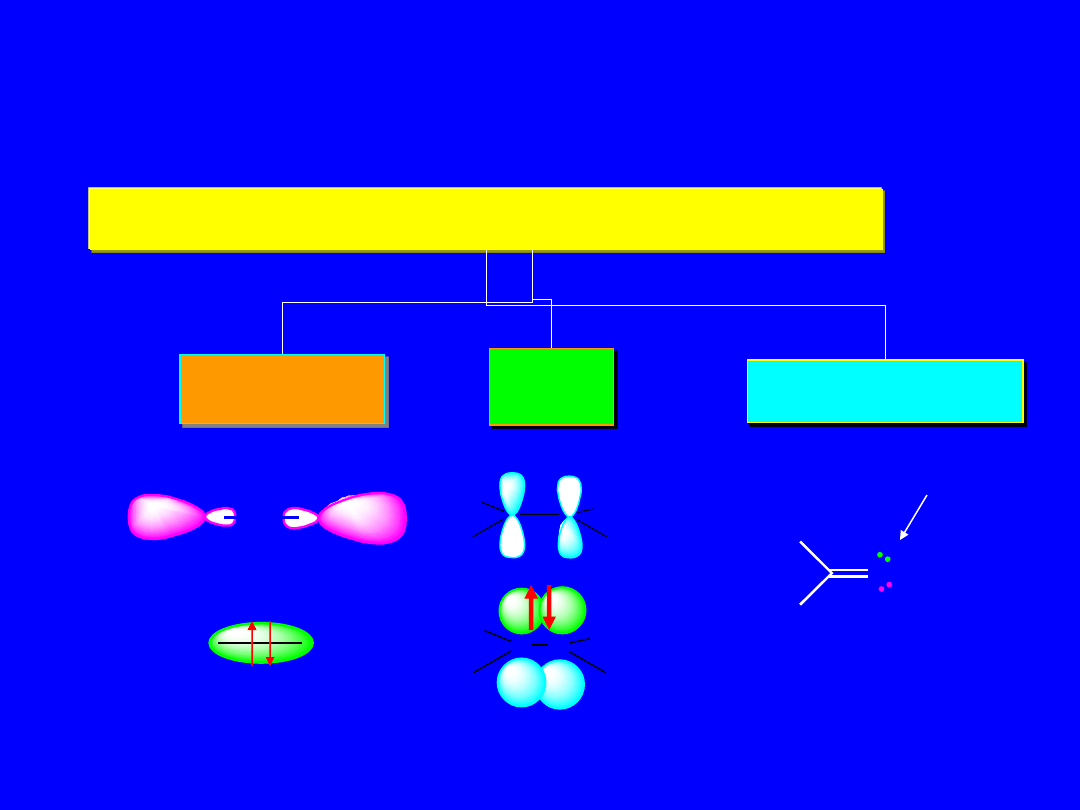
Typy przejść elektronowych
Elektrony walencyjne - orbitale cząsteczkowe
Sigma ,
s
Pi ,
p
niewiążące, n
H
3
C
C
H
3
s
*
s
H
3
C
CH
3
C
C
p
C
C
p
*
O
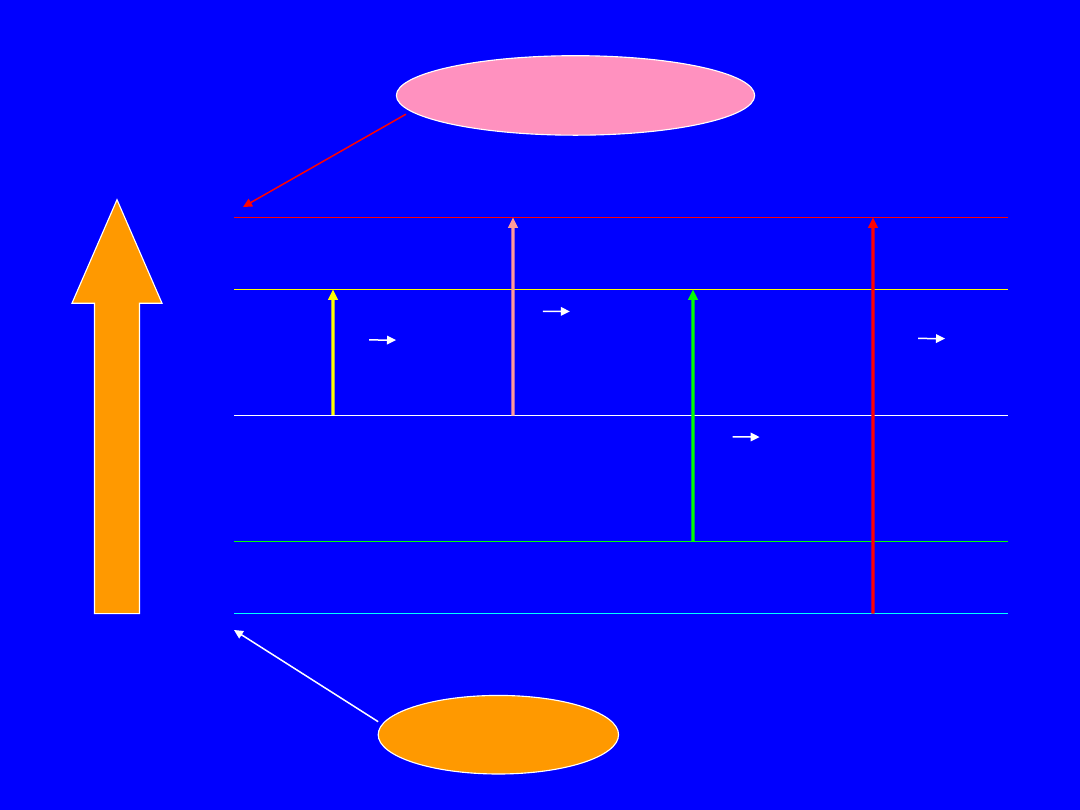
s
s
*
p
p
*
n
E
n
p
*
s
s
*
s
*
n
(> 270 nm)
< 105 kcal
(> 185 nm)
< 150 kcal
(> 165 nm)
< 170 kcal
(< 165 nm)
> 170 kcal
p
p
*
antywiążące
wiążące
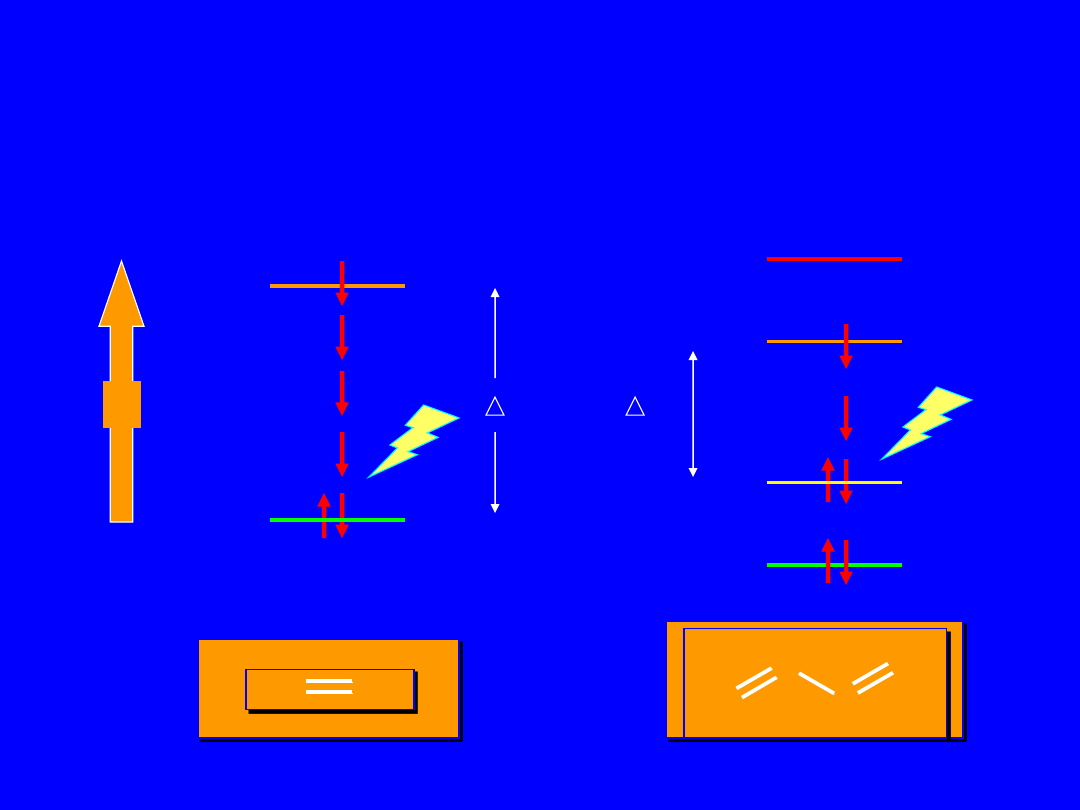
p
1
p
4
*
p
1
HOMO
p
2
HOMO
p
2
*
LUMO
p
3
*
LUMO
E
H
2
C
H
C
C
H
CH
2
H
2
C
CH
2
E
1
E
2
>
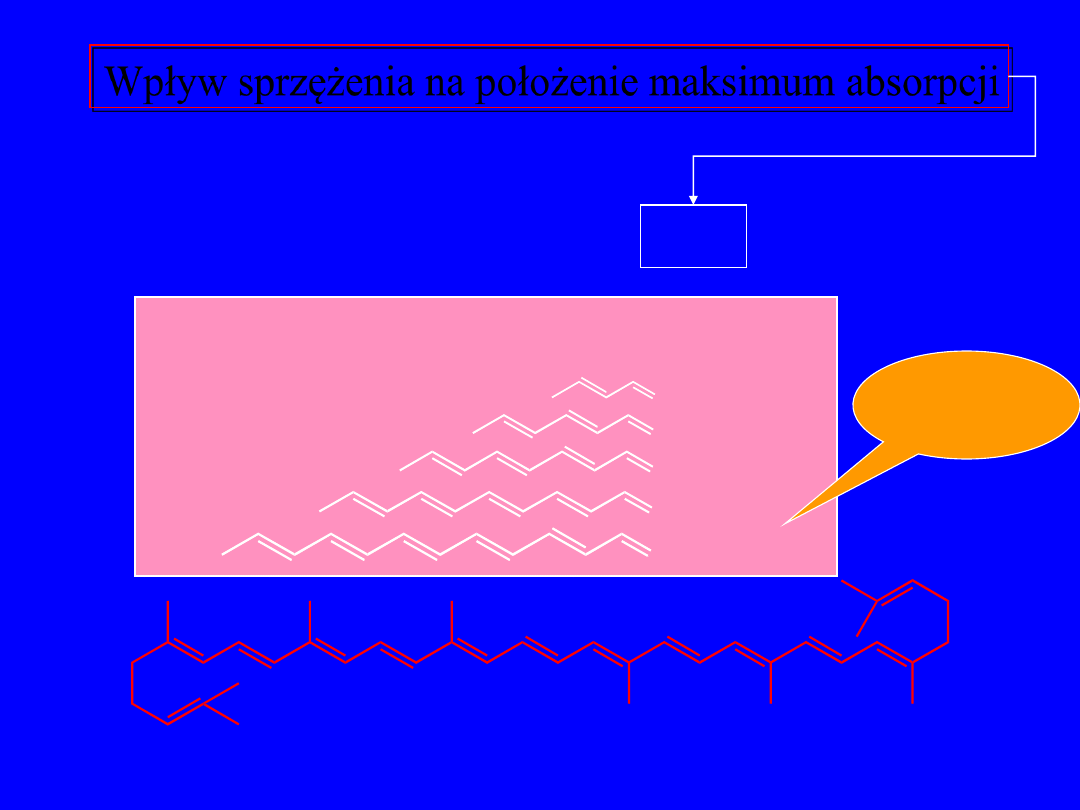
Wpływ sprzężenia na położenie maksimum absorpcji
l
max
l
max ,
nm
O
217
O
312
O
270
likopen
l
max
= 505 nm
O
343
O
370
30 nm/C=C
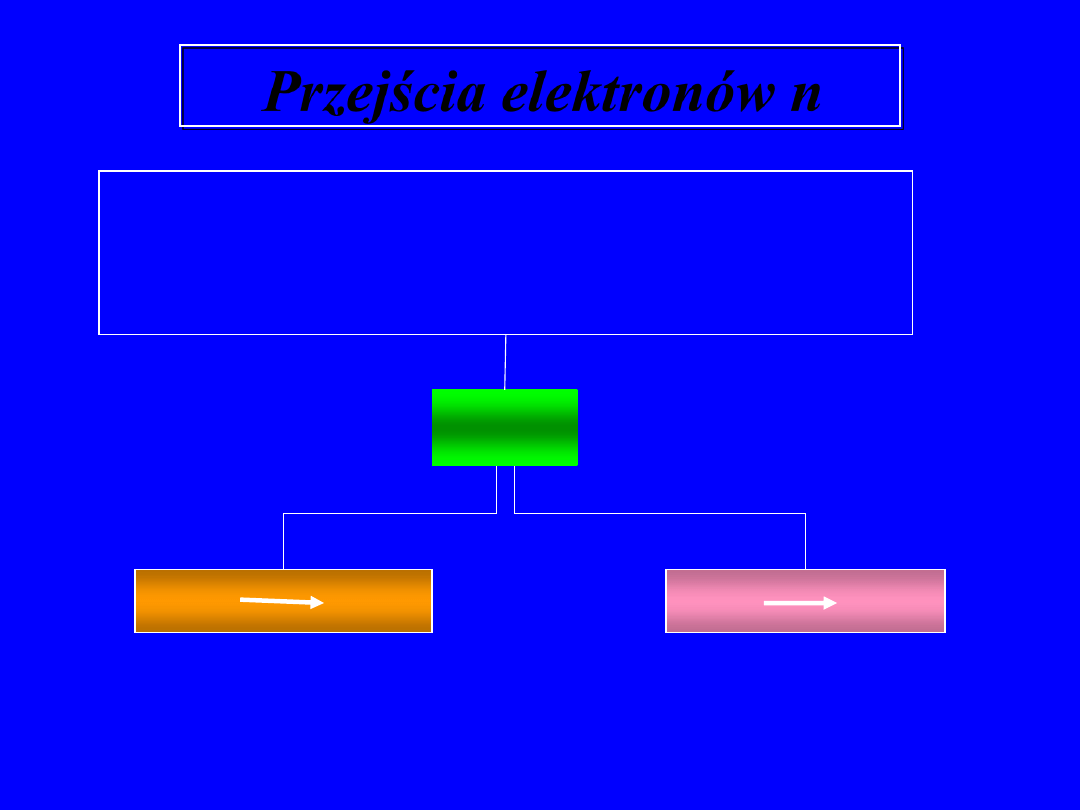
Przejścia elektronów n
Heteroatomy O, N, S, P, halogen posiadają
wolne pary elektronowe
Mogą one zostać wzbudzone na orbitale
p
*
i
s
*
s
*
n
l
max
< 200 nm
n
p
*
e
~ 10
2
l
max
> 200 nm
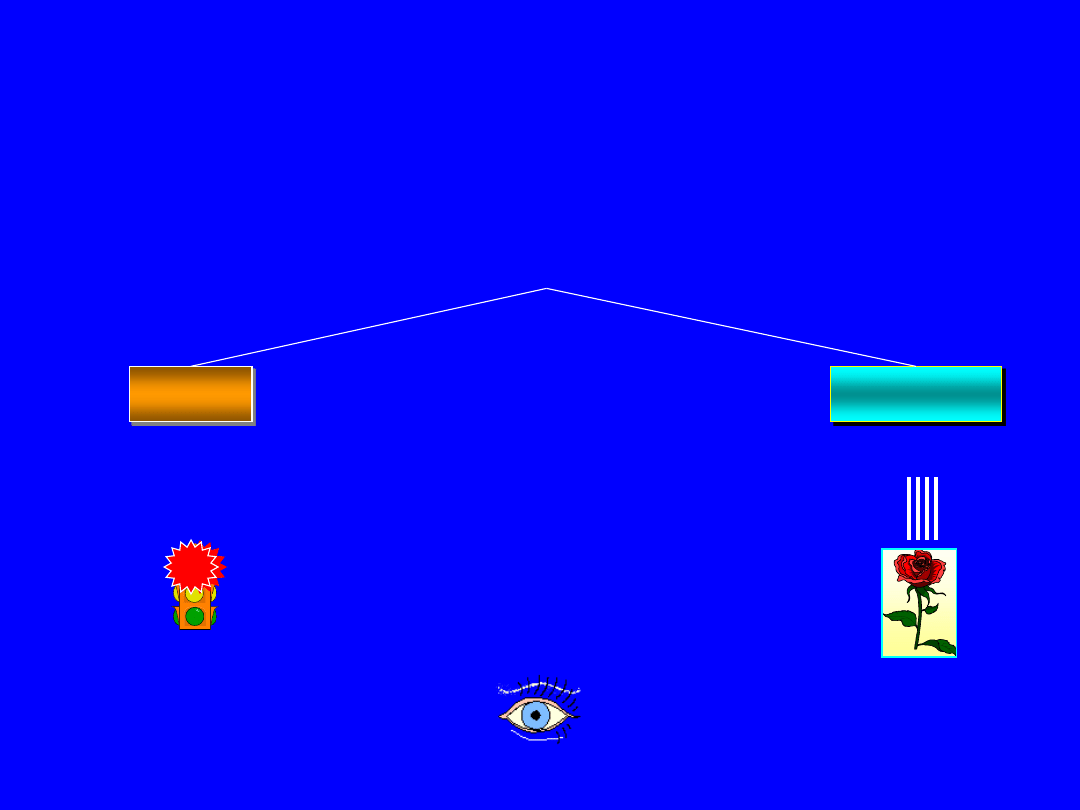
400 - 750 nm
Emisja
Absorpcja

l
, nm
kolor
kolor dopełniający
400-424
fioletowy
zielono-żółty
424-491
niebieski
żółty
491-570
zielony
czerwony
570-585
żółty
niebieski
585-647
pomarań.
zielono-błękitny
647-700
czerwony
zielony
absopcja
niebieski
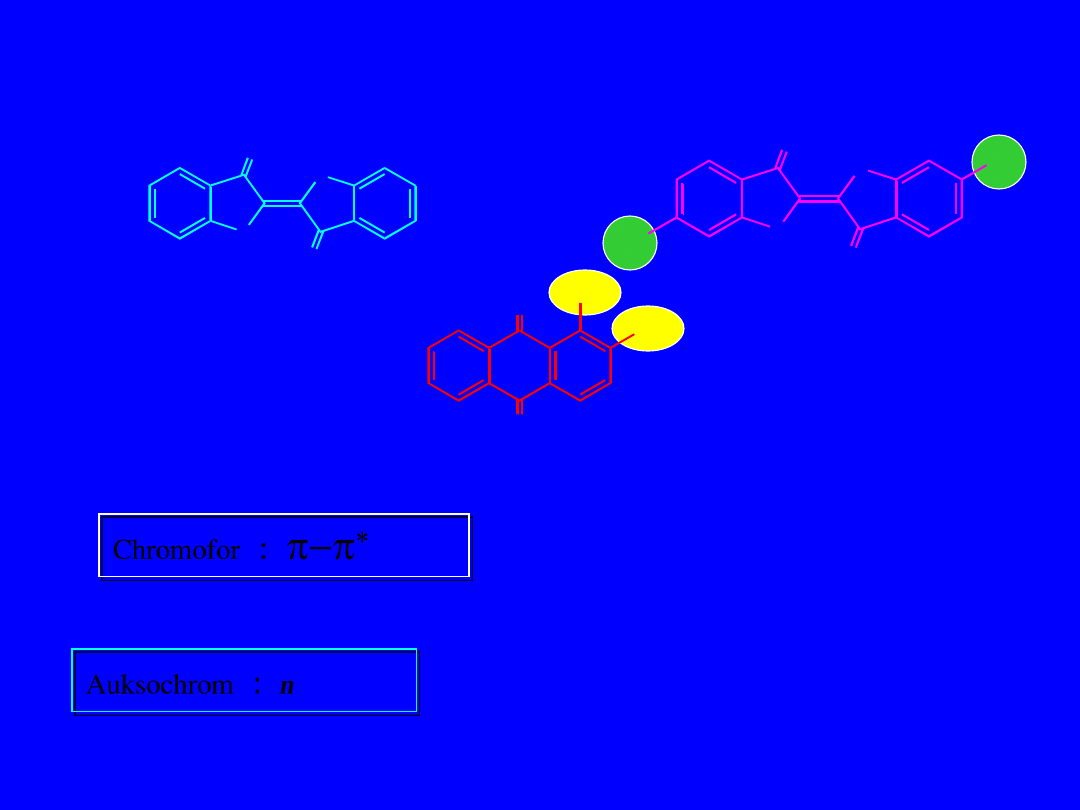
N
H
O
H
N
O
indygo
N
H
O
H
N
O
Br
Br
Purpura tyryjska
O
O
OH
OH
alizaryna
Chromofor :
p-p
*
Auksochrom : n
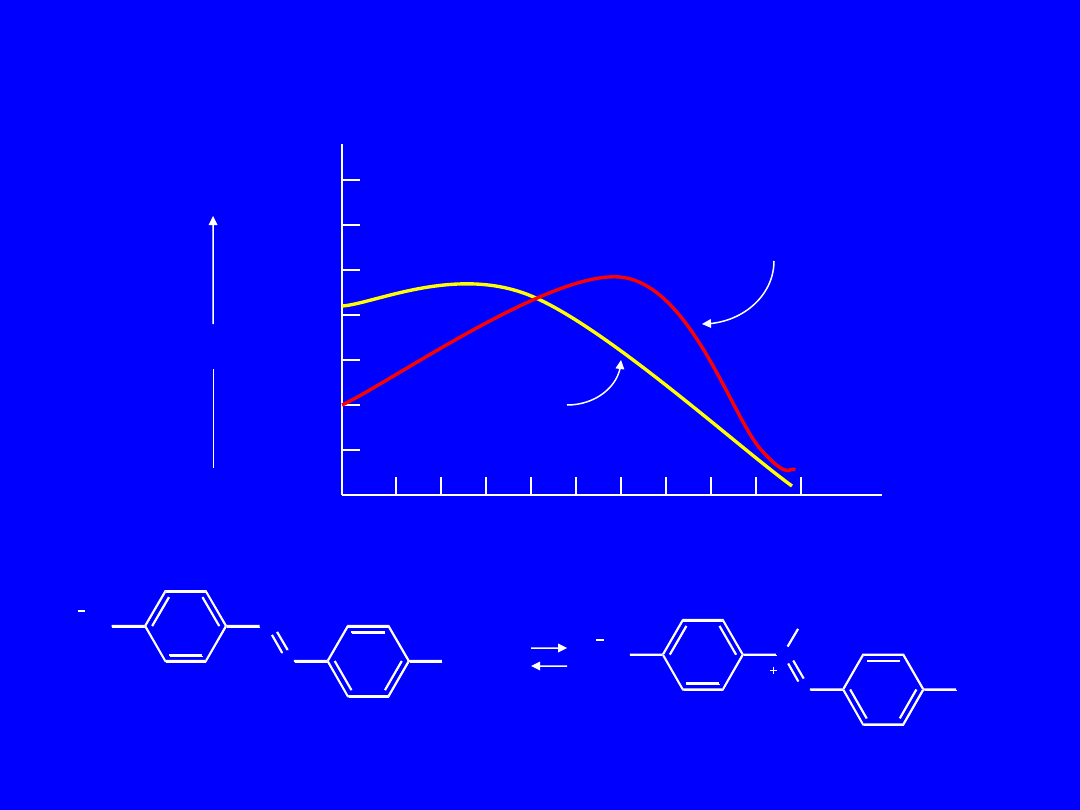
Wskaźniki kwasowo-zasadowe
400
500
600
2
3
4
5
nm
log
e
W kwasie
W zasadzie
N
N
N(CH
3
)
2
O
3
S
N
N
N(CH
3
)
2
O
3
S
H
Oraz metylowy
H
+
OH
-
Wyszukiwarka
Podobne podstrony:
biologia nmr id 87949 Nieznany
biologia pp o id 88225 Nieznany (2)
czynniki biologiczne 10 id 6672 Nieznany
biologia wyklady id 88204 Nieznany (2)
BIOLOGIA KOMORKI 2 id 87836 Nieznany
biologia ABCDE id 87704 Nieznany
Biologia Wyklad 9 id 88128 Nieznany (2)
Biologia nr 3(1) id 87951 Nieznany
Biologia Cwiczenia 4 id 87712 Nieznany (2)
Biologia Cwiczenia 8 id 87713 Nieznany (2)
biologia 2008 id 87683 Nieznany (2)
Biologia Cwiczenia 9 id 87714 Nieznany (2)
biologia mol id 87896 Nieznany
Biologia Wyklad 6 id 88126 Nieznany (2)
biologia molekularna id 87900 Nieznany (2)
biologia synteza id 88080 Nieznany
Biologia 10 id 87672 Nieznany
biologia nmr id 87949 Nieznany
więcej podobnych podstron