
Wyk
Wyk
ł
ł
ad 2
ad 2
• Koligatywne własno
ś
ci roztworów
• Osmoza
• Osmolalno
ść
• Równowaga chemiczna
• Dysocjacja
Rozpuszczalno
ść
, rozpuszczalniki

Wła
ś
ciwo
ś
ci koligatywne roztworów
Obecno
ść
substancji rozpuszczonej zmienia fizyczne
wła
ś
ciwo
ś
ci rozpuszczalnika. Wła
ś
ciwo
ś
ci, które zale
żą
od wzgl
ę
dnej liczby cz
ą
stek substancji rozpuszczanej, a
nie od ich chemicznej natury, nazywane s
ą
wła
ś
ciwo
ś
ciami koligatywnymi.
Rozpuszczalno
ść
, rozpuszczalniki

Wła
ś
ciwo
ś
ci koligatywne roztworów
•
wzgl
ę
dne obni
ż
enie pr
ęż
no
ś
ci pary nasyconej rozpuszczalnika nad
roztworem (prawo Raoulta)
•
obni
ż
enie temperatury krzepni
ę
cia roztworu wzgl
ę
dem temperatury
krzepni
ę
cia rozpuszczalnika (stała krioskopowa)
•
podwy
ż
szenie temperatury wrzenia roztworu wzgl
ę
dem temperatury
wrzenia rozpuszczalnika (stała ebulioskopowa)
•
tendencja rozpuszczalnika do przenikania przez membran
ę
do
roztworu - ci
ś
nienie osmotyczne
Rozpuszczalno
ść
, rozpuszczalniki

Wzgl
ę
dne obni
ż
enie pr
ęż
no
ś
ci pary nasyconej
rozpuszczalnika nad roztworem - prawo Raoulta
Rozpuszczalno
ść
, rozpuszczalniki
http://www.sparknotes.com/chemistry/solutions/colligative/section1.rhtml
Na powierzchni czystego rozpuszczalnika
wyst
ę
puje wi
ę
cej cz
ą
steczek tego
rozpuszczalnika ni
ż
na powierzchni
roztworu. Dlatego w czystym
rozpuszczalniku jest bardziej
prawdopodobne,
ż
e cz
ą
steczki
rozpuszczalnika uciekn
ą
do fazy gazowej w
porównaniu do roztworu. St
ą
d roztwór
charakteryzuje si
ę
ni
ż
sz
ą
pr
ęż
no
ś
ci
ą
pary
rozpuszczalnika ni
ż
czysty rozpuszczalnik.

Słone jeziora paruj
ą
wolniej ni
ż
jeziora słodkowodne.
Rozpuszczalno
ść
, rozpuszczalniki
Wzgl
ę
dne obni
ż
enie pr
ęż
no
ś
ci pary nasyconej
rozpuszczalnika nad roztworem - prawo Raoulta
kolumber.pl
http://pl.wikipedia.org/wiki/Plik:Skalnemiasto1.jpg
Podwy
ż
szenie temperatury wrzenia
Rozpuszczalno
ść
, rozpuszczalniki
http://hyperphysics.phy-astr.gsu.edu/hbase/kinetic/vappre.html
http://library.thinkquest.org/C006669/data/Chem/colligative/colligative.html
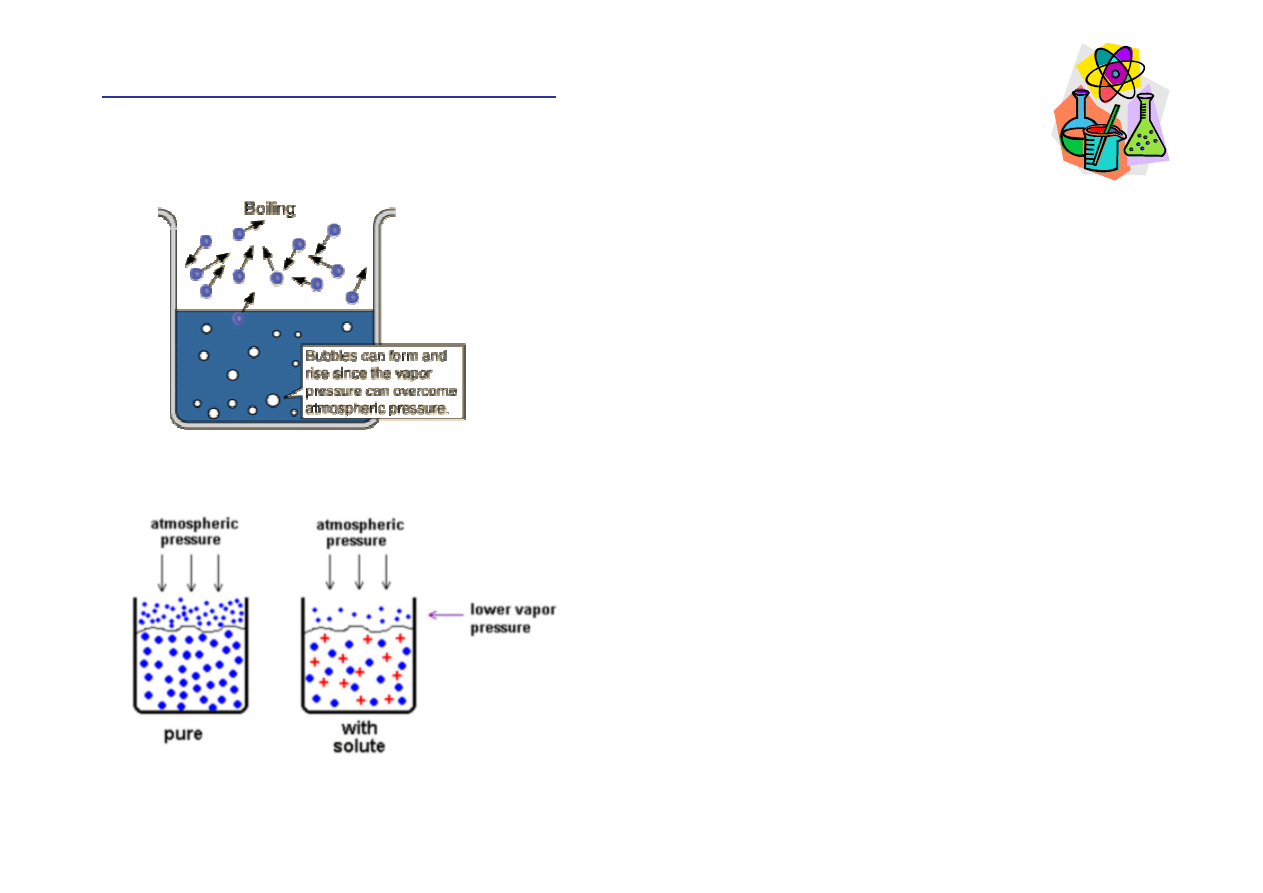
W temperaturze wrzenia dla danego
rozpuszczalnika pr
ęż
no
ść
pary tego
rozpuszczalnika jest równa ci
ś
nieniu
atmosferycznemu. W przypadku roztworu,
w tej samej temperaturze pr
ęż
no
ść
pary
rozpuszczalnika jest ni
ż
sza od ci
ś
nienia
atmosferycznego i roztwór nie wrze.
Dlatego, w porównaniu z czystym
rozpuszczalnikiem, aby doprowadzi
ć
roztwór do wrzenia, potrzebna jest wy
ż
sza
temperatura.
Obni
ż
enie temperatury krzepni
ę
cia
Rozpuszczalno
ść
, rozpuszczalniki
http://www.scienceiscool.org/solutions/fpdepression.html
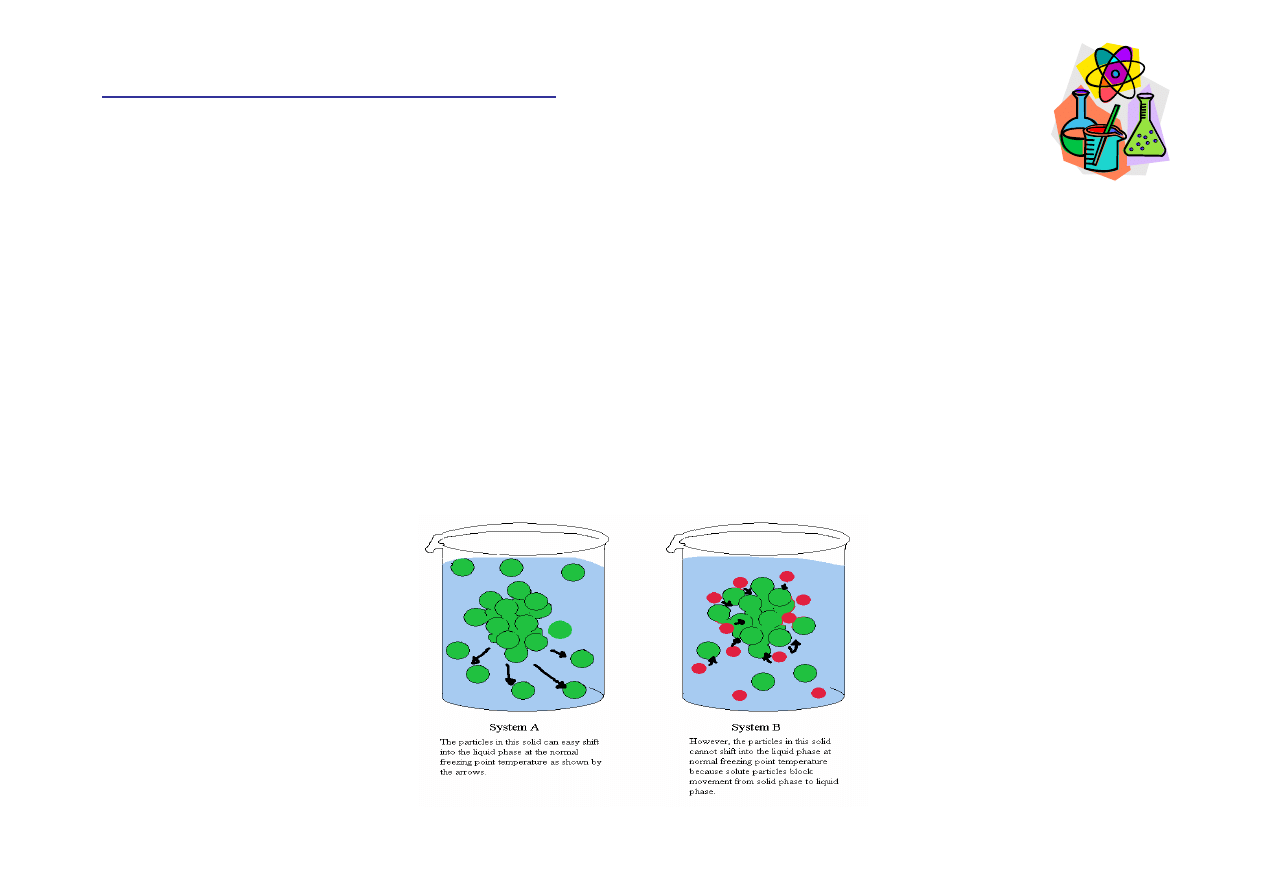
Temperatura krzepni
ę
cia roztworu jest ni
ż
sza od temperatury
krzepni
ę
cia czystego rozpuszczalnika. Cz
ą
steczki substancji
rozpuszczonej przeszkadzaj
ą
w tworzeniu uporz
ą
dkowanej
struktury lodu. Im wy
ż
sze st
ęż
enie roztworu, tym ni
ż
sza
temperatura krzepni
ę
cia.

Obni
ż
enie temperatury krzepni
ę
cia
Owady i ryby
ż
yj
ą
ce w klimacie okołobiegunowym kontroluj
ą
tworzenie lodu poprzez wytwarzanie biologicznych substancji
zapobiegaj
ą
cych zamra
ż
aniu. Niektóre owady mog
ą
przetrwa
ć
temperatur
ę
poni
ż
ej -60°C, np. chrz
ą
szcz Alaskan darkling
beetle, który produkuje ksylomannan (polimer zawieraj
ą
cy
ksyloz
ę
i mannoz
ę
)
Rozpuszczalno
ść
, rozpuszczalniki
http://www.asknature.org/strategy/5797e8c7e111f7a085a852790a37d02f

Obni
ż
enie temperatury krzepni
ę
cia
Rozpuszczalno
ść
, rozpuszczalniki
http://www.kdlt.com/index.php?option=com_content&task=view&id=7284&Itemid=122
dziennikpolski24.pl
Posypywanie sol
ą
nawierzchni dróg i chodników w
temperaturze poni
ż
ej 0°C.
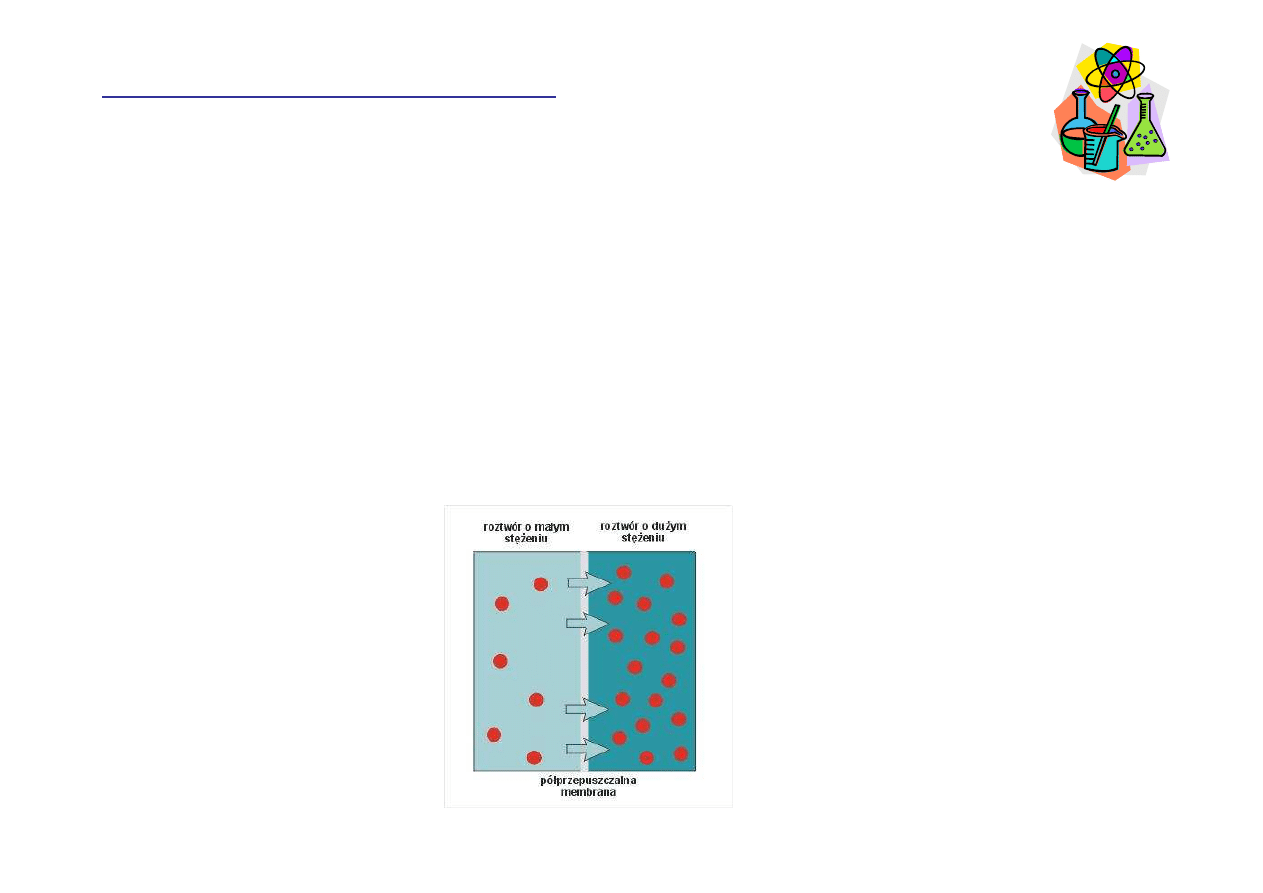
Osmoza
Przepływ rozpuszczalnika przez membran
ę
(błon
ę
)
półprzepuszczaln
ą
rozdzielaj
ą
c
ą
dwa roztwory o ró
ż
nym
st
ęż
eniu. Osmoza spontanicznie zachodzi od roztworu o
ni
ż
szym st
ęż
eniu substancji rozpuszczonej do roztworu o
wy
ż
szym st
ęż
eniu substancji rozpuszczonej.
Rozpuszczalno
ść
, rozpuszczalniki
http://www.zeglarstwo.sail-ho.pl/faqw/osmoza/osmoza.html

Osmoza
Woda przemieszcza si
ę
z miejsca, gdzie jej st
ęż
enie jest wy
ż
sze do
miejsca o ni
ż
szym st
ęż
eniu.
Rozpuszczalno
ść
, rozpuszczalniki
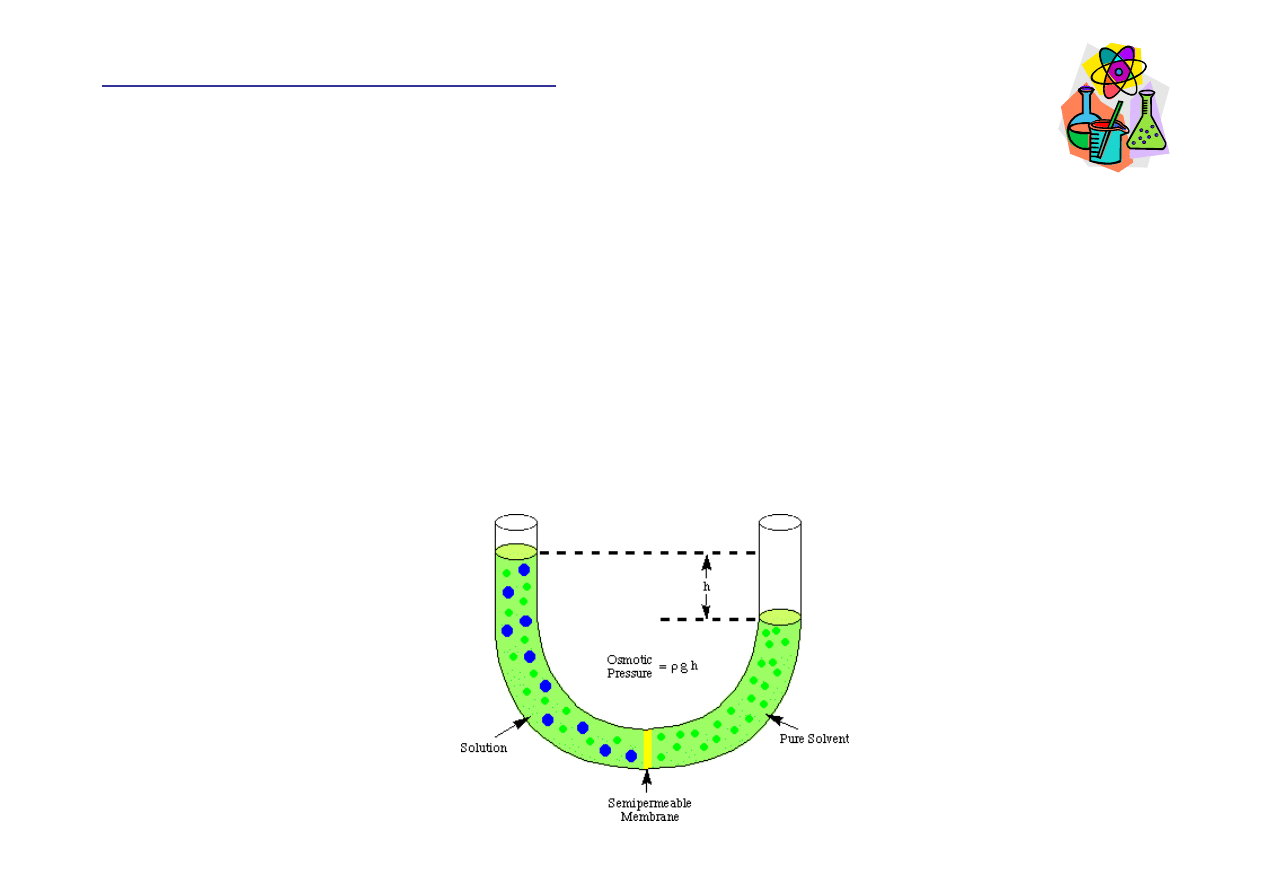
Ci
ś
nienie osmotyczne
Przepływ rozpuszczalnika przez błon
ę
półprzepuszczaln
ą
powoduje wzrost
obj
ę
to
ś
ci po stronie roztworu. Proces ten trwa do momentu, kiedy ró
ż
nica
wysoko
ś
ci słupa cieczy stanie si
ę
na tyle du
ż
a,
ż
e powstałe ci
ś
nienie
hydrostatyczne zatrzyma przepływ rozpuszczalnika przez błon
ę
.
Ci
ś
nienie niezb
ę
dne do zatrzymania przepływu rozpuszczalnika jest
nazywane ci
ś
nieniem osmotycznym.
Rozpuszczalno
ść
, rozpuszczalniki
http://www.sparknotes.com/chemistry/solutions/colligative/section1.rhtml

Ci
ś
nienie osmotyczne
Ci
ś
nienie osmotyczne zapobiega przepływowi dodatkowej ilo
ś
ci wody
do bardziej st
ęż
onego roztworu i zale
ż
y od st
ęż
enia substancji
rozpuszczonej w roztworze.
П
= iC
m
RT
П
– ci
ś
nienie osmotyczne (Pa)
i – bezwymiarowy współczynnik van’t Hoff’a (i=1 dla zwi
ą
zków, które nie
ulegaj
ą
dysocjacji)
C
m
– st
ęż
enie molowe (mol/L)
R – stała gazowa (0.08205746 L atm K
-1
mol
-1
)
T – temperatura (K)
Rozpuszczalno
ść
, rozpuszczalniki
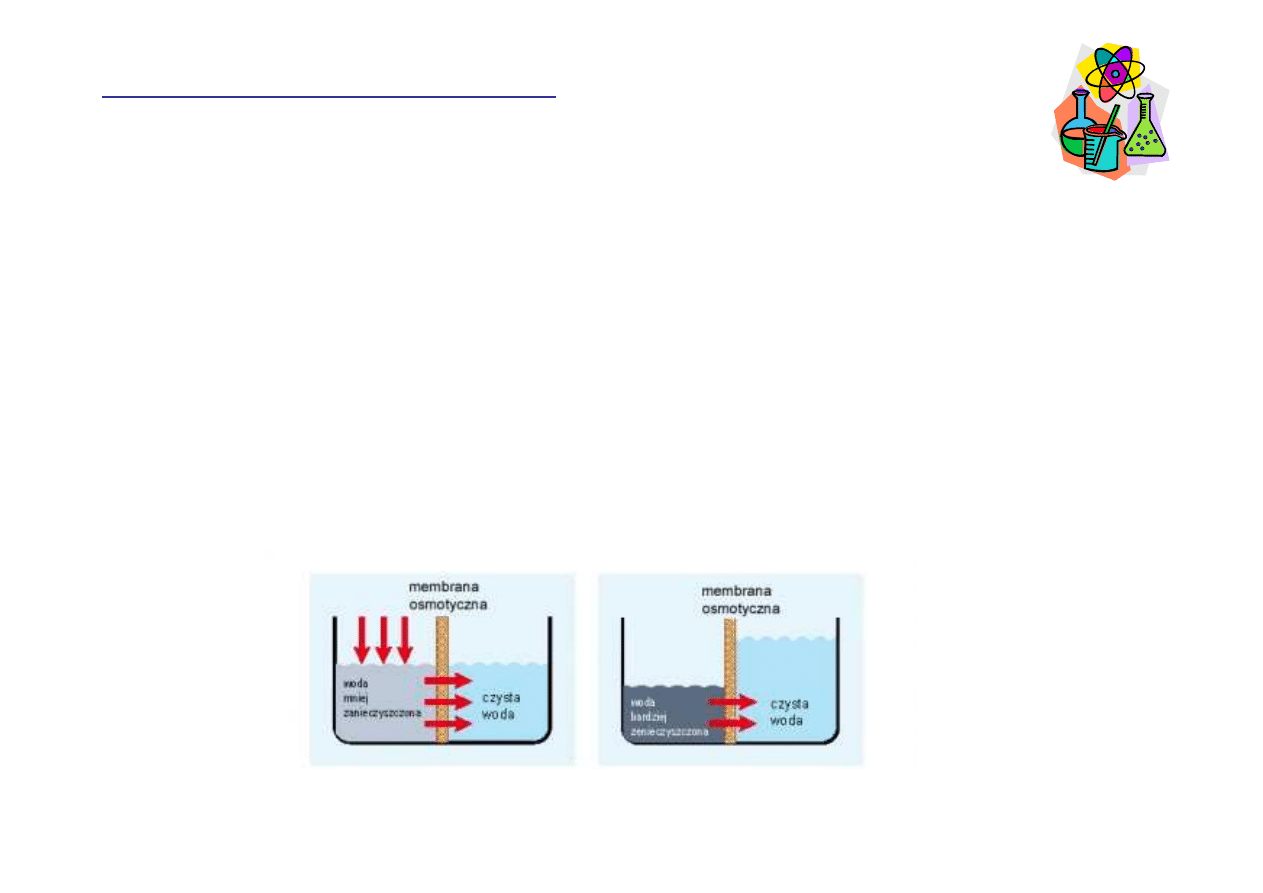
Odwrócona osmoza
Przyło
ż
enie ci
ś
nienia o warto
ś
ci wy
ż
szej ni
ż
ci
ś
nienie
osmotyczne powoduje odwrócenie przepływu wody, która
płynie z obszaru o ni
ż
szym st
ęż
eniu wody do obszaru o
wy
ż
szym st
ęż
eniu wody.
Rozpuszczalno
ść
, rozpuszczalniki
http://www.ewoda.pl/strona.php?25853

Odwrócona osmoza jest wykorzystywana do odsalania wody
morskiej, główn
ą
zalet
ą
tej metody jest stosunkowo małe
zu
ż
ycie energii, gdy
ż
proces zachodzi bez przemiany
fazowej. W zakładach odsalaj
ą
cych woda morska jest w
sposób ci
ą
gły poddawana ci
ś
nieniu, a czysta woda zbierana.
Rozpuszczalno
ść
, rozpuszczalniki
Zakłady odsalania wody morskiej Shuaiba, Arabia Saudyjska
http://kanat.jsc.vsc.edu/student/glowact/body.htm

Oblicz ci
ś
nienie osmotyczne roztworu przygotowanego
poprzez rozpuszczenie 13.65 g sacharozy (C
12
H
22
O
11
) w
odpowiedniej ilo
ś
ci wody, tak aby otrzyma
ć
250 ml roztworu
w temp. 25 °C?
Π
= iC
m
RT
П
– ci
ś
nienie osmotyczne (Pa)
i – bezwymiarowy współczynnik van’t Hoff’a (i=1 dla zwi
ą
zków,
które nie ulegaj
ą
dysocjacji)
C
m
– st
ęż
enie molowe (mol/L)
R – stała gazowa (0.08205746 L atm K
-1
mol
-1
)
T – temperatura (K)
Rozpuszczalno
ść
, rozpuszczalniki

Krok 1: obliczenie st
ęż
enia molowego sacharozy
Masa molowa sacharozy
12 x (12 g/mol) + 22 x (1g/mol) + 11 x (16g/mol) = 342g/mol
n
sacharozy
= 13.65 g x 1 mol/342 g
n
sachrozy
= 0.04 mola
C
M
sacharozy = n
sacharozy
/obj
ę
to
ść
roztworu
C
M
sacharozy = 0.04 mola/0.25l
C
M
sacharozy = 0.16 mola/l
Krok 2: obliczenie temperatury w K
T = °C + 273
T = 25 + 273
T = 298 K
Rozpuszczalno
ść
, rozpuszczalniki

Krok 3: Okre
ś
lenie współczynnika van 't Hoff’a
sacharoza nie dysocjuje w wodzie, st
ą
d współczynnik van 't
Hoff’a i = 1
Krok 4: Obliczenie ci
ś
nienia osmotycznego
Π
= iC
m
RT
Π
= 1 x 0.16 mol/L x 0.08206 L·atm/mol·K x 298 K
Π
= 3.9 atm
Odpowied
ź
:
Ci
ś
nienie osmotyczne roztworu sacharozy* wynosi 3.9 atm.
* 1 ły
ż
eczka cukru – 5 g, szklanka – 250 ml wody
2.73 ły
ż
eczki cukru w szklance wody
Rozpuszczalno
ść
, rozpuszczalniki

Osmolalno
ść
• Miar
ą
aktywno
ś
ci osmotycznej roztworu jest osmolalno
ść
,
która jest równa iloczynowi liczby moli substancji
rozpuszczonej i liczby cz
ą
stek (i) powstałych w wyniku
dysocjacji w 1 kg rozpuszczalnika (wody).
osmolalno
ść
= C
m
× i
• Jednostk
ą
jest 1 osmol (Osm), czyli aktywno
ść
osmotyczna roztworu, który zawiera 1 mol substancji nie
dysocjuj
ą
cej lub jonów w 1 kg wody.
Rozpuszczalno
ść
, rozpuszczalniki

Osmolalno
ść
• Cz
ę
sto zamiast osmoli u
ż
ywane s
ą
jednostki 1000-krotnie
mniejsze, czyli miliosmole (mOsm/kg), odpowiadaj
ą
ce
st
ęż
eniu wyra
ż
onemu w milimolach/kg wody.
• Je
ż
eli roztwór zawiera kilka ró
ż
nych składników, jego
osmolalno
ść
jest sum
ą
osmolalno
ś
ci poszczególnych
składowych.
• Roztwory o tej osmolalno
ś
ci wykazuj
ą
to samo ci
ś
nienie
osmotyczne.
Rozpuszczalno
ść
, rozpuszczalniki

Osmolalno
ść
Je
ż
eli po obu stronach półprzepuszczalnej membrany
mamy roztwory o ró
ż
nych osmolalno
ś
ciach, woda b
ę
dzie
przepływała z roztworu o ni
ż
szej osmolalno
ś
ci do roztworu
o wy
ż
szej osmolalno
ś
ci.
Osmolalno
ść
osocza u ludzi dorosłych wynosi 275–300
Mosm/kg wody.
Osmolalno
ść
płynów ustrojowych oznacza si
ę
instrumentalnie za pomoc
ą
osmometru poprzez pomiar
obni
ż
enia temperatury krzepni
ę
cia roztworu w porównaniu
z czyst
ą
wod
ą
.
Rozpuszczalno
ść
, rozpuszczalniki

Osmolalno
ść
– przykład oblicze
ń
Wodne roztwory - NaCl o st
ęż
eniu 0.50 M oraz Ca(NO
3
)
2
o
st
ęż
eniu 0.30 M umieszczono po dwóch stronach
półprzepuszczalnej membrany. Oblicz osmolalno
ść
ka
ż
dego z
roztworów oraz kierunek przepływu wody.
NaCl dysocjuje na dwa jony — Na
+
i Cl
−
osmolalno
ść
(NaCl) = 0.50 M × 2 = 1.0 Osm
Ca(NO
3
)
2
dysocjuje na trzy jony — jeden Ca
2+
i dwa NO
3
−
osmolalno
ść
[Ca(NO
3
)
2
] = 0.30 M × 3 = 0.90 Osm
Osmolalno
ść
roztworu Ca(NO
3
)
2
jest ni
ż
sza od roztworu NaCl,
woda b
ę
dzie wi
ę
c przepływała przez membran
ę
z roztworu
Ca(NO
3
)
2
do roztworu NaCl.
Rozpuszczalno
ść
, rozpuszczalniki

Osmoza – znaczenie w biologii
Zjawisko osmozy jest niezwykle wa
ż
ne w biochemii,
biologii i medycynie. W zasadzie ka
ż
da bariera, która
oddziela organizm b
ą
d
ź
komórk
ę
od otoczenia
zachowuje si
ę
jak półprzepuszczalna membrana, przez
któr
ą
swobodnie mo
ż
e przepływa
ć
woda, natomiast
substancje rozpuszczone nie mog
ą
jej pokona
ć
.
Rozpuszczalno
ść
, rozpuszczalniki

Osmoza – znaczenie w biologii
• Biologiczne błony komórkowe działaj
ą
jak błony
półprzepuszczalne.
• Substancje rozpuszczone w płynach ustrojowych (krew,
osocze) wywieraj
ą
ci
ś
nienie osmotyczne.
• Roztwory izotoniczne wywieraj
ą
to samo ci
ś
nienie
osmotyczne co krew.
Rozpuszczalno
ść
, rozpuszczalniki
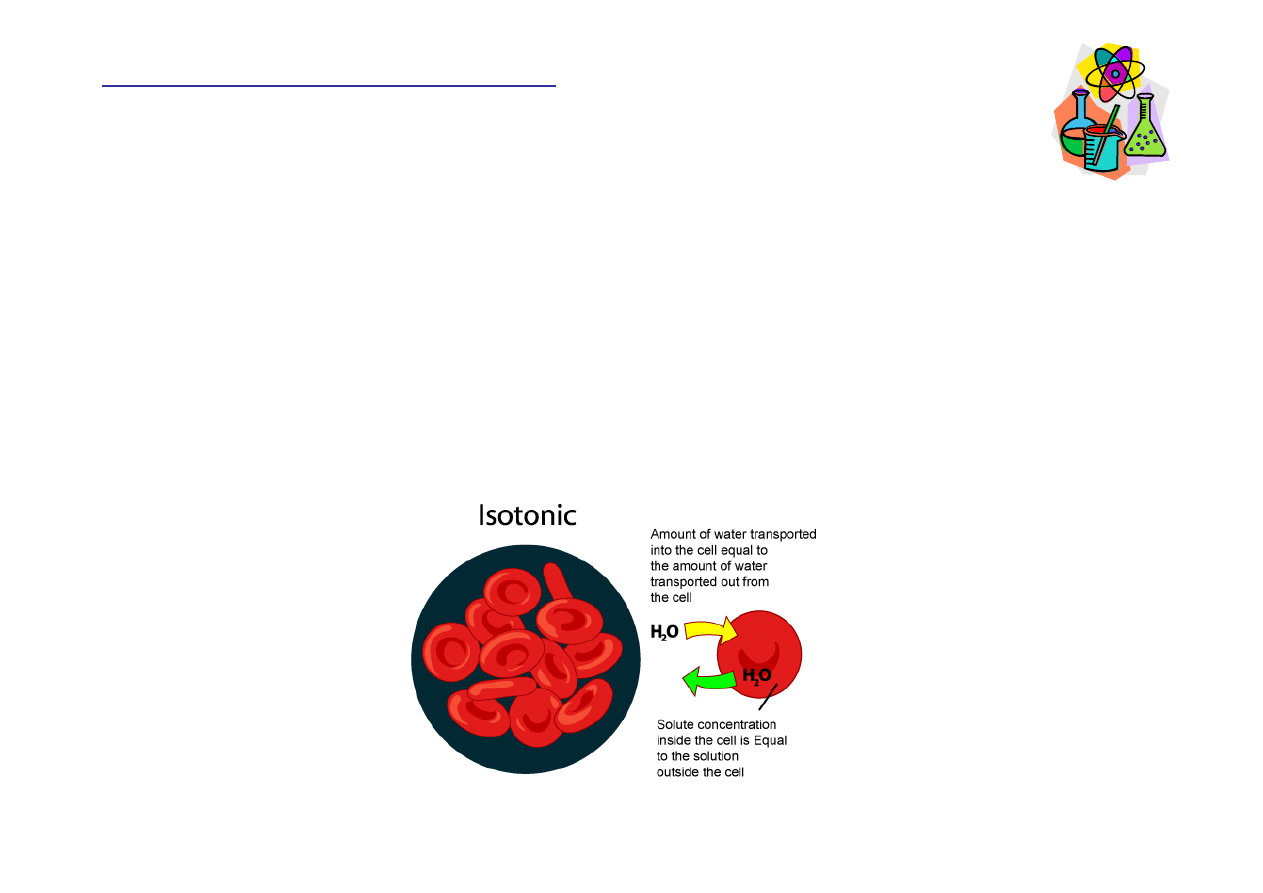
Roztwory izotoniczne
Roztwory izotoniczne to 0.9% (m/v) roztwór NaCl i 5% (m/v)
roztwór glukozy – oba roztwory maj
ą
to samo st
ęż
enie
molowe 0.3 M (jony Na
+
i Cl
-
albo cz
ą
steczki glukozy).
Je
ż
eli komórka znajduje si
ę
w roztworze izotonicznym
przepływ wody do i z komórki jest równy.
Rozpuszczalno
ść
, rozpuszczalniki
http://spmbiology403.blogspot.com/2008/08/types-of-solution-isotonic.html
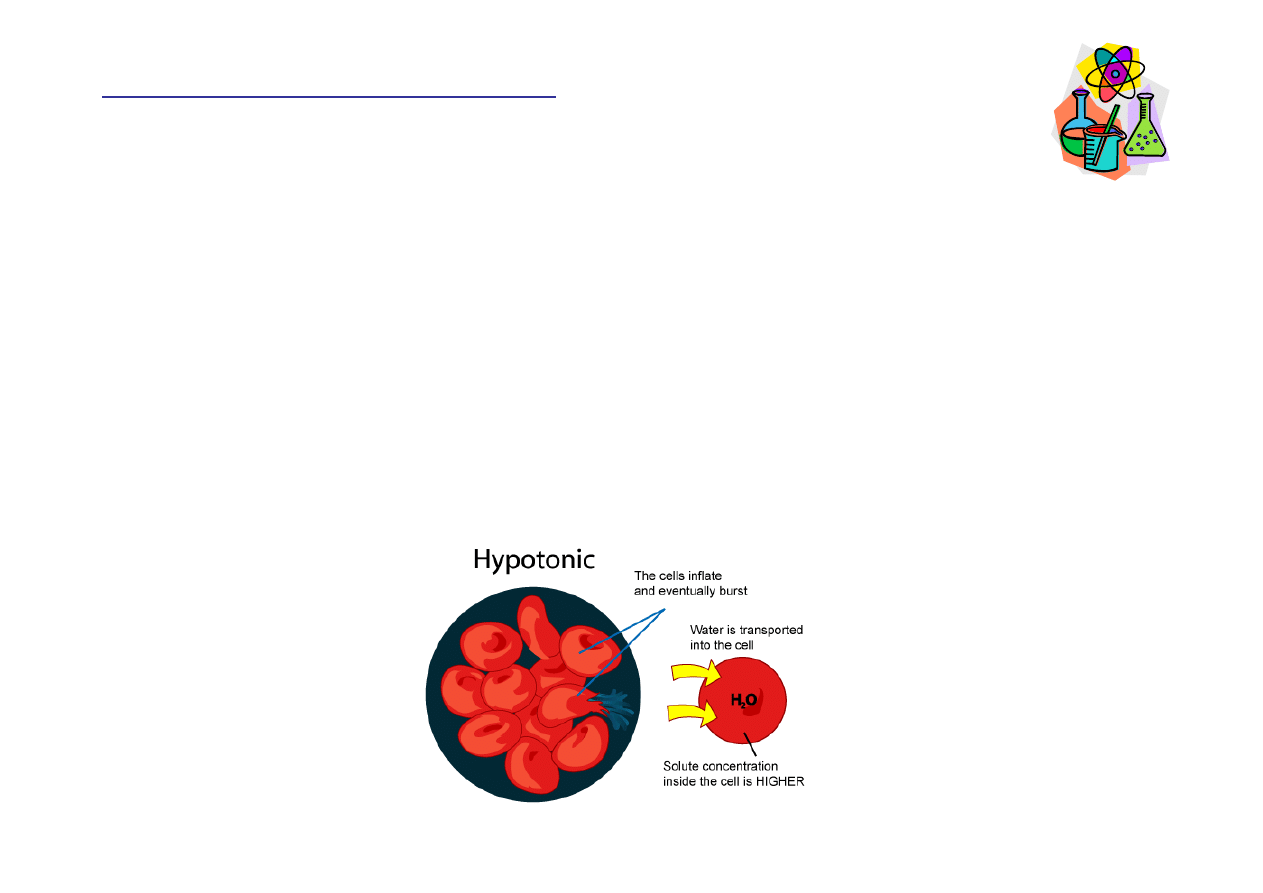
Roztwór hipotoniczny
Roztwór hipotoniczny cechuje si
ę
ni
ż
szym st
ęż
eniem
substancji rozpuszczonej ni
ż
to, które jest wewn
ą
trz
komórki. Je
ś
li umie
ś
cimy w nim komórk
ę
, woda b
ę
dzie
napływa
ć
do jej wn
ę
trza, powoduj
ą
c jej p
ę
cznienie, a
nawet p
ę
kanie (hemoliza w przypadku erytrocytów).
http://spmbiology403.blogspot.com/2008/08/types-of-solution-isotonic.html
Rozpuszczalno
ść
, rozpuszczalniki
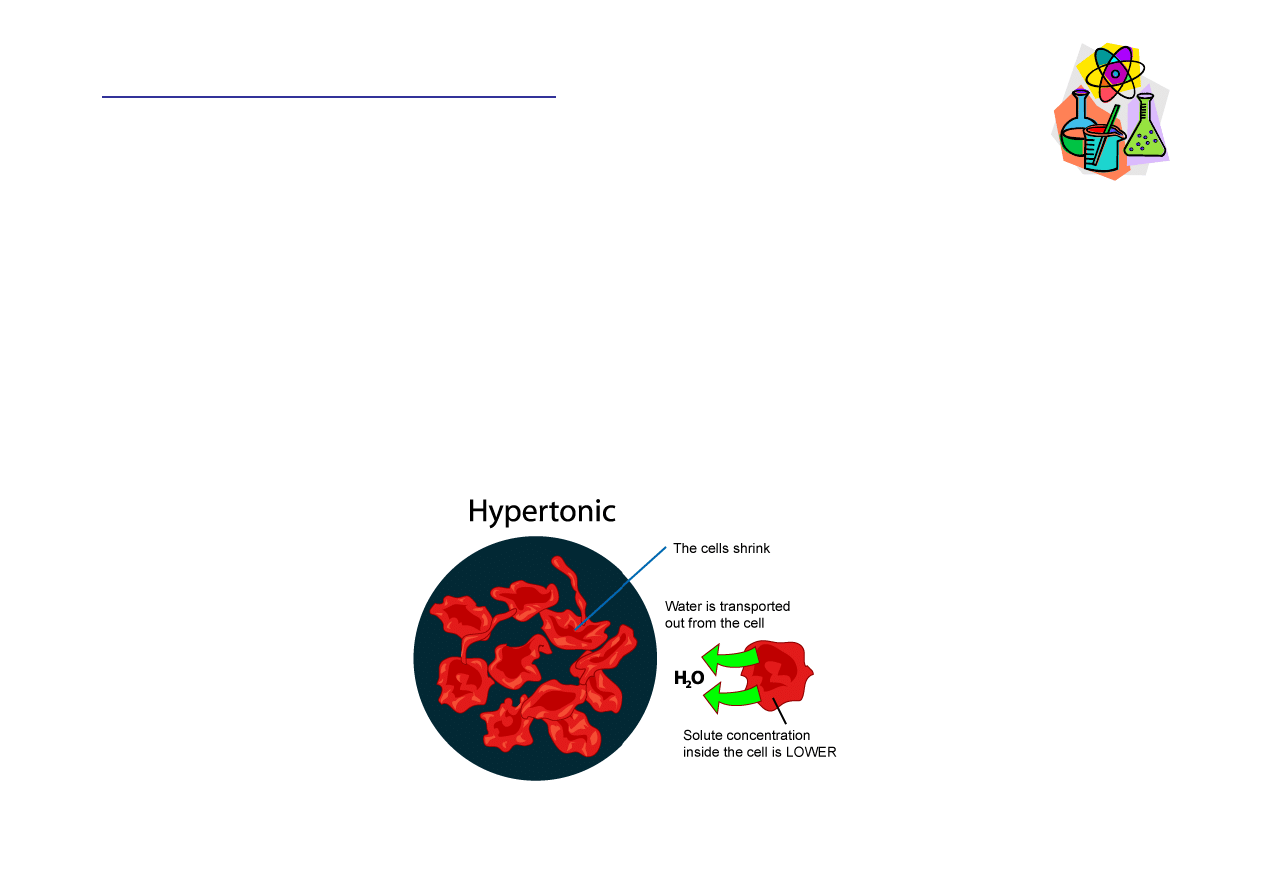
Roztwór hipertoniczny
Roztwór hipertoniczny cechuje si
ę
wy
ż
szym st
ęż
eniem
substancji rozpuszczonej ni
ż
to, które jest wewn
ą
trz
komórki. Je
ś
li umie
ś
cimy w nim komórk
ę
, woda b
ę
dzie
wypływa
ć
z jej wn
ę
trza, powoduj
ą
c obkurczanie.
Rozpuszczalno
ść
, rozpuszczalniki
http://spmbiology403.blogspot.com/2008/08/types-of-solution-isotonic.html
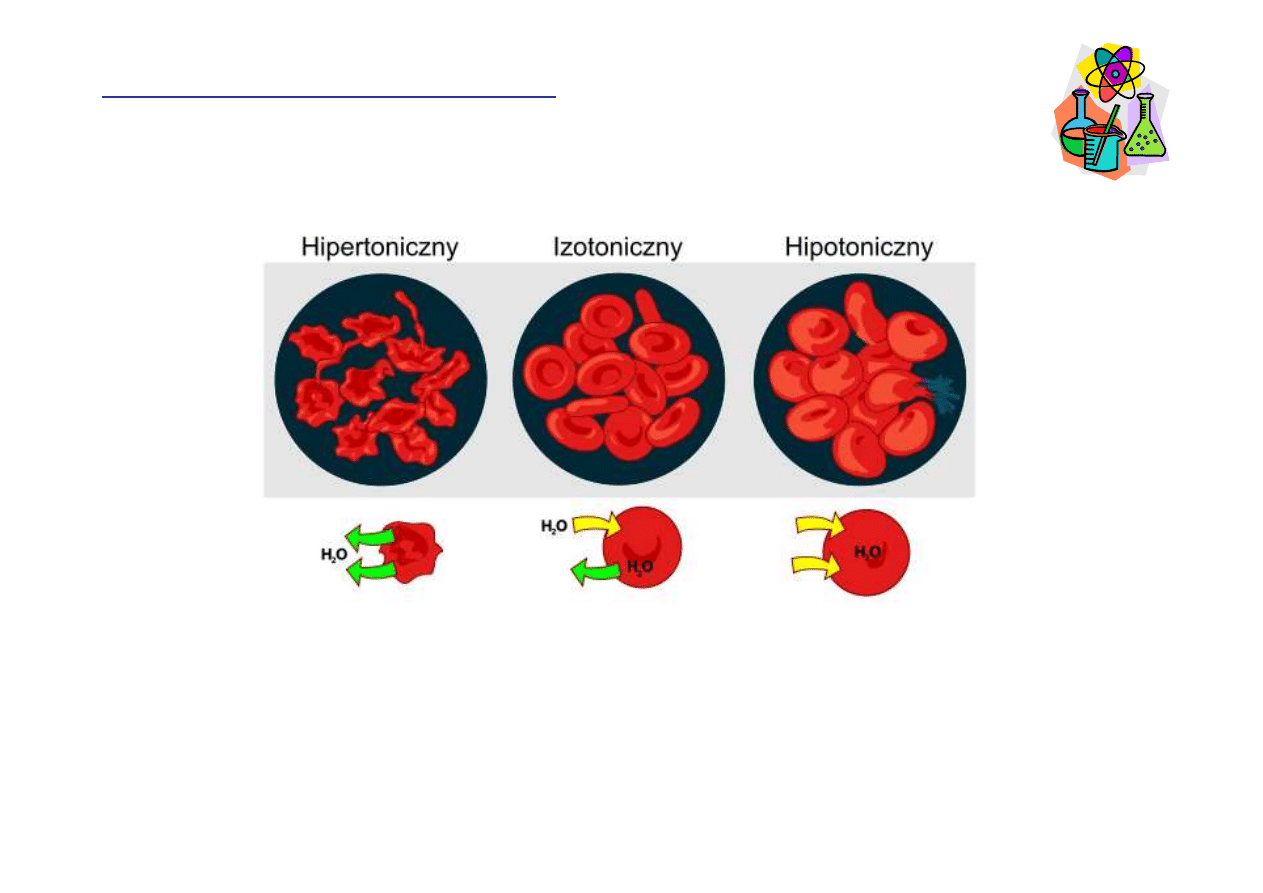
Rozpuszczalno
ść
, rozpuszczalniki
http://pl.wikipedia.org/wiki/Plik:Osmotic_pressure_on_blood_cells_diagram_pl.svg

Ci
ś
nienie osmotyczne w układach biologicznych - obliczenia
Rozpuszczalno
ść
, rozpuszczalniki
Oblicz jak
ą
mas
ę
glukozy (C
6
H
12
O
6
) nale
ż
y rozpu
ś
ci
ć
w 1 litrze
wody, aby uzyska
ć
roztwór przeznaczony do do
ż
ylnej kroplówki –
o takim samym ci
ś
nieniu osmotycznym jak krew - 7.65 atm w
temp. 37°C ?
Π
= iC
m
RT
Krok 1: Obliczenie warto
ś
ci czynnika van 't Hoffa
Glukoza nie dysocjuje
→
i=1
Krok 2: Obliczenie temperatury
T = °C + 273
T = 37 + 273
T = 310 K

Ci
ś
nienie osmotyczne w układach biologicznych - obliczenia
Rozpuszczalno
ść
, rozpuszczalniki
Krok 3: Obliczenie st
ęż
enia molowego glukozy
Π
= iC
m
RT
C
m
=
Π
/iRT
C
m
= 7.65 atm/(1)(0.08206 L·atm/mol·K)(310)
C
m
= 0.301 mol/L
Krok 4: Obliczenie ilo
ś
ci glukozy
C
m
= n/V
n = C
m
·V
n = 0.301 mola/L x 1 L
n = 0.301 mola
masa molowa glukozy = 180 g/mol
masa glukozy = 0.301 mol x 180 g/1 mol = 54.1 g
Odp. Aby otrzyma
ć
roztwór przeznaczony do do
ż
ylnej kroplówki – o takim
samym ci
ś
nieniu osmotycznym jak krew (7.65 atm w temp. 37°C) nale
ż
y
rozpu
ś
ci
ć
54.1 g glukozy w 1 litrze wody.
Ci
ś
nienie osmotyczne – dlaczego nie nale
ż
y pi
ć
wody
morskiej?
Rozpuszczalno
ść
, rozpuszczalniki
Osmolalno
ść
wody morskiej jest około
trzy razy wy
ż
sza od osmolalno
ś
ci płynów
w naszym ciele. Niewielkie ilo
ś
ci wypitej
wody morskiej nie s
ą
szkodliwe dla
człowieka, jednak picie wody aby
zapobiec odwodnieniu jest nie tylko
szkodliwe, ale i bezcelowe. Woda z
komórek naszego ciała b
ę
dzie
wypływa
ć
, tak aby rozcie
ń
czy
ć
wchłoni
ę
ta wod
ę
morsk
ą
. W efekcie
spo
ż
ycie wody morskiej tylko
przyspiesza proces odwodnienia.
http://dc718.4shared.com/doc/HEK5xqDe/preview.html
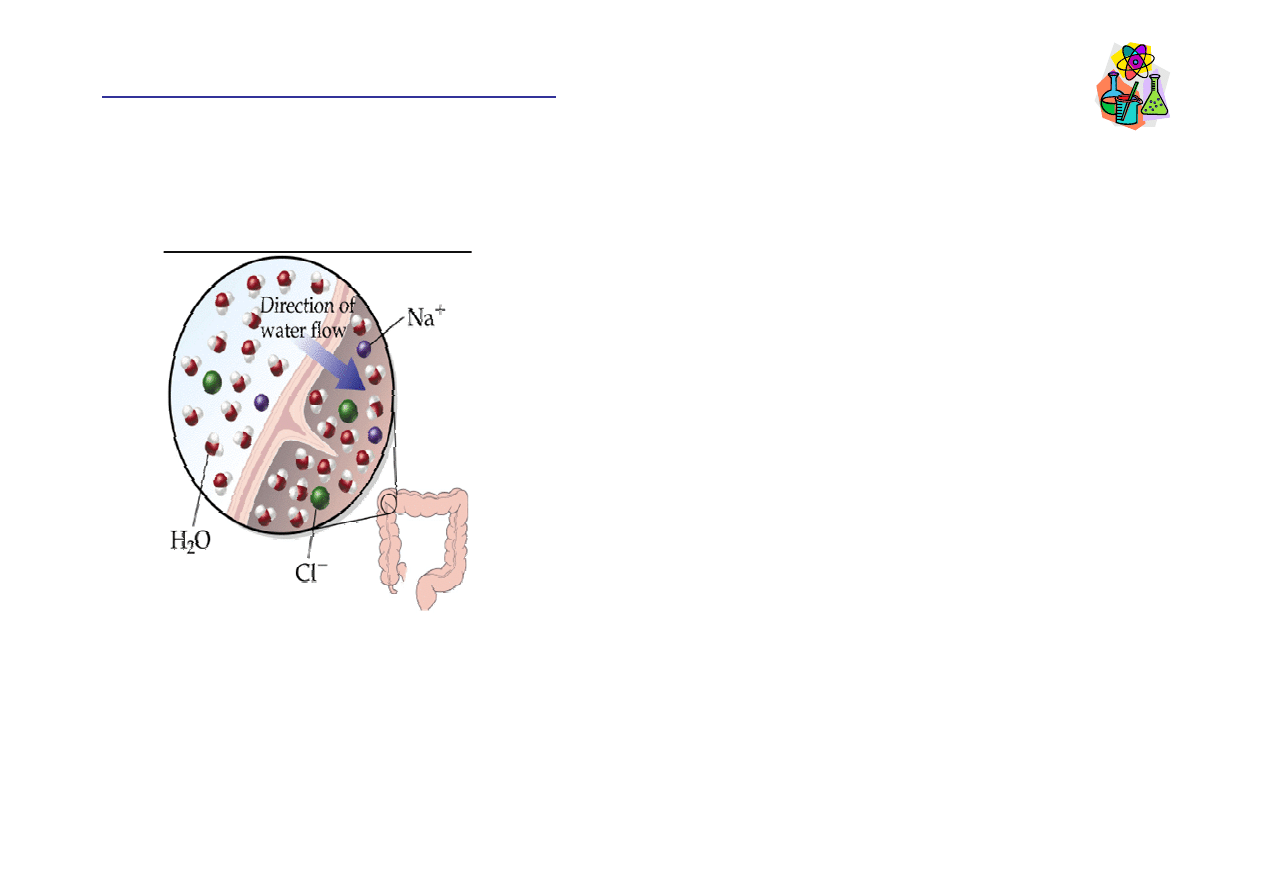
Dializa
Półprzepuszczalna membrana
(membrana dializacyjna)
posiada małe otwory, przez
które mog
ą
przenika
ć
cz
ą
steczki rozpuszczalnika,
jony, sole nieorganiczne,
mocznik, zatrzymuje za
ś
du
ż
e
cz
ą
steczki (np. białka).
Rozpuszczalno
ść
, rozpuszczalniki
http://en.wikipedia.org/wiki/Dialysis_(biochemistry)
Dializa
Rozpuszczalno
ść
, rozpuszczalniki
http://www.gujaratkidneyfoundation.com/dialysis.html
Utrzymywanie równowagi biochemicznej oraz wodno-elektrolitowej w
ludzkim organizmie jest w olbrzymim stopniu zale
ż
ne od
prawidłowej pracy nerek. Płyny ustrojowe s
ą
dializowane przez
membrany w nerkach. Osoby z chorymi nerkami musz
ą
u
ż
ywa
ć
sztucznej nerki, która oczyszcza krew poprzez proces hemodializy.
http://www.shodor.org/master/biomed/physio/dialysis/hemodialysis/sixa.htm
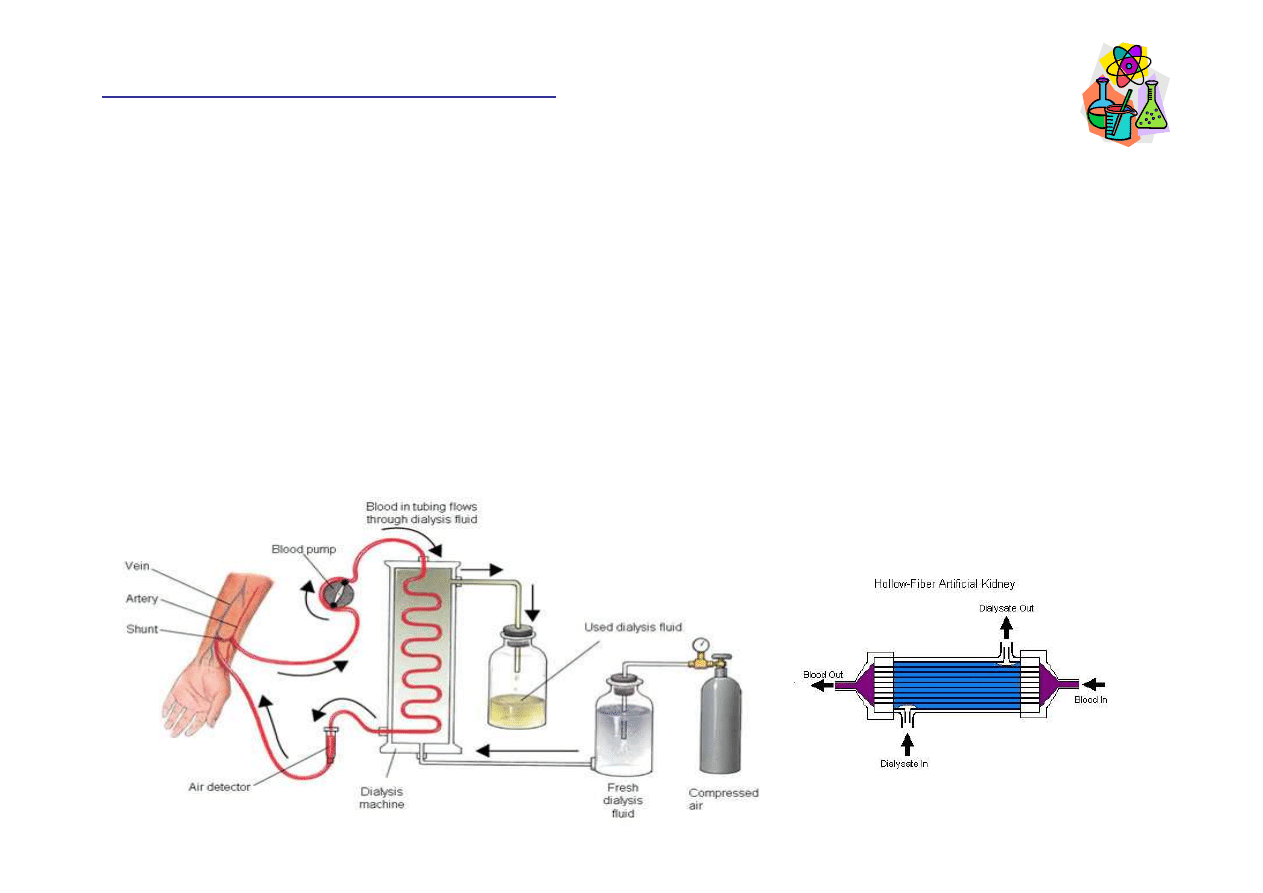
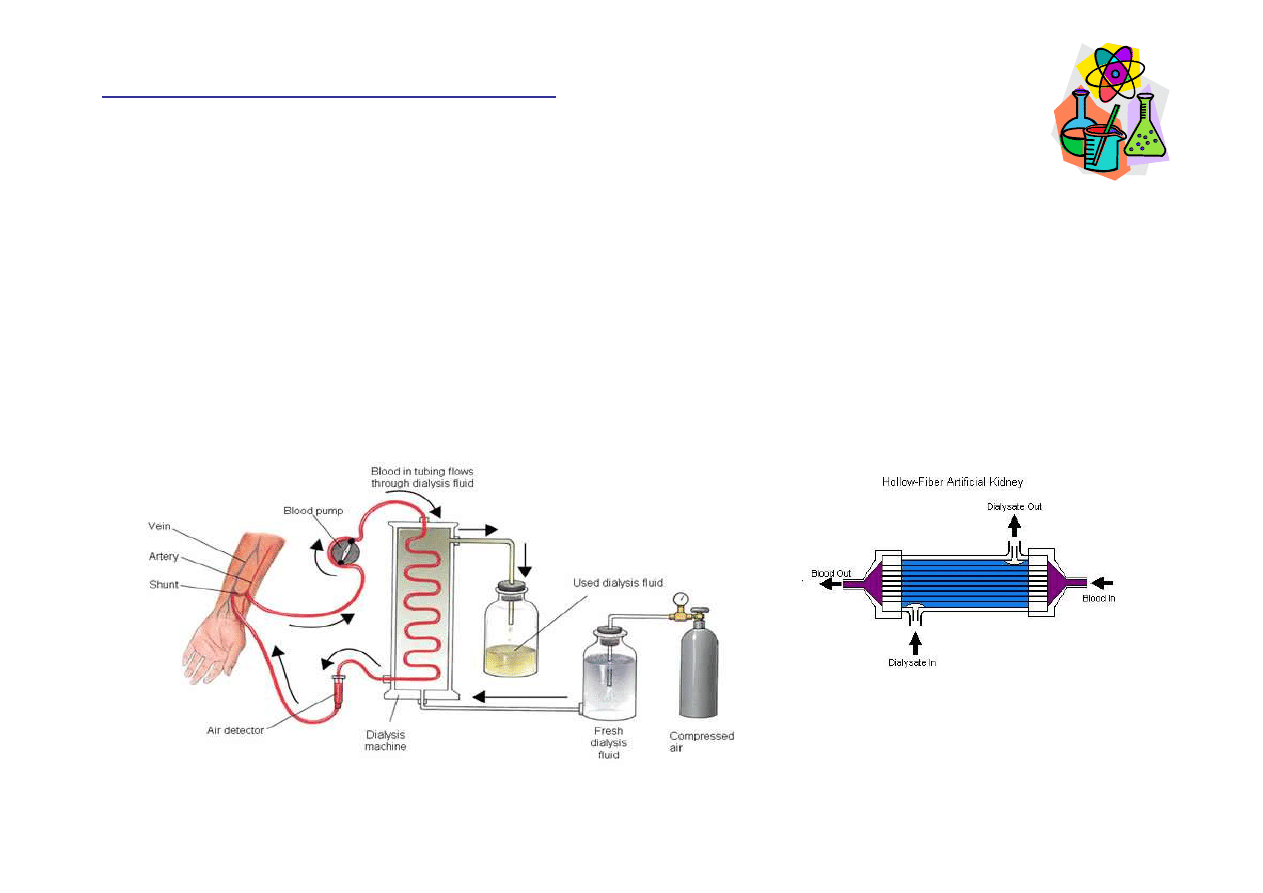
Hemodializa
Rozpuszczalno
ść
, rozpuszczalniki
http://www.gujaratkidneyfoundation.com/dialysis.html
Dializator to tysi
ą
ce bardzo cienkich rurek zbudowanych z półprzepuszczalnej
membrany, którymi płynie krew chorego. Wokół rurek przepływa sterylny płyn
dializacyjny (wodny roztwór zawieraj
ą
cy glukoz
ę
, aminokwasy i elektrolity).
Ci
ś
nienie osmotyczne krwi powoduje przechodzenie produktów przemiany materii
do płynu dializacyjnego. Krwinki (czerwone i białe) s
ą
zbyt du
ż
e i pozostaj
ą
we
krwi. Po oczyszczeniu krew powraca do organizmu osoby poddawanej dializie.
http://www.shodor.org/master/biomed/physio/dialysis/hemodialysis/sixa.htm

Równowagi jonowe w roztworach
Równowaga chemiczna
Wi
ę
kszo
ść
reakcji chemicznych jest odwracalna, tj. mo
ż
e
przebiega
ć
w obu kierunkach. Na pocz
ą
tku szybko
ść
reakcji do przodu jest wi
ę
ksza, ale w miar
ę
jak powstaje
coraz wi
ę
cej produktów (C i D), a substraty s
ą
zu
ż
ywane
(A i B), wzrasta szybko
ść
reakcji do tyłu.
Równowagi jonowe w roztworach
A + B
C + D
A + B
C + D
C
Z
A
S
Równowaga chemiczna
Po pewnym reakcja osi
ą
ga stan równowagi dynamicznej, w
którym szybko
ś
ci reakcji do przodu i do tyłu s
ą
sobie równe.
Równowagi jonowe w roztworach
A + B
C + D
A + B
C + D
C
Z
A
S
A + B
C + D
Równowaga chemiczna
W stanie równowagi, reakcje w obie strony zachodz
ą
z
tak
ą
sam
ą
szybko
ś
ci
ą
, co oznacza,
ż
e st
ęż
enia
substratów i produktów pozostaj
ą
stałe.
Równowagi jonowe w roztworach
K
c
= [produkty] = [C]
c
[D]
d
[substraty] [A]
a
[B]
b
K
c
– stała równowagi
[A] – st
ęż
enie molowe substancji A (mole/L)
aA + bB
cC + dD
Współczynniki
stechiometryczne
w zbilansowanym
równaniu reakcji
chemicznej
Obliczanie stałej równowagi
H
2
(g) + I
2
(g)
↔
2HI(g)
[H
2
] = 0.1M, [I
2
] = 0.2M, [HI] = 1.04M; M (mol/l)
K
c
=
[HI]
[HI]
2
2
=
=
(1.04)
(1.04)
2
2
= 54
[H
2
][I
2
] 0.1x0.2
MxM = 1
MxM
Równowagi jonowe w roztworach
St
ęż
enia ka
ż
dego uczestnika reakcji podnosimy do pot
ę
gi o warto
ść
jego współczynnika stechiometrycznego !!!
aA + bB
cC + dD
K
c
= [C]
c
[D]
d
[A]
a
[B]
b

Równowaga chemiczna
Warto
ść
stałej równowagi K
c
dla danej reakcji
wskazuje, czy w stanie równowagi przewa
ż
aj
ą
produkty, czy substraty.
Równowagi jonowe w roztworach
http://www.getting-in.com/guide/a-level-chemistry-equilibrium-constants/
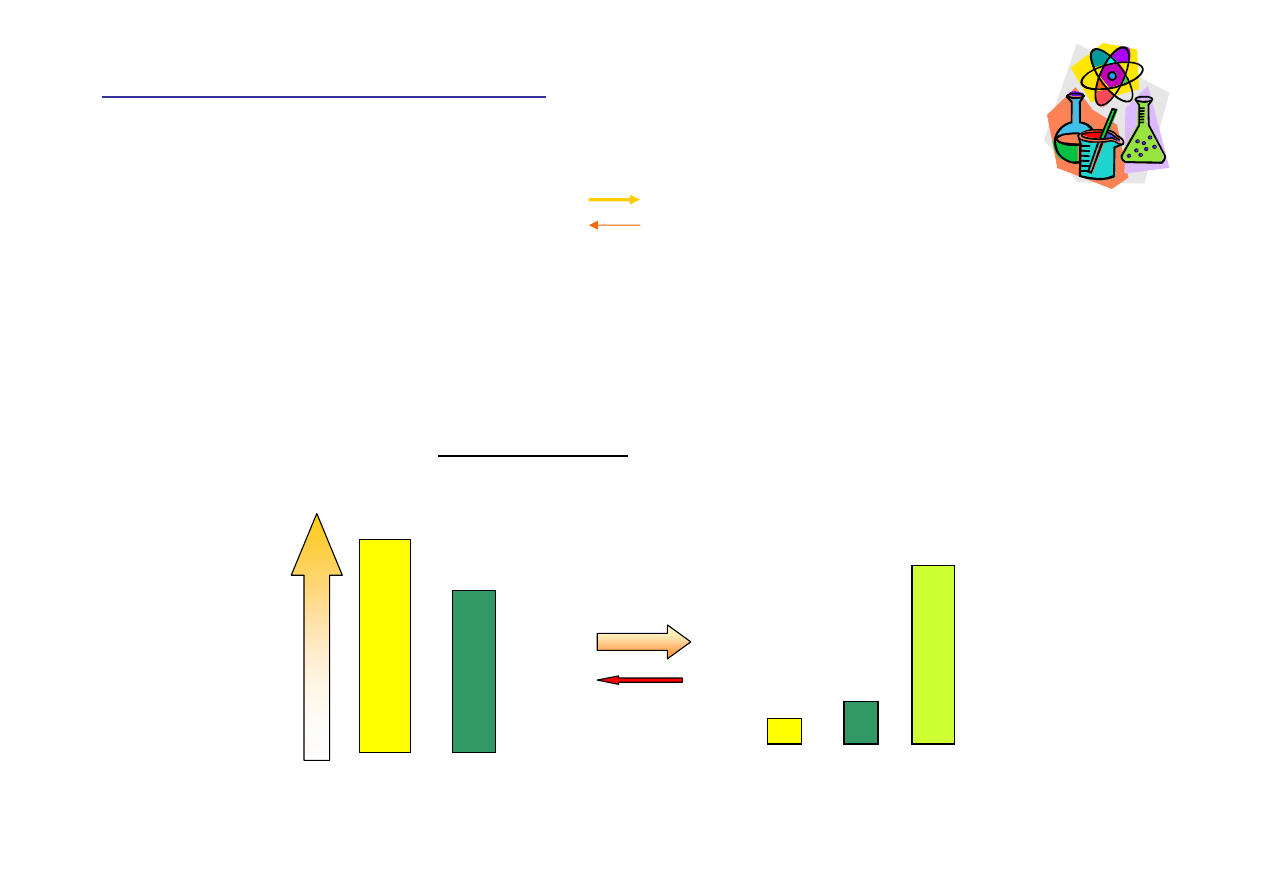
Du
ż
e warto
ś
ci stałej równowagi K
c
Do osi
ą
gni
ę
cia stanu równowagi reakcja do przodu dostarczyła du
ż
ych
ilo
ść
produktu (produktów). Mieszanina reakcyjna w stanie równowagi
zawiera głównie produkty.
Równowagi jonowe w roztworach
A
B
A
B
C
Stan pocz
ą
tkowy
Stan równowagowy
S
t
ę
z
e
n
ie
m
o
lo
w
e
(
m
o
le
/L
)
A + B
C
K
c
= du
ż
o produktów
= ~10
3
lub wi
ę
cej
mało substratów
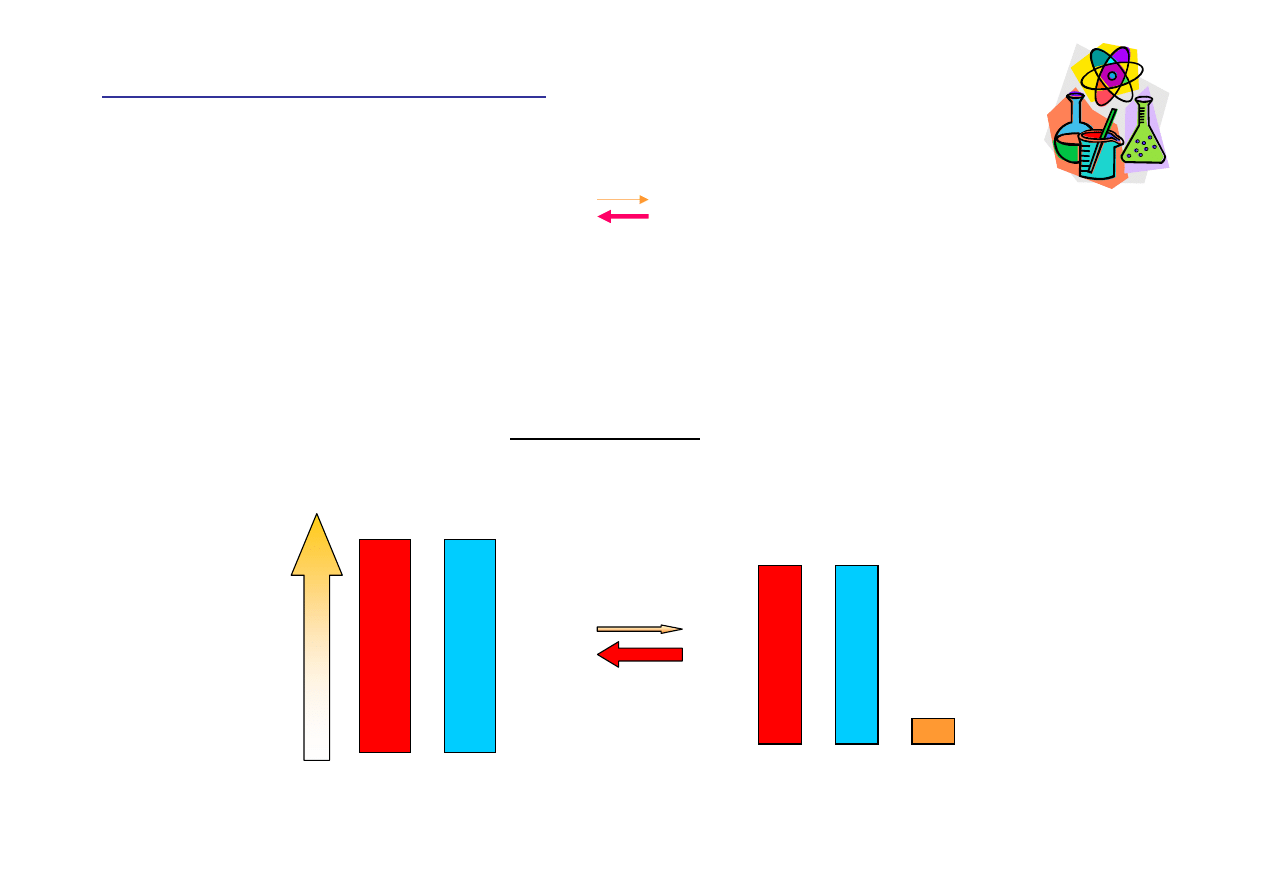
Małe warto
ś
ci stałej równowagi K
c
Do osi
ą
gni
ę
ciu stanu równowagi reakcja do tyłu dostarcza du
ż
ych ilo
ś
ci
substratów. Mieszanina reakcyjna w stanie równowagi zawiera głównie
substraty.
Równowagi jonowe w roztworach
A + B
C
K
c
= mało produktów = poni
ż
ej ~ 10
-3
du
ż
o substratów
A
B
A
B
C
Stan pocz
ą
tkowy
Stan równowagowy
S
t
ę
ż
e
n
ie
m
o
lo
w
e
(
m
o
le
/L
)
Stała równowagi K
c
Równowagi jonowe w roztworach
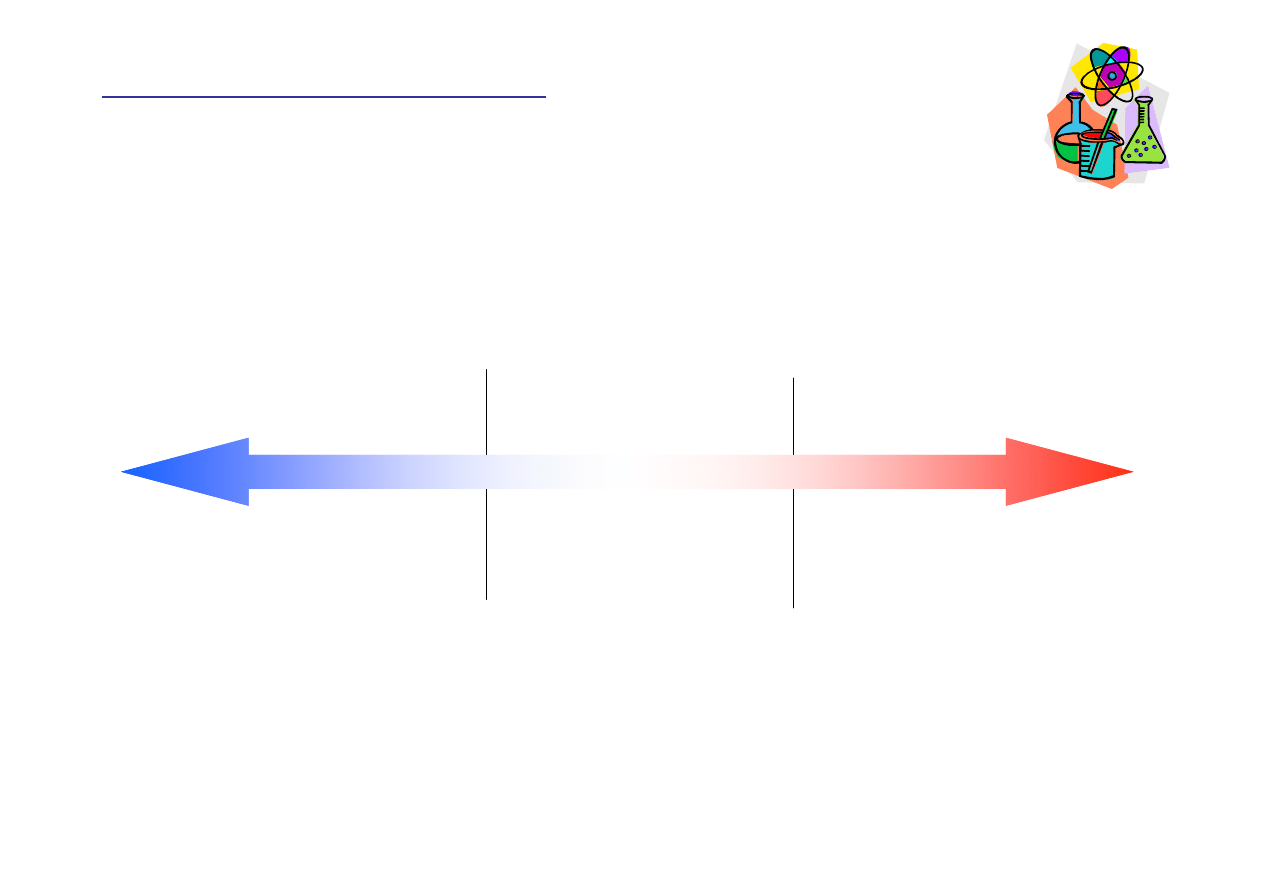
Substraty =Produkty
Reakcja w stanie równowagi
K
c
=1
Mała warto
ść
K
c
Du
ż
a warto
ść
K
c
Substraty >> Produkty
Reakcja prawie nie zachodzi
Substraty << Produkty
Reakcja dobiega prawie do ko
ń
ca
Przewa
ż
aj
ą
substraty
Przewa
ż
aj
ą
produkty
10
-3
- 10
3
<10
-3
>10
3
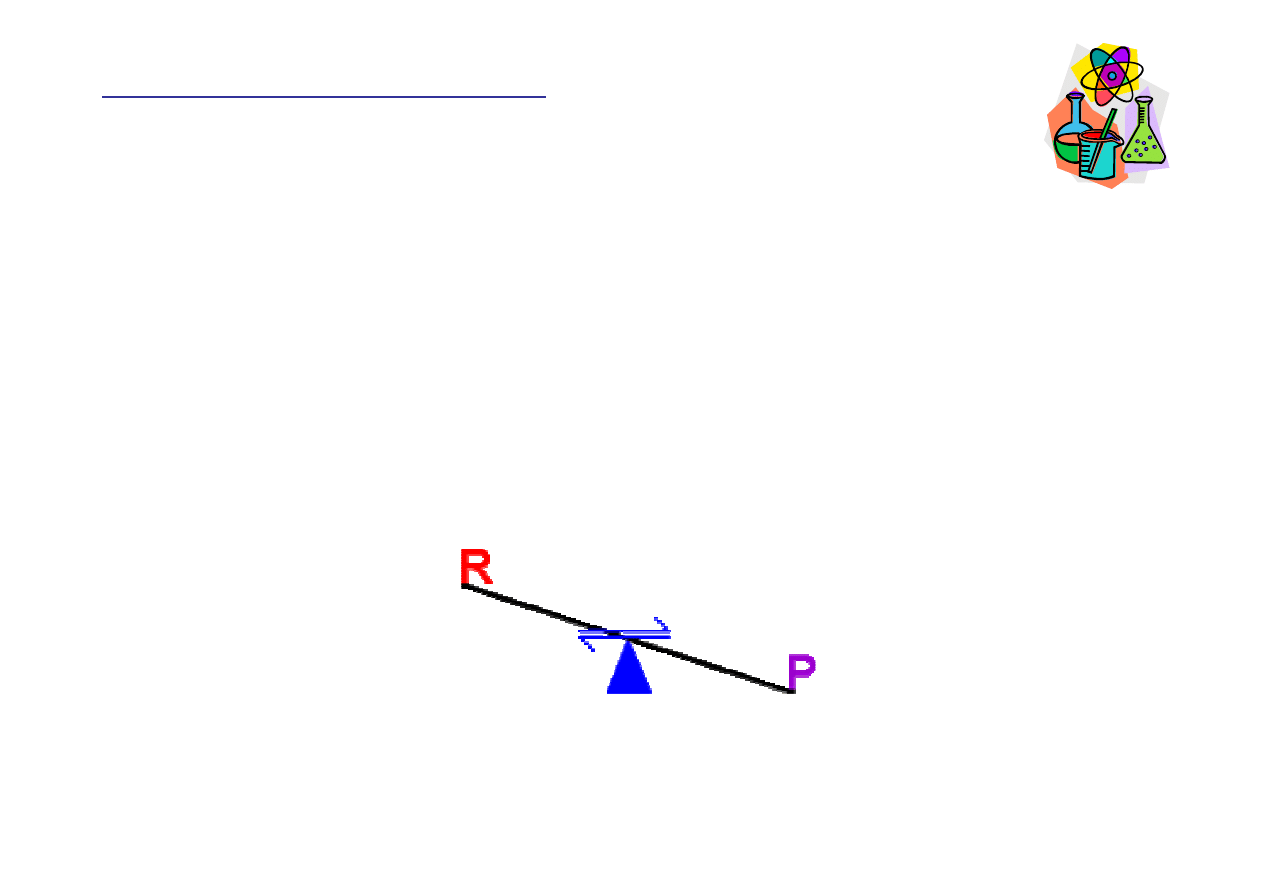
Reguła Le Chateliera
Je
ż
eli na układ w stanie równowagi dynamicznej działa
jaki
ś
czynnik zewn
ę
trzny to powoduje on tak
ą
zmian
ę
stanu równowagi, która zminimalizuje działanie tego
czynnika.
Równowagi jonowe w roztworach
http://www.digipac.ca/chemical/mtom/contents/chapter3/chap3_7.htm
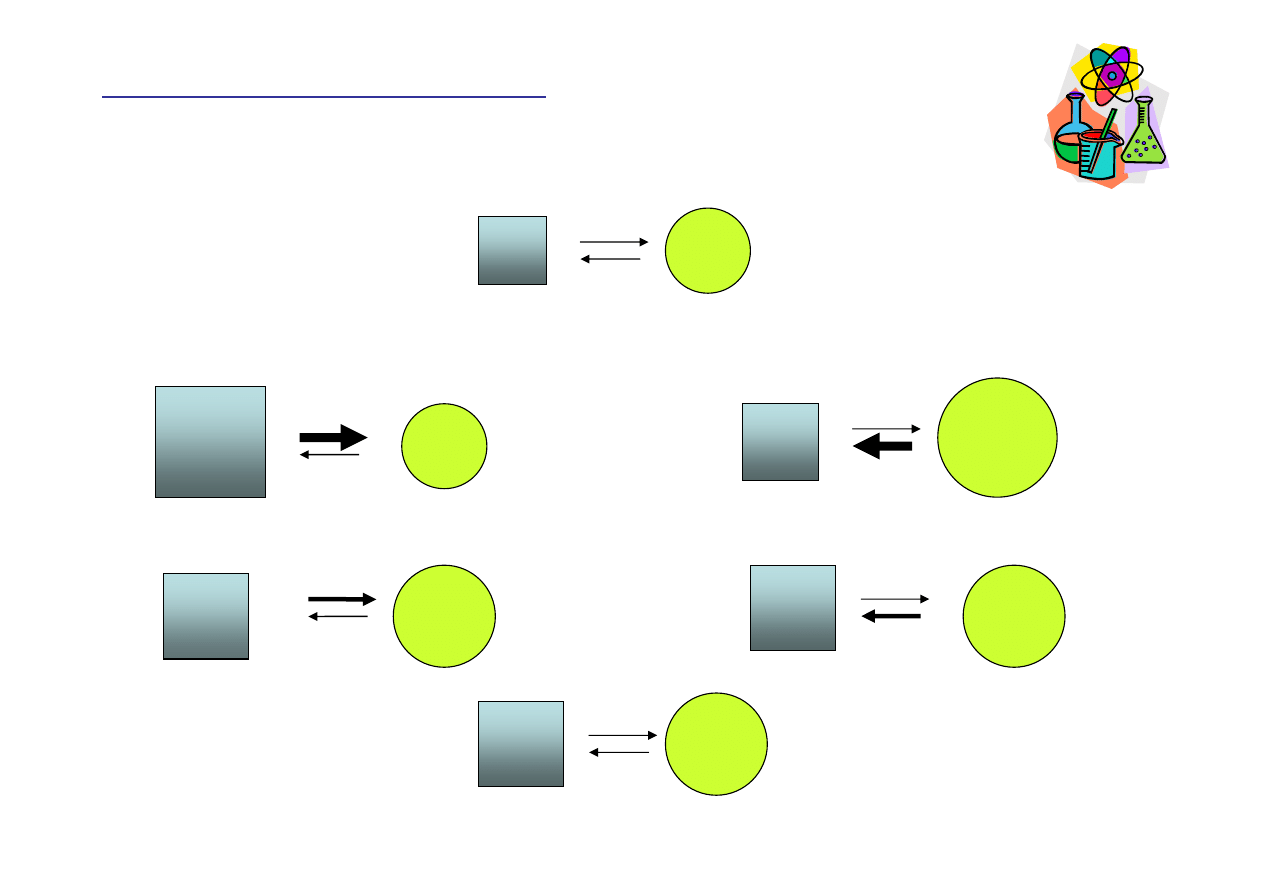
Reguła Le Chateliera
Równowagi jonowe w roztworach
Substrat
y
Produkty
Pocz
ą
tkowe warunki równowagi
Substraty
Produkty
Substraty
Produkty
Substraty
Produkty
Produkty
Substraty
Produkty
Ko
ń
cowe warunki równowagi
Dodanie substratów
Przesuni
ę
cie w kierunku produktów
Substraty
Powrót do stanu równowagi
Dodanie produktów
Przesuni
ę
cie w kierunku substratów
Reguła Le Chateliera
Równowagi jonowe w roztworach
Substraty
Produkty
Pocz
ą
tkowe warunki równowagi
Substraty
Produkty
Produkty
Substraty
Produkty
Produkty
Substraty
Produkty
Ko
ń
cowe warunki równowagi
Usuni
ę
cie substratów
Przesuni
ę
cie w stron
ę
substratów
Substraty
Powrót do stanu równowagi
Substraty
Usuni
ę
cie produktów
Przesuni
ę
cie w stron
ę
produktów

Dysocjacja
Szwedzki chemik Svante Arrhenius w swojej pracy doktorskiej
obronionej na Uniwersytecie w Uppsali (1884) przedstawił
nowatorsk
ą
teori
ę
dysocjacji elektrolitycznej, wg której sole
rozpuszczone w wodzie rozpadaj
ą
si
ę
na naładowane jony
(kationy obdarzone dodatnim ładunkiem i aniony obdarzone
ujemnym ładunkiem). Chocia
ż
jego teoria nie zrobiła wra
ż
enia na
profesorach z Uniwersytetu w Uppsali, otrzymał za ni
ą
Nagrod
ę
Nobla w roku 1903.
Równowagi jonowe w roztworach
http://kawaii-baka.blogspot.com/2010/01/like-disolves-like.html
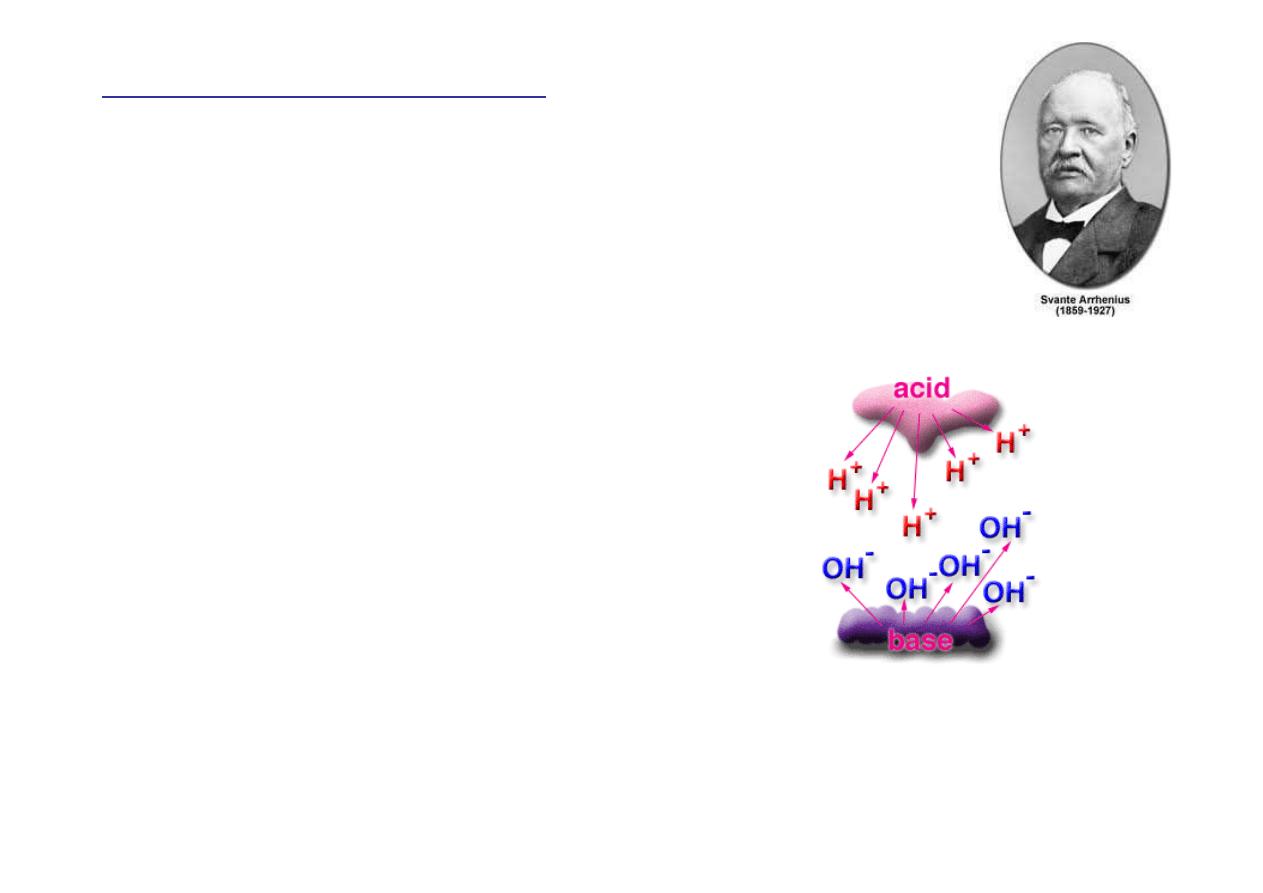
Kwasy i zasady
W uzupełnieniu swojej teorii dysocjacji
elektrolitycznej Arrhenius zaproponował
definicj
ę
kwasu i zasady (1884):
Kwas
Kwas – ka
ż
dy zwi
ą
zek chemiczny, który
wprowadzony do roztworu dysocjuje z
powstaniem jonów H
+
.
Zasada - ka
ż
dy zwi
ą
zek chemiczny, który
wprowadzony do roztworu dysocjuje z
powstaniem jonów wodorotlenkowych OH
-
.
Równowagi jonowe w roztworach
http://www.brooklyn.cuny.edu/bc/ahp/SDKC/Chem/SD_AcidBase.html
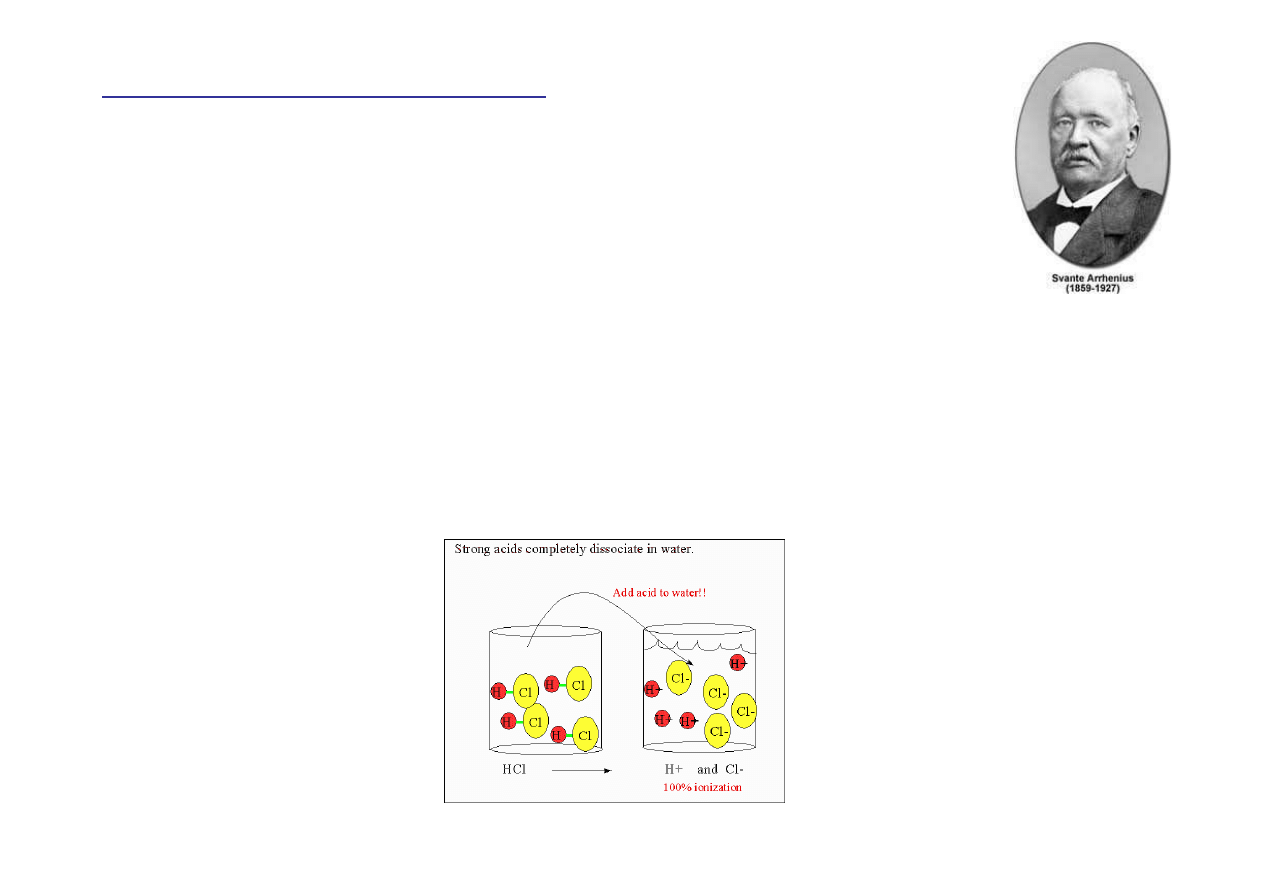
Kwasy
Kwasy – zwi
ą
zki chemiczne, które po rozpuszczeniu
w wodzie dostarczaj
ą
kationów wodorowych (H
+
)
oraz anionów (jony niemetali lub wieloatomowe)
H
Cl (g)
→
H
+
(aq) + Cl
-
(aq)
Równowagi jonowe w roztworach
http://wikis.lawrence.edu/display/CHEM/Acids+and+Bases-Davis

Popularne kwasy
Równowagi jonowe w roztworach
azotynowy
NO
2
-
Kwas azotawy
HNO
2
chlorkowy
Cl
-
Kwas chlorowodorowy (solny)
HCl
octanowy
CH
3
COO
-
Kwas octowy
CH
3
COOH
fosforanowy
PO
4
3-
Kwas fosforowy
H
3
PO
4
w
ę
glanowy
CO
3
2-
Kwas w
ę
glowy
H
2
CO
3
siarczynowy
SO
3
2-
Kwas siarkawy
H
2
SO
3
siarczanowy
SO
4
2-
Kwas siarkowy
H
2
SO
4
azotanowy
NO
3
-
Kwas azotowy
HNO
3
bromkowy
Br
-
Kwas bromowodorowy
HBr
Nazwa
anionu
Anion
Nazwa kwasu
Kwas

Kwasy
Jony wodorowe nadaj
ą
kwasom kwa
ś
ny smak
(owoce cytrusowe, ocet) i s
ą
odpowiedzialne za
korozj
ę
metali i niszczenie marmuru.
Równowagi jonowe w roztworach
http://hecooksshecooks.net/2009/02/acid-redux/
http://www.elmhurst.edu/~chm/vchembook/196buildings.html
http://www.sciencedirect.com/science/article/pii/S0010938X12000595
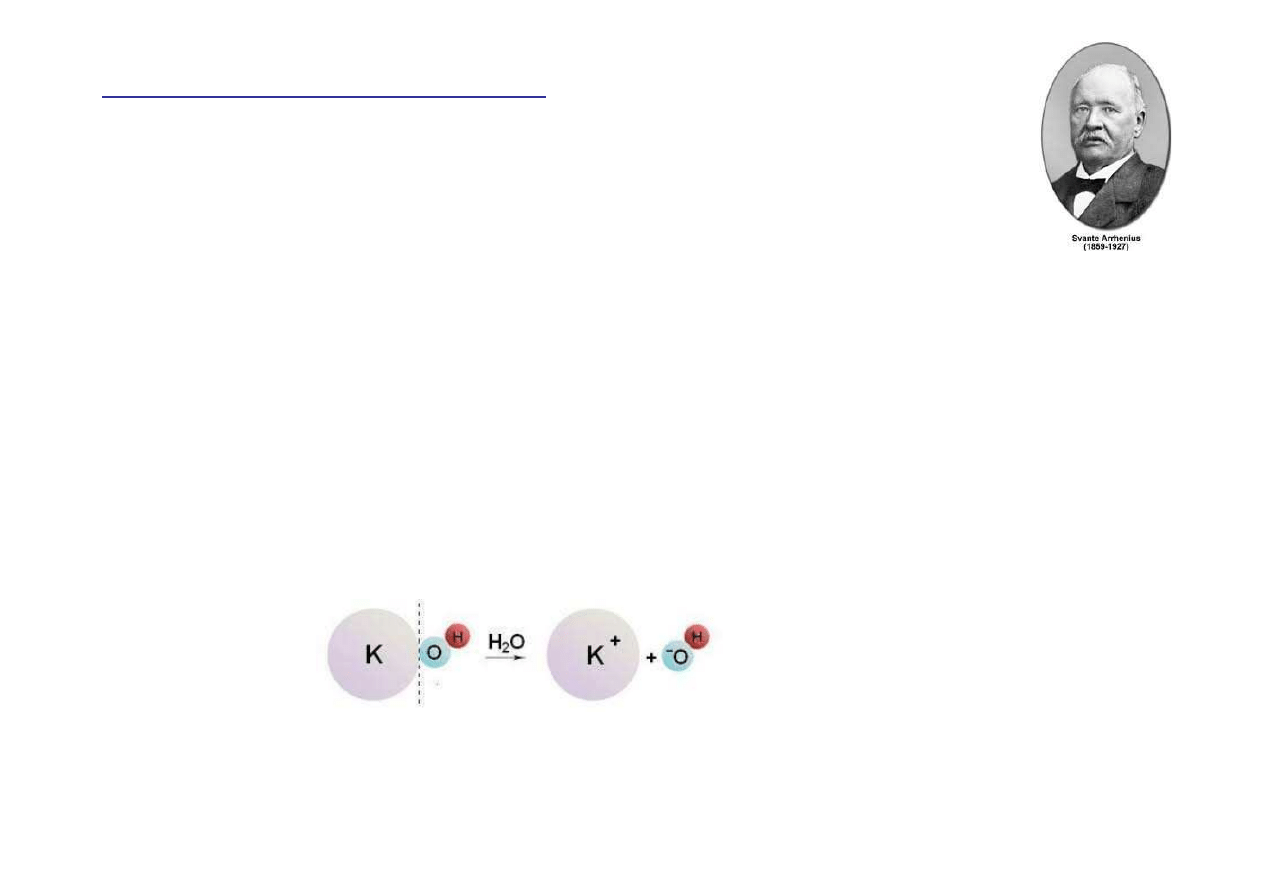
Zasady
Zasady – zwi
ą
zki chemiczne, które w wodzie tworz
ą
jony
wodorotlenkowe (OH
-
) oraz dodatnio naładowane jony
(kationy). Wi
ę
kszo
ść
zasad Arrheniusa jest tworzonych
przez metale z grupy 1A i 2A (Na, K, Li, Ca)
K
OH
(s)
→
K
+
(aq) +
OH
-
(aq)
Równowagi jonowe w roztworach
http://zapytaj.onet.pl/Category/006,005/2,15002476,Na_czym_polega_dysocjacja_jonowa_elektrolityczna_zasad_.html
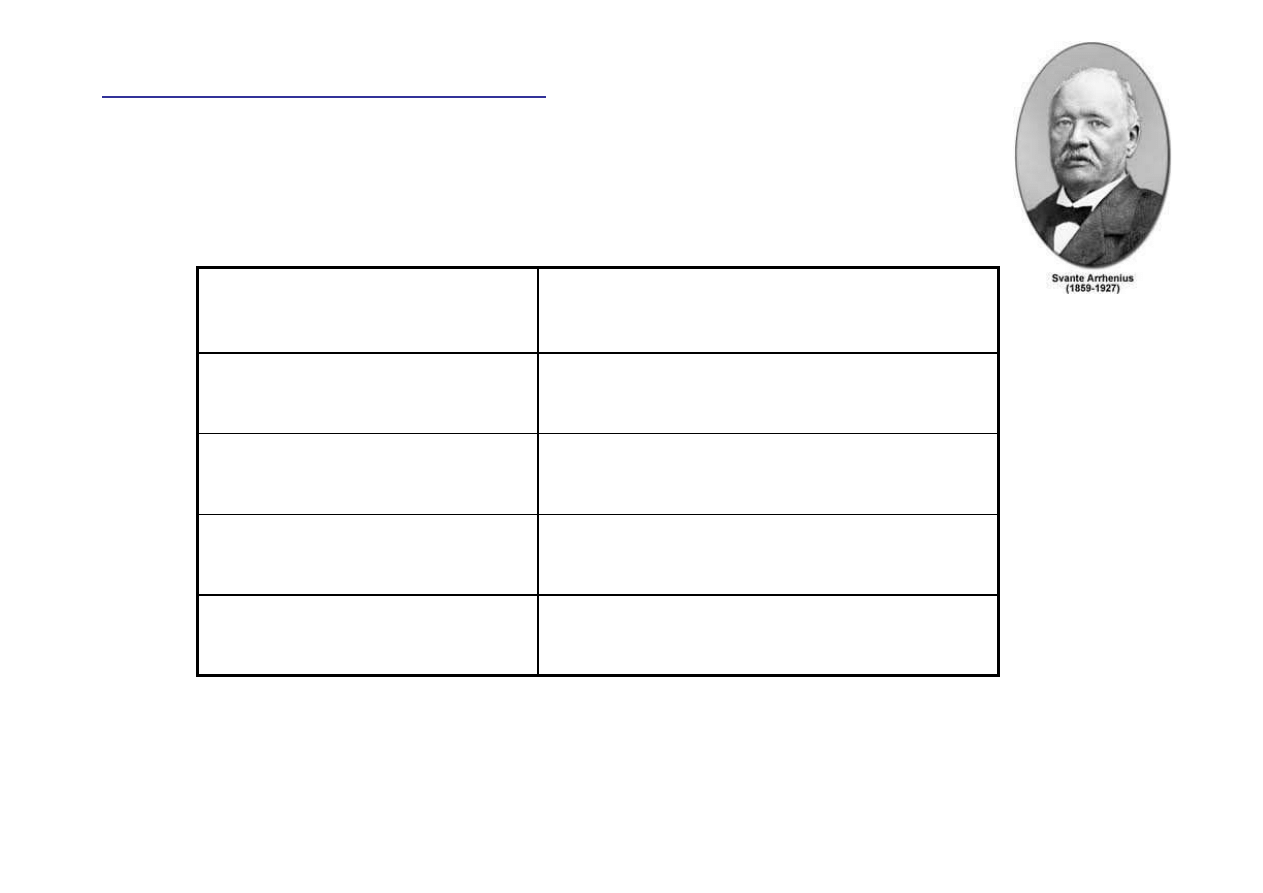
Popularne zasady
Równowagi jonowe w roztworach
Wodorotlenek glinu
Al(OH)
3
Wodorotlenek wapnia
Ca(OH)
2
Wodorotlenek potasu
KOH
Wodorotlenek sodu
NaOH
Nazwa
Zasada
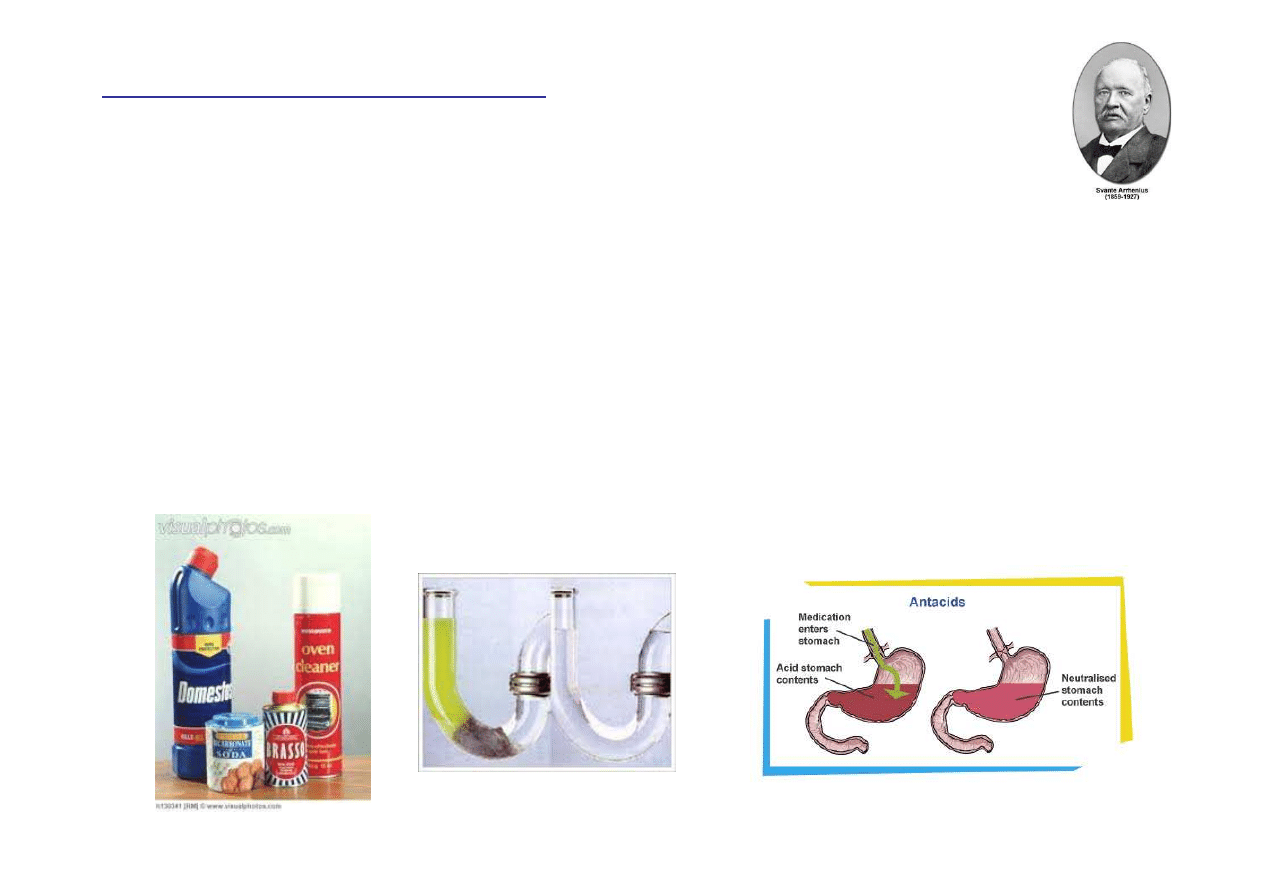
Zasady
Jony wodorotlenkowy (OH
-
) nadaj
ą
roztworom zasad Arrhenius’a gorzki
smak i
ś
liski dotyk.
Zasady w gospodarstwie domowym: płyny do mycia okien, płyny do
mycia piekarników, preparaty do neutralizacji kwasu
ż
oł
ą
dkowego
(antacydy), płyny i granulaty do przetykania rur.
visualphotos.com
megadistributors.co.nz
http://www.irishhealth.com/clin/heartburn/overthecounter.html
Równowagi jonowe w roztworach

Kwasy i zasady zoboj
ę
tniaj
ą
si
ę
nawzajem, poniewa
ż
jon
wodorowy i jon wodorotlenkowy reaguj
ą
ze sob
ą
tworz
ą
c
cz
ą
steczk
ę
wody.
Równowagi jonowe w roztworach
Teoria Arrheniusa - zoboj
ę
tnianie
H
+
+ OH
-
→
H
2
O
HA + BOH
→
BA + H
2
O
HA – kwas Arrheniusa, BOH – zasada Arrheniusa
HCl + NaOH
→
NaCl + H
2
O

Braki teorii Arrheniusa
•
Rozpuszczalnik nie odgrywa
ż
adnej roli w teorii Arrheniusa,
tymczasem je
ż
eli rozpu
ś
cimy HCl w benzenie, a nie w wodzie,
HCl nie ulegnie dysocjacji. Zatem rodzaj rozpuszczalnika w
istotny sposób wpływa na wła
ś
ciwo
ś
ci kwasowo-zasadowe
substancji.
•
Według teorii Arrheniusa sole powinny mie
ć
zawsze odczyn
oboj
ę
tny. Tymczasem, je
ż
eli wymieszamy równomolowe ilo
ś
ci
HCl i amoniaku, otrzymamy roztwór o lekko kwa
ś
nym
charakterze, natomiast je
ż
eli wymieszamy równomolowe ilo
ś
ci
NaOH i kwasu octowego, otrzymamy roztwór o lekko zasadowym
charakterze. Teoria Arrheniusa tego nie wyja
ś
nia.
Równowagi jonowe w roztworach

• Teoria Arrheniusa nie wyja
ś
nia zasadowego charakteru
zwi
ą
zków, które nie posiadaj
ą
w swojej strukturze grupy
wodorotlenowej, takich jak NH
3
albo anilina.
• Wolny proton H
+
jest bardzo reaktywny i praktycznie, jak tylko
powstanie, reaguje z wod
ą
. Jego st
ęż
enie molowe w wodzie
jest szacowane na poziomie 10
-130
M!
Równowagi jonowe w roztworach
Braki teorii Arrheniusa

Dzi
ę
kuj
ę
za uwag
ę
Wyszukiwarka
Podobne podstrony:
chemia 2014 odp
Arkusz CKU Chemia 2014
chemia 2014 kolos, lekarski, I rok, chemia, kolos - teoria
Chemia 3 2014
Zagadnienia chemia 2014, żcioż, III semestr, Chemia żywności
chemia 7 2014
Chemia 6 2014
chemia 2014
chemia 2014 odp
Arkusz CKU Chemia 2014
chemia 2014 operon probna rozszerzona odpowiedzi
chemia 2014 maj matura rozszerzona
Pytania z wejściówek, analityka medyczna UMP 2014, chemia fizyczna, ćwiczenia
arkusz 2 opm chemia z tutorem 12 06 2014 klasy przedmaturalne
WF-Zagadnienia Egz-22.05.2014, rok numero uno, chemia nieorganiczna
Rzeczy których nie ma u piegusa wykład chemia( 02 2014
Sprawozdanie 2 Badanie właściwości i analiza jakościowa anionów, Politechika Białostocka, budownictw
więcej podobnych podstron