Ć W I C Z E N I E Nr 53
MIARECZKOWANIE PEHAMETRYCZNE
Celem ćwiczenia jest wyznaczenie ilości kwasów: mocnego oraz mocnego i
słabego w mieszaninie zawierającej oba kwasy, metodą miareczkowania
pehametrycznego.
Miareczkowanie pehametryczne polega na pomiarze pH miareczkowanego roztworu po
dodaniu kolejnych porcji titranta (odczynnika miareczkującego). pH jest to ujemny
logarytm z aktywności jonów wodorowych,
:
+
H
a
+
−
=
H
a
log
pH
Wykres zależności pH roztworu miareczkowanego od ilości dodanego titranta nosi nazwę
krzywej miareczkowania pehametrycznego.
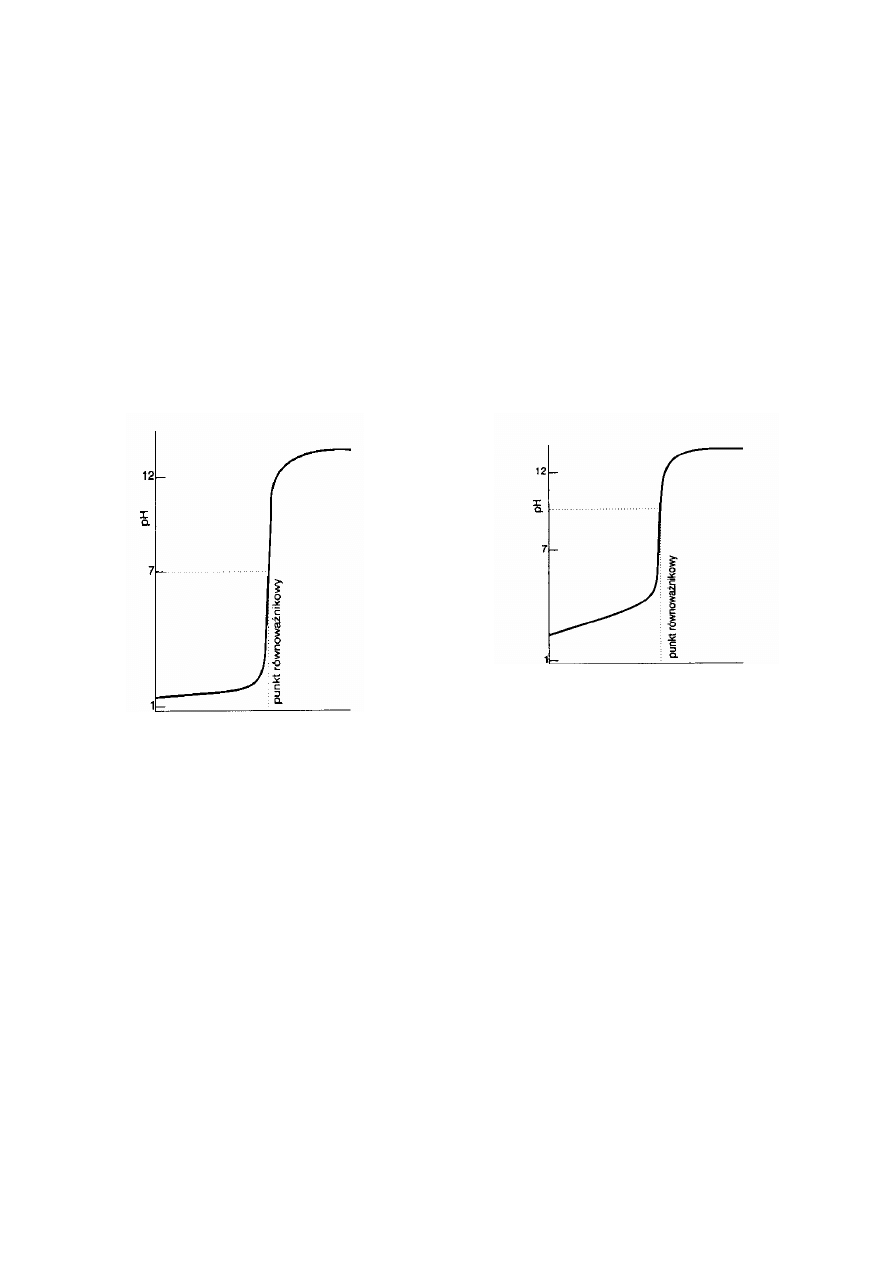
objętość titranta
Krzywa miareczkowania mocnego kwasu
(roztwór analizowany) mocną zasadą (titrant).
W punkcie równoważnikowym (stechiometrycznym)
pH = 7
objętość titranta
Krzywa miareczkowania słabego kwasu (roztwór
analizowany) mocną zasadą (titrant).
Punkt równoważnikowy (punkt stechiometryczny)
jest przy pH>7
Miareczkowanie mocnego kwasu mocną zasadą, np. kwasu solnego ługiem sodowym:
HCl(aq) + NaOH(aq) = NaCl (aq) + H
2
O(c)
(1)
Początkowo zmiany pH roztworu miareczkowanego są małe. W miarę dodawania roztworu
ługu stopniowo ubywa jonów wodorowych, H
+
, które są zastępowane jonami Na
+
.
W pobliżu punktu stechiometrycznego następuje gwałtowna zmiana pH. W tym punkcie
stężenie jonów wodorowych jest takie jak w czystej wodzie, a odpowiadające temu
stężeniu pH = 7. Po przekroczeniu punktu równoważnikowego dodatek zasady prowadzi
do dalszego wzrostu pH roztworu, ze względu na przyrost stężenia jonów OH
-
.
Miareczkowanie słabego kwasu mocną zasadą
W czasie miareczkowania słabego kwasu, np. kwasu octowego, mocną zasadą, np.
NaOH, stężenie jonów H
+
w roztworze zależy od stopnia dysocjacji miareczkowanego
kwasu. Dodanie titranta przeprowadza część kwasu w sól (czyli według teorii Brønsteda
sprzężoną z nim zasadę) zgodnie z reakcją:
CH
3
COOH(aq) + OH
-
(aq) = CH
3
COO
-
(aq) + H
2
O
(2)

Dysocjację słabego kwasu opisuje termodynamiczna stała równowagi K
a
:
HAc
Ac
H
HAc
Ac
H
Ac
H
Ac
H
a
c
c
c
a
a
a
K
γ
γ
⋅
γ
⋅
⋅
≡
⋅
=
−
+
−
+
−
+
(3)
Dla roztworów rozcieńczonych, można przyjąć, że współczynniki aktywności
termodynamicznej niezdysocjowanego kwasu,
γ
HAc
, i jonu octanowego,
γ
Ac
, są bliskie
jedności.
Ponieważ obecność soli (elektrolitu jonoforowego) zmniejsza dysocjację słabego kwasu,
można przyjąć, że stężenie niezdysocjowanego kwasu jest równe stężeniu kwasu w
próbce,
, natomiast stęzenie jonu octanowego jest równe stężeniu soli,
, równanie (3) przyjmie postać:
kwas
HAc
c
c
=
sól
Ac
c
c
=
−
kwas
sól
H
a
c
c
a
K
⋅
=
+
(4)
z której łatwo obliczyć pH roztworu:
sól
kwas
a
c
c
log
pK
pH
−
=
(5)
Zależność (5) znana jest jako równanie Hendersona-Hasselbacha:
Z równania (5) wynika, że po zobojętnieniu połowy wyjściowej ilości kwasu, gdy,
stężenia kwasu i soli są sobie równe,
a
pK
pH
=
.
Natomiast w punkcie równoważnikowym,
gdy ilość dodanej zasady odpowiada wyjściowej ilości kwasu, roztwór ma odczyn
zasadowy. Dodanie następnych porcji zasady powoduje dalszy wzrost pH roztworu
badanego. Położenie punktu równoważnikowego odpowiada punktowi przegięcia na
krzywej miareczkowania. Punkt przegięcia krzywej można wyznaczyć z maksimum
pierwszej pochodnej:
)
V
(
f
V
)
pH
(
NaOH
NaOH
=
Δ
Δ
.
Zasada pomiaru pH. Do pomiarów pH wykorzystuje się ogniwo zbudowane z elektrod
szklanej i kalomelowej. Elektroda szklana jest elektroda pomiarową, której potencjał zależy
od pH:
pH
F
RT
3
,
2
E
a
ln
E
E
0
szkl
H
F
RT
0
szkl
szkl
⋅
⋅
−
≡
+
=
+
(6)
Potencjał standardowy elektrody szklanej
zależy od jej budowy i może ulegać
nieznacznym zmianom.
0
szkl
E
Elektroda kalomelowa jest elektrodą odniesienia, której potencjał jest stały, niezależny od
pH. Elektrody zanurzone są w roztworze badanym o nieznanym stężeniu jonów
wodorowych i siłę elektromotoryczną takiego ogniwa określa zależność:
pH
059
,
0
A
pH
F
RT
3
,
2
E
E
E
E
E
0
szkl
kal
szkl
kal
⋅
+
≡
⋅
⋅
+
−
=
−
=
(7)
Z równania (7) widać, że SEM ogniwa, złożonego z elektrod szklanej i kalomelowej, jest
liniową funkcja pH roztworu, a jednostkowa zmiana pH powoduje zmianę SEM ogniwa o
0,059 V. Umożliwia to wyskalowanie przyrządu do pomiaru pH, nazywanego pehametrem
w jednostkach pH. Aby uniknąć wyznaczania parametru A w równaniu (7) konieczne jest
kalibrowanie pehametru przy pomocy roztworów buforowych, których pH jest znane. Do
kalibracji pehametru często stosuje się 0,05 M kwaśny ftalan potasu, pH=4.00 w 25
o

Wykonanie ćwiczenia
1. Przygotować pehametr do pomiarów pH (nacisnąć czerwony przycisk sieć, oraz
przycisk pH). Wykalibrować przyrząd nalewając do zlewki około 50 ml buforu
ftalanowego o pH = 4,00.
2. Dipol magnetyczny ostrożnie umieścić w naczyniu i nałożyć pokrywkę z elektrodami
szklaną i kalomelową. Włączyć mieszadło na kilka minut.
3.
Po wyłączeniu mieszadła ustawić wskazania pehametru na pH = 4,00 przy pomocy
pokrętła kalibracji. Położenia tego pokrętła nie wolno zmieniać w trakcie
pomiarów.
4. Bufor z naczynia wlać ponownie do butelki (może być używany wielokrotnie). Elektrody
opłukać wodą destylowaną.
5. Przygotować roztwór zawierający: 10 ml roztworu mocnego kwasu, 20 ml acetonu i 20
ml wody destylowanej.
6. Biuretę napełnić roztworem NaOH o stężeniu 0,2 mol/dm
3
. Roztwór z biurety dodawać
do roztworu kwasu porcjami początkowo po 0,5 ml, później po 0,2 ml, a w pobliżu
punktu równoważnikowego po 0,1 ml. Po dodaniu każdej porcji mieszać roztwór
przez około 5 min, a następnie po wyłączeniu mieszadła, zmierzyć pH.
7. Wyniki pomiarów pH i odpowiadające im objętości zużytego do miareczkowania NaOH
zapisać w tabeli. Wyjąć dipol magnetyczny, wylać roztwór ze zlewki, a elektrody
przemyć wodą destylowaną.
8. Przygotować nową próbkę o składzie: 10 ml mocnego kwasu, 10 ml słabego kwasu, 20
ml acetonu i 10 ml wody destylowanej.
9. Wykonać miareczkowanie jak w punkcie 6.
10. Wyniki pomiarów pH i odpowiadające im objętości zużytego do miareczkowania NaOH
zapisać w tabeli.
11. Po zakończeniu pomiarów wyłączyć pehametr, elektrody przemyć wodą destylowaną i
pozostawić zanurzone w wodzie destylowanej. Uporządkować stanowisko pracy.
Opracowanie wyników
1. Sporządzić wykres I przedstawiający zmiany pH podczas miareczkowania roztworu
mocnego kwasu od objętości dodanej zasady, V
NaOH,
)
V
(
f
pH
NaOH
=
. Punkt przegięcia
krzywej miareczkowania odpowiada punktowi równoważnikowemu miareczkowania.
2. W celu dokładnego wyznaczenia punktu równoważnikowego sporządzić wykres II
przedstawiający pochodną krzywej miareczkowania od objętości dodanej zasady,
V
NaOH
:
)
V
(
f
V
)
pH
(
NaOH
NaOH
=
Δ
Δ
.
3. Obliczyć liczbę moli mocnego kwasu w próbce oraz stężenie molowe roztworu
wyjściowego kwasu.
4. Sporządzić wykres III przedstawiający zmiany pH podczas miareczkowania roztworu
mocnego i słabego kwasu od objętości dodanej zasady, V
NaOH
,
.
)
V
(
f
pH
NaOH
=
5. Pierwszy punkt przegięcia krzywej miareczkowania na tym wykresie odpowiada
zobojętnieniu mocnego kwasu, drugi punkt przegięcia - zobojętnieniu słabego kwasu.
6. Sporządzić wykres IV przedstawiający pierwszą pochodną
)
V
(
f
V
)
pH
(
NaOH
NaOH
=
Δ
Δ
7. Obliczyć liczbę moli obu kwasów oraz stężenia molowe wyjściowych roztworów
kwasów.
8. W oparciu o literaturę uzasadnić cel miareczkowania mieszaniny kwasów mocnego i
słabego w obecności acetonu.
Document Outline
Wyszukiwarka
Podobne podstrony:
53, Cwiczenie 53 d, Piotr Biernat
Ćwiczenie 53, Ćwiczenie 53, Gołąbecki Mateusz
Ćwiczenie 53, Ćwiczenie 53, Gołąbecki Mateusz
Ćwiczenie1 53, TiR UAM II ROK, Informatyka
53, Cwiczenie 53 b, Sprawozdanie z ?wiczenia nr53
Fizyka Laborki (cwiczenie 53) nasze
ćwiczenie 53 sprawozdanie (FUNKCJA REGLINP!!!!
Fizyka Laborki (cwiczenie 53) nasze
cwiczenie 53
cwiczenie 04 53
cwiczenie 03 53
cwiczenie 02 Matlab 53
53 wykres, sprawozdania, Fizyka - Labolatoria, Ćwiczenie nr53
cwiczenie 02 Matlab 53
Ćwiczenie nr 53, sprawozdania, Fizyka - Labolatoria, Ćwiczenie nr53
53, studia, Budownctwo, Semestr II, fizyka, Fizyka laborki, Fizyka - Labolatoria, Ćwiczenie nr53
cwiczenie 04 53
więcej podobnych podstron