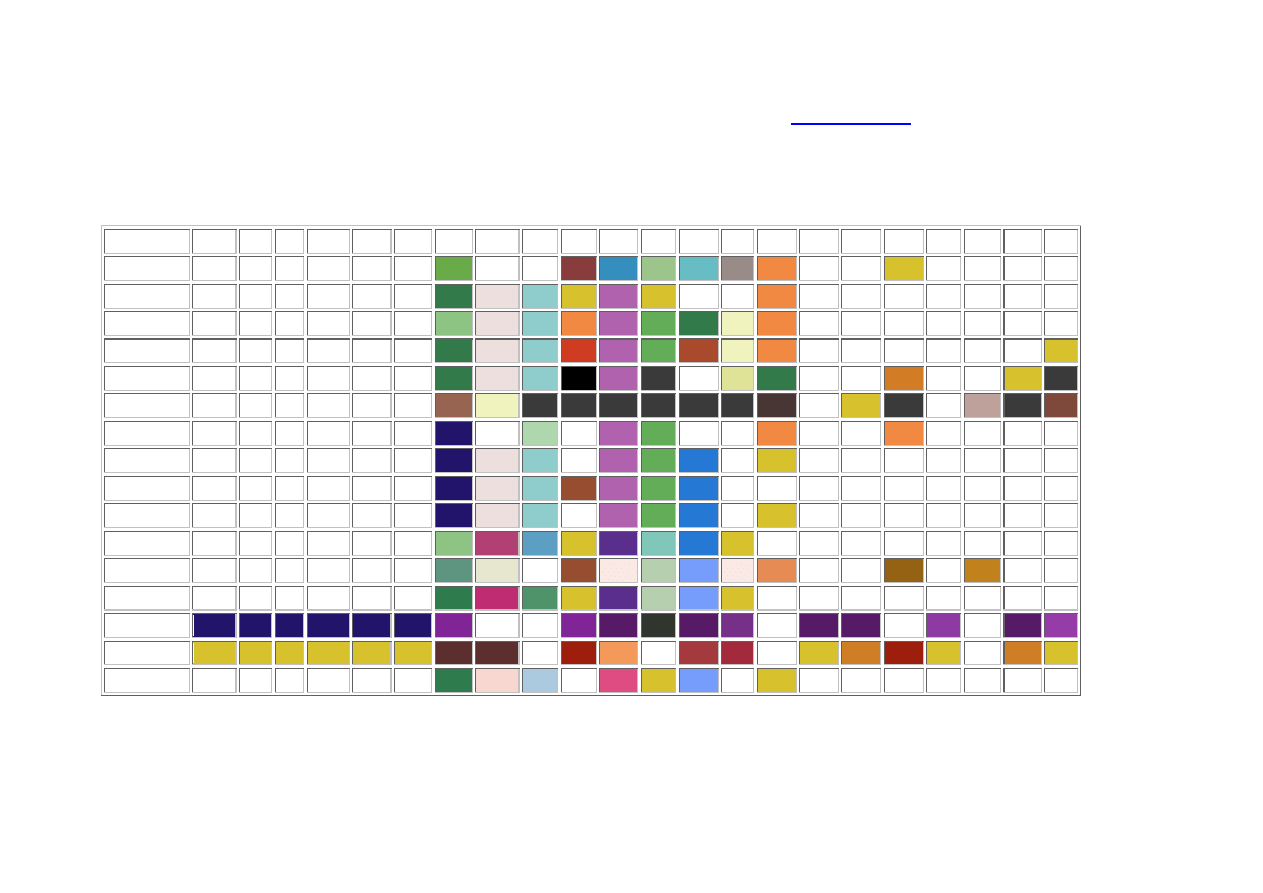
Rozwiązania zadań do sprawdzenia uczniowie VII LO w Zielonej Górze mogą przesłać na adres:
lub przedłożyć do sprawdzenia w formie pisemnej
V. Dysocjacja elektrolityczna (jonowa) - zdania do samodzielnego rozwiązania
Tabela rozpuszczalności soli i wodorotlenków w wodzie:
Kolor tła odzwierciedla charakterystyczną barwę substancji należy go traktować umownie (biały kolor tła oznacza bezbarwny roztwór)
NH
4
+
Na
+
K
+
Mg
2+
Ca
2+
Ba
2+
Cr
3+
Mn
2+
Fe
2+
Fe
3+
Co
2+
Ni
2+
Cu
2+
Ag
+
Au
3+
Zn
2+
Cd
2+
Hg
2+
Al
3+
Sn
2+
Pb
2+
Bi
3+
OH
-
R
R
R NR
TR R
NR NR
NR NR NR NR NR && NR NR NR NR NR NR NR NR
F
-
R
R
R NR
NR NR NR TR
TR NR R
TR NR R
R
NR TR R
TR R
NR R
Cl
-
R
R
R R
R
R
R
R
R
R
R
R
R
NR R
R
R
R
R
R
TR R
Br
-
R
R
R R
R
R
R
R
R
R
R
R
R
NR R
R
R
TR R
R
TR R
I
-
R
R
R R
R
R
R
R
R
&&
R
R
&& NR TR R
R
NR R
TR NR
NR
S
2-
R
R
R && TR R
NR NR
NR NR NR NR NR NR NR
NR NR
NR
&& NR
NR
NR
SO
3
2-
R
R
R R
NR NR
R
NR
NR && NR NR && TR NR TR TR && && TR NR TR
SO
4
2-
R
R
R R
TR NR
R
R
R
R
R
R
R
TR R
R
R
R
R
R
NR R
NO
2
-
R
R
R R
R
R
R
R
R
NR R
R
R
TR && R
R
R
R
TR R
NR
NO
3
-
R
R
R R
R
R
R
R
R
R
R
R
R
R
R
R
R
R
R
R
R
R
PO
4
2-
R
R
R NR
NR NR NR NR
NR NR NR NR NR NR NR NR NR NR NR NR NR NR
CO
3
2-
R
R
R NR
NR NR NR NR
NR && NR NR && NR NR NR NR NR && NR NR NR
SiO
3
2-
R
R
R NR
NR NR && NR
NR NR NR NR && && && NR NR && NR && NR &&
MnO
4
2-
R
R
R R
R
R
R
&& && R
R
R
R
R
&&
R
R
&& R
&&
R
R
CrO
4
2-
R
R
R R
TR NR
NR NR
&& R
NR NR R
NR && TR NR TR NR NR NR NR
CH
3
-COOH
-
R
R
R R
R
R
R
NR
R
R
R
R
R
R
R
R
R
R
R
R
R
R
R - substancja dobrze rozpuszczalna (rozpuszczalność powyżej 1 g w 100 g wody)
TR - substancja o niewielkiej rozpuszczalności, strąca się przy odpowiednim stężeniu roztworu (rozpuszczalność 0,1 - 1 g w 100 g wody)
NR - substancja praktycznie nierozpuszczalna, strąca się z rozcieńczonych roztworów (rozpuszczalność poniżej 0,1 g w 100 g wody)
&& - zachodzą skomplikowane reakcje, lub substancja nie została otrzymana
Wskazówki:
Dysocjacja kwasów: H
n
R ; wieloprotonowych (wielowodorowych) przebiega stopniowo:
H
2
O
H
n
R ↔ H
+
+ H
(n-1)
R
-
H
2
O
H
(n-1)
R
-
↔ H
+
+ H
(n-2)
R
2-
H
2
O
H
(n-2)
R
2-
↔ H
+
+ H
(n-3)
R
3-
H
2
O
H
(n-3)
R
3-
↔ H
+
+ H
(n-4)
R
4-
Dysocjacja zasad: Me(OH)
m
; wielowodorotlenkowych (wielowodorotlenowych) przebiega stopniowo:
H
2
O
Me(OH)
m
↔ Me(OH)
+
(m-1)
+ OH
-
H
2
O
Me(OH
+
(m-1)
↔ Me(OH)
2+
(m-2)
+ OH
-
H
2
O
Me(OH
+
(m-2)
↔ Me(OH)
3+
(m-3)
+ OH
-
Dysocjacja soli: Me
n
R
m
; przebiega jednostopniowo:
H
2
O
Me
n
R
m
↔ nMe
m+
+ mR
n-
H
2
O H
2
O
Dysocjacja wodorosoli: Me
n
(H
k
R)
m
↔ nMe
m+
+ mH
k
R
n-
;
H
k
R
n-
↔ H
+
+ H
k-1
R
(n+1)-
H
2
O H
2
O
NaHCO
3
↔ Na
+
+ HCO
3
-
;
HCO
3
-
↔ H
+
+ CO
3
2-
H
2
O H
2
O
Dysocjacja hydroksosoli (wodorotlenosoli): Me
n
(OH)
k
R
m
↔ nMe(OH)
k
m+
+ mR
n-
;
Me(OH)
k
m+
↔ Me(OH)
k-1
(m+1)+
+ OH
-
H
2
O H
2
O
[Cu(OH)]
2
CO
3
↔ 2Cu(OH)
+
+ CO
3
2-
;
Cu(OH)
+
↔ Cu
2+
+ OH
-
Dysocjacja hydratów (soli uwodnionych): Me
n
R
m
· kH
2
O ↔ nMe
m+
+ mR
n-
+ kH
2
O
H
2
O
Na
2
SO
4
· 10H
2
O ↔ 2Na
+
+ SO
4
2-
+ 10H
2
O
Dysocjacja soli podwójnych: Me
n
R
m
·Me`
n`
R
m`
↔ nMe
m+
+ n`Me`
m`+
+ m+m`R
n-
H
2
O
(NH
4
)
2
KPO
4
↔ 2NH
4
+
+ K
+
+ PO
4
3-
H
2
O
Pb
2
Cl
2
CO
3
(PbCl
2
·PbCO
3
) ↔ 2Pb
2+
+ 2Cl
-
+ CO
3
2-
Uwaga ogólna do poniższych zadań - nie ma substancji z omawianej grupy związków nierozpuszczalnych w wodzie (są
praktycznie nierozpuszczalne) w związku z tym można zapisać równanie dysocjacji dla tych związków pomimo, że w tabeli
rozpuszczalności wynika, że dany związek jest nierozpuszczalny.
1. Zapisz równania dysocjacji elektrolitycznej następujących kwasów tlenowych i uszereguj jony wg ich wzrastającego stężenia
w roztworze: H
3
AsO
4
;
H
3
BO
3
; HClO; H
2
CO
3
, HClO
4
;
HClO
2
; HClO
4
; H
2
CrO
4
; H
2
Cr
2
O
7
;
HIO
3
;
HMnO
4
;
H
5
OI
6
;
HNO
2
;
HNO
3
;
H
3
PO
4
;
H
4
P
2
O
7
;
HPO
3
; H
2
PHO
3
; H
2
SO
4
;
H
2
SO
3
; H
2
SO
2
; H
2
S
2
O
8
; H
2
SO
5
;
H
2
S
2
O
3
; H
2
SiO
3
;
H
4
SiO
4
;
H
6
TeO
6
2. Zapisz równania dysocjacji elektrolitycznej następujących kwasów beztlenowych I uszereguj jony wg wzrastającego ich stężenia
w roztworze: HF;
HCl;
HBr;
HI;
H
2
S;
H
2
Se;
H
2
Te;
HCN.
3. Zapisz równania dysocjacji elektrolitycznej następujących wodorotlenków i uszereguj jony wg wzrastającego ich stężenia w roztworze:
NaOH;
Ca(OH)
2
;
Ba(OH)
2
;
Fe(OH)
3
;
Fe(OH)
2
;
Cr(OH)
3
;
Mn(OH)
4
;
NH
4
·H
2
O;
Al(OH)
3
4. Zapisz równania dysocjacji po stopieniu soli lub zapisz, że sól ulga rozkładowi:
NaHCO
3
;
NaCl; ;
NaBr;
PbCl
2
;
RbNO
3
;
ZnSO
4
;
KMnO
4
;
K
2
Cr
2
O
7
;
K
2
CrO
4
;
AlPO
4
;
(NH
4
)CO
3
;
NH
4
Cl
5. Zapisz równania dysocjacji elektrolitycznej soli w roztworach wodnych i uszereguj jony wg wzrastającego ich stężenia
w roztworze: CuSO
4
·5H
2
O; Al(OH)
2
Cl; MgSO
4
·7H
2
O;
NaCr(SO
4
)
2
·12H
2
O;
Ca(HCO
3
)
2
,
NaHSO
4
;
(NH
4
)
2
CO
3
;
(NH
4
)Fe(SO
4
)
2·
12H2O;
KMnO
4
;
(NH
4
)
2
Cr
2
O
7
,
K
2
MnO
4
;
AlCl
3
,
K
3
PO
4
,
NH
4
K
2
PO
4
;
Al(NO
3
)
3
;
Fe
2
(SO
4
)
3
;
FeSO
4.
6. W 100g wody rozpuszczono 5g chloru glinu i 5 g chlorku żelaza(III). W którym jest się większe stężenie anionów chlorkowych?
(odp. w roztworze chlorku glinu: 0,1136mola, w roztworze chlorku żelaza 0,093mola).
7. W tej samej objętości wody rozpuszczono po 10g dichromianu(VI) potasu i chromianu(VI) potasu. W którym roztworze jest mniejsze
stężenie kationów potasowych? (odp. w roztworze dichromianu 0,068mola, w roztworze chromianu 0,103mola).
8. Podaj wzory sumaryczne związków chemicznych, które w roztworze wodnym dysocjują na następujące jony:
a) Ca
+
; H
+
, PO
4
3-
;
b) Ca
2+
, OH
-
, Br
-
;
c) K
+
, [Al(OH)
6
]
3-
;
d) Na
+
, H
+
, HPO
4
2-
, PO
4
3-
;
e) Al
3+
, SO
4
2-
.
9. Do wody wprowadzono następujące substancje: H
2
O
2
; NaH; NH
3
; N
2
O
5
; HI; SiH
4
; BeO; Mg; H
2
Te; Cl
2
; CO
2
; CO; SiO
2
; Na
2
SiO
3
;
K
2
CO
3
; CH
3
COO(NH
4
); CaO; Które roztwory w/w substancji będą miały: - odczyn obojętny, - zasadowy, - odczyn kwasowy?
10. Jodek, wodorek i tlenek potasu są związkami jonowymi, kryształy tworzą kationy potasu oraz aniony: I
-
, H
-
i O
2-
. Jeżeli wszystkie
próbki w/w związków mają po 10g, to w której próbce znajduje się największa liczba wszystkich jonów?
(odp. KH - 0,5mola, K2O - 0,32mola, KI - 0,12 mola).
11. Roztwór zawiera masowo: 10% KBr; 10% KI; 10% NaBr. Uszereguj jony wg wzrastającego ich stężenia w rozworze
(odp. I
-
< Na
+
< K
+
< Br
-
)
Wyszukiwarka
Podobne podstrony:
DYSOCJACJA JONOWA
Dysocjacja jonowa soli(1)
Dysocjacja jonowa, Wypracowania do szkoły, Chemia
Dysocjacja Jonowa, ŚCIĄGI
Chemia - Dysocjacja jonowa, Ściągi (liceum)
Dysocjacja jonowa (elektrolityczna), pH roztworów
Dysocjacja jonowa zasad
Dysocjacja jonowa soli
kartkówka dysocjacja jonowa soli
Dysocjacja Jonowa
06 Psych zaburz z somatoformiczne i dysocjacyjne
11 WYMIANA JONOWAid 12683 ppt
Dysocjacja elektrolityczna
psychopatologia 10 zaburzenia dysocjacyjne
Moduł III cz 2 stała i stopien dysocjacji, zobojetnianie
więcej podobnych podstron