
Aktualizacja: 29.09.2014
41. OTRZYMYWANIE KWASU FOSFOROWEGO METODĄ EKSTRAKCYJNĄ
I. ZAŁOŻENIA DO WYKONANIA ĆWICZENIA:
1. Surowiec fosforowy: 30g, Ca
3
(PO
4
)
2
2. zawartość CaO w surowcu fosforowym wynosi: ……. % (obliczyć przed zajęciami)
3. zawartość P
2
O
5
w surowcu fosforowym wynosi: ……. %, (obliczyć przed zajęciami)
4. stężenie H
2
SO
4
w zakresie: 50- 80 %
,
5. nadmiar H
2
SO
4
wynosi 50-70 %
*
,
6. temperatura procesu: 80-90
°C
*
,
7. liczba pobieranych próbek do analizy: 4,
8. częstotliwość pobierania próbek: 30 min.,
9. objętość pobieranej próbki (zawiesina): 1-2 cm
3
.
Wykaz sprzętu:
1. kolba trójszyjna poj. 250 cm
3
– 1 szt.,
2. mieszadło mechaniczne – 1 szt.,
3. termopara,
4. łaźnia wodna – 1 szt.,
5. kolba miarowa poj. 100 cm
3
– 2 szt.,
6. kolba stożkowa poj. 50 cm
3
– 4 szt.,
7. pipeta 2 cm
3
– 1 szt.,
8. pipeta jednomiarowa 10 cm
3
– 2 szt.,
9. biureta 25 cm
3
– 1 szt.,
10. cylinder miarowy poj. 250, 50 cm
3
, - po 1 szt.
11. lejek zwykły – 1szt,
12. lejek nasypowy – 1 szt,
13. łyżka – 1 szt,
14. kubek plastikowy – 1 szt,
15. zlewki: 50, 250 ml – po 1 szt.
16. łopatka szklana, wygięta – 1 szt.
17. zestaw do sączenia pod zmniejszonym ciśnieniem:
- pipeta do pobierania próbki – 2szt;
- lejek ze spiekiem – 2 szt;
- probówka ze szlifem o poj. 10 cm
3
– 2 szt,
- nasadka do sączenia – 1 szt.
- kolbka ssawkowa poj. 50 i 250 cm
3
– po1 szt
- lejek Buchnera – 1 szt.
Wykaz odczynników:
Surowiec fosforowy,
Kwas siarkowy 70%,
0,5 N NaOH,
oranż metylowy,
fenoloftaleina,
*
- Podaje prowadzący.
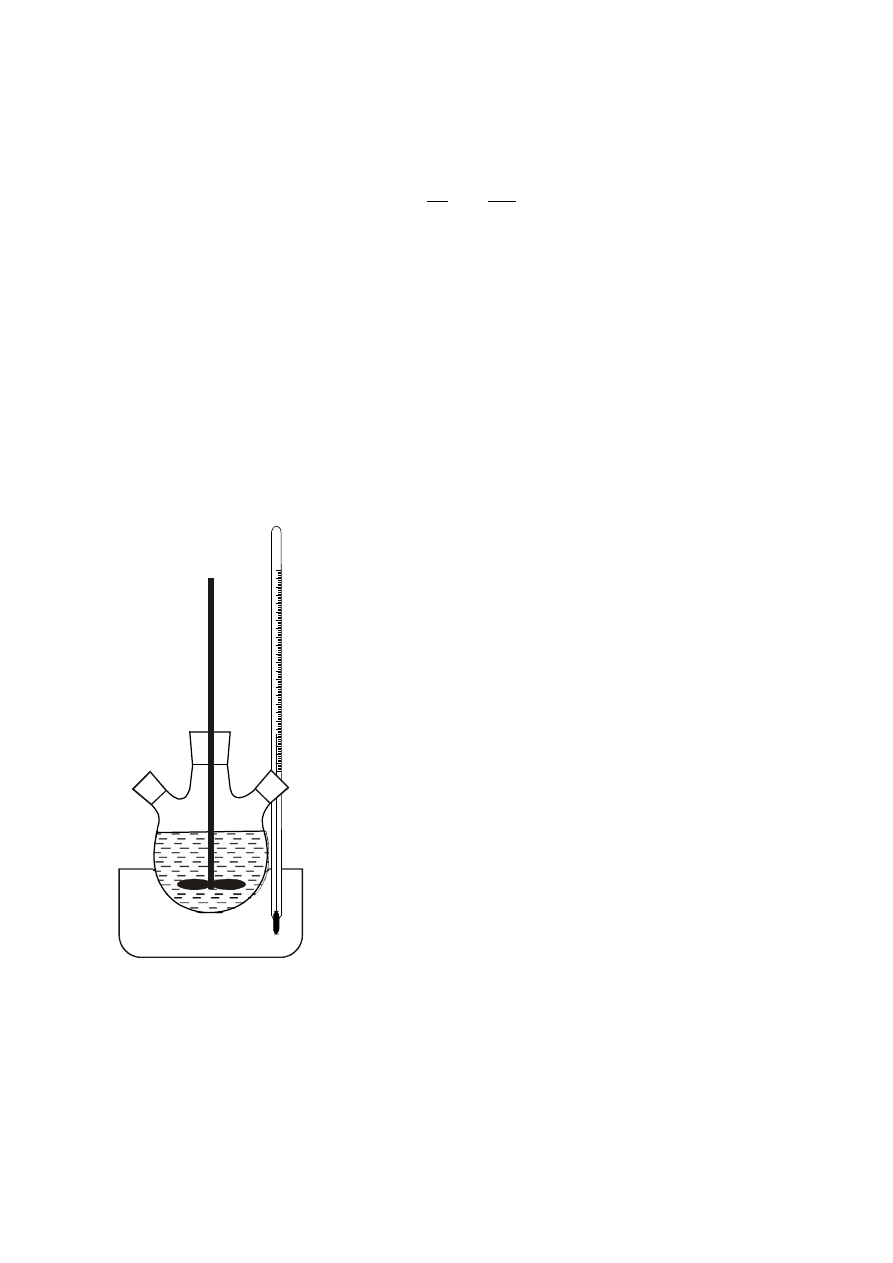
II. SPOSÓB PROWADZENIA PROCESU:
Na wadze technicznej odważyć określoną ilość surowca fosforowego i obliczyć
zapotrzebowanie kwasu siarkowego do ekstrakcji ze stechiometrii (lub wzoru):
V = Z
t
·
cd
m (1 +
100
n )
gdzie:
V – zapotrzebowanie kwasu siarkowego (w cm
3
) o stężeniu c i gęstości d,
Z
t
– teoretyczne zapotrzebowanie kwasu siarkowego na 100 g surowca fosforowego,
m – masa surowca fosforowego w gramach,
n – nadmiar kwasu siarkowego w %,
c – stężenie kwasu siarkowego w %,
d – gęstość kwasu siarkowego w g/dm
3
.
Zmontować zestaw reakcyjny z powierzonego szkła. Sprawdzić prawidłowość pracy
zestawu reakcyjnego bez obciążania reaktora surowcami!
Przygotować kwas siarkowy o zadanym stężeniu w
wyznaczonej ilości z kwasu o większym stężeniu (wymagana
znajomość stosownych obliczeń). Gęstości kwasu siarkowego
potrzebne do obliczeń wyznaczyć przyjmując liniową
zależność gęstości od stężenia kwasu oraz to, że gęstości
kwasu o stężeniu 50 i 95% wynoszą odpowiednio 1,40, 1,83
[g/cm
3
]. Przygotowany kwas siarkowy umieścić w reaktorze,
włączyć termostat i mieszadło, a po uzyskaniu żądanej
temperatury dodać określoną ilość surowca fosforowego.
Boczne szyje kolby zakorkować.
W podanych w założeniach odstępach czasu, pobierać próbki
do analizy na zawartość kwasów w fazie ciekłej. Przez jedną z
szyi kolby pobrać próbkę, przesączyć na lejku ze spiekiem,
następnie ilościowo przenieść do kolby miarowej i dopełnić
wodą destylowaną do objętości 100 cm
3
.
Z kolby miarowej pobrać 10 lub 20 cm
3
próbkę i miareczkować wobec oranżu metylowego –
kwasowość M (dwie analizy). To samo powtórzyć wobec fenoloftaleiny – kwasowość F
(dwie analizy).
2

Kwasowość oblicza się wg wzoru:
p
V
f
m
a
F
M
⋅
⋅
=
)
(
Gdzie:
a – ilość (cm
3
) NaOH zużytego do miareczkowania próbki,
m – miano NaOH (mol/dm
3
),
f – mnożnik uściślający miano, przyjąć 1.
V
p
– objętość stężonego roztworu miareczkowanej próbki (cm
3
).
Po zakończeniu procesu ekstrakcji ochłodzić mieszaninę reakcyjną do temperatury pokojowej
i oddzielić osad fosfogipsu od fazy ciekłej, sącząc na lejku Buchnera. Zmierzyć objętość
filtratu. Fosfogips przepłukać na sączku 200 cm
3
wody, wyznaczyć objętość filtratu i
wyznaczyć kwasowości próbki. Do wyznaczenia kwasowości pobrać po 2 cm
3
przesączu i dla
wygody dodać do kolby 10 cm
3
wody przed miareczkowaniem.
Po zakończeniu ćwiczenia fosfogips zutylizować do wskazanego przez prowadzącego zajęcia
pojemnika. To samo uczynić z przesączami.
III. OBLICZENIA I DYSKUSJA WYNIKÓW
Informacje ogólne:
Gdy:
1. M > F-M, (nadmiar kwasu siarkowego; jest kwas siarkowy w brei)
2. M = F-M,
3. M < F-M (niedomiar kwasu siarkowego; w breji jest H
3
PO
4
i nieprzereagowany
surowiec fosforowy)
Wzory na stężenie molowe kwasu fosforowego:
a) [H
3
PO
4
] = F – M, dla przypadku 1.
b) [H
3
PO
4
] = M, dla przypadku 3.
Wzór na [H
2
SO
4
]
, (mol/dcm
3
), w wariancie zastosowania w nadmiarze z wykorzystaniem
kwasowości M i F ma postać: (2M-F)/2
Wzór na obliczenie stężenia [P
2
O
5
]
, (mol/dcm
3
) w breji, dla obu wariantów z
wykorzystaniem kwasowości M i F ma postać: (F-M)/2.
1. Obliczanie stopnia wykorzystania kwasu siarkowego:
Przy założeniu, że nie ma zmiany objętości reagującej mieszaniny wyznacza się
następująco:
o
M
M
F
SO
H
)
(
3
4
2
−
=
α
3
4
gdzie M
o
– kwasowość mieszaniny reakcyjnej w chwili rozpoczęcia procesu, wyznaczona
przez ekstrapolację. Powinna być jednakowa wobec oranżu metylowego i fenoloftaleiny.
2. Obliczanie całkowitej wydajności procesu
Policzyć na podstawie objętości uzyskanego przesączu końcowego oraz popłuczyn oraz
wyznaczonych w nich zawartości kwasu fosforowego w porównaniu do wartości
stechiometrycznych.
Zestawić dane doświadczalne i obliczenia w tabeli poniżej (wzór):
Czas
Objętość Temp. Kwasowość M Kwasowość F [H
2
SO
4
] [H
3
PO
4
]
α
H2SO4
[P
2
O
5
]
min.
dm
3
°C
cm
3
0.5
M NaOH
mol/
dm
3
cm
3
0.5 M
NaOH
mol/
dm
3
mol/dm
3
mol/dm
3
-
mol/dm
3
0
-
30
-
…
-
Przesącz
końc.
Popłuczyny
-
-
Wyniki badań należy przedstawić graficznie wykreślając: a) M=f(
τ); b) F=f(τ); c)
[H
3
PO
4
]=f(
τ). Wykresy 1. i 2. pozwalają oszacować wartość M
o
potrzebnej do obliczenia
wydajności procesu; Wykres 3. pozwala na określenie niezbędnego czasu ekstrakcji.
W sprawozdaniu powinny się znaleźć wszystkie obliczenia włącznie z ewentualnym
wyprowadzaniem niezbędnych wzorów.
Document Outline
- Wykaz sprzętu:
- 1. kolba trójszyjna poj. 250 cm3 – 1 szt.,
- 2. mieszadło mechaniczne – 1 szt.,
- 3. termopara,
- 4. łaźnia wodna – 1 szt.,
- 5. kolba miarowa poj. 100 cm3 – 2 szt.,
- 6. kolba stożkowa poj. 50 cm3 – 4 szt.,
- 7. pipeta 2 cm3 – 1 szt.,
- 8. pipeta jednomiarowa 10 cm3 – 2 szt.,
- 9. biureta 25 cm3 – 1 szt.,
- 10. cylinder miarowy poj. 250, 50 cm3, - po 1 szt.
- 11. lejek zwykły – 1szt,
- 12. lejek nasypowy – 1 szt,
- 13. łyżka – 1 szt,
- 14. kubek plastikowy – 1 szt,
- 15. zlewki: 50, 250 ml – po 1 szt.
- 16. łopatka szklana, wygięta – 1 szt.
- 17. zestaw do sączenia pod zmniejszonym ciśnieniem:
- - pipeta do pobierania próbki – 2szt;
- - lejek ze spiekiem – 2 szt;
- - probówka ze szlifem o poj. 10 cm3 – 2 szt,
- - nasadka do sączenia – 1 szt.
- - kolbka ssawkowa poj. 50 i 250 cm3 – po1 szt
- - lejek Buchnera – 1 szt.
- Wykaz odczynników:
- Surowiec fosforowy,
- Kwas siarkowy 70%,
- 0,5 N NaOH,
- oranż metylowy,
- fenoloftaleina,
- Gdy:
- 1. M > F-M, (nadmiar kwasu siarkowego; jest kwas siarkowy w brei)
- 2. M = F-M,
- 3. M < F-M (niedomiar kwasu siarkowego; w breji jest H3PO4 i nieprzereagowany surowiec fosforowy)
- Wzory na stężenie molowe kwasu fosforowego:
- a) [H3PO4] = F – M, dla przypadku 1.
- b) [H3PO4] = M, dla przypadku 3.
- Wzór na [H2SO4], (mol/dcm3), w wariancie zastosowania w nadmiarze z wykorzystaniem kwasowości M i F ma postać: (2M-F)/2
- Wzór na obliczenie stężenia [P2O5], (mol/dcm3) w breji, dla obu wariantów z wykorzystaniem kwasowości M i F ma postać: (F-M)/2.
- 1. Obliczanie stopnia wykorzystania kwasu siarkowego:
- Przy założeniu, że nie ma zmiany objętości reagującej mieszaniny wyznacza się następująco:
- gdzie Mo – kwasowość mieszaniny reakcyjnej w chwili rozpoczęcia procesu, wyznaczona przez ekstrapolację. Powinna być jednakowa wobec oranżu metylowego i fenoloftaleiny.
- 2. Obliczanie całkowitej wydajności procesu
- Policzyć na podstawie objętości uzyskanego przesączu końcowego oraz popłuczyn oraz wyznaczonych w nich zawartości kwasu fosforowego w porównaniu do wartości stechiometrycznych.
- Zestawić dane doświadczalne i obliczenia w tabeli poniżej (wzór):
- Czas
- Objętość
- Temp.
- Kwasowość M
- Kwasowość F
- [H2SO4]
- [H3PO4]
- (H2SO4
- [P2O5]
- min.
- dm3
- (C
- cm3 0.5 M NaOH
- mol/
- dm3
- cm3 0.5 M NaOH
- mol/
- dm3
- mol/dm3
- mol/dm3
- -
- mol/dm3
- 0
- -
- 30
- -
- …
- -
- Przesącz końc.
- Popłuczyny
- -
- -
- Wyniki badań należy przedstawić graficznie wykreślając: a) M=f((); b) F=f((); c) [H3PO4]=f((). Wykresy 1. i 2. pozwalają oszacować wartość Mo potrzebnej do obliczenia wydajności procesu; Wykres 3. pozwala na określenie niezbędnego czasu ekstrakcji.
Wyszukiwarka
Podobne podstrony:
Kwas fosforomolibdenowy
Kwas fosforowolframowy hydrat
Kwas o fosforowy r ru
kwas fosforowy (V), CAŁOŚĆ - poprawione, 1
Kwas fosforomolibdenowy hydrat
kwas fosforowy (V), Kwas fosforowy Sankey ciepło
Kwas o fosforowy r r?
KWAS FOSFOROWY(V), BHP KARTA CHARAKTERYSTYKI SUBSTANCJI NIEBEZPIECZNEJ
kwas fosforowy V, plakaty (GOTOWE DO WYDRUKOWANIA) jeden cały folder to jeden plakat formatu A1, che
kwas fosforowy (V), Kwas fosforowy Sankey masa
Kwas fosforowy dysocjuje 3 stopniowo w wyniku czego powstają sole 1
Kwas m fosforowy
Kwas fosforowy V
więcej podobnych podstron