
Kwas fosforowy V

Wzór sumaryczny
H
2
SO
4
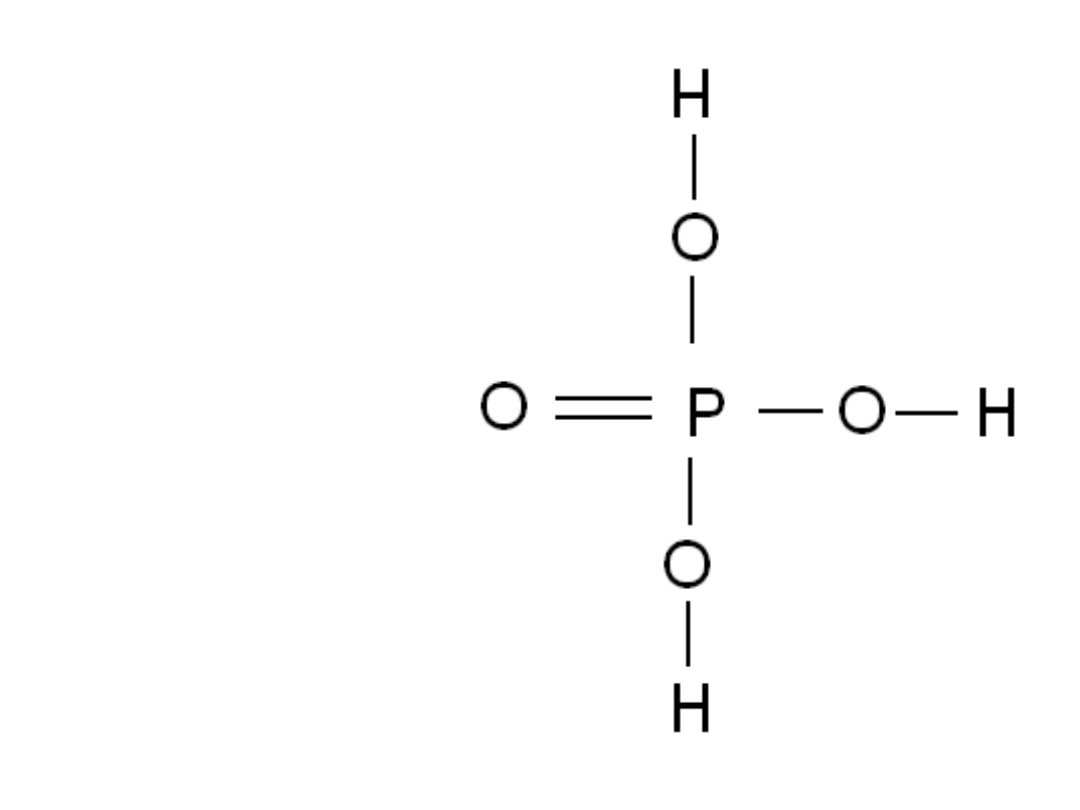
Wzór strukturalny
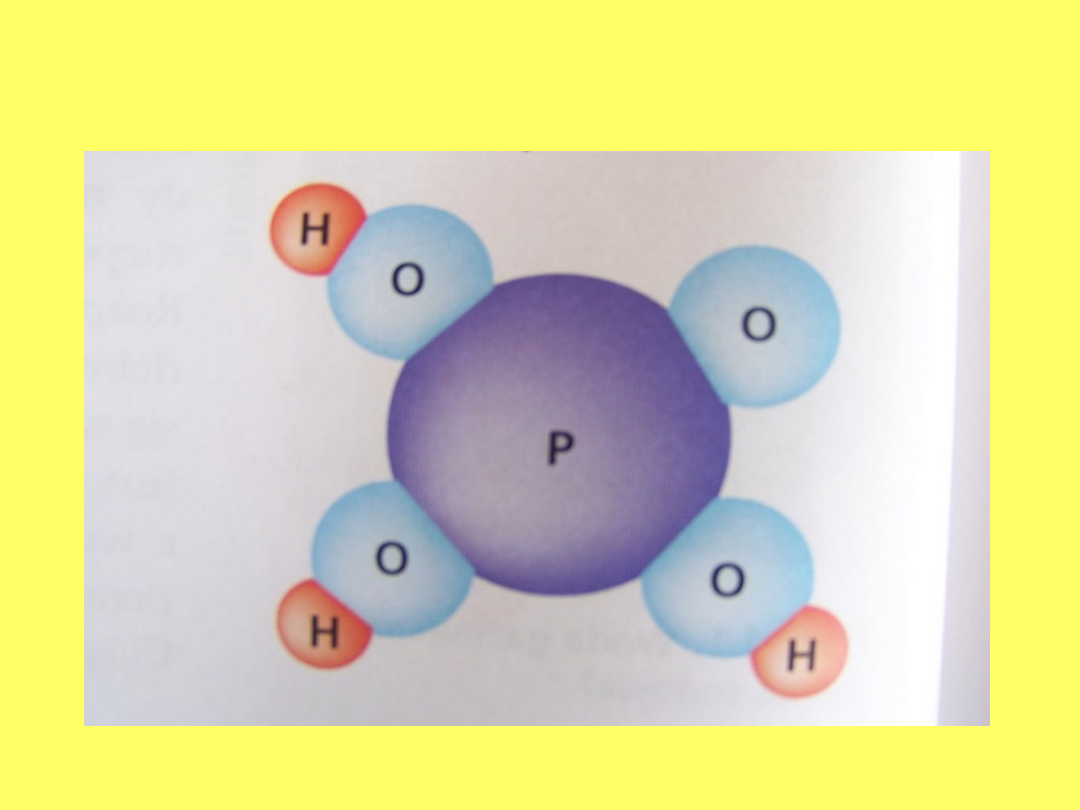
Model cząsteczki:

OTRZYMYWANIE

• Kwas fosforowy otrzymuje się w reakcji
tlenku fosforu (V) i wody
P
4
O
10
+ 6H
2
O → 4H
3
PO
4
• W przemyśle otrzymuje się go w
wyniku działania kwasu siarkowego(VI)
na ortofosforan(V) wapnia, którego
źródłem są minerały apatyt i fosforyt a
czasami także zmielone kości zwierząt:
Ca3(PO4)2 + 3 H2SO4 → 3 CaSO4 + 2
H3PO4

• Kwas ortofosforowy(V) powstaje
również podczas działania na fosfor
czerwony kwasem azotowym:
3P + 5HNO
3
+ 2H
2
O → 3H
3
PO
4
+
5 NO.
*Reakcja ta jest niebezpieczna i może
przebiegać wybuchowo.

WŁAŚCIWOŚCI FIZYCZNE I
CHEMICZNE

Kwas fosforowy (V)to :
• białe, krystaliczne ciało stałe o temperaturze
topnienia 42,3 °C,
• dobrze rozpuszczalne w wodzie (670g / 100g wody
w temp. 25 °C).
• W zastosowaniach laboratoryjnych i
przemysłowych stosuje się jednak zwykle 85-90%
roztwór tego kwasu w wodzie, o konsystencji
gęstego syropu.
• Kwas ten nie posiada silnych własności
utleniających .
• Jest kwasem trójprotonowym o średniej mocy o
stałych dysocjacji:
H
3
PO
4
→ H
2
PO
4
-
+ H
+
; K
1
=1,1×10
-2
;
H
2
PO
4
-
→ HPO
4
2-
+ H
+
; K
2
=1,2×10
-7
;
HPO
4
2-
→ PO
4
3-
+ H
+
; K
3
=1,8×10
-12
;

ZASTOSOWANIE

Kwas ortofosforowy(V) stosowany
głównie do wyrobu nawozów
sztucznych (np. superfosfatu
podwójnego).
-w przemyśle spożywczym jest
stosowany jako dodatek do napojów
gazowanych (np.Coca-Coli) jako
regulator kwasowości (symbol E
338).
-stosowany jest też do wytwarzania
fosforanowych(V) powłok
ochronnych na metalach, stali.

-do wytwarzania wielu środków
farmaceutycznych, --oczyszczania soków w
cukrownictwie,
-odkamieniania armatury w ciepłownictwie,
-jako płyn do lutowania,
-w stomatologii, do wyrobu kitów
porcelanowych,
- w lecznictwie i laboratoriach analitycznych.
-Jest także składnikiem fosolu - odrdzewiacza
do

•Fosfor jest powszechnie
uważany za niemetal, ale
jedna z jego odmian – fosfor
czarny ma metaliczny
połysk, przewodzi prąd i
jest dobrym przewodnikiem
ciepła.

KONIEC
!!!
Document Outline
- Slide 1
- Slide 2
- Wzór strukturalny
- Model cząsteczki:
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Kwas fosforowy (V)to :
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
Wyszukiwarka
Podobne podstrony:
kwas fosforowy
Kwas fosforomolibdenowy
Kwas fosforowolframowy hydrat
Kwas o fosforowy r ru
kwas fosforowy (V), CAŁOŚĆ - poprawione, 1
Kwas fosforomolibdenowy hydrat
więcej podobnych podstron