
Katedra Chemii Fizycznej Uniwersytetu Łódzkiego
Badanie zjawiska pęcznienia żelatyny w wodzie
ćwiczenie nr 7
opracowała dr A. Pietrzak
Zakres zagadnień obowiązujących do ćwiczenia
1. Układy koloidalne – struktura i właściwości.
2. Metody otrzymywania koloidów.
3. Stopień dyspersji a trwałość koloidu.
4. Zależność koagulacji od potencjału elektrokinetycznego.
5. Zależność pęcznienia od pH roztworu.
Literatura
1. Praca zbiorowa pod red. Woźnickiej J. i Piekarskiego H., Ćwiczenia laboratoryjne
z chemii fizycznej, Wydawnictwo UŁ, Łódź 2005.
2. Brdička R., Podstawy chemii fizycznej, PWN, Warszawa 1970.
3. Praca zbiorowa pod red. Bielańskiego A., Chemia fizyczna, PWN, Warszawa 1980.
4. Sobczyk L., Kisza A., Gatner K., Koll A., Eksperymentalna chemia fizyczna, PWN,
Warszawa 1982.
5. Barrow G.M., Chemia fizyczna, PWN, Warszawa 1978.
6. Sobczyk L., Kisza A., Chemia fizyczna dla przyrodników, PWN, Warszawa 1981.
7. Dutkiewicz E., Fizykochemia powierzchni, WNT, Warszawa 1998.
8. Gumiński K., Wykłady z chemii fizycznej, PWN, Warszawa 1973.

2
Celem ćwiczenia jest wyznaczenie punktu izoelektrycznego żelatyny w roztworze
wodnym na podstawie zależności stopnia pęcznienia P od pH badanych roztworów.
Stopień pęcznienia żelu P wyrażony w procentach określa się następująco:
P
m
m
w
żel
=
⋅
100%
gdzie: m
w
−
masa pochłoniętej wody przez żelatynę, m
żel
−
masa suchego żelu.
Minimalna wartość P świadczy o maksymalnym przestrzennym usieciowaniu struktury
żelatyny.
Odczynniki chemiczne i sprzęt laboratoryjny:
CH
3
COOH (c = 0,1 mol dm
-3
), CH
3
COONa (c = 0,1 mol dm
-3
), żelatyna spożywcza
w płatkach,
7 kolbek stożkowych (50 cm
3
), 2 szalki Petriego, lejek, bagietka, pęseta, bibuła filtracyjna,
2 pipety - 1ml i 5ml, folia aluminiowa, odważniki, stoper.
Wykonanie ćwiczenia i przedstawienie wyników pomiarów
1.
Sporządzić 7 roztworów buforu octanowego w odpowiednio oznakowanych kolbkach
stożkowych o pojemności 50 cm
3
przez zmieszanie mianowanych roztworów CH
3
COOH
i CH
3
COONa w stosunkach objętościowych podanych w tabeli wyników pomiarów.
2.
Przygotować 7 listków folii aluminiowej o wymiarach ok. 10×10cm i zważyć je na wadze
analitycznej.
3.
Umieścić na każdym z nich po płatku żelatyny o wymiarach ok. 2 × 3 cm.
4.
Zważyć listki wraz z żelatyną na wadze analitycznej.
5.
Do kolbki z roztworem buforowym dodać płatek żelatyny. Roztwór wraz
z żelatyną zamieszać i pozostawić na okres 3 minut w temperaturze otoczenia w celu
spęcznienia żelatyny.
Uwaga: Proces pęcznienia należy prowadzić jednocześnie co najwyżej w dwóch kolbkach
(a nie od razu w siedmiu)w odstępach przynajmniej jednominutowych, ze względu na
konieczność zachowania podobnych warunków pomiaru we wszystkich roztworach.
Należy zachować jednakowy czas pęcznienia żelatyny dla wszystkich próbek, ponieważ
badanego
procesu
nie
doprowadza
się
do
stanu
stacjonarnego.
Zatem,
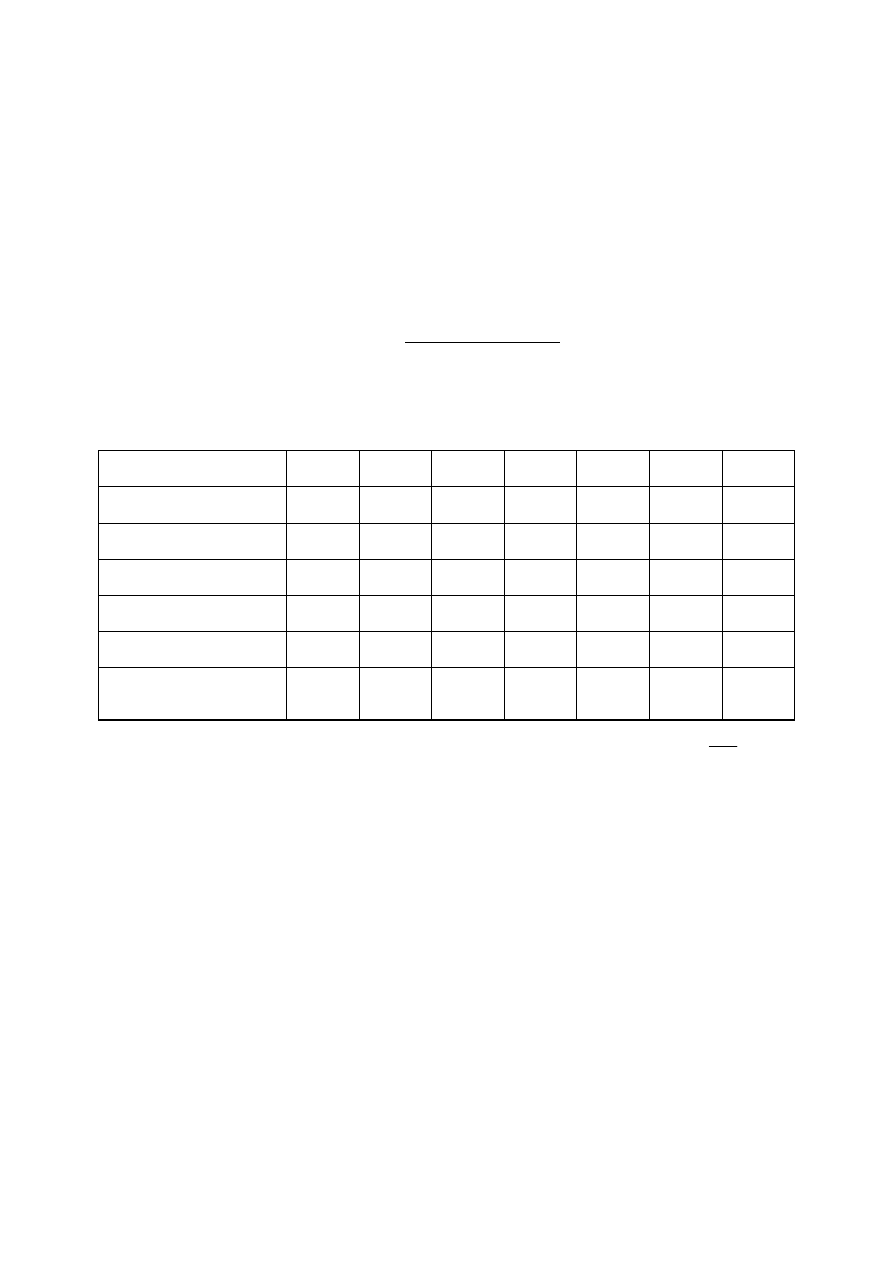
3
w przeprowadzonym eksperymencie miarą pęcznienia będzie ilość pochłoniętej wody
przez żelatynę w określonym czasie.
6.
Po upływie 3 minut oddzielić roztwór od napęczniałej żelatyny. W tym celu należy całą
zawartość
kolbki
przenieść
na
bibułę
filtracyjną
umieszczoną
w
lejku
i odsączyć roztwór przy użyciu pompki wodnej.
7.
Przy użyciu pęsety, umieścić płatek napęczniałej żelatyny na suchej bibule filtracyjnej
w szalce Petriego i delikatnie osuszyć.
8.
Zważyć osuszony płatek żelatyny w szczelnie zawiniętym listku folii aluminiowej (woda
‘niezwiązana’, obecna na żelatynie uniemożliwia dokładne ważenie).
9.
Czynności opisane w punktach 4
−
8 powtórzyć dla wszystkich badanych próbek.
Tabela wyników pomiarów:
Numer kolbki
1
2
3
4
5
6
7
Objętość CH
3
COOH [ml]
30
30
15
10
5
1
1
Objętość CH
3
COONa [ml]
1
5
15
20
30
20
30
pH buforu octanowego
Masa folii aliminiowej m
0
[g]
Masa suchej żelatyny +
folia aluminiowa m
0+żel
[g]
Masa
żelatyny
po
pęcznieniu
+
folia
aluminiowa m
0+żel+w
[g]
Uwaga: Wartość pH buforu octanowego można obliczyć ze wzoru: pH
p
lg
=
+
K
c
c
a
sol
a
gdzie: pK
a
– ujemny logarytm stałej dysocjacji kwasu octowego, c
a
– stężenie molowe kwasu,
c
sol
– stężenie molowe soli tego kwasu z mocną zasadą w danym roztworze buforowym
dla każdej próbki.
Opracowanie i dyskusja wyników pomiarów
1.
Obliczyć masę suchej żelatyny m
żel
dla każdej próbki.
2.
Wyznaczyć masę wody pochłoniętej przez żelatynę m
w
(różnica pomiędzy masą żelatyny
po pęcznieniu a masą suchej żelatyny).
3.
Obliczyć stopień pęcznienia P[%] żelatyny dla każdej próbki.
4.
W tabeli wyników obliczeń zamieścić wartości stopnia pęcznienia żelatyny
odpowiadające roztworom o określonym pH.
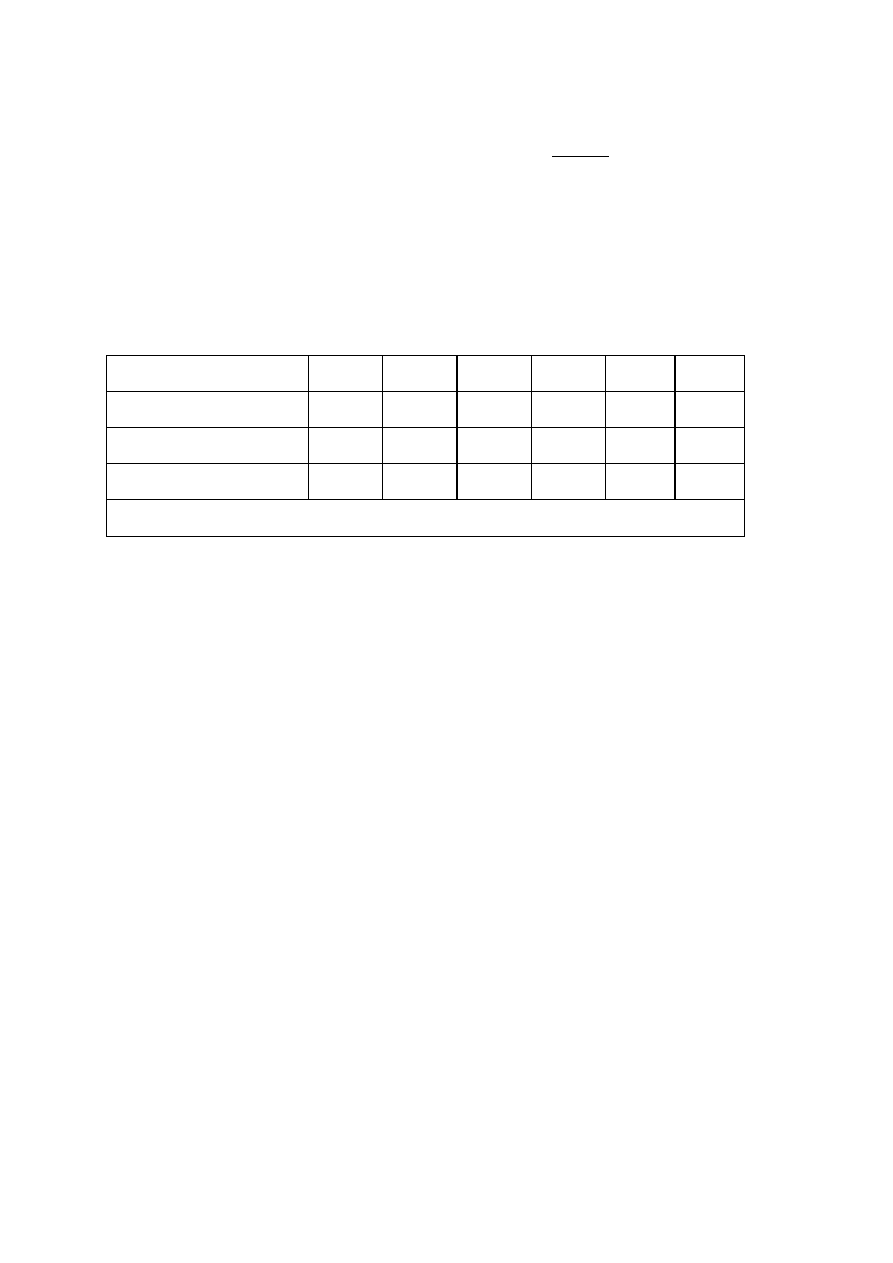
4
5.
Sporządzić wykres zależności P = f(pH) i określić punkt izoelektryczny żelatyny
na podstawie położenia minimum uzyskanej funkcji. Uwaga: badana zależność jest
funkcją potęgową drugiego stopnia. Zatem położenie minimum funkcji można określić
wiedząc, że jej pierwsza pochodna jest równa zeru w tym punkcie.
6.
Zinterpretować położenie minimum na wykresie z punktu widzenia budowy żelatyny jako
białka.
Tabela wyników obliczeń:
pH roztworu
Masa suchej żelatyny m
żel
[g]
Masa wody pochłoniętej przez
żelatynę m
w
[g]
Stopień pęcznienia P [%]
Punkt izoelektryczny pH
Wyszukiwarka
Podobne podstrony:
EŚT 07 Użytkowanie środków transportu
07 Windows
07 MOTYWACJAid 6731 ppt
Planowanie strategiczne i operac Konferencja AWF 18 X 07
Wyklad 2 TM 07 03 09
ankieta 07 08
Szkol Okres Pracodawcy 07 Koszty wypadków
Wyk 07 Osprz t Koparki
zarządzanie projektem pkt 07
Prezentacja NFIN 07
6 Zagrozenia biosfery 07 05 05
więcej podobnych podstron