
1. Napisać wzór dowolnego tripeptydu utworzonego z aminokwasów: obojętnego,
kwaśnego, i zasadowego. Podać jego nazwę oraz zaznaczyć wiązanie peptydowe
2. Co rozumiemy pod pojęciami I- i II-rzędowej struktury białka? Wymienić typy wiązań
odpowiedzialnych za tworzenie tych struktur. Które z nich to wiązania kowalencyjne a
które niekowalencyjne?
Struktura pierwszorzędowa białka to liniowa sekwencja aminokwasów połączonych wiązaniami peptydowymi (wiązanie
kowalencyjne). Sekwencję tę wyznacza się na odstawie kolejności ułożenia zasad azotowych w genie kodującym dane
białko. W strukturze pierwszorzędnej zawarte jest również położenie wszystkich innych wiązań kowalencyjnych. Są to
głównie wiązania dwusiarczkowe, między resztami cysteiny, sąsiadującymi ze sobą w przestrzeni, ale nie w sekwencji
liniowej aminokwasów.
Struktura drugorzędowa to regularne pofałdowanie regionów łańcucha polipeptydowego. Najczęściej wyst ępującymi
sposobami pofałdowania białka są alfa helisa i struktura beta. W alfa helisie, przypominającej spiralę tlen karbonylowy
każdego wiązania peptydowego jest połączony wiązaniem wodorowym (wiązanie niekowalencyjne) z wodorem grupy
aminowej czwartego z kolei aminokwasu. W strukturze beta wiązania wodorowe powstają między wiązaniami peptydowymi
różnych łańcuchów polipeptydowych lub różnych części tego samego łańcucha polipeptydowego. Struktura ta przypomina
poładowaną kartkę.
3. Na czym polega zjawisko izomerii optycznej ? Do jakiego szeregu izomerii optycznej
należą aminokwasy białkowe ?
Izomeria optyczna - rodzaj izomerii konfiguracyjnej, która polega na występowaniu związków chemicznych w dwóch
postaciach wykazujących przeciwną aktywność optyczną. Pary takich izomerów nazywa się enancjomerami, a ich istnienie
jest związane z cechą związków chemicznych zwaną chiralnością. Enancjomery danego związku stanowią swoje wzajemnie
nienakładalne odbicia lustrzane. Izomery odgrywają bardzo ważną rolę w procesach ży ciowych zwierząt, gdyż tylko
najczęściej jeden izomer substancji jest przez nie przyswajalny i bierze udział w konkretnej reakcji. w biosyntezie białka,
aktywne są tylko tzw. „L-aminokwasy” (szereg „D” nie jest tolerowany”).
4. Napisz wzór ATP, nazwij jego składniki i rodzaje wiązań w nim występujące. Jaka jest
rola tego związku w komórce?
Odgrywa ważną rolę w biologii komórki, jako wielofunkcyjny koenzym i molekularna jednostka w wewnątrzkomórkowym
transporcie energii. Stanowi nośnik energii chemicznej używanej w metabolizmie komórki. Powstaje jako magazyn energii w
procesach fotosyntezy i oddychania komórkowego. Zużywają go liczne enzymy, a zgromadzona w nim energia służy do
przeprowadzania różnorodnych procesów, jak biosyntezy, ruchu i podziału komórki. Inny izomer optyczny tej samej
substancji jest albo obojętny dla organizmu i nie bierze udziału w procesach biochemicznych, albo jest szkodliwy –
powoduje inny przebieg reakcji.
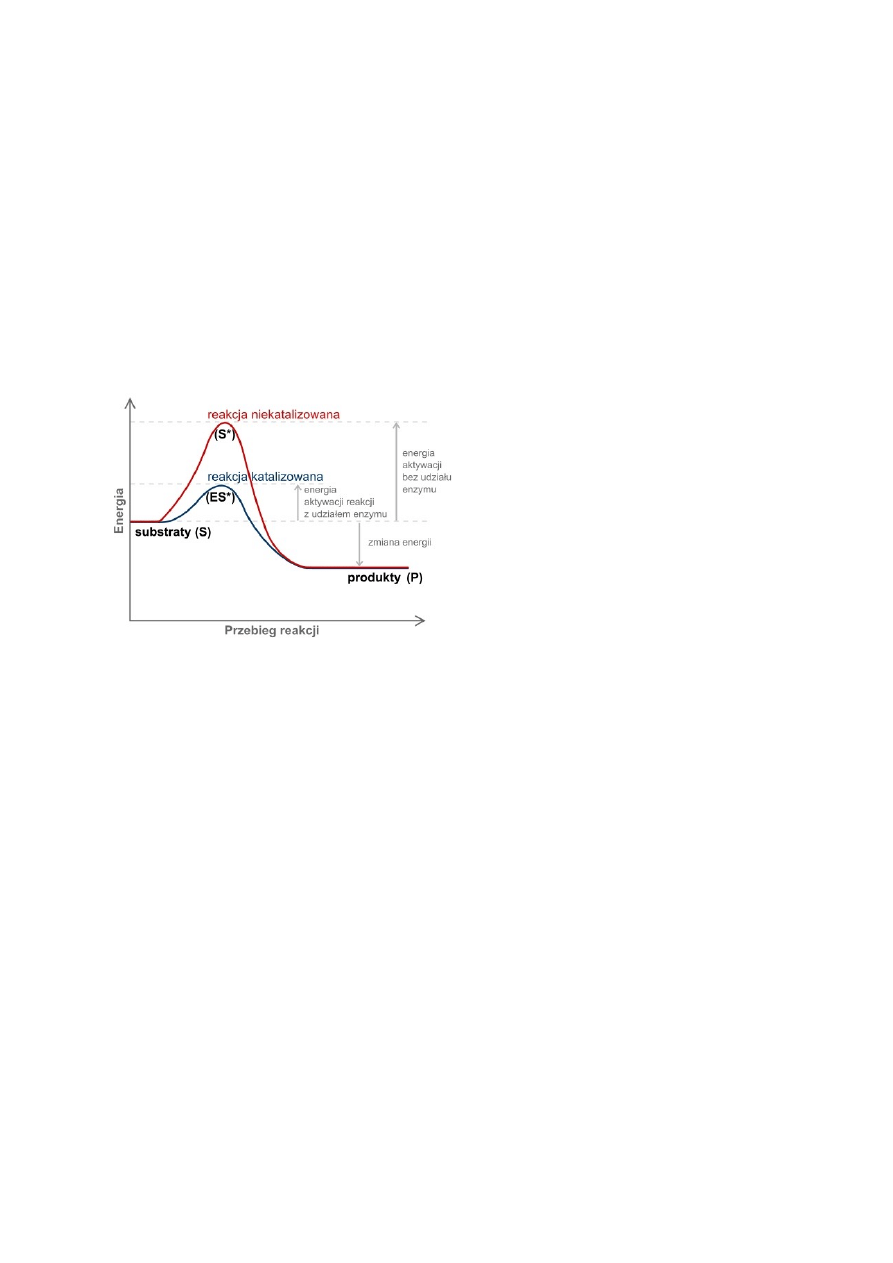
5. Zdefiniuj pojęcia energii aktywacji i stanu prze jściowego. Przedstaw graficznie i objaśnij
zmiany energii swobodnej zachodzące podczas reakcji katalizowanej i niekatalizowanej.
Energia aktywacji jest - podawaną często w przeliczeniu na 1 mol substancji - wielkością bariery energetycznej (w skali
mikroskopowej - bariera potencjału), którą musi pokonać układ reagujących indywiduów chemicznych, aby doszło do reakcji
chemicznej.
Aby zaszła reakcja biochemiczna musi zostać pokonana bariera energetyczna ( przekształcenie cząsteczki substratu w stan
przejściowy). Stan przejściowy w przebiegu reakcji ma najwieksza energie swobodna. Różnica energii swobodnej miedzy
substratem a stanem przejściowym nazywana jest energia aktywacji.
6. Na czym polega odwracalna modyfikacja kowalencyjna będąca jednym ze sposobów
aktywacji enzymów. Podaj odpowiedni przykład.
Odwracalne modyfikacje kowalencyjne polegają na tworzeniu i rozcinaniu wiązań kowalencyjnych między grupami
niebiałkowymi a cząsteczką enzymu. Chociaż wiele niebiałkowych grup może być odwracalnie dołączanych do enzymów,
wpływając na ich aktywność, najczęstszą modyfikacją jest dodawanie i usuwanie grupy fosforanowej (odpowiednio:
fosforylacja i de fosforylacja). Fosforylacja katalizowana jest przez kinazy białkowe używając często ATP jako donora grupy
fosforanowej, natomiast de fosforylacja jest katalizowana przez fosfatazy białkowe.
7. Co to jest centrum aktywne enzymu? Omówić budowę centrum aktywnego oraz opisać
modele wiązania enzymu z substratem opracowane przez Fishera oraz Koshlanda.
Centrum aktywne enzymu jest regionem, który wiąże substrat i przemienia go w produkt. Zazwyczaj jest to niewielka część
całej cząsteczki enzymu i stanowi określoną trójwymiarową przestrzeń, utworzoną przez reszty aminokwasów, które w
liniowym łańcuchu polipeptydowym mogą leżeć daleko od siebie. Miejsce aktywne jest często szczeliną lub zagłębieniem w
cząsteczce enzymu, które tworzy środowisko w znacznym stopniu niepolarne, co ułatwia wiązanie substratu. Substrat jest
wiązany w miejscu aktywnym przez liczne słabe siły np. siły van der Waalsa, oddziaływania hydrofobowe, wiązania
wodorowe. Po związaniu cząsteczki substratu i utworzeniu kompleksu enzym-substrat, w miejscu aktywnym katalityczne
reszty działają na cząsteczkę substratu tak aby przekształcić go w stan przejściowy, a następnie w produkty, który jest
uwalniany do roztworu. Potem enzym jest wolny i może wiązać kolejne cząsteczki substratu. Zaproponowano dwa modele
wiązania enzymu z substratem. Model Fischera to model zamka i klucza – kształt substratu i aktywnego miejsca enzymu
miałby pasować tak jak klucz do zamka. Oba kształty są uważane za sztywne i utrwalone oraz pasujące do siebie idealnie po
odpowiednim zestawieniu. W modelu Koshlanda – model indukowanego dopasowania – związanie substratu indukuje
zmianę konformacyjną w aktywnym miejscu enzymu. Poza tym enzym może zniekształcić substrat wymuszając w nim
konformację podobną do stanu przejściowego.

8. Na czym polega inhibicja aktywności enzymatycznej. Podaj przykład inhibitora
działającego nieodwracalnie na enzym. Wyjaśnij dlaczego jest to działanie
nieodwracalne ?
Inhibicja aktywności enzymatycznej jest głównym mechanizmem kontroli i regulacji w układach biologicznych. Istnieje
wiele typów cząsteczek, które są zdolne do zakłócania aktywności danego enzymu. Każda cząsteczka działająca
bezpośrednio na enzym w kierunku zmniejszenia jego szybkości katalitycznej jest określana jako inhibitor. Inhibicja taka
może być odwracalna lub nieodwracalna. W inhibicji nieodwracalnej enzym wiąże się z cząsteczką inhibitora za pomocą
wiązań kowalencyjnych. Wiązanie te następuje między cząsteczkami inhibitora a resztami aminokwasów znajdującymi się w
miejscu aktywnym lub jego pobliżu i inaktywuje enzym na stałe. Przykładami inhibitorów działających nieodwracalnie na
enzym są: DIPF, amid kwasu jodooctowego, penicylina.
9. Wymień w odpowiedniej kolejności klasy enzymów. Określ do jakiej klasy należą i jakie
reakcje katalizują: peroksydazy, kinazy, peptydazy, dekarboksylazy
1. Oksydoreduktazy
2. Transferazy
3. Hydrolazy
4. Liazy
5. Izomerazy
6. Ligazy (syntetazy)
Peptydazy (klasa: hydrolazy) - rozkładające wiązania peptydowe w białkach (proteazy) lub w innych peptydach.
Kinazy (klasa: transferazy) - katalizujących reakcję przeniesienia grupy fosforanowej z wysokoenergetycznego związ ku
(takiego jak ATP) na właściwą cząsteczkę docelową. Reakcja ta nazywa się reakcją fosforylacji.
Peroksydazy (klasa: oksydoreduktazy) - katalizują utlenianie nadtlenkiem wodoru różnych substratów.
Dekarboksylazy (klasa: liazy) - katalizujących reakcję dekarboksylacji, czyli usunięcia grupy karboksylowej ze związku
organicznego (najczęściej aminokwasu lub ketokwasu).
10.
Wymień witaminy rozpuszczalne w tłuszczach. Krótko scharakteryzuj dowolną
witaminę należącą do tej grupy.
Witaminy rozpuszczalne w tłuszczach: A, D, E, K, F. Witamina A wpływa na syntezę białek, tłuszczów, hormonów,
właszcza tarczycy, stan skóry, śluzówki, wzrost ciała, procesy widzenia, chroni wątrobę, aktywizuje jej układ
enzymatyczny, zwiększa odporność ustroju na infekcje, utrzymuje odporność immunologiczną, uczestniczy w
metabolizmie węglowodanów i hormonów sterydowych. Witamina A jest niezbędna do prawidłowego wzrostu
i rozwoju nabłonka, podwyższa odporność błon śluzowych, odgrywa ważną rolę w Zaburzenia w organizmie mogą
być związane z brakiem witaminy A (awitaminoza) lub jej nadmiarem w organizmie (hiperwitaminoza)Awitaminoza
to głównie ysychanie rogówki i spojówek oka tzw. /kseroftalmia/, kurza ślepota, choroby skóry, łuszczyca, rogowiec
dłoni, stóp, trądzik pospolity, łysienie plackowate, zmniejszone wydzielanie kwasu solnego żołądka, skłonność do
biegunek.
11. Jaka witamina wchodzi w skład koenzymów: NAD
+
i NADP
+
? Podaj pełne nazwy wymienionych
koenzymów. W jakich procesach metabolicznych bierze udział NAD
+
, a jakich zredukowany NADP ?
Witamina PP (niacyna, amid kwasu nikotynowego) wchodzi w skład tych koenzymów.
NAD
+
- dinukleotyd nikotynoamidoadeninowy utleniony
NADP
+
- fosforan dinukleotydu nikotynoamidoadeninowego utleniony .
Oba koenzymy przenoszą elektrony i biorą udział w reakcjach oksydoredukcyjnych. NAD
+
jest używany w reakcjach
katabolicznych (rozkładu), natomiast NADP
+
w reakcjach anabolicznych (biosyntezy).
12. Co to jest fosforylacja substratowa? Napisać 1 reakcję fosforylacji substratowej zachodzącej podczas
glikolizy lub cyklu kwasu cytrynowego.
Fosforylacja substratowa – reakcja chemiczna, która ma miejsce, gdy reszta fosforanowa zostanie przeniesiona ze związku
ufosforylowanego – substratu – bezpośrednio na ADP przez enzymy, najczęściej z grupy kinaz. Ten sposób wytwarzania
ATP nie wymaga udziału tlenu i zachodzi np. w glikolizie oraz cyklu Krebsa. Ten sposób wytwarzania ATP jest ewolucyjnie
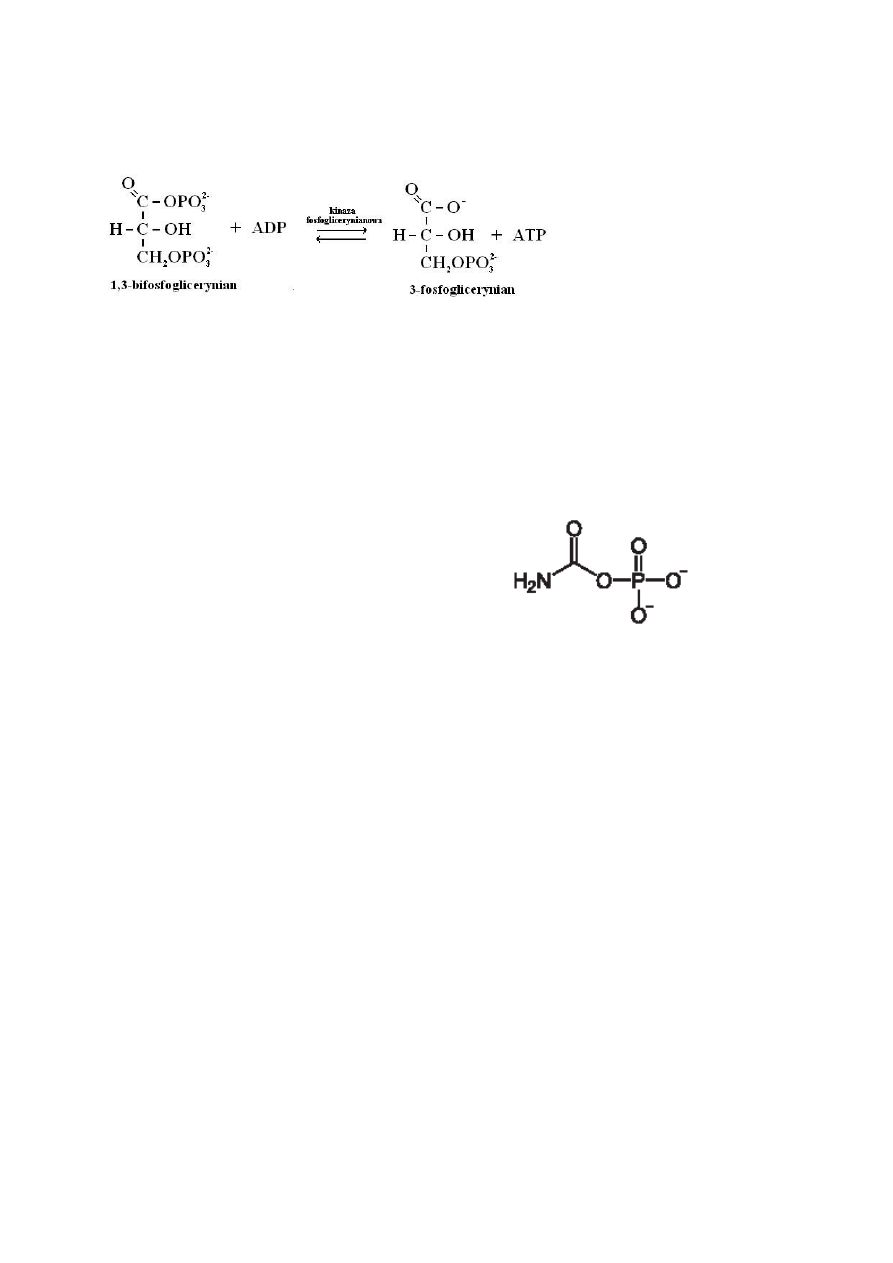
najstarszy, jednak ilość związków, które mogą wejść w reakcję fosforylacji substratowej jest ograniczona. Fosforylacja ta
pozwala, np. mięśniom szkieletowym funkcjonować sprawnie podczas dużego wysiłku fizycznego przy niedostatecznym
dopływie tlenu.
13. W jakiej postaci u zwierząt może być usuwany nadmiar azotu? Podać nazwy i wzory 2
związków, które są donorami grup aminowych w cyklu mocznikowym. W jakich
strukturach subkomórkowych przebiega cykl mocznikowy u zwierząt?
Nadmiar azotu jest przekształcany w amoniak, a następnie jest wydalany przez żywe organizmy na różne sposoby.
Wiele zwierząt lądowych wydala amoniak bezpośrednio do otaczającej wody. Ptaki i gady lądowe wydalają amoniak w
postaci kwasu moczowego, natomiast większość kręgowców lądowych przed wydaleniem przekształca amoniak w
mocznik.
asparaginian karbamoilofosforan
Cykl przebiega w mitochondriach i cytoplazmie komórek wątroby (hepatocytów) i wymaga dostarczenia energii.
14. Na czym polega fosforylacja oksydacyjna? Gdzie w warunkach fizjologicznych mamy do
czynienia z rozprzęgnięciem fosforylacji oksydacyjnej i jakie ten proces ma znaczenie dla
organizmu ?
Fosforylacja oksydacyjna jest procesem łączący m syntezę ATP z utlenieniem NADH i FADH
2
poprzez transport
elektronów przebiegający wzdłuż łańcucha oddechowego. Ten proces oparty jest na mechanizmie przedstawionym jako
hipoteza chemiosmotyczna. Energia uwalniana podczas transportu elektronów zostaje wykorzystana do pompowania
jonów H
+
na zewnątrz mitochondrium, w celu utworzenia elektrochemicznego gradientu protonowego. Protony
przedostają się z powrotem do mitochondrium poprzez cytazę ATP umieszczoną w wewnętrznej błodnie
mitochondrialnej i tak napędzają syntezę ATP. Podczas utleniania cząsteczki NADH syntetyzowane są 2,5 cząsteczki
ATP, a podczas utleniania FADH
2
syntetyzowane jest 1,5 cząsteczki ATP. Z rozprzęgnięciem fosforylacji oksydacyjnej
w mechanizmie termogenezy. Ma ona duże znaczenie w pewnych sytuacjach biologicznych. Na przykład, w brunatnej
tkance tłuszczowej rozprzężenie jest procesem naturalnym. Tkanka ta obfituje w mitochondria, których wewnętrzna
błona zawiera białko zwane termo geniną. Termogenina umożliwia przepływ jonów H+ z powrotem do mitochondriów
z pominięciem syntazy ATP i w ten sposób rozprzęgając transport elektronów od fosforylacji oksydacyjnej generuje
ciepło. Znaczenie tego zjawiska polega na tym, że brunatna tkana tłuszczowa występuje we wrażliwych na chłód
okolicach noworodków, gdzie dostarczane przez nią ciepło stanowi ochronę przed niską temperaturą.

15. Na czym polega proces glukoneogenezy i jakie ma on znaczenie dla organizmu ?
W procesie glukoneogenezy glukoza jest syntetyzowana z prekursorów niecukrowych, takich jak mleczan i pirogronian.
Ten proces jest ogromnie ważny, ponieważ mózg i erytrocyty w normalnych warunkach jako źródło energii
wykorzystują prawie wyłącznie glukozę. Zapas glikogenu w wątrobie jest wystarczający, aby zaopatrywać mózg w
glukozę przez około pół dnia głodowania. Dlatego glukoneogeneza ma szczególne znaczenie w okresie głodu lub
intensywnego wysiłku. Do wytwarzania glukozy w procesie glukoneogenezy podczas głodowania zostają wykorzystane
przede wszystkim aminokwasy pochodzące z rozłożonych białek oraz glicerol z tłuszczów. Podczas wysiłku fizycznego
wykorzystany zostaje mleczan wytwarzany w mięśniach. W procesie glukoneogenezy szlak zaczyna się od
przekształceniu pirogronianu w szczawioctan kończąc ostatecznie na glukozie wytworzonej z glukozo-6-fosforanu.
Wyszukiwarka
Podobne podstrony:
BIOCHEMIA 5 2 id 86299 Nieznany
biochemia3 id 86647 Nieznany (2)
Biochemia(1) id 86587 Nieznany
Kopia ggg id 247542 Nieznany
biochemia id 86123 Nieznany (2)
Analiza biochemiczna id 59863 Nieznany
biochemia4 id 86651 Nieznany
biochemia 6 id 86300 Nieznany (2)
biochemia0001 id 86614 Nieznany
biochemia0008 id 86628 Nieznany (2)
Kopia Niewywazenia[1] id 247625 Nieznany
biochemia0005 id 86622 Nieznany (2)
biochemia0003 id 86618 Nieznany (2)
biochemia 8 id 86302 Nieznany (2)
biochemia0002 id 86616 Nieznany
biochemia 4 2 id 86296 Nieznany (2)
biochemia 3 2 id 86285 Nieznany (2)
biochemia5 id 86653 Nieznany (2)
więcej podobnych podstron