
1
Wac aw L. Ko odziejski
Wyk ady z chemii
ogólnej i nieorganicznej
Farmacja, Warszawski Uniwersytet
Medyczny, Rok akademicki 2012

2
UWAGA
Zak adam, e s uchacze znaj
chemi na poziomie licealnym !

3
Egzamin i podr czniki
Zalecane podr czniki i skrypty:
1. L. Pajdowski, „Chemia ogólna”
2. A. Biela ski, „Podstawy chemii nieorganicznej”
3. M.
nowski, „Zwi
y opis chemii wybranych pierwiastków” (skrypt)
4. L. Jones, P. Atkins, „Chemia ogólna”
5. F. A. Cotton, G. Wilkinson i P. L. Gaus, „Chemia nieorganiczna”
6. R. So oniewicz, „Zasady nowego s ownictwa zwi zków nieorganicznych”
7. Z. S. Szmal i T. Lipiec, „Chemia analityczna z elementami analizy
instrumentalnej”
Egzamin b dzie obejmowa zagadnienia z mojego wyk adu z chemii ogólnej
i nieorganicznej, z wyk adu mgr Niebisz-Nowak z analizy jako ciowej oraz z
pracowni nieorganicznej analizy jako ciowej. Podstaw
do nauki powinny
by notatki z wyk adów.

4
Teoria atomistyczna Daltona
(1803 wyk ad, 1808 publikacja)
1. Wszystkie pierwiastki sk adaj si z
niezmiernie ma ych, chemicznie
niepodzielnych cz stek zwanych atomami,
zachowuj cych swoj indywidualno
we
wszystkich reakcjach chemicznych.
2. Atomy danego pierwiastka s identyczne
pod ka dym wzgl dem, m.in. maj
jednakow mas . Atomy ró nych
pierwiastków ró ni si swoimi w
ciwo ciami, maj te ró ne masy.
3. Zwi zki chemiczne powstaj wskutek czenia si atomów ró nych
pierwiastków w okre lonych, sta ych stosunkach liczbowych. Masy
atomów nie ulegaj zmianie w czasie reakcji chemicznej.
5
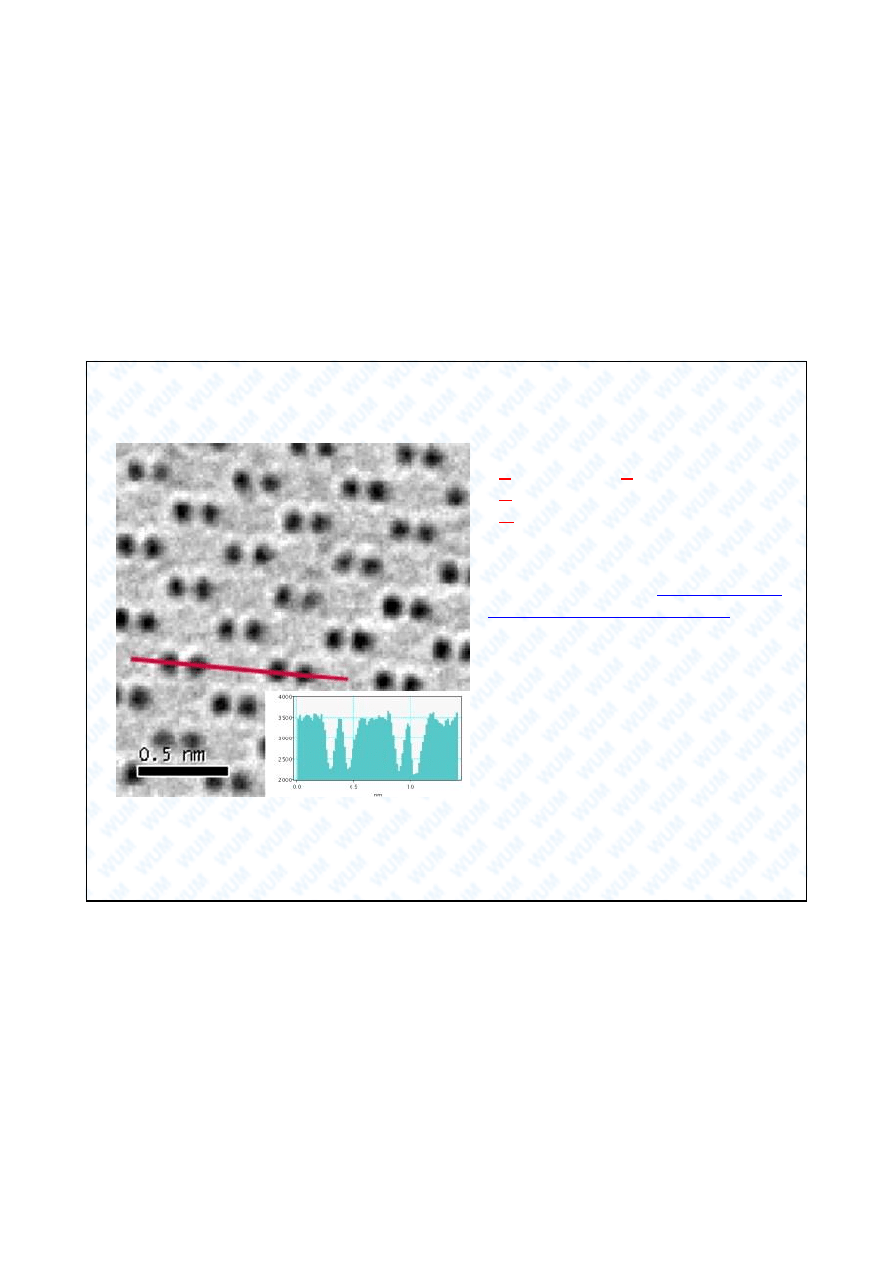
Atomy mo na ju zaobserwowa !
The highest-resolution images ever
seen (0.05 nanometer and below).
This is equivalent to a quarter of the
diameter of a carbon atom. This
microscope will be delivered to the
Berkeley National
Laboratory
in
2008 and will be fully operational in
2010. To achieve this resolution, this
microscope mixes two technologies,
SEM
(Scanning
Electron
Microscope) and TEM (Transmission
Electron Microscope).
You can see above a high resolution TEAM image of the dumbbell structure (0.14
nm) of Germanium, which reveals that inter atomic distances can be measured with
ultrahigh precision.
http://blogs.zdnet.com/emergingtech/?p=692
Transmission Electron
Aberration-corrected
Microscope
6
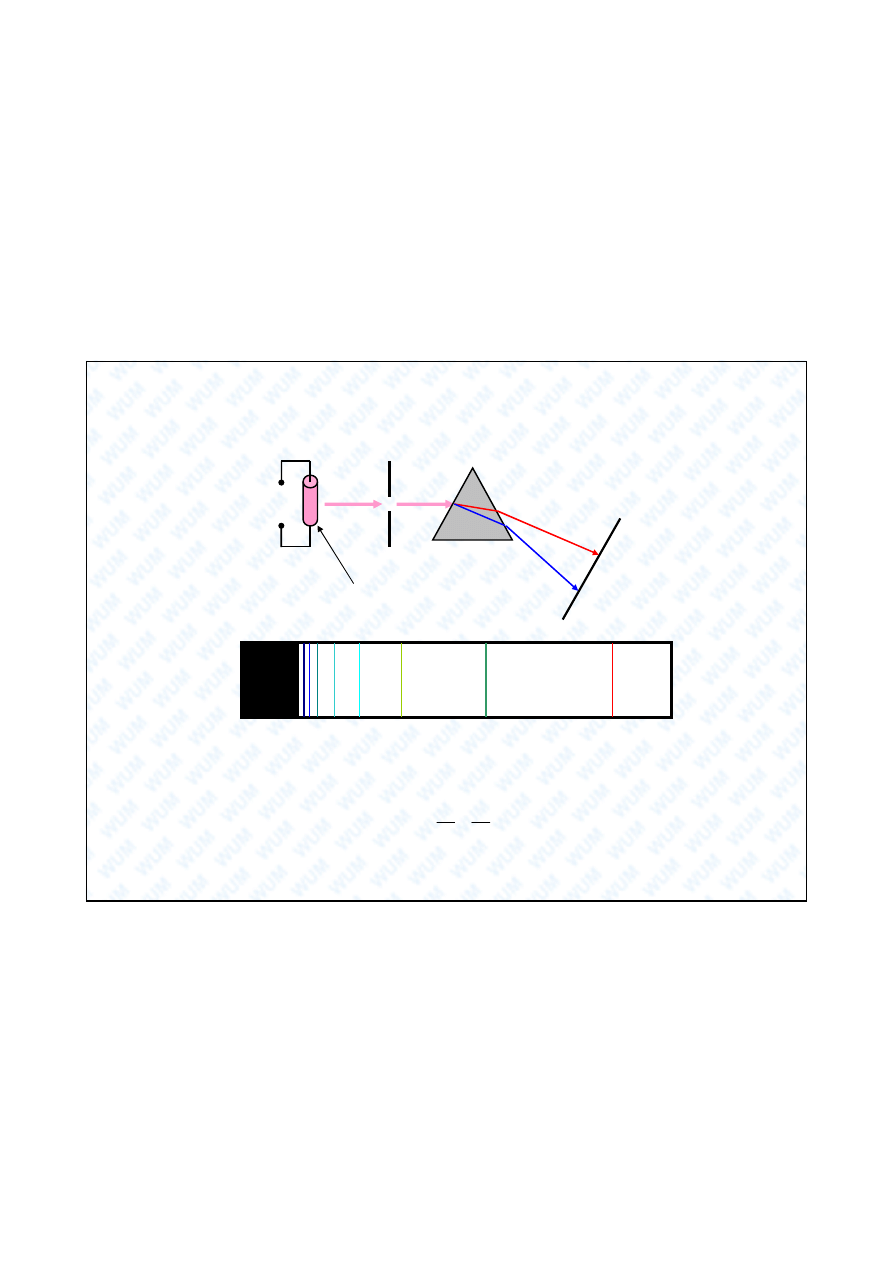
wysokie
napi cie
wy adowanie w rozrzedzonym
gazie (np. H
2
)
szczelina
pryzmat
p yta
fotograficzna
Liniowy charakter widm atomowych – wzór Balmera (1885)
Eksperymentalny wzór Balmera dla jednej z serii widmowych
wodoru:
2
2
1
2
1
n
R
H
dla
3
n
R
H
jest sta Rydberga dla wodoru.
Teoria ?

7
Liniowe widmo wodoru w zakresie widzialnym
Widmo ciag
wiat a bia ego
8
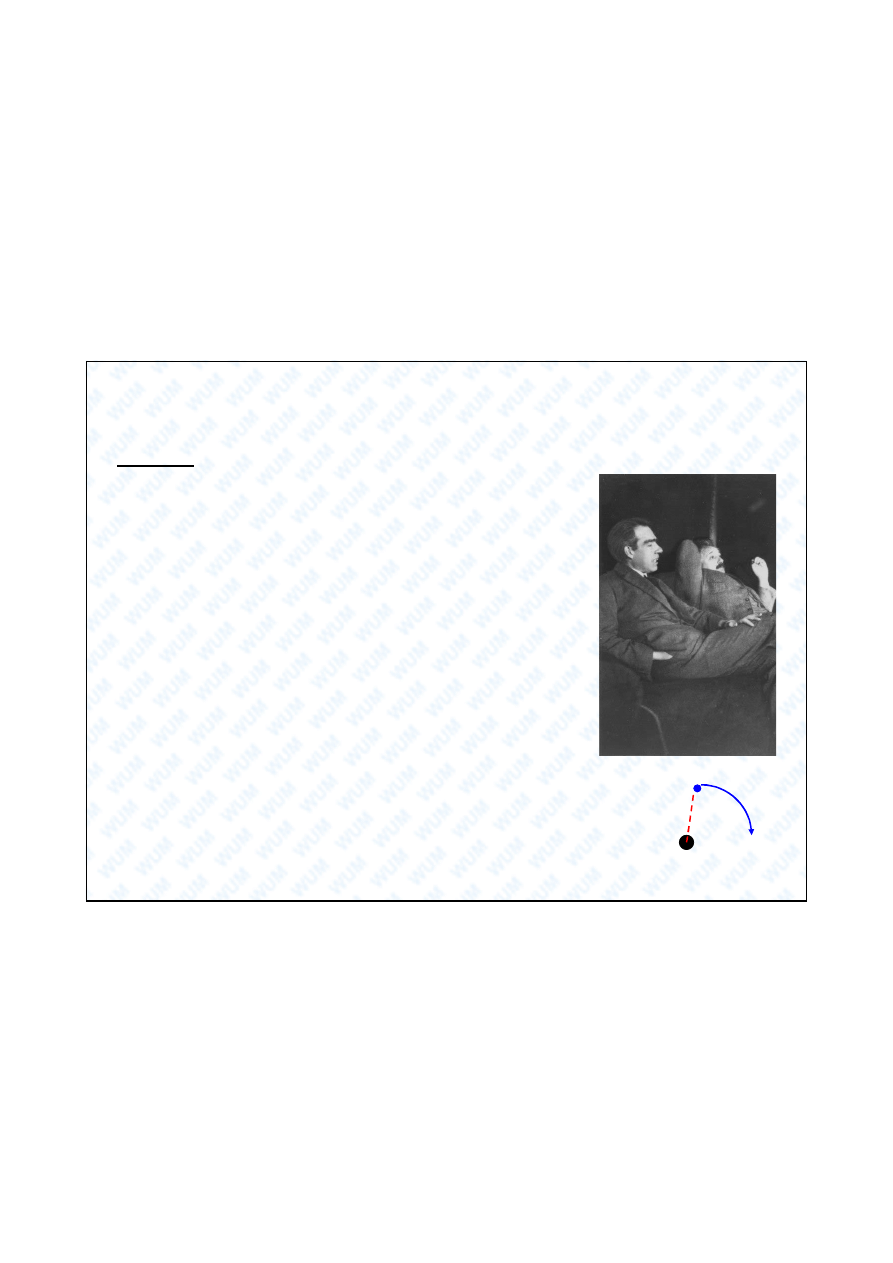
Model Bohra atomu wodoru (1913)
Postulaty:
1. Elektron w atomie wodoru porusza si po okre lonych
orbitach, nazwanych przez Bohra stacjonarnymi. Orbicie
stacjonarnej elektronu odpowiada stan stacjonarny atomu,
w którym ten atom nie emituje i nie absorbuje
promieniowania elektromagnetycznego.
2. Przy przej ciu elektronu z jednej orbity stacjonarnej na
drug , atom emituje lub absorbuje kwant promieniowania
o energii E = h równej ró nicy energii tych stanów
stacjonarnych.
3. Elektron porusza si wokó j dra po orbitach ko owych.
4. Moment p du elektronu jest skwantowany : mvr = n , dla n = 1, 2, 3 ...
(m – masa elektronu, v – pr dko
elektronu, r – promie orbity,
n – liczba kwantowa, = h / 2 ).
r
v
m
Niels Bohr (bli ej) i
Albert Einstein (dalej)
9
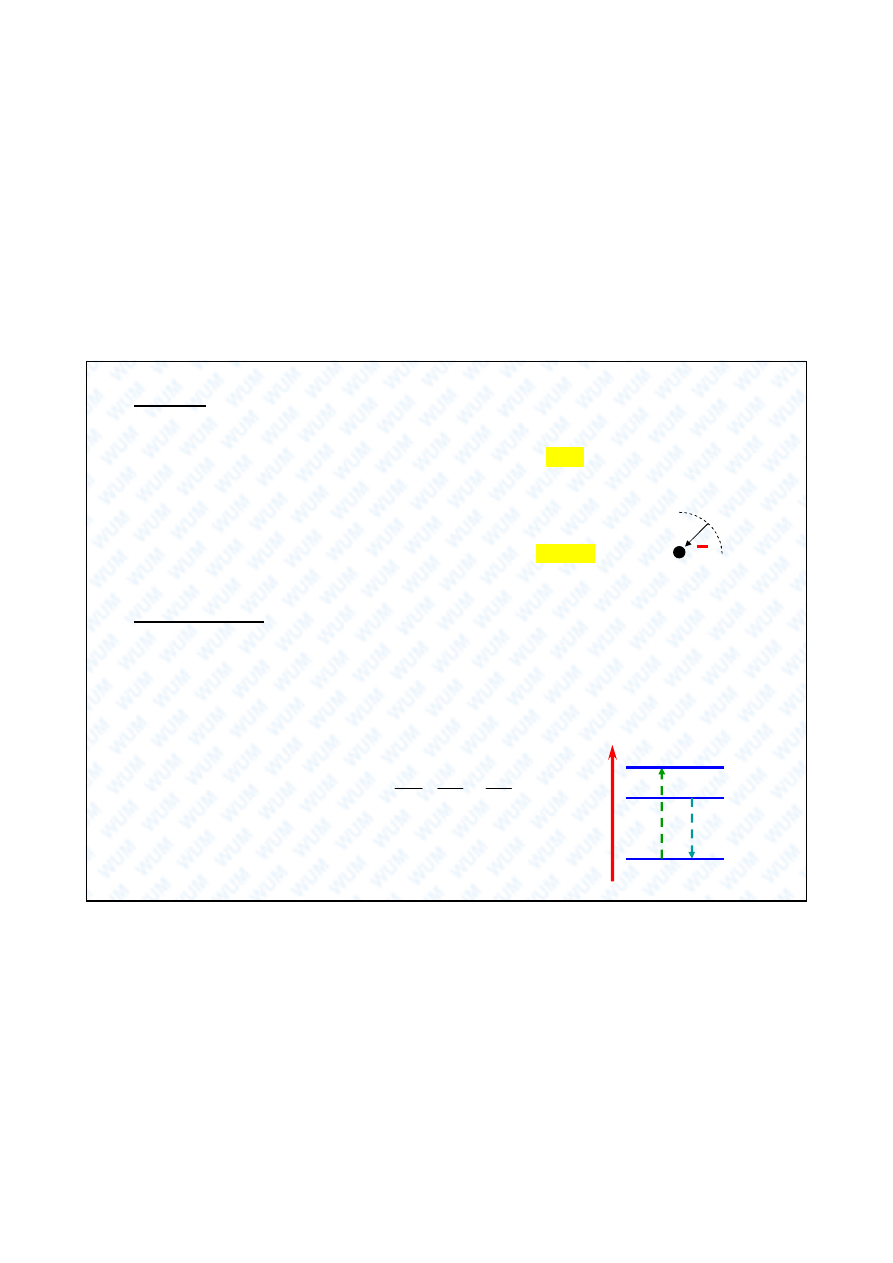
Wnioski:
1. Kwantowanie promienia orbity elektronu: r = a
0
n
2
, gdzie a
0
= 0,53 Å
(a
0
jest atomow jednostk d ugo ci o nazwie bohr).
2. Kwantowanie ca kowitej energii atomu: E =
-
E
0
/ n
2
,
gdzie E
0
= 13,6 eV = 313 kcal mol
-1
(E
0
jest atomow jednostk energii o nazwie hartree).
Konsekwencje:
a) wprowadzenie poj cia poziomów energetycznych i przej
spektroskopowych,
b) teoretyczne wyprowadzenie eksperymentalnego, spektroskopowego
wzoru Balmera: dla przej cia elektronu z poziomu n
i
na poziom n
j
(n
i
> n
j
),
mamy
2
2
0
1
1
i
j
n
n
h
E
h
/
E
,
gdzie E
0
/ h jest sta Rydberga.
0
E
Emi
sja
A
b
sor
p
c
ja
E
1
=h
1
E
2
=h
2
10
-
+
U
+
-
0,5 V
(napi cie hamuj ce)
i
K
S
A
pary rt ci
i
U
4,9 eV
2
4,9 eV
3
4,9 eV
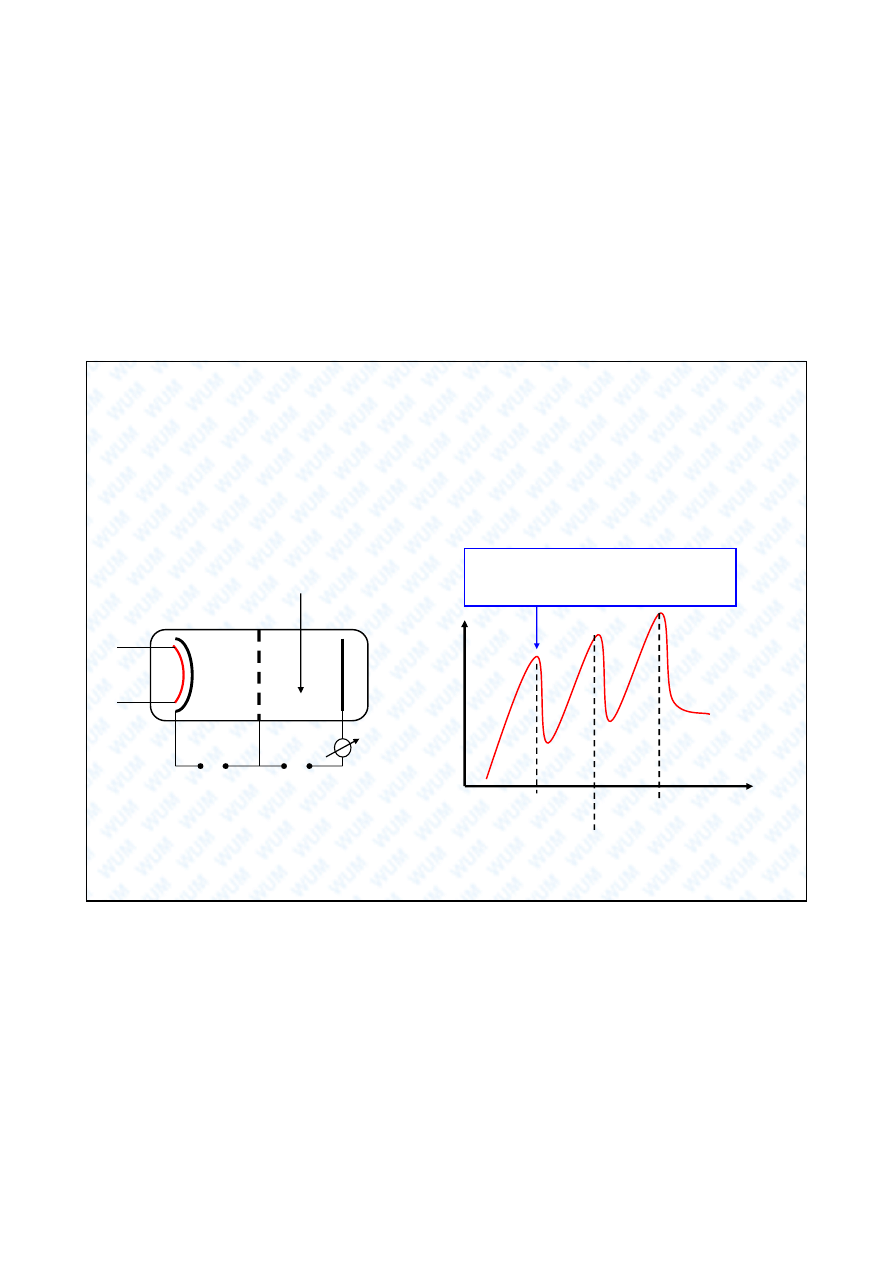
Energia elektronu pasuje do ró nicy
poziomów energetycznych g ówny -
wzbudzony atomu rt ci.
Do wiadczenie Francka - Hertza (1914)
Eksperymentalne potwierdzenie istnienia poziomów
energetycznych w atomie

11
W
ciwo ci korpuskularne i falowe fotonu
h
E
2
mc
E
2
2
c
h
c
E
m
d fotonu:
h
c
h
mc
p
ugo
fali fotonu:
mc
h
(w
pró ni)
Planck 1900 r.
widmo emisyjne cia a
doskonale czarnego
Einstein 1905 r.
efekt fotoelektryczny
i teoria wzgl dno ci
12
Falowa natura materii: hipoteza de Broglie’a (1924)
Z ruchem ka dej cz stki, np. elektronu, zwi zana jest okre lona fala.
Cz stce o masie m i pr dko ci v mo na przypisa fal o d ugo ci:
We wzorze de Broglie’a w
ciwo ci korpuskularne (m) s powi zane z
ciwo ciami falowymi ( ) za pomoc sta ej Plancka.
mv
h
Problemy do przemy lenia:
1. Dualizm korpuskularno – falowy.
2. Masa fotonu (kwestia masy spoczynkowej).
3. Mechanika falowa a mechanika klasyczna:
•
Elektron, m = 9,1 × 10
-31
kg, v = 1 × 10
6
m s
-1
= 7,3 Å
•
Auto, m = 1300 kg, v = 105 km/godz
= 1,7 × 10
-28
Å
1 Å = 10
-10
m = 0,1 nm
h = 6,6 × 10
-34
J s
Davisson i Germer (1927) – dyfrakcja elektronów na kryszta ach niklu
dowodem na ich falowy charakter.
13
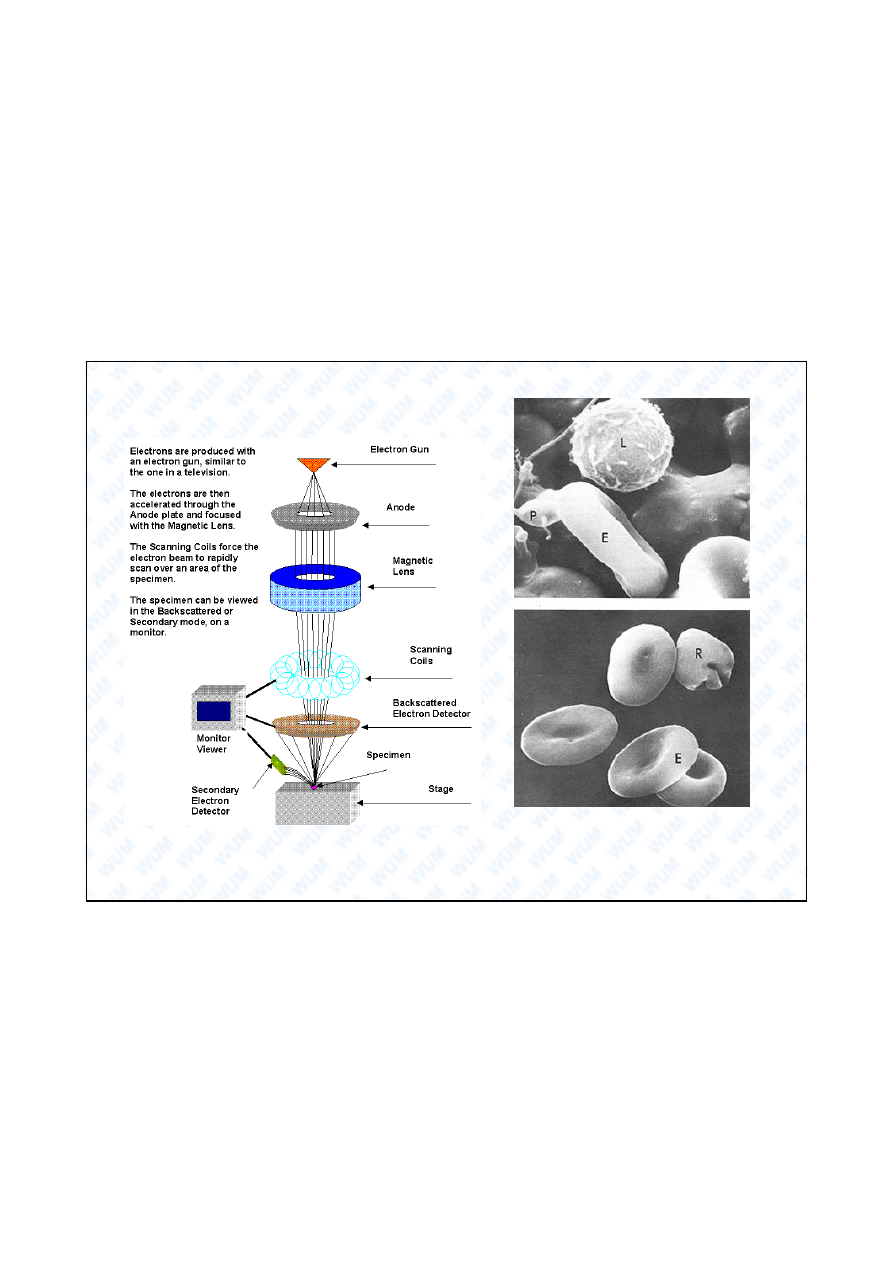
Mikroskop elektronowy (TEM i SEM)
Skanuj cy mikroskop elektronowy (SEM)
Normalne komórki krwi:
erytrocyty (E), limfocyty (L),
ytki (P) i retikulocyty (R).
14
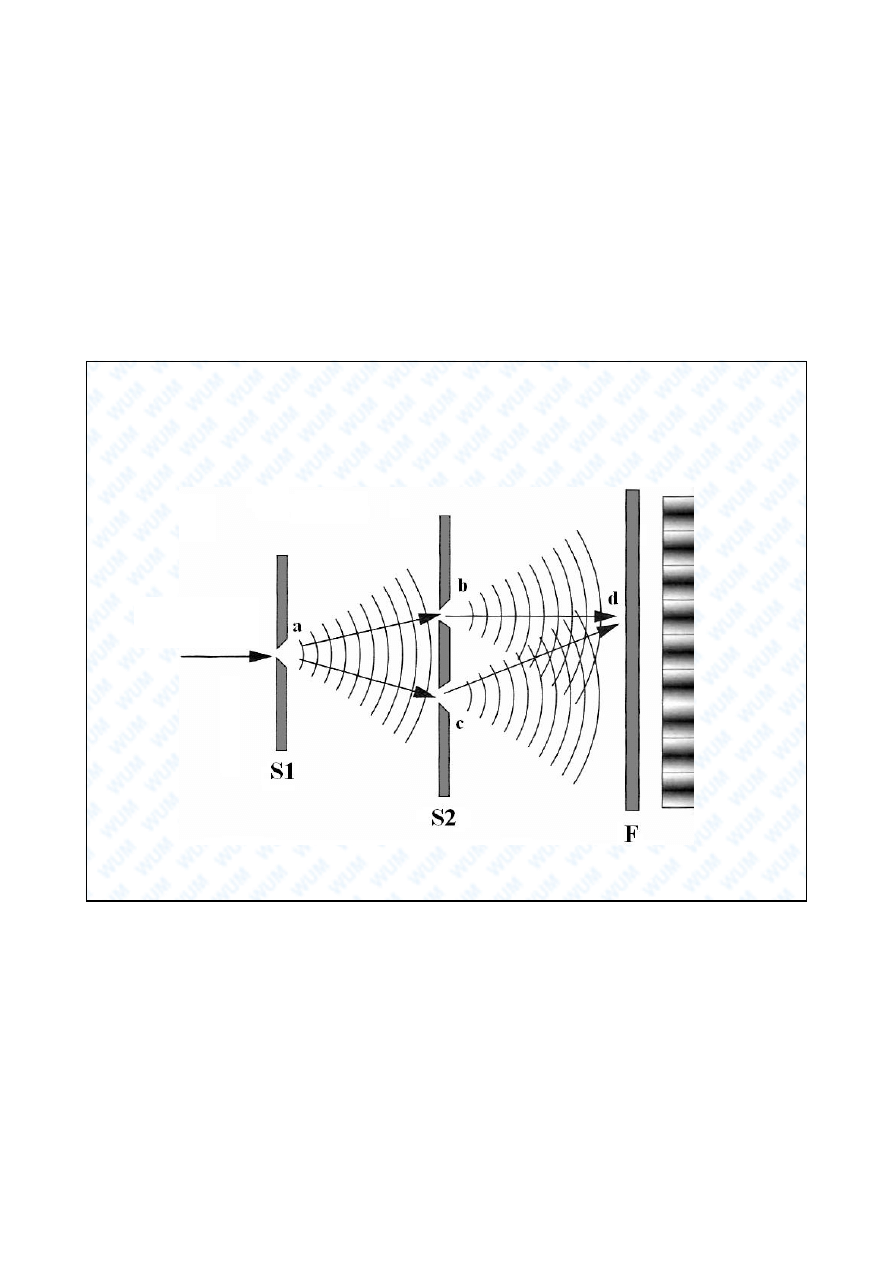
Thomas Young 1801:
dyfrakcja fal wietlnych na dwóch szczelinach
pr
ki in
terfer
ency
jn
e
ze ród a
wiat a

15
Dualizm korpuskularno – falowy:
dyfrakcja na dwóch szczelinach
Nowoczesna wersja
do wiadczenia Younga
Eksperyment zaproponowany
przez Feynmana

16
Dualizm korpuskularno - falowy
Dwa rodzaje eksperymentów daj cych pr
ki interferencyjne:
Wys anie silnego strumienia elektronów w bardzo krótkim czasie (impuls
elektronowy) –
ze szczelinami oddzia uje równocze nie wiele
elektronów.
Bombardowanie szczelin pojedynczymi elektronami w przeci gu
ugiego czasu – ze szczelinami oddzia uje zawsze tylko jeden elektron !

17
Dualizm korpuskularno - falowy
A Tonomura, J Endo, T Matsuda, T Kawasaki and H Ezawa 1989
Demonstration of single-electron build-up of an interference pattern
American Journal of Physics 57 117-120

18
Wnioski z do wiadczenia dyfrakcyjnego z
pojedynczymi elektronami
Pojedynczy elektron ma w
ciwo ci falowe zgodne z hipotez
de
Broglie’a – przechodzi jednocze nie przez obie szczeliny !
Po
enie elektronu jako cz stki powinno by
rozpatrywane w
kategoriach prawdopodobie stwa, zgodnie z interpretacj
Schrödingera funkcji falowej elektronu:
intensywno
~ A
2
prawdopodobie stwo ~
2

19
Heisenberga zatrzymuje patrol policyjny, kiedy jedzie ulic w swoim
samochodzie.
- Czy wie Pan z jak pr dko ci Pan jecha ?!? - pyta policjant.
- Nie, ale wiem gdzie jestem - odpowiedzia Heisenberg.
Zasada nieoznaczono ci Heisenberga (1927)
Heisenberg uwa
, e zasada nieoznaczono ci wyznacza do wiadczaln
granic dok adno ci, z jak mo na wykona równocze nie pomiary po
enia
i p du cz stki kwantowej (i odpowiednio innych par wielko ci tzw.kanonicznie
sprz
onych). Wi za on ten fakt z przekonaniem, e aden pomiar w
mikro wiecie nie mo e pomin
oddzia ywania mierzonego obiektu z
przyrz dem pomiarowym.
x
p
x
i analogicznie dla sk adowych y i z.
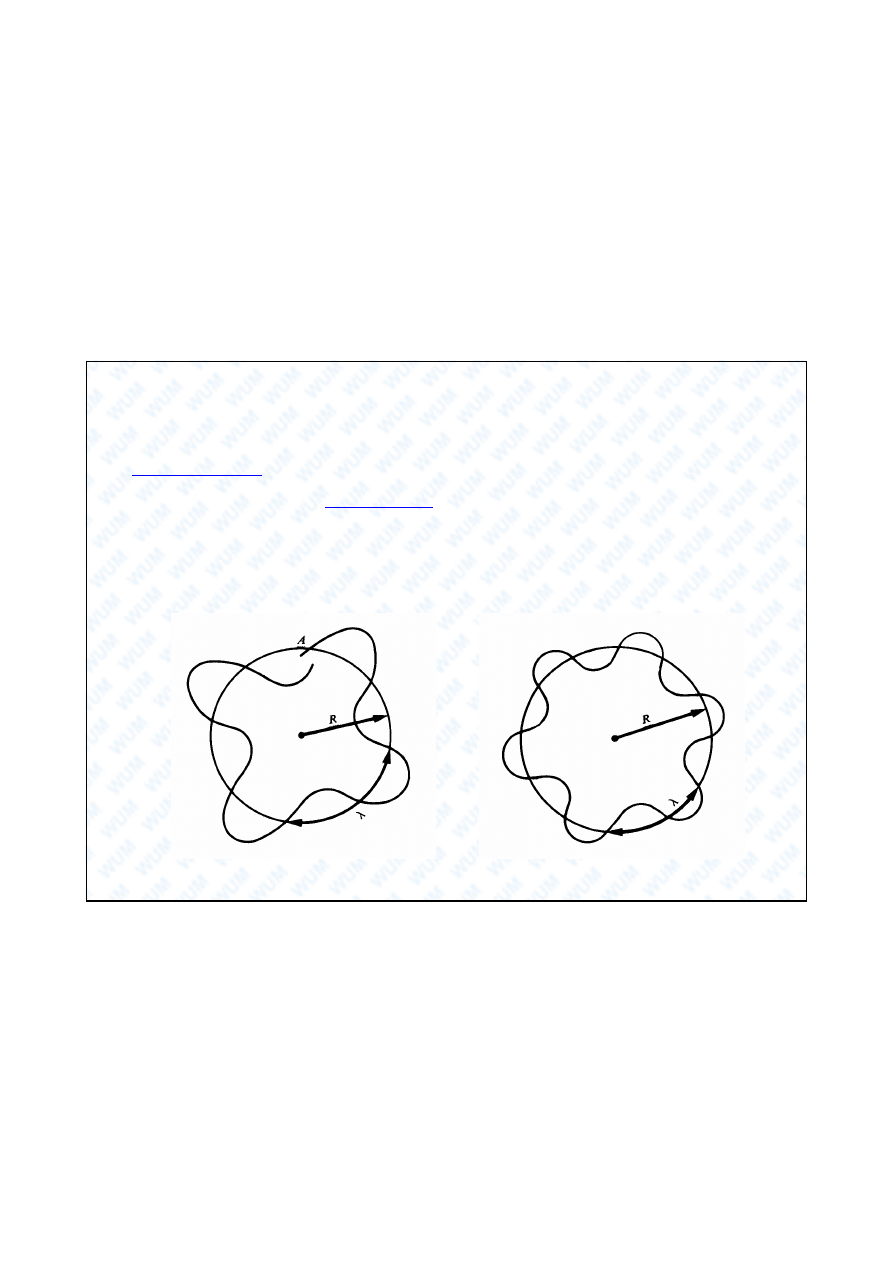
20
Kwantowanie wielko ci fizycznych
Falowa natura cz stek materii, je eli ich ruch jest przestrzennie
ograniczony, wymaga kwantowania takich wielko ci fizycznych jak p d,
moment p du i promie orbity w ruchu po okr gu oraz energia:
6 =2 R
n =2 R
n=1,2,3...

21
Problemy z teori Bohra
Niezgodno
z fizyk
klasyczn
–
elektron na orbicie
stacjonarnej powinien emitowa
promieniowanie
elektromagnetyczne.
Zasada nieoznaczono ci podwa a sens poj cia orbity elektronu.
Spróbujmy obliczy , pos uguj c si
zasad
nieoznaczono ci,
dok adno
okre lenia szybko ci elektronu v. Zak adamy np.
dok adno
pomiaru po
enia x = 0,05 Å (5
10
-12
m), czyli ok.
10 % promienia pierwszej orbity Bohra. Stosujemy wzór:
Po podstawieniu x i masy elektronu m otrzymujemy v
x
ok.10
10
cm/s, a wi c wynik bliski pr dko ci wiat a. Wobec tego poj cie
toru elektronu traci sens.
x
v
m
x
Wyszukiwarka
Podobne podstrony:
kinetyka, studia, ochrona środowiska UJ, chemia ogólna i nieorganiczna, wyrównawcze
rownowagi1, studia, ochrona środowiska UJ, chemia ogólna i nieorganiczna, wyrównawcze
Nazewnictwo IUPAC, Studia - Inżynieria materiałowa, Chemia ogólna i nieorganiczna, Klasyfikacja i na
Zakres materiału obowiązujący na II kolokwium wykładowe, Chemia ogólna i nieorganiczna, giełdy
Teoria do I i II gr. anionów, ~FARMACJA, I rok, CHEMIA OGÓLNA I NIEORGANICZNA, Chemia końcowy z kati
28, ~FARMACJA, I rok, CHEMIA OGÓLNA I NIEORGANICZNA, Egzamin chemia
Chemia ogolna i nieorg 13 2010
Opracowanie - chemia ogólna i nieorganiczna, Nanotechnologia, sem I, chemia
Litowce, 08. MEDYCYNA, 1.Analityka medyczna, I rok, Chemia ogólna i nieorganiczna, Inne
praktyczny z soli, ~FARMACJA, I rok, CHEMIA OGÓLNA I NIEORGANICZNA, egzamin sole
Kompleksy i elektrochemia notatka, ~FARMACJA, I rok, CHEMIA OGÓLNA I NIEORGANICZNA, Chemia końcowy z
2011 info dla studentow sesja letnia OŚ, Studia PŁ, Ochrona Środowiska, Chemia, ogólna i nieorganicz
prop IV notatka, ~FARMACJA, I rok, CHEMIA OGÓLNA I NIEORGANICZNA, Chemia końcowy z kationów i anionó
więcej podobnych podstron