Próbny egzamin maturalny z chemii. Poziom r
ozszerzony
Copyright by ZamKor P
. Sagnowski i Wspólnicy spółka jawna, Kraków 2013
Z
K
am
or
1
MODEL
ODPOWIEDZI I SCHEMA
T PUNKT
OW
ANIA
Poziom r
ozszerzony
Zadanie
Odpowiedzi
Uwagi
Punktacja
za czynność
za
zadanie
1
– za prawidłowe uzupełnienie tabeli:
Zapis ogólny konfiguracji elektronów walencyjnych
Nazwa grupy
Symbol bloku ener
getycznego
Wzór ogólny
tlenku
ns
1
litowce
s
X
2
O
(n – 1)d
3
ns
2
wanadowce
d
X
2
O
5
ns
2
np
2
węglowce
p
XO
2
1.1
za poprawne uzupełnienie
3 wierszy – 2 pkt 2 wierszy –1 pkt
za 1 wiersz
– 0 pkt
2
2
–
za napisanie wzoru i określenie rodzaju wiązania:
wzór:
CaCl
2
rodzaj wiązania:
jonowe
2.1
1
1
3
– za poprawny wzór elektronowy:
Cl
Cl
lub
Cl
Cl
Uczeń otrzymuje punkt za zapis:
B
B
B
B
3.1
1
2
–
za podanie, w którym rozpuszczalniku chlor się lepiej rozpuszcza i odniesienie tej właściwości do budowy cząsteczki Cl
2
:
Chlor
lepiej r
ozpuszcza się w r
ozpuszczalniku niepolarnym. Cząsteczka Cl
2
zawiera wiązanie kowalencyjne (ma budowę niepolarną).
3.2
1
4
– za prawidłowe równanie przemiany:
235 92
U +
1 0
n →
140 57
La +
94 35
Br
+ 2 ·
1 0
n
4.1
1
1
Dokument pobrany przez:
Próbny egzamin maturalny z chemii. Poziom r
ozszerzony
Copyright by ZamKor P
. Sagnowski i Wspólnicy spółka jawna, Kraków 2013
Z
K
am
or
2
5
– za prawidłowe wypełnienie całej tabeli:
Zdanie
P/F
1. Spośród powyższych izotopów największą trwałość wykazuje izotop
A.
F
2. Czas połowicznego rozpadu dla izotopu C wynosi dwa lata.
P
3. Po pięciu latach najwięcej rozpadnie się izotopu B.
F
5.1
1
1
6
a) za poprawne uzupełnienie zdań: Przedstawione
na
rysunku
I nakładanie
się
orbitali
atomowych
2p
x
/ 2p
y
/ 2p
z
atomów
tlenu
z
orbitalami
zhybrydyzowanymi
atomu
węgla
prowadzi
do
powstania
wiązań
typu
σ / π.
Na
rysunku
II
przedstawiono
sposób
tworzenia
wiązań
typu
σ
/ π
, które
powstają
w
wy
-
niku
czołowego
/ bocznego
nakładania
się
orbitali
atomowych
2p
x
/
2p
y
/
2p
z
atomów
tlenu z orbitalami
atomowymi
/ zhybrydyzowanymi atomu węgla.
6.1
1
2
b) za poprawne uzupełnienie zdań: Atom
węgla
w
cząsteczce
tlenku
węgla(IV)
wykazuje
hybrydyzację
sp
/ sp
2
/ sp
3
. Czą
-
steczka CO
2
ma budowę
liniową
/ kątową / płaską / p
rzestrzenną.
6.2
1
7
a)
za podanie prawidłowej odpowiedzi i poprawne uzasadnienie:
Po podniesieniu temperatury układu wartość K
zmaleje
.
Uzasadnienie:
Podwyższenie temperatury układu (dla pr
ocesów egzoenerge
-
tycznych) zgodnie z
r
egułą przekory powoduje przesunięcie stanu równowagi
reakcji w
lewo (w
str
onę tworzenia substratów) – wartość K maleje.
lub inne poprawne uza
-
sadnienie odnoszące się do reguły przekory
7.1
1
2
b)
za podanie prawidłowej odpowiedzi:
Po zwiększeniu ciśnienia w układzie wydajność procesu
wzr
ośnie
.
7.2
1
8
– za poprawny zakres temperatur:
45–80ºC
lub
powyżej
44ºC do 80ºC
8.1
1
1
Dokument pobrany przez:
Próbny egzamin maturalny z chemii. Poziom r
ozszerzony
Copyright by ZamKor P
. Sagnowski i Wspólnicy spółka jawna, Kraków 2013
Z
K
am
or
3
9
– za poprawną metodę
– za obliczenia i wynik z jednostką:
1,
57
mo
l
dm
3
CV
n
mZ
mo
l
dm
mo
l
dm
mola
c
==
⋅=
11
3
3
3
3
=0
,0
4d
m0
,0
4d
m0
,0
4
zzyli
mo
l
dm
p
n
C
Cd
M
C
k
=0
,0
4m
ol
a
1
3
1
100
28
7
28
7
=
⋅
⋅
=
=
%
,
,
mmo
l
dm
mola
mole
HC
l
3
3
1
3
3
28
7
3
Vn
=1
dm
0,
02
dm
0,
04
dm
=
,
–
−−
==
=
xx
n
C
=6
2
moli
moli
mola
mola
mo
l
2
2
62
87
31
3
31
3
–,
,
,
ddm
3
=
1,
57
mo
l
dm
3
lub inna poprawna metoda
9.1
1 1
2
10
– za każdy poprawnie uzupełniony wiersz tabeli:
W
arunki
Wzory związków
1. Po wprowadzeniu do wody obniża wartość pH.
NO
2
, Mn
2
O
7
, (NH
4
)
2
SO
4
, C
6
H
5
OH
2.
Reaguje
z mocnym
kwasem
oraz
mocną
zasadą.
ZnO,
Al(OH)
3
10.1
2 x 1
2
11
–
za prawidłowe obserwacje w obydwóch probówkach:
Probówka 1:
W
ydziela się brunatny gaz, powstały r
oztwór
ma barwę niebieską.
Probówka 2:
W
ydzielają się pęcherzyki bezbarwnego gazu, powstały r
oztwór
jest bezbarwny
.
Uczeń otrzymuje punkt gdy napisze, że w pro
-
bówce 1 powstał roztwór o
barwie zielononiebie
-
skiej
lub
zielonej
.
11.1
2 x 1
2
12
–
za prawidłowe równania reakcji:
Probówka 1:
Cu + 2NO
– 3
+ 4H
+
= Cu
2+
+ 2NO
2
+ 2H
2
O
Probówka 2:
2Al + 6H
+
= 2Al
3+
+ 3H
2
12.1
2 x 1
2
Dokument pobrany przez:
Próbny egzamin maturalny z chemii. Poziom r
ozszerzony
Copyright by ZamKor P
. Sagnowski i Wspólnicy spółka jawna, Kraków 2013
Z
K
am
or
4
13
a)
za prawidłowe równania procesów redukcji i utleniania:
Równanie procesu redukcji:
I
2
+ 2e
–
→ 2I
–
/ (x 5)
Równanie procesu utleniania:
I
2
+ 12OH
–
→ 2IO
– 3
+ 6H
2
O + 10e
–
lub
inny
poprawny
zapis
13.1
2 x 1
3
b)
za prawidłowy dobór współczynników stechiometrycznych:
6I
2
+
12
KOH =
10
KI +
2KIO
3
+
6H
2
O
lub:
3I
2
+
6KOH =
5KI +
(1)
KIO
3
+
3H
2
O
13.2
1
14
a)
za prawidłowe równanie w formie cząsteczkowej:
NaHCO
3
+ HCl = NaCl + CO
2
+ H
2
O
14.1
1
3
b)
za określenie barwy wskaźnika i prawidłowe równanie reakcji:
Barwa wskaźnika:
niebieska
Uzasadnienie:
BaH
2
+ 2H
2
O = Ba
2+
+ 2OH
–
+ 2H
2
lu
b
Ba(OH)
2
→ Ba
2+
+ 2OH
–
14.2
1
c)
za
prawidłowe
obserwacje:
W
ytrącił
się
(brunatny)
osad,
który
(w
temperaturze
pokojowej) po dodaniu nadmiaru odczynnika nie r
ozpuszcza się.
Lub inne poprawne określenie barwy
.
Uczeń otrzymuje punkt jesli napisze, że
osad
po dodaniu nadmiaru odczynnika r
ozpuszcza
się, tworząc r
oztwór
(o barwie żółtej)
.
14.3
1
15
– za poprawną metodę – za obliczenia i wynik z jednostką:
0,16 cm
3
Ag
=
0,
0001
mo
l
1d
m
=1
0
mo
l
dm
=A
gC
l
+
3
–4
3
r
+–
⋅
I
⋅
⋅
czyli
Cl
=
Ag
=
1,
61
0
10
=1
,6
10
–
r
+
–10
–4
I
––6
3
3
Cl
H
–6
mo
l
dm
=1
dm
czyli
==
1,
61
0m
ol
a
pH
=2
=>
–+
Vn
n
⋅
HH=
10
mo
l
dm
=
1,
61
0
10
dm
=1
,6
10
dm
+–
2
3
k
–6
–2
3–
4
⋅
⋅
V
33
=
0,
16
cm
3
lub inna poprawna metoda
15.1
1 1
2
Dokument pobrany przez:
Próbny egzamin maturalny z chemii. Poziom r
ozszerzony
Copyright by ZamKor P
. Sagnowski i Wspólnicy spółka jawna, Kraków 2013
Z
K
am
or
5
16
– za prawidłowe uzupełnienie schematów:
NaNO
2(aq)
KMnO
4(aq)
KOH
(aq)
K
2
Cr
2
O
7(aq)
H
2
SO
4
NaNO
2(aq)
K
2
Cr
2
O
7(aq)
1
2
3
Jeżeli uczeń w probówce nr 3 wśród odczynników
nie uwzględni H
2
SO
4
, to
otrzymuje punkt.
Uczeń nie traci punktów za brak zapisu (aq).
16.1
3 x 1
3
17
– za poprawną metodę – za obliczenia i wynik z jednostką:
0,281 mola
V
1
= 0,25 · 0,5 = 0,125
mo
l
dm
s
3
⋅
Po
pierwszej
sekundzie
ubywa
0,125
mola
N
2
O
5
z
przestrzeni
reakcyjnej
o
objętości
1 dm
3
.
0,5 – 0,125 = 0,375 mola – pozostaje N
2
O
5
po 1 sekundzie
V
2
= 0,25 · 0,375 = 0,094
mo
l
dm
s
3
⋅
0,375 – 0,094 =
0,281 mola
– pozostaje N
2
O
5
po 2 sekundzie
17.1
1 1
2
18
a)
– za poprawną metodę
– za obliczenia i wynik z jednostką:
149,33 dm
3
m
r
=
30
100
20
=
150
g
⋅
m
wody
= 230 g – 150 g = 80 g
Obliczenie łącznej objętości gazów: 18 g H
2
O – 33,6 dm
3
(H
2
i O
2
)
80 g –
x
x =
149,33 dm
3
lub inna poprawna metoda
18.1
1 1
3
b) za wybór właściwej substancji:
NaNO
3
18.2
1
Dokument pobrany przez:
Próbny egzamin maturalny z chemii. Poziom r
ozszerzony
Copyright by ZamKor P
. Sagnowski i Wspólnicy spółka jawna, Kraków 2013
Z
K
am
or
6
19
– za poprawną metodę – za obliczenia i wynik z jednostką:
0,059 V
EE
CV
EE
Ag
Ag
C
Ag
Ag
C
|
|
,
lo
g,
,
+
+
=°
+=
+
=°
+
1
2
0
059
1
08
0
00
1
559
1
08
00
059
0
741
2
lo
g,
,,
CV
V
=+
−=
+
SEM = +0,80
V
– 0,741
V
=
0,059 V
lub inna poprawna metoda
19.1
1 1
2
20
– za prawidłowo uzupełniony rysunek:
klu
cz
ele
ktr
olity
czn
y
Ag
Ag
C
1Ag
+
C
2Ag
+
Kie
ru
ne
k pr
ze
pływu
e
le
ktr
onó
w
(
+
)
katoda
(
–
)
anoda
20.1
1
1
21
– za poprawny wzór i nazwę izomeru: Wzór:
CH
3
CH
3
H
3
C
Nazwa:
1,2,3-trimetylocyklopr
opan
21.1
1
1
Dokument pobrany przez:
Próbny egzamin maturalny z chemii. Poziom r
ozszerzony
Copyright by ZamKor P
. Sagnowski i Wspólnicy spółka jawna, Kraków 2013
Z
K
am
or
7
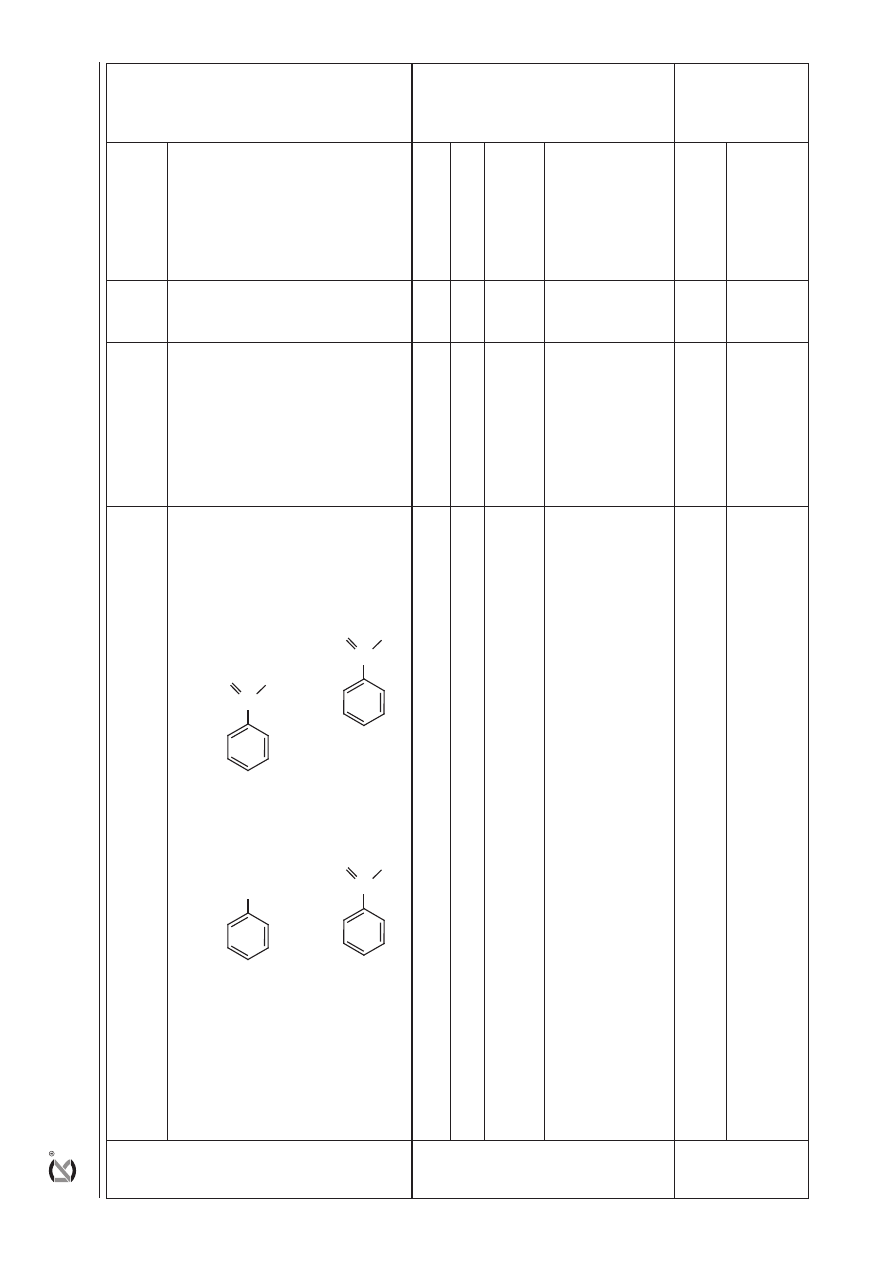
22
– za prawidłowe uzupełnienie zdań:
1.
Reakcja
metylobenzenu
z chlorem
pod
wpływem
światła
przebiega
zgodnie
z mecha
-
nizmem
nukleofilowym
/ elektrofilowym
/ wolnor
odnikowym
. Pod
wpływem
światła
z
cząsteczek
chloru
powstają
wolne r
odniki
/
czynniki
nuklofilowe
/
czynniki
elek
-
trofilowe,
które
atakują
fragment
alifatyczny
/
aromatyczny
metylobenzenu.
Wśród
or
ganicznych
produktów
tej
reakcji
znajdzie
się
chlor
ofenylometan
/
1-chloro-2-me
-
tylobenzen / 1-chloro-3-metylobenzen.
2.
Reakcja
metylobenzenu
z
chlorem
w
obecności
chlorku
glinu
przebiega
zgodnie
z
mechanizm
em
nukleofilowym
/
elektr
ofilowym
/
wolnorodnikowym.
Pod
wpły
-
wem
katalizat
ora
z
cząstec
zek
chloru
powstają
wolne
rodniki
/ czynniki
nuklofilowe
/
czynniki
elektr
ofilowe
, które
atakują
fragment
alifaty
czny
/ ar
omatyczny
metyloben
-
zenu.
Wśród
głównych
or
ganicznych
produktów
tej
reakcji
znajdzie
się
chlorofenylo
-
metan /
1-chlor
o-2-metylobenzen
/ 1-chloro-3-metylobenzen.
22.1
2 x 1
2
23
a) za poprawnie zapisane równanie reakcji:
CH
C
H
3
C
H
3
+ HCl
(st
ęż.
)
OH
CH
C
H
3
C
H
3
+ H
2
O
Cl
ZnCl
2
23.1
1
2
b) za prawidłową obserwację:
Zmętnienie pojawia się po kilku minutach.
23.2
1
24
– za napisanie równania reakcji:
6C
+3
H+
1
2
O=
CH
OH
graf
it
2(
g)
2(
g)
65
(s
)
Jeśli uczeń nie uwzględ
-
ni stanu skupienia
reagentów
, otrzymuje
punkt.
24.1
1
3
– za poprawną metodę – za obliczenia i wynik z jednostką:
–164,52 kJ/mol
lub
–164,52 kJ
∆H
o
= 6
· ∆H
1
o
+ 3
· ∆H
2
o
+ (–1)
· ∆H
3
o
∆H
o
= 6
· (–393,50) + 3
· (–285,84) + (–1)
· (–3054) =
–164,52 kJ
24.2
1 1
Dokument pobrany przez:
Próbny egzamin maturalny z chemii. Poziom r
ozszerzony
Copyright by ZamKor P
. Sagnowski i Wspólnicy spółka jawna, Kraków 2013
Z
K
am
or
8
25
a)
za poprawną nazwę systematyczną oraz wzór sumaryczny odczynnika:
Nazwa ketonu:
pr
opanon
Wzór odczynnika Grignarda:
CH
3
MgBr
25.1
1
3
b)
za poprawnie zapisane równania dwóch etapów:
Równanie 1 etapu:
MgBr
C
+ CO
2
=
O
OMgBr
Równanie 2 etapu:
C
+ HBr
=
+ MgBr
2
O
OH
C
O
OMgBr
25.2
2 x 1
26
a) za wybór odpowiedniej probówki:
4
26.1
1
5
b) za wskazanie numeru probówki o szafirowym zabarwieniu:
2
26.2
1
c)
za poprawnie sformułowane obserwacje:
W
pr
obówce 3 nie widać zamian,
natomiast w
pr
obówce 4 pojawia się fioletowe zabarwienie
.
lub inne poprawne okre
-
ślenie barwy
26.3
1
d)
za poprawnie uzupełnione wnioski z doświadczenia:
Cukrem, który nie wykazywał właściwości redukujących, jest
sachar
oza.
W
probówce, która zawierała
fruktozę
, powstał ceglastoczerwony osad
tlenku
miedzi(I)
, a w probówce, w której była
sachar
oza
, otrzymano czarny osad
tlenku
miedzi(II)
.
26.4
za 5 poprawnych uzupełnień – 2 pkt 4 i 3 poprawne uzu
-
pełnienia –1 pkt 2, 1 lub brak po
-
prawnych uzupeł
-
nień – 0 pkt
27
a)
za wybór odpowiedniego kwasu i poprawne uzasadnienie:
CCl
3
COOH, ponieważ ma największą wartość stałej dysocjacji.
27.1
1
2
b)
za poprawną odpowiedź wraz z uzasadnieniem:
Im więcej atomów chloru w cząsteczce kwasu etanowego, tym moc wiązania O–H w grupie karboksylowej maleje.
27.2
1
Dokument pobrany przez:
Próbny egzamin maturalny z chemii. Poziom r
ozszerzony
Copyright by ZamKor P
. Sagnowski i Wspólnicy spółka jawna, Kraków 2013
Z
K
am
or
9
28
– za prawidłowe uzupełnienie tabeli:
Zdanie
P/F
1. Cząsteczka dopy wykazuje czynność optyczną.
P
2. Pod względem budowy cząsteczka dopy jest
β-aminokwasem.
F
3.
Pod wpływem wodnego roztworu chlorku żelaza(III) przyjmuje granato
-
wofioletowe zabarwienie.
P
28.1
1
1
29
– za poprawne uzupełnienie równania:
+
H
3
N
C
H
+
O
H
–
+
H
2
O
CH
2
OH
COO
–
H
2
N
C
H
CH
2
OH
COO
–
29.1
1
1
30
– za prawidłowy wzór fosfolipidu:
H
2
C
O
H
C
O
H
2
C
O
C
17
H
35
C
O
C
17
H
35
C
O
O
P
OH
OH
30.1
1
1
Dokument pobrany przez:
Wyszukiwarka
Podobne podstrony:
arkusz rozszerzony zamkor 2013 marzec
odpowiedzi podstawowy zamkor 2013 marzec
odpowiedzi rozszerzony zamkor 2014 oficjalne
odpowiedzi przykladowy arkusz maturalny poziom rozszerzony wyd 2013 r
arkusz i odpowiedzi matura probna biologia rozszerzona operon 2013 2014
odpowiedzi przykladowy arkusz maturalny poziom rozszerzony wyd 2013 r
odpowiedzi przykladowy arkusz maturalny poziom rozszerzony wyd 2013 r
matura rozszerzona angielski 2013 odpowiedzi
arkusz i odpowiedzi matura probna biologia rozszerzona operon 2013 2014
Informatyka poziom rozszerzony Matura 2013 id 214067
Baza pytań egzaminacyjnych z odpowiedziami teoria 1 05 2013
chemia zywnosci odpowiedzi, Dietetyka 2012,2013, Chemia żywności
więcej podobnych podstron