Próbny egzamin maturalny z chemii. Poziom r
ozszerzony
Copyright by ZamKor spółka z ograniczoną odpowiedzialnością S.K.A., Kraków 2014
Z
K
am
or
1
MODEL
ODPOWIEDZI I SCHEMA
T PUNKT
OW
ANIA
Poziom r
ozszerzony
Zadanie
Odpowiedzi
Uwagi
Punktacja
za czynność
za
zadanie
1
a) za poprawne uzupełnienie tabeli:
Konfiguracja elektronów
walencyjnych
Symbol pierwiastka
Nazwa grupy
Numer okresu
4s
1
3d
5
(lub
3d
5
4s
1
)
Cr
chr
omowce
4
1.1
1
2
b) za poprawne uzasadnienie:
W
yjaśnienie:
Połowiczne zapełnienie podpowłoki d jest energetycznie korzystne.
lub inaczej
poprawnie
sformułowane uzasadnienie
1.2
1
2
– za poprawne uzupełnienie podpunktów I-III:
I. E
Na → Na
+
<
E
Cl → Cl
+
II. E
Mg → Mg
+
<
E
Mg
+
→ Mg
2+
III. E
Cl → Cl
–
>
E
Br→ Br
–
2.1
1
1
3
– za poprawne uzasadnienie:
Atom sodu ma większy pr
omień niż atom chloru. Jego elektr
on walencyjny jest bardziej
oddalony od jądra atomowego i łatwiej go oderwać – potrzeba mni
ejszej energii jonizacji.
lub inaczej
poprawnie
sformułowane uzasadnienie
3.1
1
1
4
– za poprawne uzupełnienie tabeli:
P /
F
Ener
gia cząsteczki N
2
jest wyższa w porównaniu z en
er
gią izolowanych ato
mów
azotu.
F
W
iązanie typu
s w cząsteczce N
2
tworzy się w wyniku nakładania orbitali 2p
x
atomów azotu.
P
Niewiążące (wolne) pary elektronowe w
cząsteczce N
2
stanowią pary elektronowe
z
poziomów �
2p
y
–2p
y
i �
2p
z
–2p
z
.
F
4.1
1
1
Dokument pobrany przez: c4f4561668056071b2ee1a91ec738090c9ddac6a
Próbny egzamin maturalny z chemii. Poziom r
ozszerzony
Copyright by ZamKor spółka z ograniczoną odpowiedzialnością S.K.A., Kraków 2014
Z
K
am
or
2
5
– za poprawne uzupełnienie równania przemiany promieniotwórczej:
92
238
82
206
UP
→+
−
b+
86
2
4
-1
0
αβ
5.1
1
1
6
– za poprawną metodę rozwiązania – za obliczenia i wynik z jednostką:
8 dni
X:
T
1/2
= 2 dni
Y:
T
1/2
= 4 dni
Przykładowe r
ozwiązanie:
100
50
25
12
56
25
25
22
22
4
%%
%,
%,
%
%
dni
dni
dni
dni
dn
→
→
→
→
ii
dni
→
→
12
56
25
4
,%
,%
Masy izotopów X i
Y
będą takie same po upływie
8 dni
od rozpoczęcia obserwacji.
lub inna
poprawna metoda
rozwiązania
6.1
1 1
2
7
a) za poprawnie narysowany wzór elektronowy kreskowy:
O
H
lub
–
O
H
–
lub
O
H
lub
–
O
H
–
7.1
1
3
b) za podanie poprawnej nazwy wiązania i uzasadnienie mechanizmu jego powstawania.
Nazwa wiązania:
(wiązanie) koordynacyjne
Aniony wodor
otlenowe są donorami wolnych par
elektr
onowych, zaś kation glinu ich
akceptor
em.
lub inaczej
poprawnie
sformułowane uzasadnienie
7.2
1
c) za poprawnie zapisane równanie reakcji w formie jonowej skróconej: 2Al + 2OH
–
+ 6H
2
O → 2[Al(OH)
4
]
–
+ 3H
2
7.3
1
8
– za poprawne uzupełnienie tabeli:
W
arunek
Oznaczenia literowe
związków
Orbitale
wszystkich
atomów
węgla
w
cząsteczce
związku
wykazują hybrydyzację sp
3
.
A, B
Cząsteczka ma budowę płaską.
C, D, E, F
Cząsteczka
wykazuje
trwały
(niezerowy)
moment
dipolowy
.
A, C, F
8.1
Za poprawne uzu
-
pełnienie 3 wierszy
– 2 pkt
Za poprawne uzu
-
pełnienie 2 wierszy
– 1 pkt
Za poprawne
uzupełnienie 1–0 wiersza – 0 pkt
2
Dokument pobrany przez: c4f4561668056071b2ee1a91ec738090c9ddac6a
Próbny egzamin maturalny z chemii. Poziom r
ozszerzony
Copyright by ZamKor spółka z ograniczoną odpowiedzialnością S.K.A., Kraków 2014
Z
K
am
or
3
9
– za poprawnie uzupełnienie podpunktów a–c:
a)
Reaguje z wodą (na zimno):
Ba, K
b)
Nie reaguje z wodą (na zimno), reaguje z rozcieńczonym kwasem siarkowym(VI):
Fe
c)
Nie reaguje z wodą, reaguje ze stężonym kwasem siarkowym(VI):
Ag, C, Cu
9.1
Za poprawne
uzupełnienie
3 podpunktów –
2 pkt
Za poprawne
uzupełnienie
2 podpunktów –
1 pkt
Za poprawne
uzupełnienie 1–0 podpunktu – 0 pkt
2
10
– za poprawne uzupełnienie wiersza tabeli:
Barwa warstwy
or
ganicznej
Równanie reakcji
Uzasadnienie
Probówka 1
żółtobrunatna
2Br
–
+ Cl
2
→
2Cl
–
+ Br
2
chlor
jest bardziej aktywnym
fluor
owcem niż br
om (dlate
-
go wyprze br
om z jego soli)
Probówka 2
różowofioletowa
reakcja nie zachodzi
jod jest mniej aktywnym flu
-
or
owcem niż br
om (dlatego
nie wyprze br
omu z jego soli)
lub inne poprawne określenie barwy
10.1
2 x 1
2
11
a) za podanie odpowiedniego numeru zlewki:
2
11.1
1
2
b) za uzupełnienie zdania i poprawne uzasadnienie:
W
teorii Brönteda mocniejszą zasadą jest anion (
fluorkowy
, chlorkowy ), ponieważ
jest
z
nią sprzężony słabszy kwas fluor
owodor
owy
.
lub inaczej
poprawnie
sformułowane uzasadnienie
11.2
1
12
– za poprawnie zapisane równanie reakcji w formie cząsteczkowej:
HClO
3
+ NaIO
3
→
HIO
3
+ NaClO
3
12.1
1
1
Dokument pobrany przez: c4f4561668056071b2ee1a91ec738090c9ddac6a
Próbny egzamin maturalny z chemii. Poziom r
ozszerzony
Copyright by ZamKor spółka z ograniczoną odpowiedzialnością S.K.A., Kraków 2014
Z
K
am
or
4
13
– za poprawną metodę rozwiązania – za obliczenia i wynik:
V
NaOH
:
V
H
2
SO
4
=
1 : 1
Przykładowe r
ozwiązanie:
roztwór NaOH: pH = 1
1 => pOH = 3 => [OH
−
] = 0,001
mol / dm
3
założenie:
V
NaOH
= 1
dm
3
=>
n
OH
−
= 0,001
mol
=>
n
NaOH
= 0,001
mol
odczyn obojętny tzn., że substraty zmieszano w stosunku stechiometrycznym:
2NaOH + H
2
SO
4
→ Na
2
SO
4
+ 2H
2
O
0,001 mol 0,0005 mol
roztwór H
2
SO
4
: pH = 3 => [H
+
] = 0,001
mol / dm
3
=>
C
H
2
SO
4
= 0,0005 mol/dm
3
V
H
2
SO
4
=
0
0005
0
0005
3
,
,/
mo
l
mo
ld
m
= 1
dm
3
V
NaOH
:
V
H
2
SO
4
=
1 : 1
lub inna
poprawna metoda
rozwiązania
13.1
1 1
2
14
a) za poprawne uzupełnienie wiersza tabeli:
Obserwacje
Równanie/równania reakcji
Probówka 1
W
ytrąca się biały osad.
MgCl
2
+ 2NaOH
→
Mg(OH)
2
+ 2NaCl
Probówka 2
W
ytrąca się biały osad,
który po pewnym czasie
brunatnieje.
Mn(NO
3
)
2
+ 2NaOH
→
Mn(OH)
2
+ 2NaNO
3
2Mn(OH)
2
+ O
2
→
2MnO
2
+ 2H
2
O
lub zapis:
2Mn(OH)
2
+ O
2
→
2MnO(OH)
2
2Mn(OH)
2
+ O
2
→ 2(MnO
2
∙ H
2
O)
14.1
2 × 1
3
b) za poprawnie sformułowaną ocenę metody:
Zapr
oponowana metoda jest wystar
czająca by r
ozróżnić wodne r
oztwory soli.
W
pr
o-
bówce nr
2 otrzymano wodor
otlenek, który ulega utlenieniu (pod wpływem tlenu za
-
wartego w powietrzu).
lub inaczej
poprawnie
sformułowane uzasadnienie
14.2
1
Dokument pobrany przez: c4f4561668056071b2ee1a91ec738090c9ddac6a
Próbny egzamin maturalny z chemii. Poziom r
ozszerzony
Copyright by ZamKor spółka z ograniczoną odpowiedzialnością S.K.A., Kraków 2014
Z
K
am
or
5
15
a) za podanie nazw odpowiednich odczynników:
Przemiana 1:
kwas chlor
owodor
owy (solny)
Przemiana 3:
chlor
15.1
1
2
b) za podanie wzoru odpowiedniego odczynnika i określenie typu reakcji:
Wzór odczynnika:
H
2
O
2
lub
O
2
Typ reakcji:
(r
eakcja) utleniania-r
edukcji
15.2
1
16
– za poprawne uzupełnienie zdania i uzasadnienie:
Stan równowagi reakcji ( przesunie się w prawo ,
przesunie się w lewo
, nie ulegnie zmianie ).
Uzasadnienie:
Zwiększenie stężenia jonów Ca
2+
powoduje, że układ zgodnie z
r
egułą
przekory dąży do zmniejszenia ich stężenia – stan równowagi r
eakcji przesuwa się
w
lewo – w
str
onę tworzenia osadu CaSO
4
.
lub inaczej
poprawnie
sformułowane uzasadnienie
16.1
1
1
17
– za poprawny wybór obserwacji:
W
ytrąciła się większa ilość białego osadu.
17.1
1
2
– za poprawne uzasadnienie:
Dodatek siar
czanu(VI) sodu, powoduje, że stężenie jonów SO
4
2−
w układzie r
ośnie.
Zwiększa się więc wartość iloczynu stężeń jonów [Ca
2+
] · [SO
4
2−
] i wytrąca się w większa
ilość osadu.
lub inaczej
poprawnie
sformułowane uzasadnienie
17.2
1
Dokument pobrany przez: c4f4561668056071b2ee1a91ec738090c9ddac6a
Próbny egzamin maturalny z chemii. Poziom r
ozszerzony
Copyright by ZamKor spółka z ograniczoną odpowiedzialnością S.K.A., Kraków 2014
Z
K
am
or
6
18
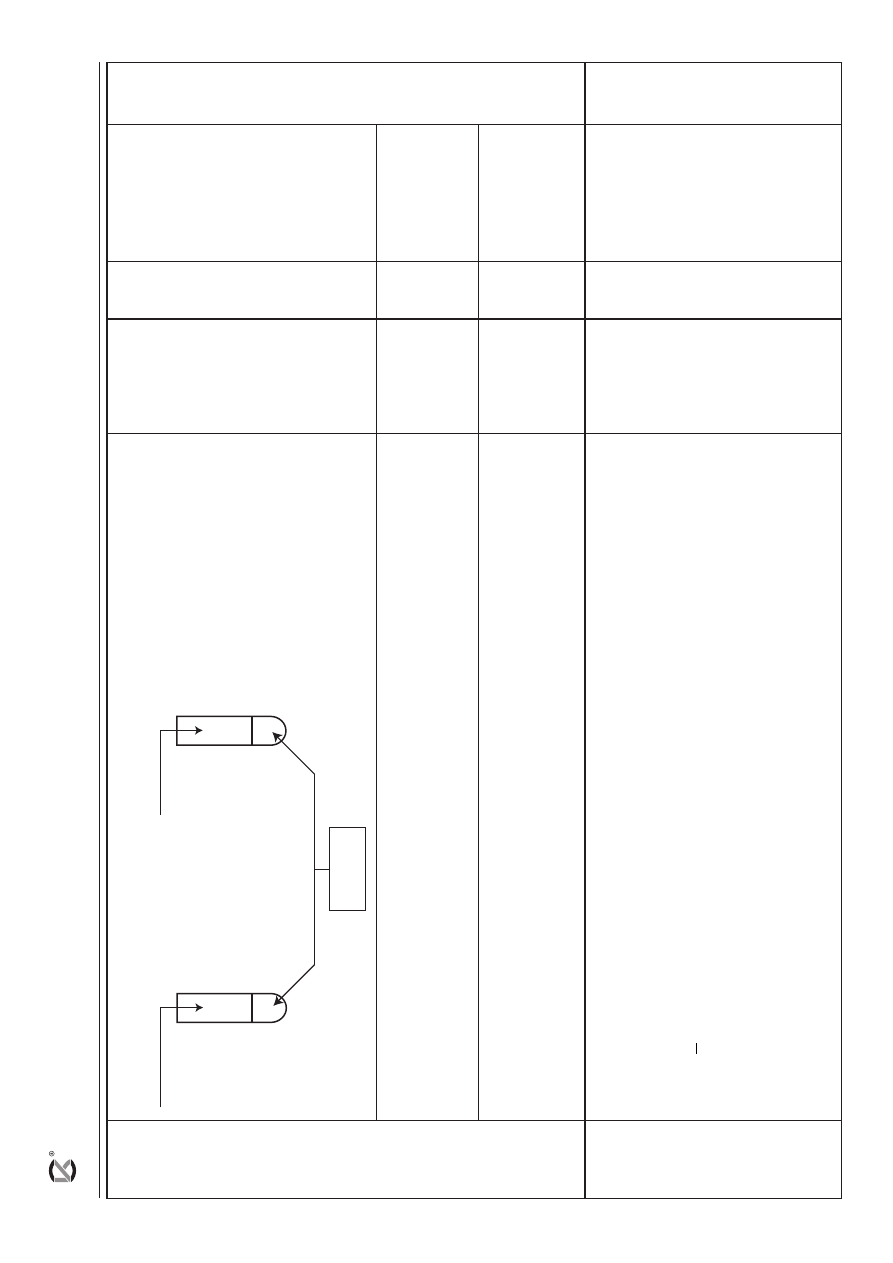
a) za poprawnie uzupełniony schemat doświadczenia:
2.
HCl
(aq)
1.
NaOH
(aq)
X
(NH
4
)
2
S
18.1
1
3
b) za poprawnie sformułowane uzasadnienie:
Amoniak jest gazem, który dobrze r
ozpuszcza się w wodzie. Zwiększenie temperatury
powoduje zmniejszenie r
ozpuszczalności amoniaku i zwiększenie jego wydzielania.
lub inaczej
poprawnie
sformułowane uzasadnienie
18.2
1
c) za poprawne sformułowanie obserwacji i poprawny zapis równania procesu dysocjacji:
Barwa wskaźnika:
pomarańczowoczerwona (czerwona)
.
Zapis procesu:
H
2
S + H
2
O
←→
HS
–
+ H
3
O
+
lub
H
2
S
←→
HS
–
+ H
+
18.3
1
19
– za poprawną metodę rozwiązania – za obliczenia i wynik z jednostką:
99%
Przykładowe r
ozwiązanie:
Mg
OM
gO
Hk
Jm
ol
sg
st
wM
gO
o
()
()
()
.
,/
+→
=−
1
2
601
6
2
∆
24,3 g Mg
− (
−
601,6 kJ)
x
g Mg
− (
− 2450,9 kJ) =>
x = 99 g
100 g
− 100%
99 g
−
y =>
y = 99 %
lub inna
poprawna metoda rozwiązania
19.1
1 1
2
Dokument pobrany przez: c4f4561668056071b2ee1a91ec738090c9ddac6a
Próbny egzamin maturalny z chemii. Poziom r
ozszerzony
Copyright by ZamKor spółka z ograniczoną odpowiedzialnością S.K.A., Kraków 2014
Z
K
am
or
7
20
a) za poprawnie zapisane wyrażenie na stałą równowagi reakcji:
K
[HI]
[H
]
2
2
20.1
1
2
b) za poprawne uzupełnienie zdania:
W
raz ze wzrostem temperatury szybkość reakcji syntezy jodowodoru
rośnie
, szybkość reak
-
cji rozpadu jodowodoru
rośnie
, wartość stałej równowagi rekcji
rośnie
.
20.2
1
21
– za poprawne uzupełnienie tabeli:
P /
F
Szczelnie przylegające powłoki: miedziana i cynkowa, chronią stal przed korozją.
P
Po zarysowaniu powłok ochronnych jedynie powłoka wykonana z cynku nadal
chroni stal przed korozją.
P
Po
zarysowaniu
powłok
ochronnych
na
płytce
stalowej
pokrytej
miedzą
pojawia
się
brunatny osad, zaś na płytce pokrytej cynkiem nie zachodzą żadne zmiany
.
F
21.1
1
1
22
a) za poprawny zapis równań procesu katodowego i anodowego:
Równanie reakcji katodowej:
Cu
2+
+ 2e → Cu
Równanie reakcji anodowej:
2H
2
O → O
2
+ 4H
+
+ 4e
lub zapis: 2H
2
O – 4e →
O
2
+ 4H
+
22.1
1
2
b) za poprawne uzupełnienie obu zdań:
Podczas elektrolizy roztworu CuSO
4
liczba moli soli w
roztworze ( rośnie ,
maleje
, nie
ulega zmianie ), stężenie molowe roztworu soli ( rośnie ,
maleje
, nie ulega zmianie ).
Po zakończeniu elektrolizy i wymieszaniu roztworów z przestrzeni katodowej i anodowej
stwierdzono, że pH roztworu ( wzrosło ,
zmalało
, nie uległo zmianie ).
22.2
1
Dokument pobrany przez: c4f4561668056071b2ee1a91ec738090c9ddac6a
Próbny egzamin maturalny z chemii. Poziom r
ozszerzony
Copyright by ZamKor spółka z ograniczoną odpowiedzialnością S.K.A., Kraków 2014
Z
K
am
or
8
23
a) za poprawny zapis procesu utleniania i redukcji:
Równanie reakcji redukcji:
MnO
4
−
+ 3e + 2H
2
O → MnO
2
+ 4OH
–
Równanie reakcji utleniania:
C
2
H
2
+ 10OH
–
→ C
2
O
4
2−
+ 6H
2
O + 8e
lub zapis: C
2
H
2
– 8e + 10OH
–
→ C
2
O
4
2−
+ 6H
2
O
23.1
2 x 1
4
b) za poprawne uzupełnienie współczynników stechiometrycznych:
3C
2
H
2
+
8KMnO
4
→
3(COOK)
2
+
2KOH +
8MnO
2
+
2H
2
O
23.2
1
c) za poprawny wybór obserwacji:
Fioletowy roztwór zmienia barwę na zieloną. Fioletow
y roztwór nie zmienia zabarwienia.
Fioletowy r
oztwór
odbarwia się.
W
ytrąca się brunatny osad.
23.3
1
24
– za poprawny wybór związków
, będących homologami benzenu:
B, D, F
24.1
1
1
25
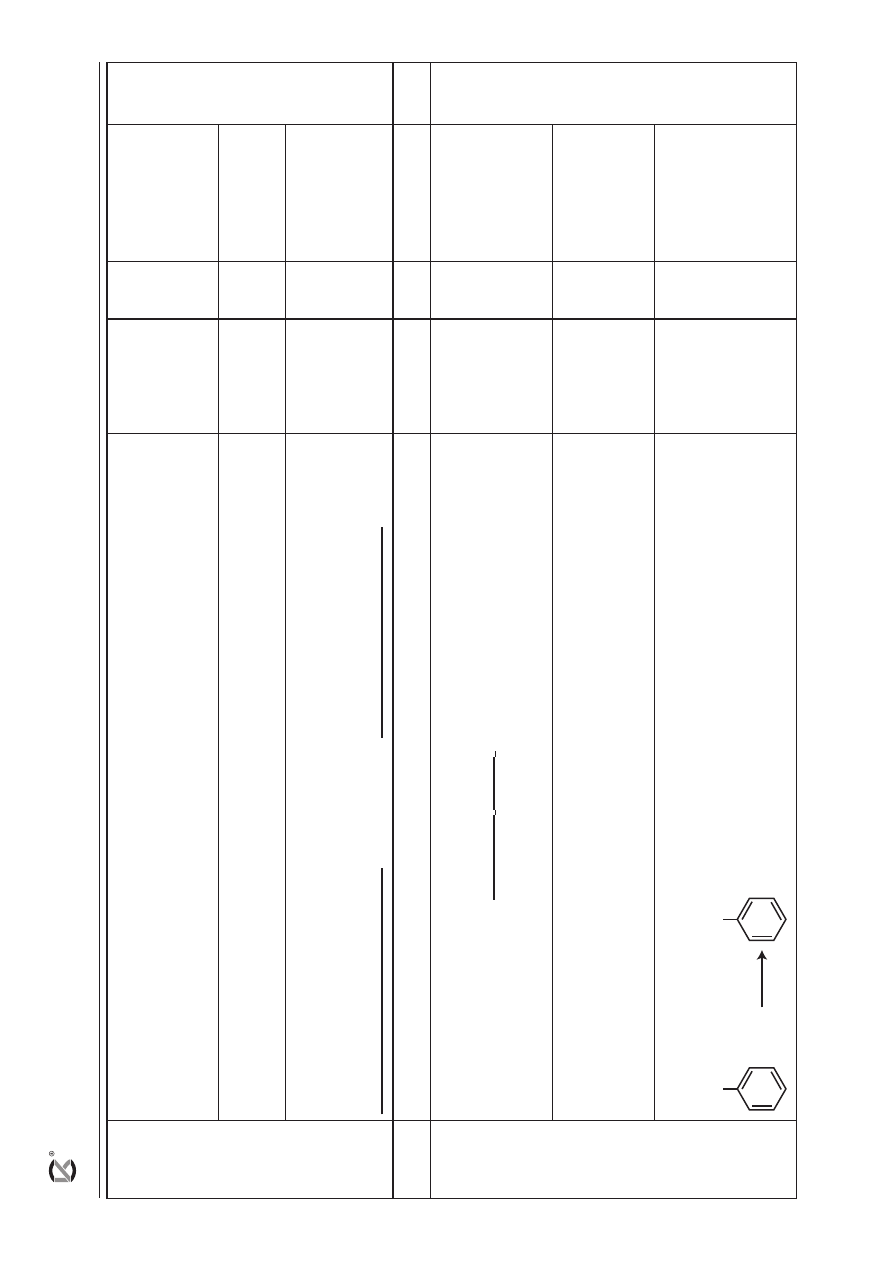
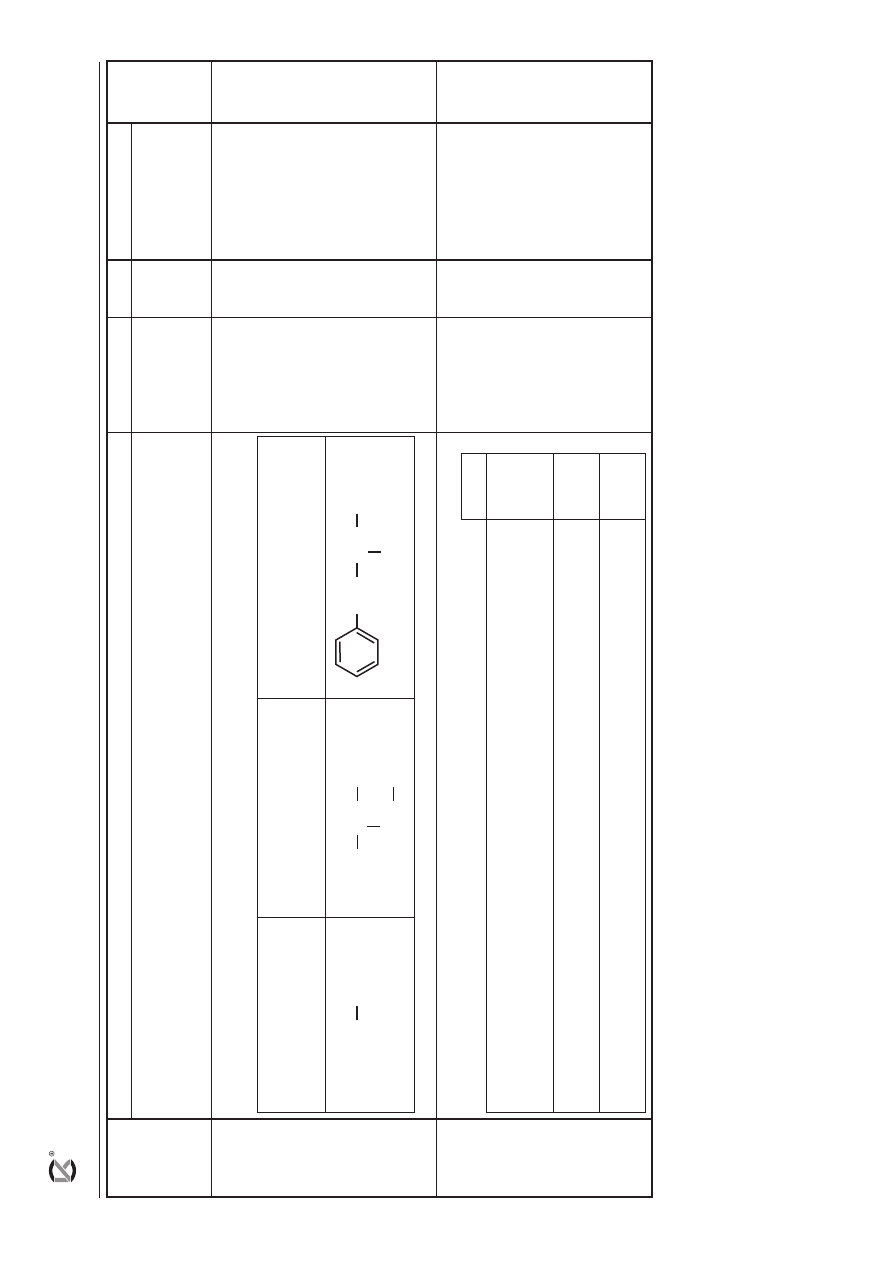
a) za poprawny wybór odczynnika i określenie warunków przebiegu reakcji:
CH
3
Cl
(g)
roztwór
Br
2
w CCl
4
HNO
3(stęż)
+ H
2
SO
4(stęż)
W
arunki przebiegu reakcji:
światło
lub
podwyższona temperatura
25.1
1
3
b) za poprawne sformułowanie obserwacji:
W
pr
obówce, w któr
ej znajdował się toluen r
oztwór
br
omu ulega odbarwieniu.
lub inaczej
poprawnie
sformułowane obserwacje
25.2
1
c) za poprawny zapis równania reakcji:
CH
3
CH
2
Br
+ Br
2
+ HBr
światło
25.3
1
Dokument pobrany przez: c4f4561668056071b2ee1a91ec738090c9ddac6a
Próbny egzamin maturalny z chemii. Poziom r
ozszerzony
Copyright by ZamKor spółka z ograniczoną odpowiedzialnością S.K.A., Kraków 2014
Z
K
am
or
9
26
a) za podanie nazw systematycznych związków:
1-chlor
o-2,3-dimetylobenzen,
1-chlor
o-3,4-dimetylobenzen
26.1
1
2
b) za określenie typu i mechanizmu reakcji:
Typ:
substytucja
, addycja , eliminacja
Mechanizm:
wolnor
odnikowy , nukleofilowy ,
elektr
ofilowy
26.2
1
27
– za podanie nazw systematycznych związków:
metanal, pr
opanon
27.1
1
1
28
– za narysowanie wzoru półstukturalnego (grupowego) związku:
CH
3
C C CH
3
CH
3
CH
3
28.1
1
1
29
– za poprawne uzupełnienie zdań:
Efedryna jest związkiem (
czynnym
, nieczynnym ) optycznie. Cząsteczka efedryny zawiera
( trzy ,
dwie
) grupy funkcyjne. Posiada grupę hydroksylową, która warunkuje przynależność
związku do (
alkoholi
, fenoli ) oraz grupę ( amidową ,
aminową
).
29.1
1
1
30
– za wybór odpowiedniej obserwacji:
Niebieski osad zmienia barwę na ceglastoczerwoną.
Niebieski osad zmienia barwę na czarną.
Niebieski osad zmienia barwę na fioletową. Nie zaobserwowano zmian.
30.1
1
1
31
a) za sformułowanie poprawnej obserwacji:
tworzy się piana
.
31.1
1
2
b) za sformułowanie poprawnej obserwacji i zapis równania procesu uzasadniającego obser
-
wację:
Uniwersalny papier
ek wskaźnikowy zmienia barwę na zielononiebieską
(lub
zieloną
lub
niebieską
).
Równanie procesu:
C
17
H
35
COO
–
+ H
2
O
←→
C
17
H
35
COOH + OH
–
31.2
1
Dokument pobrany przez: c4f4561668056071b2ee1a91ec738090c9ddac6a
Próbny egzamin maturalny z chemii. Poziom r
ozszerzony
Copyright by ZamKor spółka z ograniczoną odpowiedzialnością S.K.A., Kraków 2014
Z
K
am
or
10
32
a) za sformułowanie poprawnej obserwacji:
wytrąca się (biały) osad
.
32.1
1
2
b) za poprawny zapis równania reakcji w formie jonowej skróconej:
2C
17
H
35
COO
–
+ Ca
2+
→ (C
17
H
35
COO)
2
Ca
(↓)
32.2
1
33
– za poprawne uzupełnienie tabeli:
Związek, który nie
reaguje z zasadą sodową.
Związek, który reaguje
z
zasadą sodową w
stosunku
molowym 1: 2.
Związek, który od wpływem stężonego kwasu azotowego(V) tworzy produkt o żółtej barwie.
CH
2
CH COOH
NH
2
H
2
N
CH COOH
CH
2
COOH
CH
3
OH
CH
2
CH COOH
NH
2
H
2
N
CH COOH
CH
2
COOH
CH
3
OH
CH
2
CH COOH
NH
2
H
2
N
CH COOH
CH
2
COOH
CH
3
OH
33.1
1
1
34
– za poprawne uzupełnienie tabeli:
P /
F
Do
dodaniu
do
wodnego
roztworu
glukozy
świeżo
wytrąconego
osadu
wodoro
-
tlenku
miedzi
(II)
i wymieszaniu
zawartości
w
tempe
raturze
pokojowej
pojawia
się ceglastoczerwony osad.
F
Zarówno
glukoza,
jak
i fruktoza
dają
pozytywny
wynik
próby
Trommera
i próby
Tollensa.
P
W
wyniku
hydrolizy
jednego
mola
cząsteczek
sacharozy
powstają
dwa
mole
cząsteczek glukozy
.
F
34.1
1
1
Dokument pobrany przez: c4f4561668056071b2ee1a91ec738090c9ddac6a
Wyszukiwarka
Podobne podstrony:
odpowiedzi rozszerzony zamkor 2013 marzec
matura zamkor 2014 odpowiedzi
matura zamkor 2014 odpowiedzi
arkusz rozszerzony zamkor 2013 marzec
PRZYGOTOWANIE DO SPRAWDZIANU - FUNKCJA LINIOWA - POZIOM ROZSZERZONY 2013 2014, Sprawdziany, p
PRZYGOTOWANIE DO SPRAWDZIANU - WIELOMIANY - poziom rozszerzony 2013 2014, Sprawdziany, powtór
PROGRAM KURSU WIOSNA 2010, UPRAWNIENIA - odpowiedzi do pytań, 2010 - oficjalna płyta
odpowiedzi podstawowy zamkor 2013 marzec
WYKAZ POLSKICH NORM wiosna 2010, UPRAWNIENIA - odpowiedzi do pytań, 2010 - oficjalna płyta
PRZYGOTOWANIE DO SPRAWDZIANU - FUNKCJA KWADRATOWA I - poziom rozszerzony 2013 2014, Sprawdziany,
Kopia WDE odpowiedzi rozszerzone
PRZYGOTOWANIE DO SPRAWDZIANU - FUNKCJA KWADRATOWA II - poziom rozszerzony 2013 2014, Sprawdziany,
egzamin pytania odpowiedzi rozszerzone
Fundusze unijne w pytaniach i odpowiedziach wydanie grudzien 2014 r
Fundusze unijne w pytaniach i odpowiedziach wydanie sierpien 2014 r
więcej podobnych podstron