
Zad.1
a) 4s
1
3d
5
, Cr, chromowce, 4
b) Posiadanie 5 elektronów na podpowłoce d jest bardziej korzystne
energetycznie, więc następuje promocja elektronu z podpowłoki 4s na 3d.
Zad.2
I. E
Na
Na+
< E
Cl
Cl-
II. E
Mg
Mg+
< E
Mg+
Mg2+
III. E
Cl
Cl-
> E
Br
Br-
Zad.3
Jądro atomu sodu ma mniejszy ładunek niż jądro atomu chloru i dlatego
elektrony nie są tak mocno przyciągane, więc łatwiej je oderwać i dlatego
potrzebujemy mniejszej energii jonizacji żeby oderwać elektron z atomu sodu.
Zad.4
1. – F
2. – P
3. – F
Zad. 5
238
72
U
206
82
Pb + 8
4
2
He + 6
0
-1
B
-
Zad.6
Okres połowicznego rozpadu:
X = 2 dni
Y = 4 dni
x/y=4/1
x=4y
0 dni 4y; y
4 dni y; 0,5y

8 dni 0,25y; 0,25y
Odpowiedź: Po upływie 8 dni masy probówek X i Y będą takie same.
Zad.7
a) [ O - H ]
-
b) koordynacyjne
Jon wodorotlenkowy oddaje parę elektronową do pustego orbitalu atomu
centralnego.
c) 2Al + 2OH
-
+ 6H
2
O 2[Al(OH)
4
]
-
+ 3H
2
Zad.8
1. – A, B
2. – C, D, E, F
3. – A, C, E
Zad.9
a) Ba, K
b) Fe
c) C, Ag, Cu
Zad.10
Barwa warstwy
organicznej
Równanie reakcji
Uzasadnienie
Probówka I
Pomarańczowo-brunatna
2Br
-
+ Cl
2
2Cl
-
+ Br
2
Chlor jest
aktywniejszy od
bromu.
Probówka II
Fioletowa
Reakcja nie zachodzi
Jod jest mniej
aktywny od bromu.
Zad.11
a) pH=2

b) fluorkowy, pochodzi od słabszego kwasu (im słabszy kwas tym mocniejsza
zasada).
Zad.12
HClO
3
+ NaIO
3
HIO
3
+ NaClO
3
Zad.13
H
+
+ OH
-
H
2
O
pH=3 [H
+
]=10
-3
mol/dm
3
pH=11 pOH=3 [OH
-
]=10
-3
mol/dm
3
1mol H ---- 1 mol OH
Stosunek: 1/1
Zad.14
Obserwacje
Równanie/równania reakcji
Probówka I
Wytrąca się biały osad.
MgCl
2
+ 2NaOH Mg(OH)
2
+ 2NaCl
Probówka II
Wytrąca się biały, galaretowaty
osad, który na powietrzu brunatnieje.
Mn(NO
3
)
2
+ NaOH Mn(OH)
2
+
2NaNO
3
2Mn(OH)
2
+ O
2
2MnO(OH)
2
b) Pozwoli, ponieważ otrzymane osady różnią się barwą.
Zad.15
a) Przemiana 1: kwas chlorowodorowy
Przemiana 3: chlor
b) H
2
O
2
, erdoks
Zad.16
Przesunie się w lewo, wprowadzając do roztworu azotan (V) wapnia
wprowadzamy jony wapnia, które będą reagowały z SO
4
2-
i wytrącały więcej
osadu.
Zad.17

Wytrąciła się większa ilość osadu. W zlewce mieliśmy osad CaSO
4
, a po
dodaniu Na
2
SO
4
stężenie SO
4
2-
wzrosło, co spowodowało wytrącenie większej
ilości osadu, ponieważ został przekroczony iloczyn rozpuszczalności.
Zad.18
a) (NH
4
)
2
S
b) Żeby wydzielić gaz z roztworu.
c) Czerwona, H
2
S –
H2O
-> 2H
+
+ S
2-
Zad.19 – jeszcze nie przerobiłam tego działu : (
Zad.20
a) K=[HI]
2
/[H
2
]
b) rośnie, maleje, nie zmienia się
Zad.21
1. – P
2. – P
3. – F
Zad.22
a) katoda: 2Cu
2+
+4e
-
2Cu
anoda: 2H
2
O-4e
-
O
2
+4H
+
b) maleje, maleje, zmalało
Zad.23
a) redukcja: MnO
4
-
+2H
2
O+3e
-
MnO
2
+4OH
-
/*8
utlenianie C
2
H
2
+10OH
—
8e
-
(COO)
2
2-
+6H
2
O /*3
współczynniki: 3, 8, 3, 2, 8, 2
c) Fioletowy roztwór odbarwia się.
Wytrąca się brunatny osad.
Zad.24
B, D, F
Zad.25
a) roztwór Br
2
w CCl
4
warunki: światło
b) W probówce z benzenem brak objawów reakcji, natomiast w probówce z
węglowodorem B w warstwie organicznej znika pomarańczowe zabarwienie.
c) C
6
H
5
CH
3
+ Br
2
–światło-> C
6
H
5
CH
2
Br + HBr WZORY
PÓŁSTRUKTURALNE
Zad.26
a) 3-choloro-1,2-dimetylobenzen, 4-chloro-1,2-dimetylobenzen
b) substytucja elektrofilowa
Zad.27
Propanon, metanal
Zad.28
H
3
C-C=C-CH
3
CH
3
CH
3
Zad.29
Czynnym, dwie, alkoholi, aminową
Zad.30
Niebieski osad zmienia barwę na czarną.
Zad.31
a) Pojawiła się piana.
b) Papierek zabarwił się na niebiesko.
C
17
H
35
COO
-
+ H
2
O C
17
H
35
COOH + OH
-
Zad.32
a) Nastąpiło wytrącenie się białego osadu.
b) 2 C
17
H
35
COO
-
+ Ca
2+
(C
17
H
35
COO)
2
Ca
(osad)
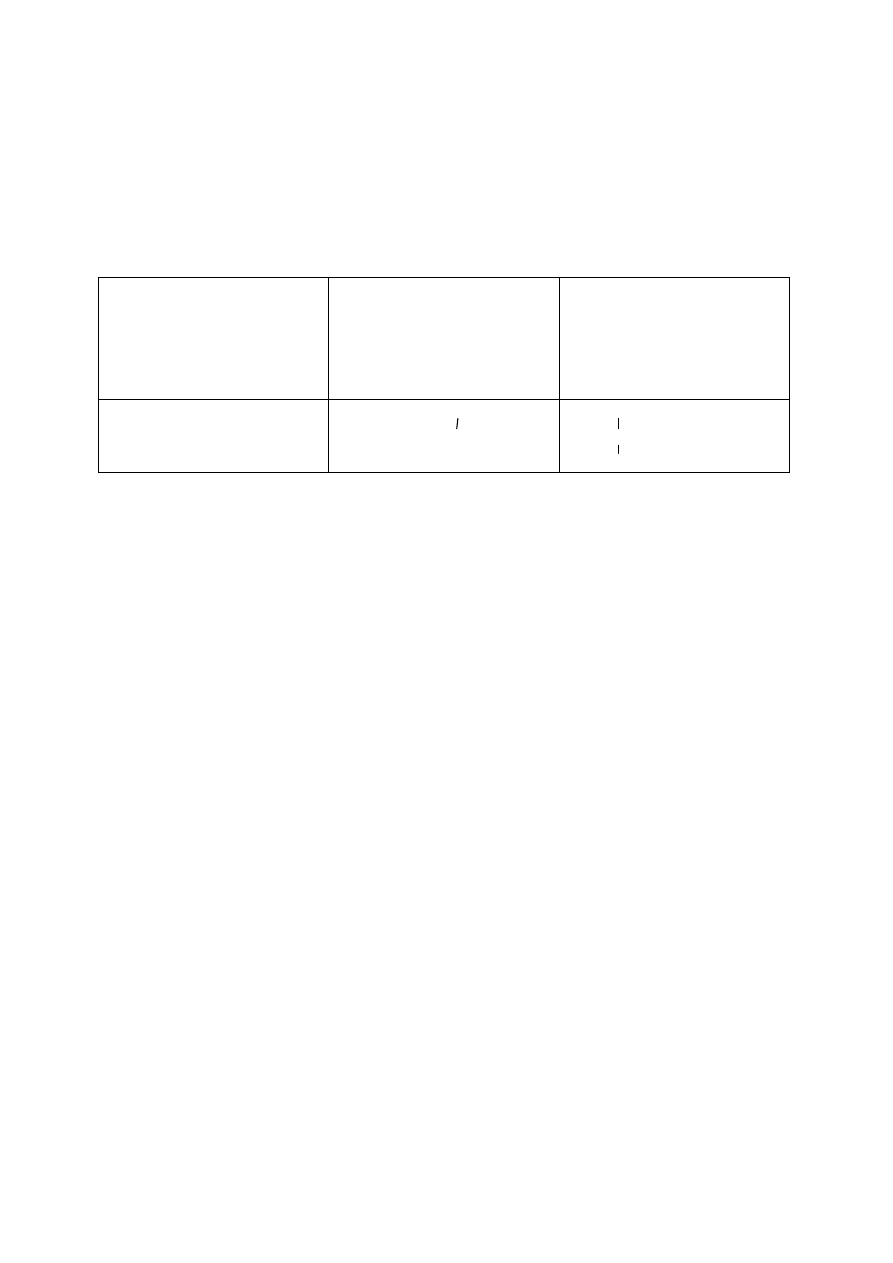
Zad. 33
Związek, który nie
reaguje z zasadą sodową
Związek, który reaguje z
zasadą sodową w
stosunku molowym 1:2
Związek, który pod
wpływem stężonego
kwasu azotowego (V)
tworzy produkt o żółtej
barwie
CH
3
-OH
HOOC-CH
2
-CH-COOH
NH
2
H
2
N-CH-COOH
CH
2
C
6
H
5
Zad.34
1. – F
2. – P
3. – F
Wyszukiwarka
Podobne podstrony:
matura zamkor 2014 odpowiedzi
odpowiedzi rozszerzony zamkor 2014 oficjalne
matura probna 2014 3 id 288983 Nieznany
MATURA PODSTAWOWA CHEMIA ODPOWIEDZI
MATURA PODSTAWOWA FIZYKA ODPOWIEDZI
MATURA ROZSZERZONA CHEMIA ODPOWIEDZI
matura z j polskiego 2014
jezyk angielski matura 2012 rozszerzony odpowiedzi
Matura 11 Matematyka ODPOWIEDZI typowane
matura ustna 2014, Szkolne, Język polski Technikum Liceum kl.2, Wiersze, wiersze
MATURA ROZSZERZONA MATEMATYKA ODPOWIEDZI
więcej podobnych podstron