1
Łańcuch oddechowy i
fosforylacja oksydacyjna
Główne przemiany metaboliczne
prowadzące do wytworzenia ATP
FOSFORYLACJA OKSYDACYJNA
1.
Budowa i funkcje mitochondriów.
2.
Fosforylacja oksydacyjna- to proces
powstawania ATP napędzany
transportem elektronów z substratów
oddechowych na tlen. W procesie tym
pośredniczy siła protonomotoryczna
wytworzona przez gradient pH i różnicę
potencjału elektrochemicznego na
wewnętrznej błonie mitochondrialnej.
3.
Fosforylacja oksydacyjna zachodzi w
błonie komórkowej organizmów
prokariotycznych i w wewnętrznej błonie
mitochondrialnej organizmów
eukariotycznych.
SUBSTRATY ODDECHOWE
Dinukleotyd nikotynamidoadeninowy (NAD)
SUBSTRATY ODDECHOWE
Dinukleotyd flawinoadeninowy (FAD)
CZĄSTECZKI UCZESTNICZĄCE W TRANSPORCIE
ELEKTRONÓW WZDŁUŻ ŁAŃCUCHA ODDECHOWEGO
2
CZĄSTECZKI UCZESTNICZĄCE W TRANSPORCIE ELEKTRONÓW
WZDŁUŻ ŁAŃCUCHA ODDECHOWEGO
Centra żelazo-siarkowe
2Fe-2S
4Fe-4S
Redukcja ubichinonu do ubichinolu
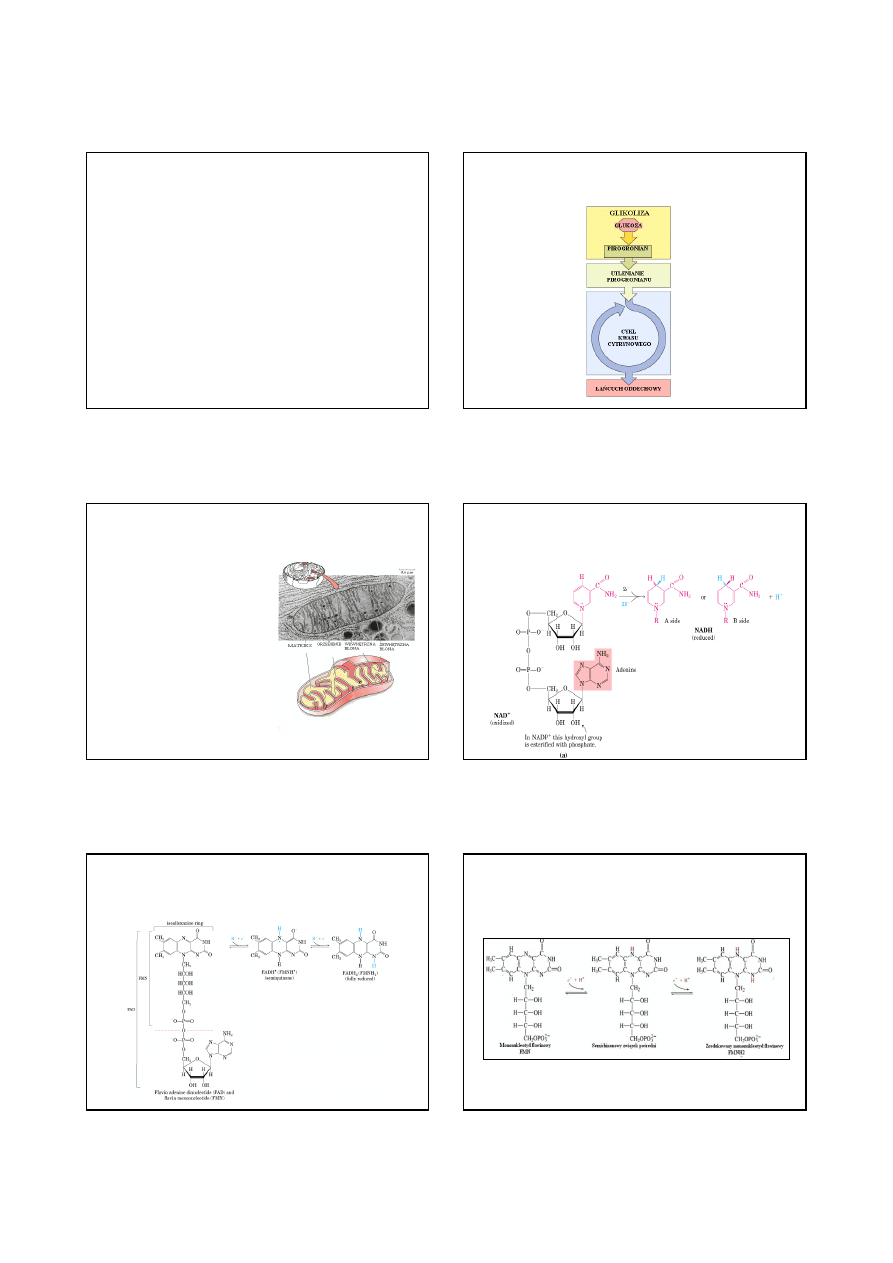
SKŁADNIKI ŁAŃCUCHA TRANSPORTU ELEKTRONÓW
Cytochrom a,
Cytochrom a
3
,
Cu
A
, Cu
B
160
(10 podjednostek)
Oksydaza cytochromu c
(Oksydaza cytochromowa)
Cytochrom b
562,
Cytochrom b
566,
Cytochrom c
1
białka Fe-S
250
(10 podjednostek)
Oksydoreduktaza
koenzym Q-cytochrom c
(Reduktaza cytochromowa)
FAD,
białka Fe-S
140
(4 podjednostki)
Reduktaza
bursztynian – koenzym Q
FMN,
białka Fe-S
880
(34 podjednostki)
Oksydoreduktaza
NADH- koenzym Q
(Dehydrogenaza NADH)
Grupa
prostetyczna
Masa
(kilodaltony
)
Kompleks
enzymatyczny
Koenzym Q – ruchomy przenośnik elektronów
Cytochrom C – ruchomy przenośnik elektronów
ŁAŃCUCH TRANSPORTU ELEKTRONÓW
• Transport elektronów przez łańcuch
oddechowy jest wymuszony różnicą
potencjału redoks między NADH i O
2
.
• E
o
’
dla NADH wynosi – 0,32 V
E
o
’
dla O
2
wynosi + 0,82 V.
NADH + H
+
+ ½ O
2
NAD
+
+ H
2
O
∆
∆
∆
∆ E
o
’
= 0,82 – (-0.32)= +1.14 V
∆
∆
∆
∆G
o
’
= - nF ∆
∆
∆
∆ E
o
’
n – ilość przeniesionych elektronów
F – stała Faradaya
∆
E
o
’
– zmiana potencjału redoks
∆
G
o
’
– energia swobodna wydzielana podczas
reakcji utleniania.
∆
∆
∆
∆G
o
’
= -2 x 96,556kJ·V
-1
·mol
-1
x 1,14V =
= - 220kJ/mol
ADP + P
i
+ H
+
ATP + H
2
O ∆G
0’
= 30,5kJ/mol
Mathews i inni, Biochemistry, 2000,
zmodyfikowany
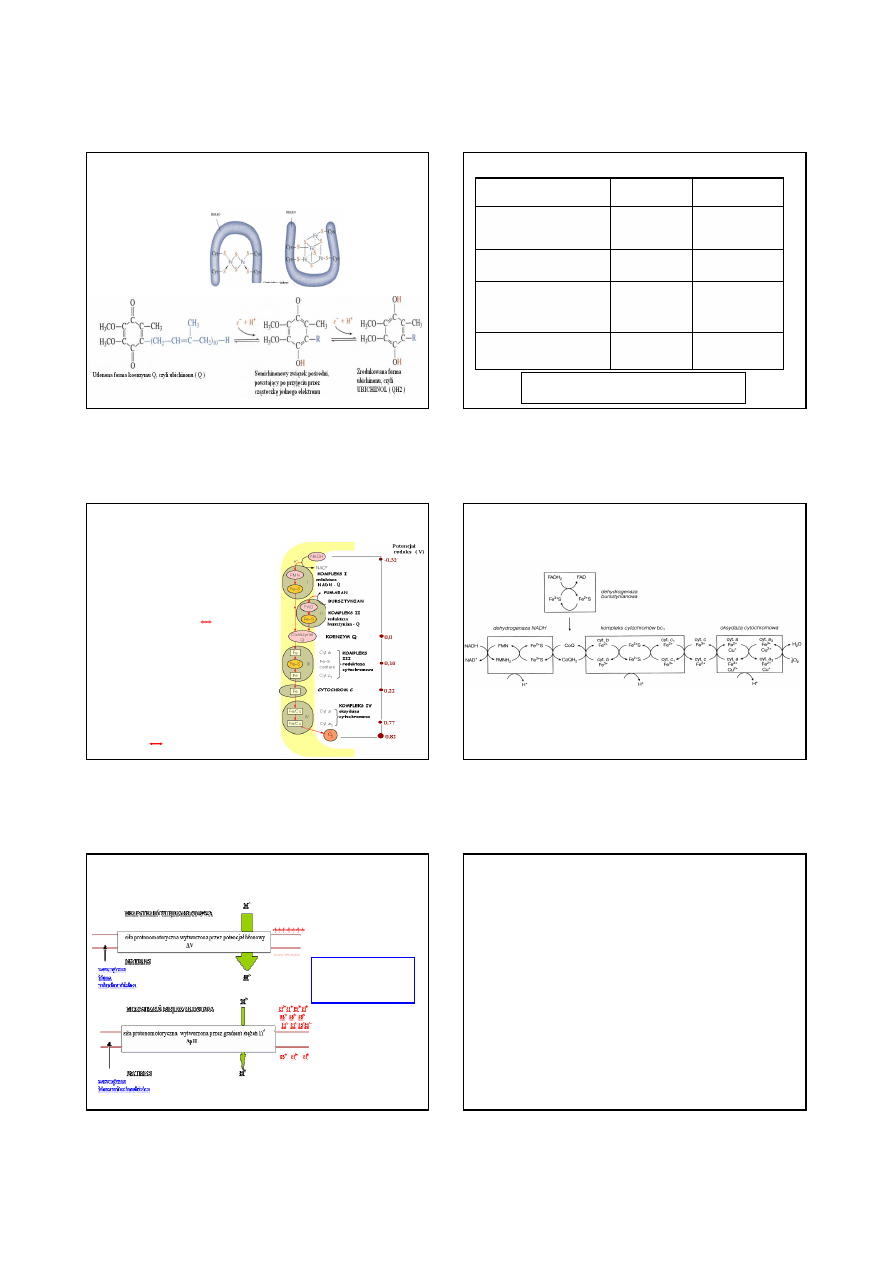
SZCZEGÓŁOWY OBRAZ TRANSPORTU
ELEKTRONÓW
Oksydoreduktaza NADH-Q
Reduktaza
NADH-koenzym Q)
POMPA PROTONOWA
Oksydoreduktaza koenzym
Q-cytochrom c
(Reduktaza cytochromowa)
POMPA PROTONOWA
Reduktaza bursztynian – koenzym Q
Oksydaza cytochromu c
(Oksydaza
cytochromowa)
POMPA PROTONOWA
Teoria chemiosmotyczna Mitchella
Wzór wyrażający siłę
protonomotoryczną
∆
µH = ∆Ψ - 2,3RT ∆pH / F
FOSFORYLACJA OKSYDACYJNA
1.
PETER MITCHELL – HIPOTEZA CHEMIOSMOTYCZNA – 1961rok.
2.
Transport elektronów i wytwarzanie ATP są sprzężone przez gradient protonowy
utworzony w poprzek wewnętrznej błony mitochondrialnej.
3.
Przepływ elektronów z NADH lub FADH
2
przez łańcuch oddechowy powoduje
uwalnianie energii. Jest ona wykorzystywana do przepompowania protonów z
matriks mitochondrialnej do przestrzeni międzybłonowej. Uczestniczą w tym:
kompleks I, kompleks III i kompleks IV.
4.
Stężenie H
+
w przestrzeni międzybłonowej wzrasta. Powstaje gradient pH. Jedna
ze składowych siły protonomotorycznej napędzającej syntezę ATP zostaje
wytworzona przez tę różnicę stężeń jonów H
+
.
5.
Jednocześnie cytoplazmatyczna (zewnętrzna) strona wewnętrznej błony
mitochondrialnej uzyskuje ładunek dodatni, a strona wewnetrzna ładunek ujemny.
Powstaje różnica potencjałów elektrochemicznych na wewnnętrznej błonie
mitochondrialnej – druga składowa siły protonomotorycznej napędzającej syntezę
ATP zostaje wytworzona przez różnicę stężeń jonów H
+
.
6.
Wzór na siłę protonomotoryczną
∆
µ
H
= ∆Ψ - 2,3RT ∆pH / F
7. Protony mogą powrócić do matriks jedynie przez specjalne kanały, którymi są
cząsteczki enzymu
syntazy ATP.
3
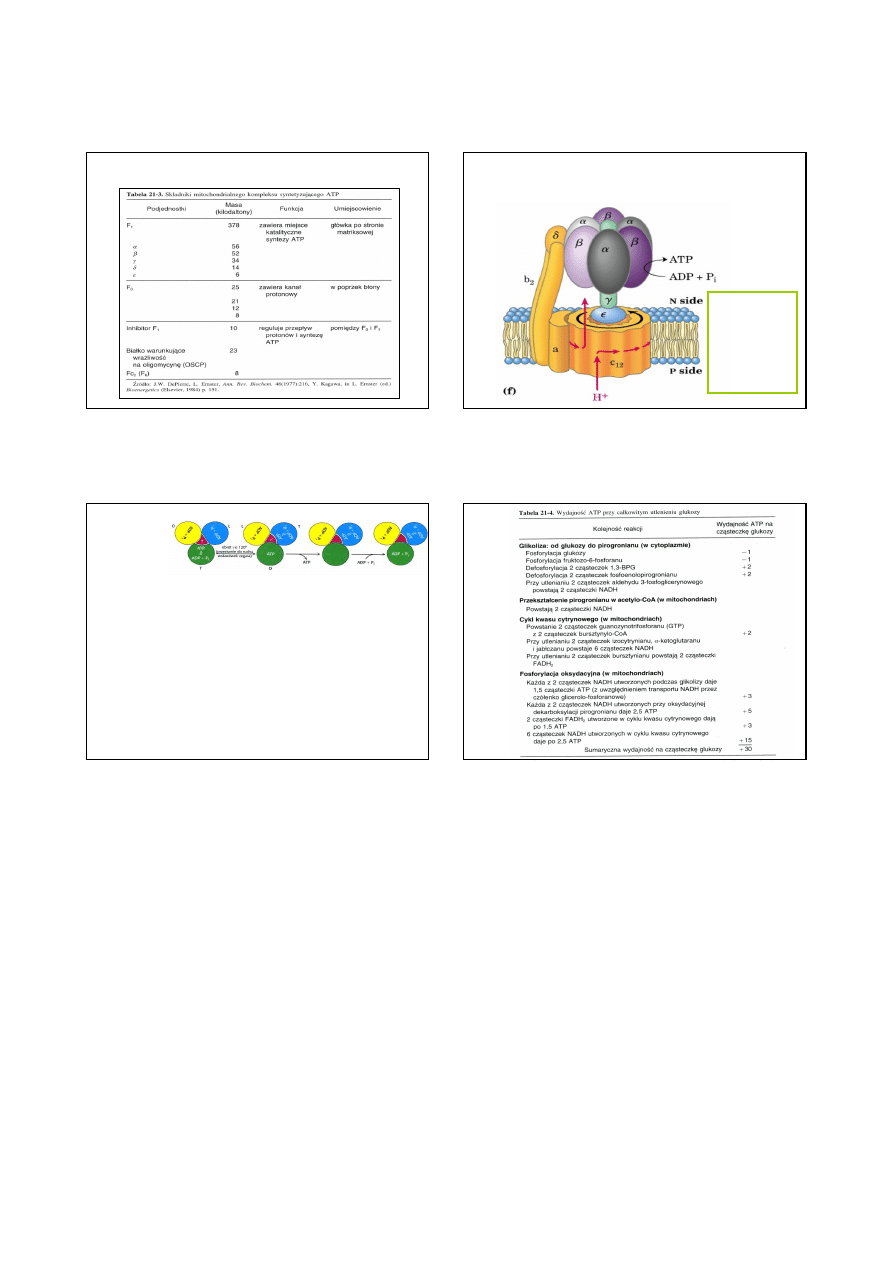
BUDOWA I DZIAŁANIE SYNTAZY ATP
Struktura syntazy ATP
Powrót 3H
+
przez
podjednostkę
F
0
syntazy
ATPdo matrix
mitochondrium
= 1 ATP
DZIAŁANIE
SYNTAZY
ATP
• Podjednostki ß syntazy ATP posiadają miejsca katalityczne - miejsca wiązania
nukleotydów: ADP +Pi oraz ATP.
• Podjednostki ß syntazy ATP są funkcjonalnie nierównoważne:
• miejsce katalityczne w formie
O
- otwarte – ma znikome powinowactwo do
substratów;
• miejsce katalityczne w formie
L
– luźno wiąże substraty i nie ma aktywności
katalitycznej;
• miejsce katalityczne
T
– mocno wiąże substraty ( ADP i Pi ) i jest katalitycznie
aktywne.
• Energia wniesiona przez przepływ protonów przez kanał Fo, powoduje zmianę
konformacji miejsc katalitycznych: T przechodzi w O, L w T a miejsce O w L.
• Te zmiany konformacyjne zachodzą prawdopodobnie na skutek rotacji podjednostek
ß względem podjednostki
γ
.
Podjednostka γ przenosi energię protonów i wymusza
transformację miejsca T w miejsce O, aby nastąpiło odłączenie ATP.
STRYER L.
BIOCHEMIA, 1997
Wyszukiwarka
Podobne podstrony:
Łańcuch oddechowy, fosforylacja oksydacyjna
Łańcuch oddechowy, fosforylacja oksydacyjna
Łańcuch oddechowy i fosforylacja
biochemia łańcuch oddechowy i fosforylacja
Oddychanie komorkowe i fosforylacja oksydacyjna
lancuch oddechowy, Biomechanika kliniczna
12 Biochemia fosforylacja oksydacyjna nowa
CKT, łańcuch oddechowy(1)
Transport elektronów i fosforylacja oksydacyjna, biochemia
łańcuch oddechowy
6a WYKŁAD Fosforylacja oksydacyjna
FOSFORYLACJA OKSYDACYJNA
FOSFORYLACJA OKSYDACYJNA - PREZENTACJA, Weterynaria rok 1, Biochemia
Łańcuch oddechowy
lancuch oddechowy
Fosforylacja oksydacyjna i mitochondrium, BIOCHEMIA
sciaga transport elektronów i fosforylacja oksydacyjna, Biochemia
więcej podobnych podstron