
Procesy hydrolizy, hydratacji i dehydratacji
1

Reakcjami hydrolizy nazywa się te procesy podstawienia lub wymiany podwójnej
przebiegające pod wpływem wody lub zasad.
Reakcje hydratacji sprowadzają się do przyłączenia wody do wiązań nienasyconych
C=C, C
≡C lub C≡N w nitrylach itp.; niekiedy hydratacja jest odwracalna.
Proces odłączenia wody nazywa się dehydratacją; może być wewnątrz- i
międzycząsteczkowa. Wydzielenie wody zachodzi w wielu reakcjach, dlatego też termin
dehydratacja używa się tylko w tych procesach, które nie mają innych bardziej
określonych klasyfikacji.
2
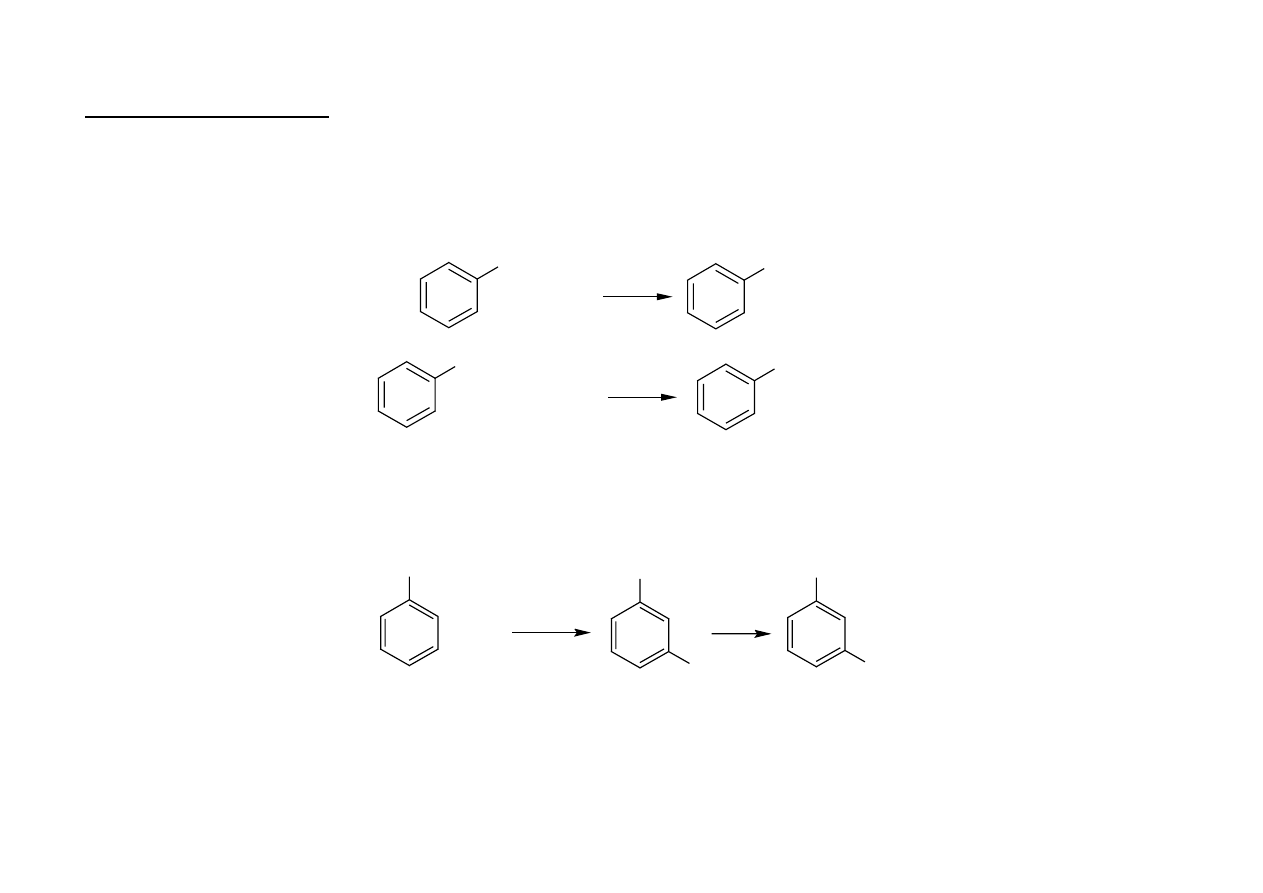
Przykłady hydrolizy
• fenol
+ HCl
+ NaOH
ONa
Cl
+ NaHCO
3
+ CO
2
+ H
2
O
ONa
OH
• pochodne fenoli, np. m-nitrofenol, o- i p-nitrofenole i 2,4-dinitrofenole
NO
2
+ Cl
2
- HCl
NO
2
Cl
- Cl
-
+ OH
-
NO
2
OH
3
Cl
+
+ HNO
3
Cl
NO
2
- Cl
-
+ OH
-
Cl
NO
2
NO
2
Cl
NO
2
+ HNO
3
+
OH
NO
2
OH
NO
2
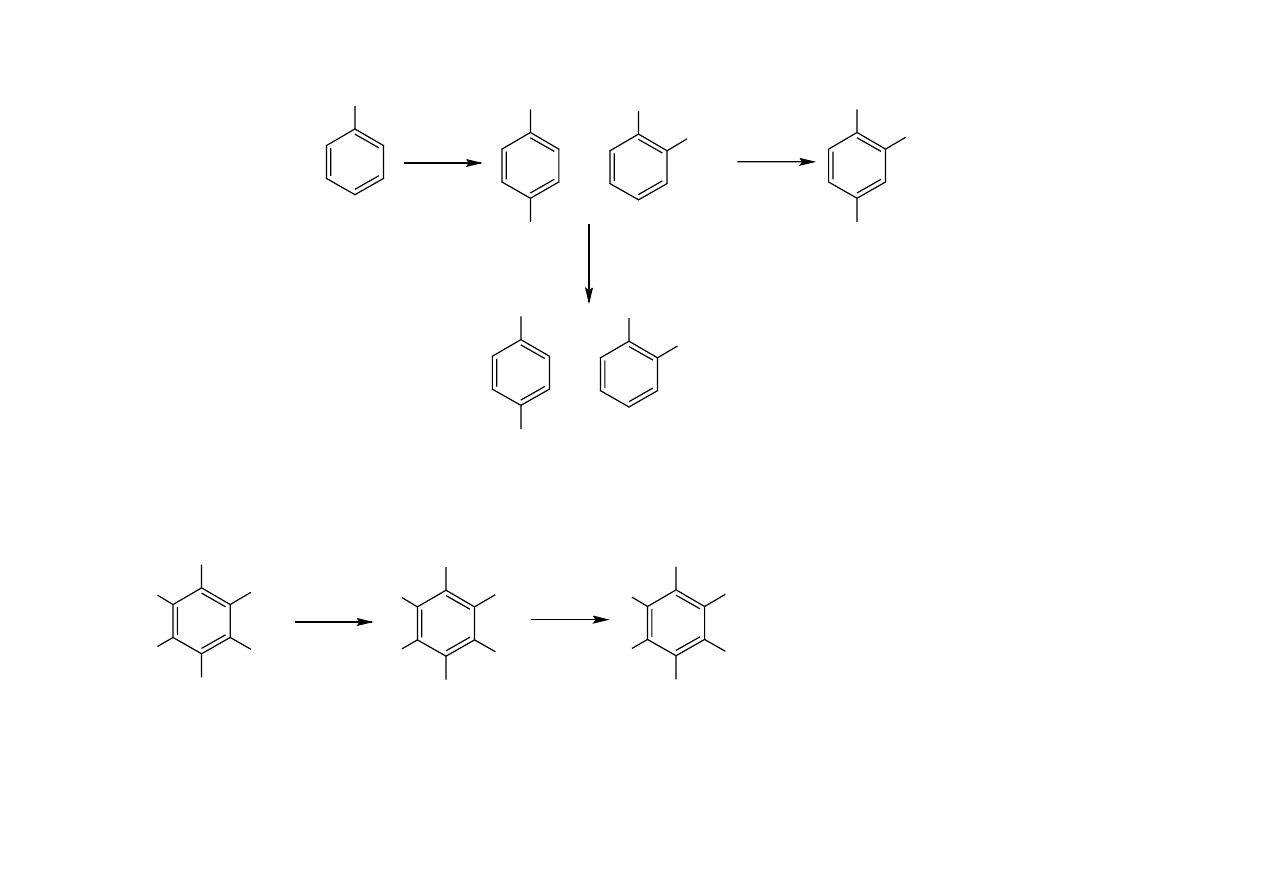
• chlorofenole
- Cl
-
+ OH
-
+ NaOH
Cl
Cl
Cl
Cl
Cl
Cl
Cl
Cl
Cl
Cl
Cl
OH
- H
2
O
Cl
Cl
Cl
Cl
Cl
ONa
4
• alkohol allilowy
2 CH
2
=CHCH
2
Cl + Na
2
CO
3
2 CH
2
=CHCH
2
OH + 2 NaCl + CO
2
HYDROLIZA CHLOROWCOPOCHODNYCH
Halogenki alkilowe
Dla przeprowadzenia procesu zwykle używa się wodne r-ry silniejszych hydrolizujących
czynników – NaOH, Ca(OH)
2
czy Na
2
CO
3
– przy ich działaniu reakcja jest nieodwracalna.
5

Przy hydrolizie zasadowej ubocznym produktem reakcji jest eter:
RCl + OH
-
ROH + Cl
-
ROH + OH
-
RO
-
+ H
2
O
RCl + RO
-
ROR + Cl
-
Duże obniżenie selektywności procesu zachodzi przy hydrolizie silnymi zasadami, gdyż
alkoholany są bardziej aktywne niż jon OH
-
.
Przy hydrolizie Na
2
CO
3
reakcja z CO
3
2-
daje tylko alkohol, a eter może tworzyć się tylko
w reakcji z alkoholem lub alkoholanem, tworzącym się z jonu OH
-
- produktu hydrolizy
Na
2
CO
3
wodą.
6

Hydrolizę chlorków arylowych prowadzi się r-rem NaOH stosując podwójną ilość zasady.
ArCl
ArO
-
+ OH
-
- HCl
ArOAr
2 ArOH
2 ArO
-
+ ArCl
+H
2
O
- Cl
-
- 2 H
+
Warunki hydrolizy chlorowcopochodnych
• temperatura - od 120-125
o
C (hydroliza chlorku alkilowego) do 300-350
o
C (hydroliza
chlorobenzenu)
• ciśnienie od 0,5-1,0 do 10 MPa (konieczność utrzymania mieszaniny reakcyjnej w
fazie ciekłej .
• czas reakcji zmienia się od kilku do 20-30 min.
7

Hydratacja olefin
RCH=CH
2
+ H
2
O
RCHCH
3
OH
R- rodnik alkilowy lub wodór
Katalizatory – kwasy fosforowy, siarkowy, kwaśne żywice jonowymienne.
Alkohole otrzymywane w procesie hydratacji olefin: etanol, alk. izopropylowy, alk.
t-butylowy, alk. sec-butylowy.
8
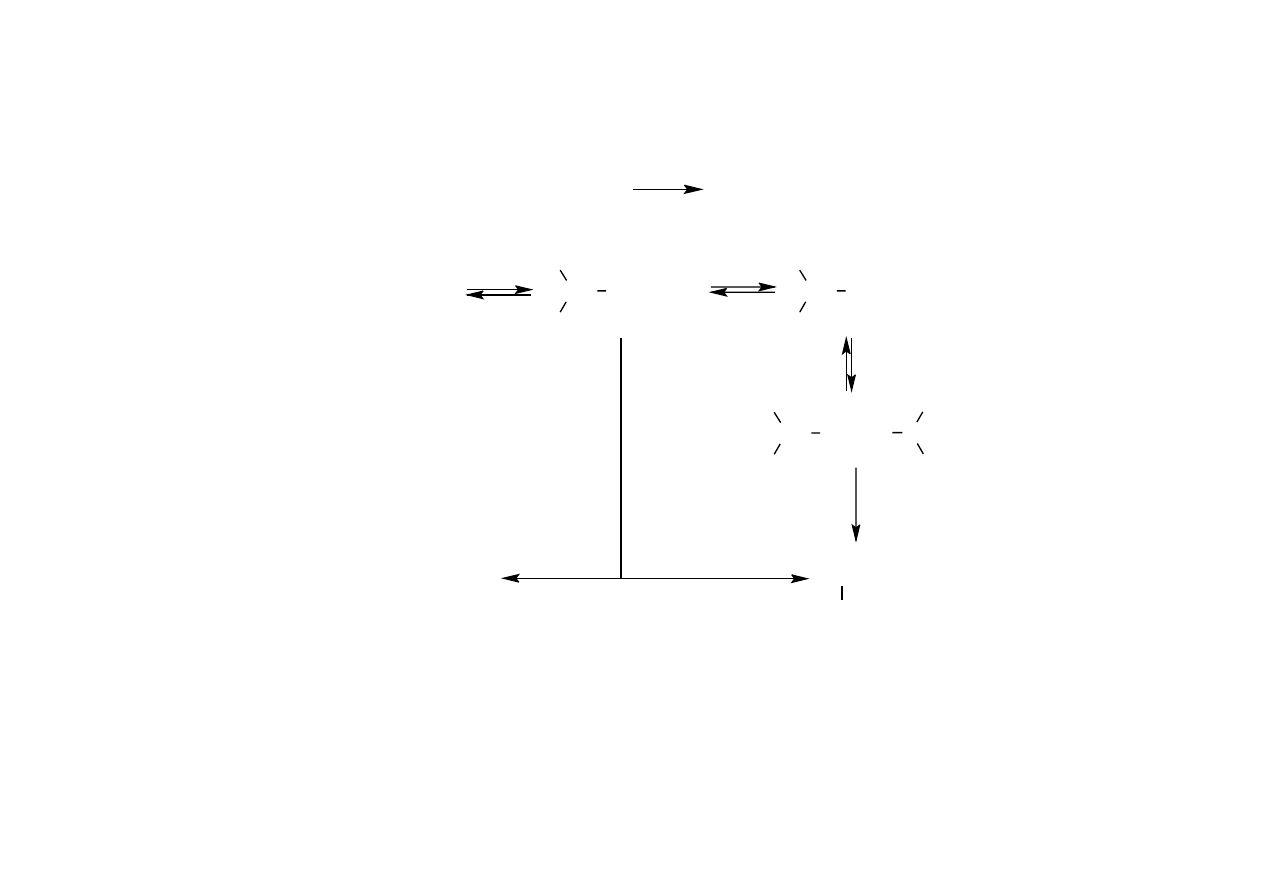
Hydratacja metodą pośrednią
+
RCH=CH
2
+ H
+
RCHCH
3
+
+ HSO
4
-
+ H
2
O
RCHCH
3
CH OSO
2
OH
R
CH
3
CH OSO
2
O
R
CH
3
_
+ H
+
+
RCHCH
3
CH OSO
2
O
R
CH
3
CH
CH
3
R
RCHCH
3
OH
+ H
2
O
H
2
SO
4
9

Hydratacja metodą bezpośrednią
+
RCH=CH
2
+ H
+
(z H
3
PO
4
)
RCHCH
3
+
+ H
+
RCHCH
3
+ H
2
O
RCHCH
3
OH
10

ETANOL SYNTETYCZNY Z ETYLENU
CH
2
=CH
2
+ H
2
O
CH
3
CH
2
OH
Metoda pośrednia
surowiec węglowodorowy - frakcja etanowo-etylenowej, która zawiera 56-60%
etylenu,
ciśnienie - ok. 2,5 MPa,
temperatura - 70-75
o
C,
96-98% H
2
SO
4
,
Wydajność - 85%.
11

Produkty uboczne w metodzie pośredniej
• kwas etionowy
+ H
2
SO
4
+ SO
3
CH
2
CH
2
CH
2
OSO
3
H
CH
2
SO
3
H
• kwas izoetionowy
+ H
2
SO
4
+ H
2
O
CH
2
OSO
3
H
CH
2
SO
3
H
CH
2
OH
CH
2
SO
3
H
Metoda bezpośrednia
surowiec węglowodorowy – czysty etylen (>98%),
temperatura - 265-300
o
C,
ciśnienie - 7,5-8 MPa,
molowy stosunek H
2
O:C
2
H
4
- 0,4-0,9,
12

katalizator - kwas fosforowy na nośniku,
bardzo niski (4,5-5%) stopień przereagowania w jednym „przejściu” przez reaktor
13
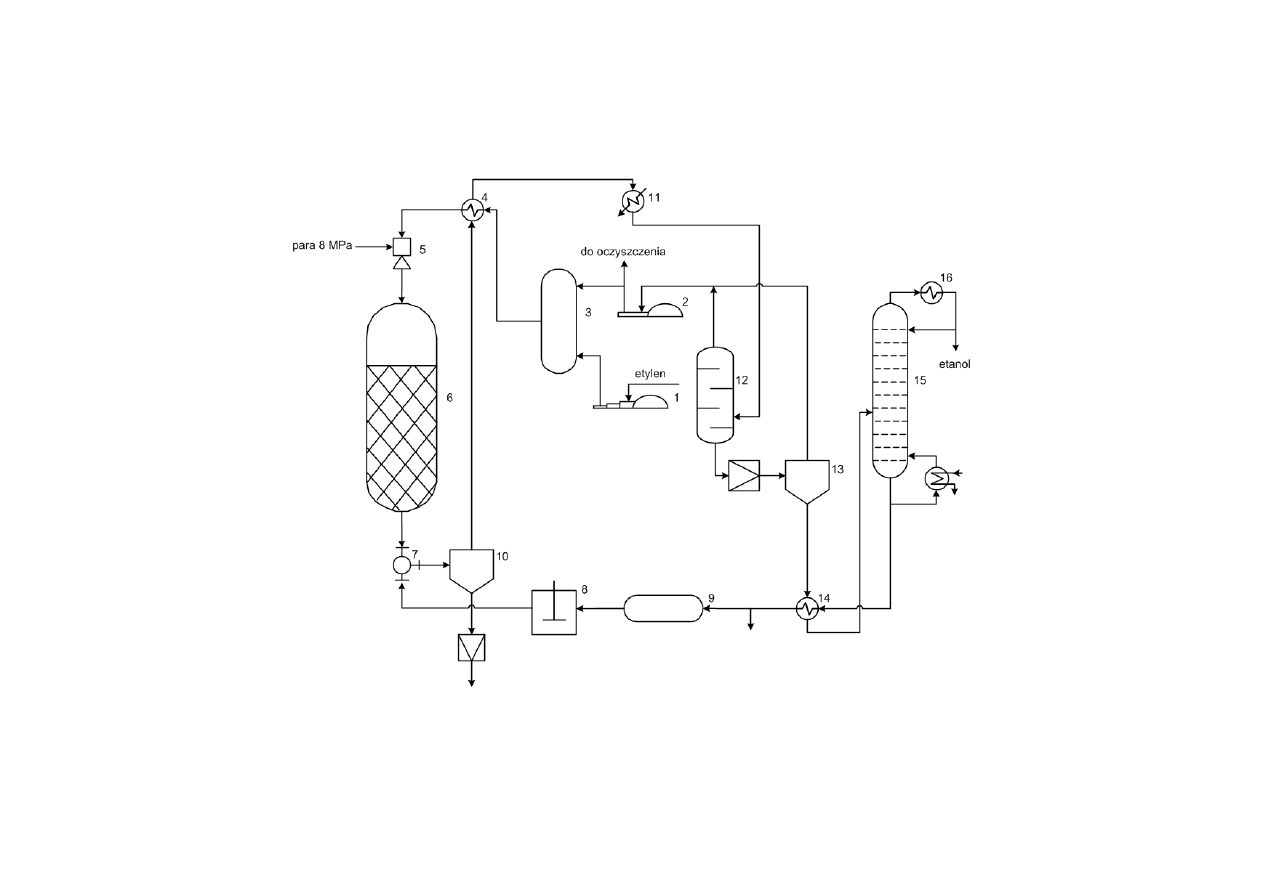
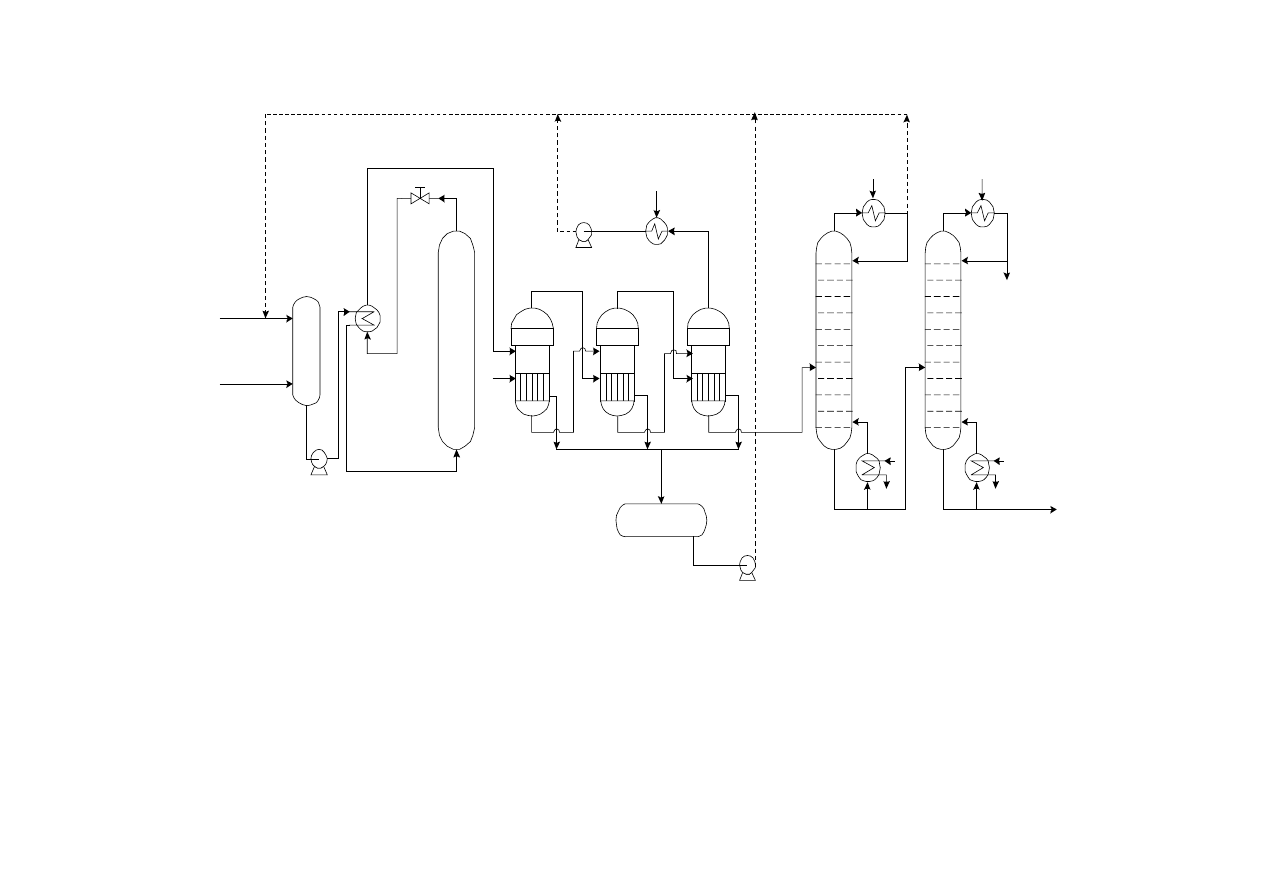
Schemat instalacji produkującej etanol metodą bezpośredniej
hydratacji etylenu
14
1 – sprężarka do świeżego etylenu, 2 – sprężarka do powrotnego etylenu, 3 – mieszalnik, 4 – wymiennik ciepła,
5 – injektor, 6 – reaktor, 7 – trójnik, 8 – pompa, 9 – zbiornik r-ru ługu, 10 – rozdzielacz, 11 – kondensator, 12 –
rozdzielacz wysokiego ciśnienia, 13 – rozdzielacz niskiego ciśnienia, 14 – wymiennik ciepła, 15 – kolumna
rektyfikacyjna, 16 – chłodnica-kondensator
Inne metody otrzymywania etanolu
Procesy fermentacyjne
Hydroliza celulozy zawartej w drewnie
(C
6
H
10
O
5
)
x
+ x H
2
O
x C
6
H
12
O
6
H
+
(z H
2
SO
4
)
2 C
2
H
5
OH + 2 CO
2
C
6
H
12
O
6
15
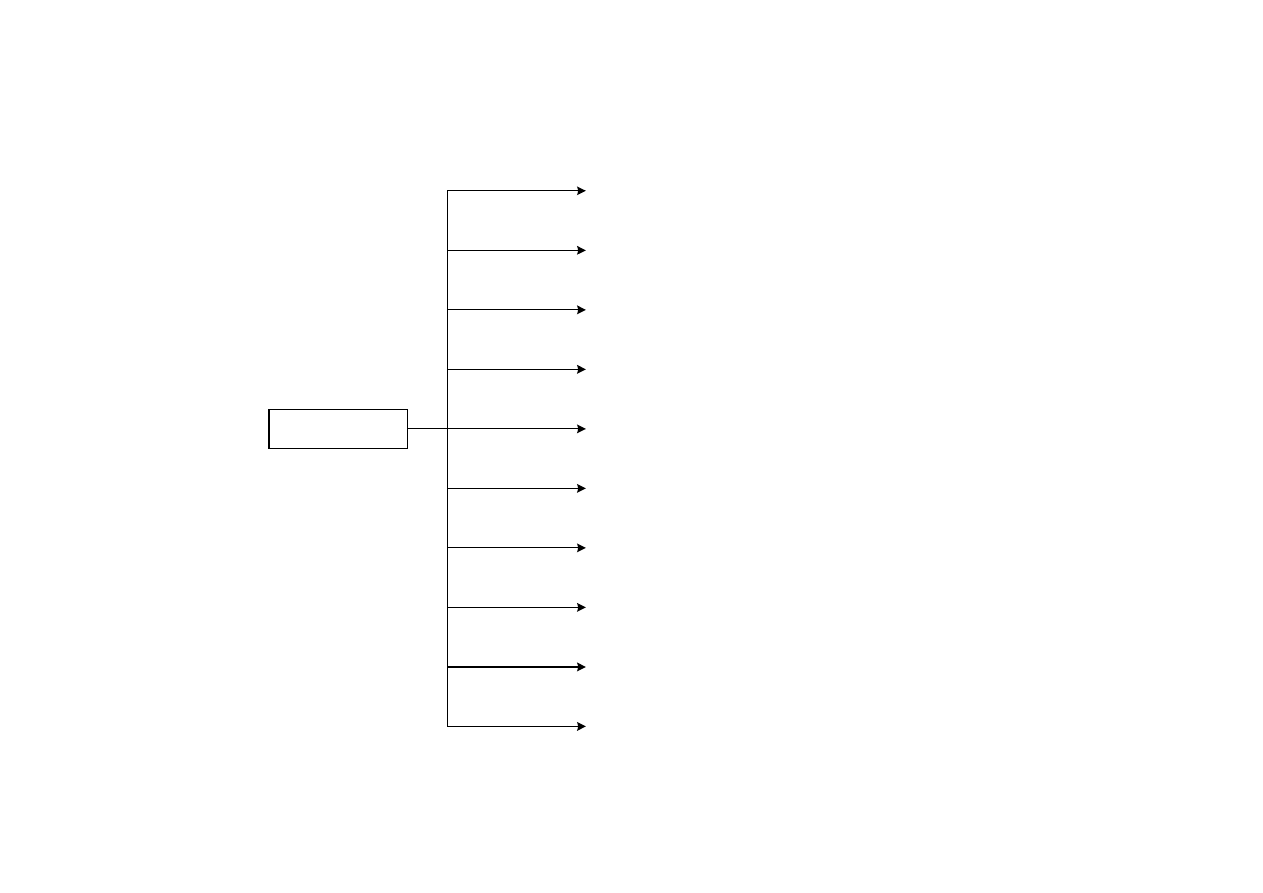
ZASTOSOWANIE ETANOLU
Etanol
dehydratacja
i odwodornienie
1,3-butadien
eter dietylowy
RNH
2
monoetylo- i dietyloaminy
niekiedy
aceton
octan etylu - cenny rozpuszczalnik w produkcji lakierów
+CH
3
COOH
akroleina
alkohol allilowy i aldehyd octowy
kwas octowy
chloroform
dehydratacja
chlorowanie
chloral
odwodornienie
lub utlenienie
aldehyd octowy
16
Hydratacja tlenku etylenu
Z tlenku etylenu
CH
2
CH
2
O
+
O
H
2
HOCH
2
CH
2
OH
∆H<0 (-80 kJ/mol)
Warunki procesu:
• reaktor kolumnowy o wysokości ok. 10 m,
• proces w fazie ciekłej,
• około 10-20-krotnym molowym nadmiar wody,
• temperatura - 50-70
o
C, w obecności katalizatorów kwaśnych (H
2
SO
4
, H
3
PO
4
, kwas
szczawiowy; ciśnienie bliskie atmosferycznego), lub 140-230
o
C (bezkatalitycznie, pod
ciśnieniem 2-4 MPa; wysokie ciśnienie jest konieczne aby utrzymać reagującą mieszaninę w
fazie ciekłej).
• wodny roztwór surowego glikolu
zawiera ok.
12% glikolu monoetylenowego oraz ok. 2%
DEG i TEG; zatęża się go w wyparkach do ok. 70% i poddaje destylacji frakcjonowanej w
szeregu kolumn próżniowych; czystość wymagana dla poliestrów - 99,9% wag.,
• selektywność do monoglikolu etylenowego tylko ok. 90%; ubocznie powstaje ok. 9% diglikolu,
1% triglikolu i wyższych glikoli etylenowych. Łączna wydajność glikoli wynosi 95-96%.
17
H
2
O
H
2
O
H
2
O
woda
tlenek etylenu
1
2
3
4
para
para
para
5a
5b
5c
2
6a
9
2
7a
7b
glikol etylenowy
6b
6c
DEG + TEG
woda z domieszką glikoli
Schemat instalacji produkującej glikol etylenowy z tlenku etylenu.
1 - mieszalnik, 2 - pompy, 3 - wymiennik ciepła, 4 - kolumnowy reaktor hydratacji, 5 - wyparki, 6 -
chłodnice wodne, 7 - próżniowe kolumny rektyfikacyjne, 8 - kotły parowe, 9 - zbiornik skroplin
wodnych zawierających nieco glikoli, DEG - glikol dietylenowy, TEG - glikol trietylenowy
18
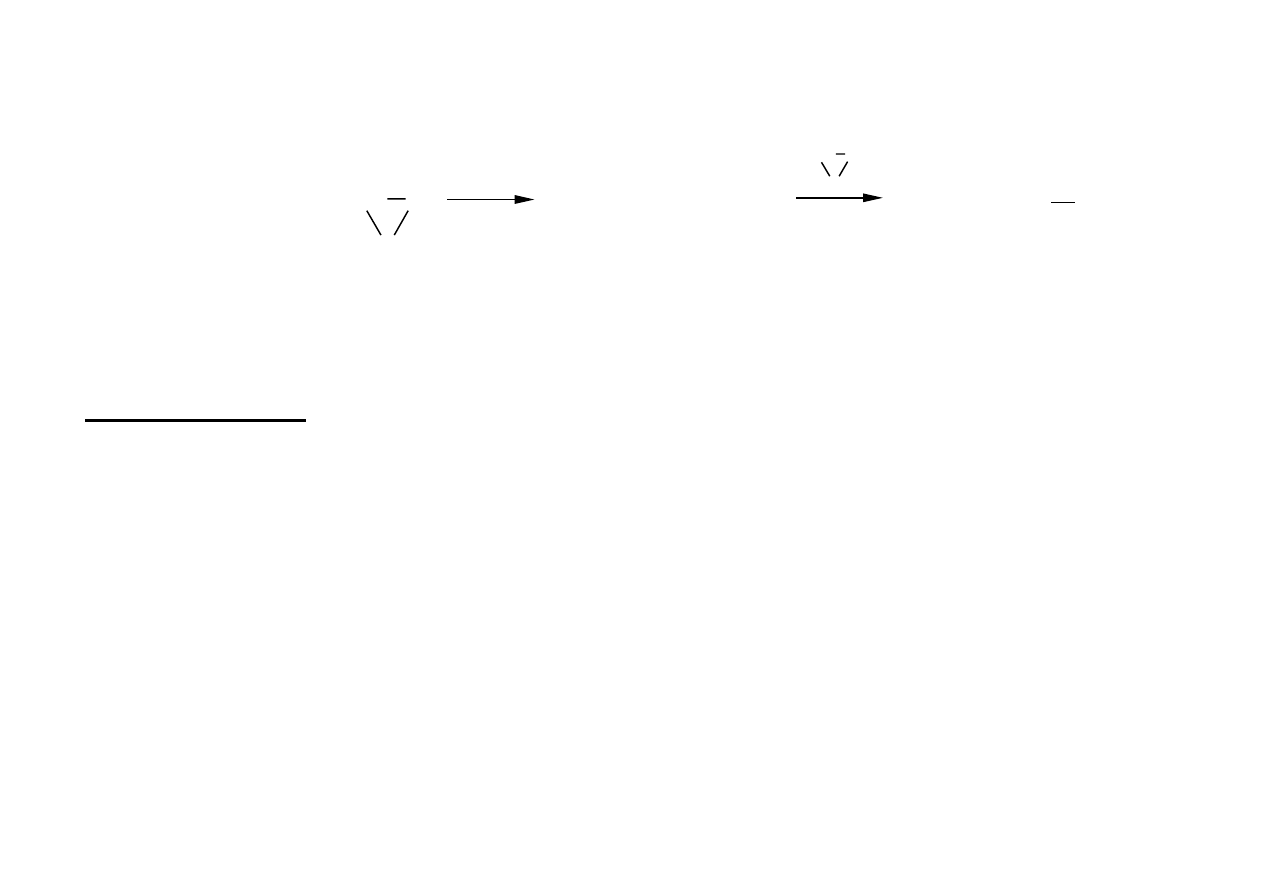
Przy mniejszym nadmiarze wody wytwarzają się di-, tri- i polietylenowe glikole.
CH
2
CH
2
O
+
HOCH
2
CH
2
OH
HOCH
2
CH
2
OCH
2
CH
2
OH
CH
2
CH
2
O
n
HO(CH
2
CH
2
O)
n+2
H
Proces pokrewny
Hydratacja tlenku propylenu do glikolu propylenowego
19

Dehydratacja
RCH=CH
2
+ H
2
O
RCH-CH
3
OH
2 ROH
ROR + H
2
O
20
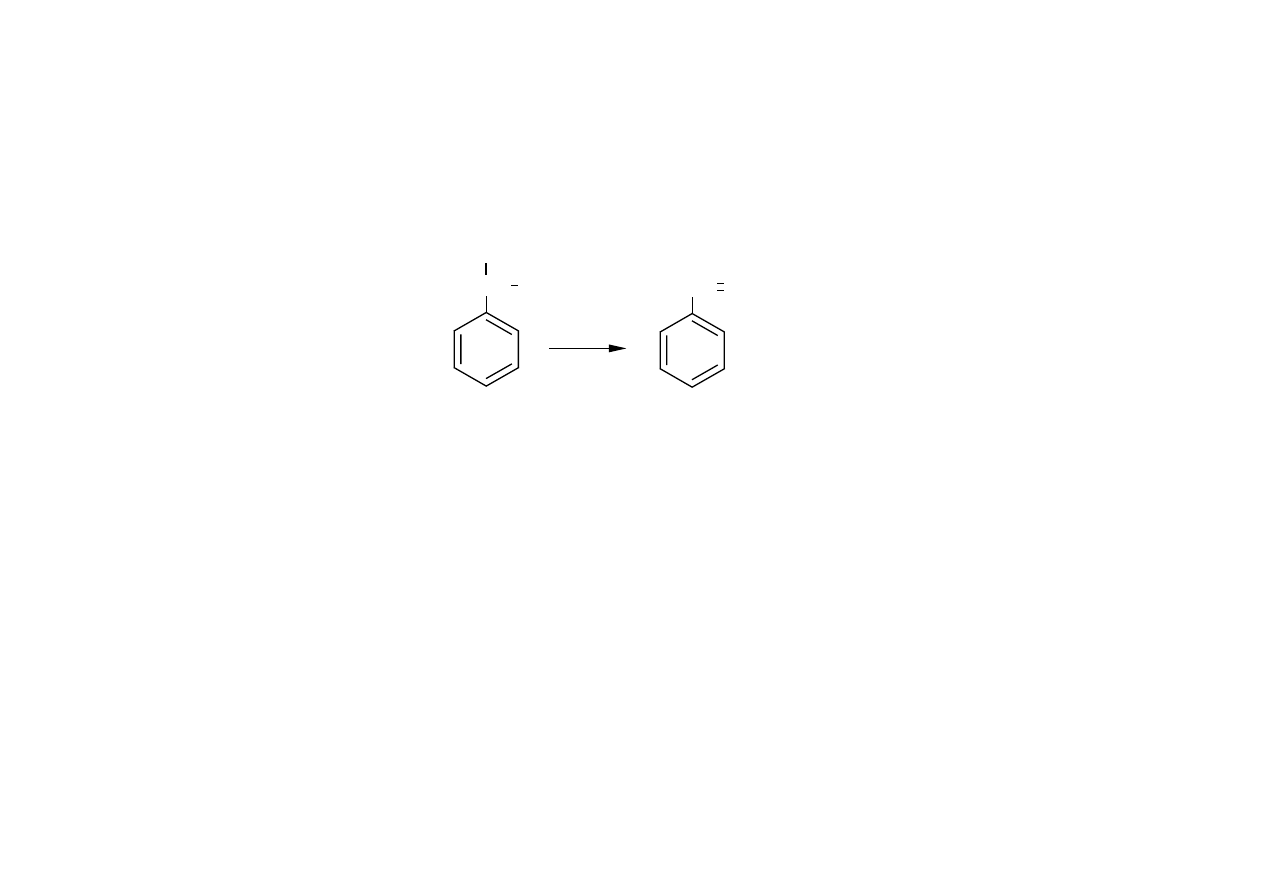
Przykłady przemysłowych procesów dehydratacji:
Synteza styrenu z 1-fenyloetanolu,
CH CH
3
OH
CH CH
2
+ H
2
O
Dehydratacja aldoli
21
Document Outline
- Procesy hydrolizy, hydratacji i dehydratacji
- Reakcjami hydrolizy nazywa się te procesy podstawienia lub w
- ETANOL SYNTETYCZNY Z ETYLENU
- Schemat instalacji produkującej etanol metodą bezpośredniej
- Hydratacja tlenku etylenu
Wyszukiwarka
Podobne podstrony:
hydroliza i hydratacja 2009
10 - hydroliza, sprawozdanie
Hydrologia cwiczenia 9 i 10
Hydrologia Wyklad nr 10
MP - ćw 10 - struga, Hydroliza soli
Hydrologia 1 23 10 2012
├ćw.3 Hydrologia.DOC, Katedra Melioracji Rolnych i Le?nych_____Pozna?, dn. 1995.10.19
Hydrologia 17.10.2008, Hydrologia
HYDROLOGIA",10,2011
HYDROLOGIA 10 id 207791 Nieznany
Hydrologia cwiczenia 9 i 10
Hydrologia 17.10.2008(1), Hydrologia
Hydrologia cwiczenia 9 i 10
więcej podobnych podstron