
1
Procesy hydrolizy, hydratacji i dehydratacji

2
Reakcje hydrolizy - procesy podstawienia lub wymiany podwójnej przebiegające pod
wpływem wody lub zasad.
Reakcje hydratacji - przyłączenie wody do wiązań nienasyconych C=C, C
C lub C
N w
nitrylach itp.; niekiedy hydratacja jest odwracalna.
Proces odłączenia wody nazywa się dehydratacją; może być wewnątrz- i
międzycząsteczkowa.
Wydzielenie wody zachodzi w wielu reakcjach, dlatego też termin dehydratacja używa się
tylko w tych procesach, które nie mają innych bardziej określonych klasyfikacji.
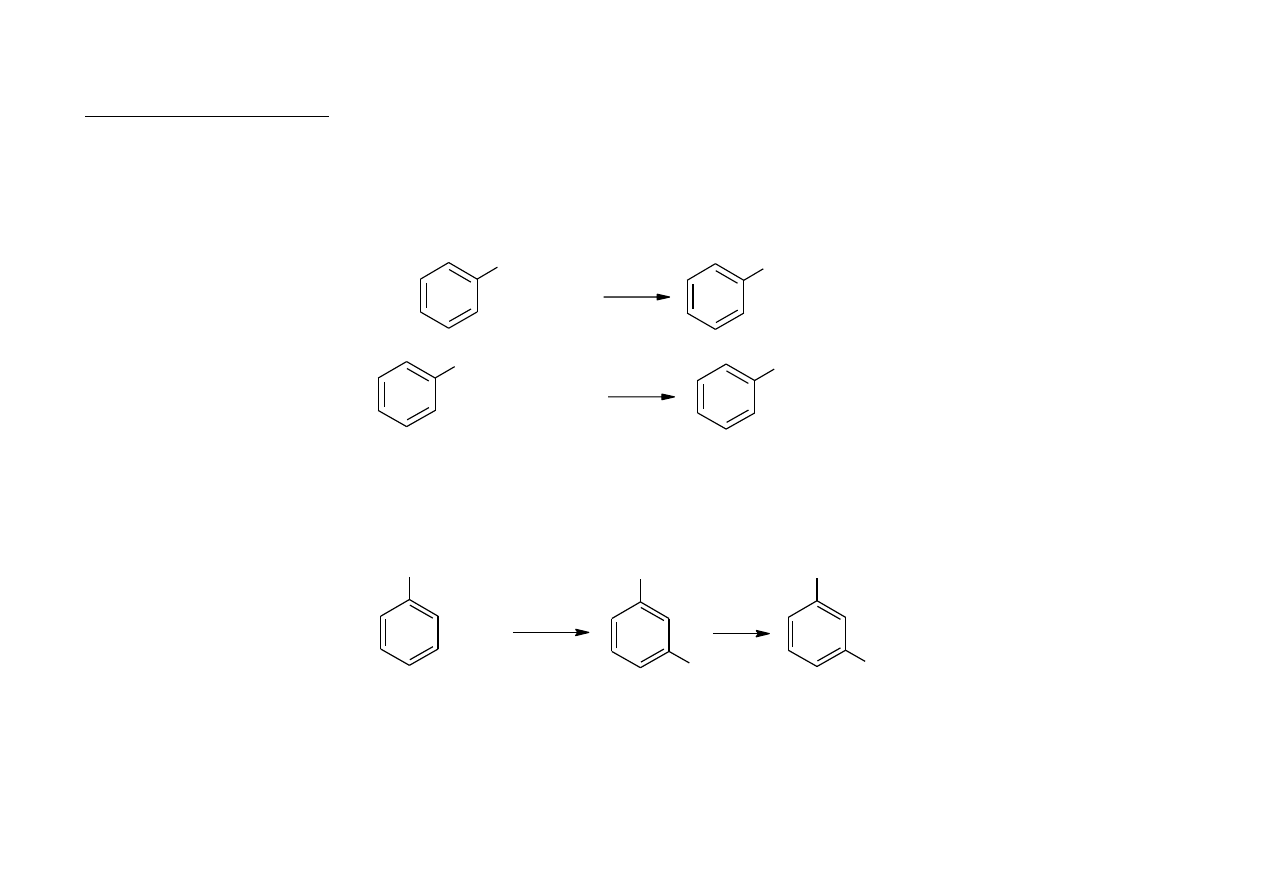
3
Przykłady hydrolizy
fenol
+ HCl
+ NaOH
ONa
Cl
+ NaHCO
3
+ CO
2
+ H
2
O
ONa
OH
pochodne fenoli, np. m-nitrofenol, o- i p-nitrofenole i 2,4-dinitrofenole
NO
2
+ Cl
2
- HCl
NO
2
Cl
- Cl
-
+ OH
-
NO
2
OH
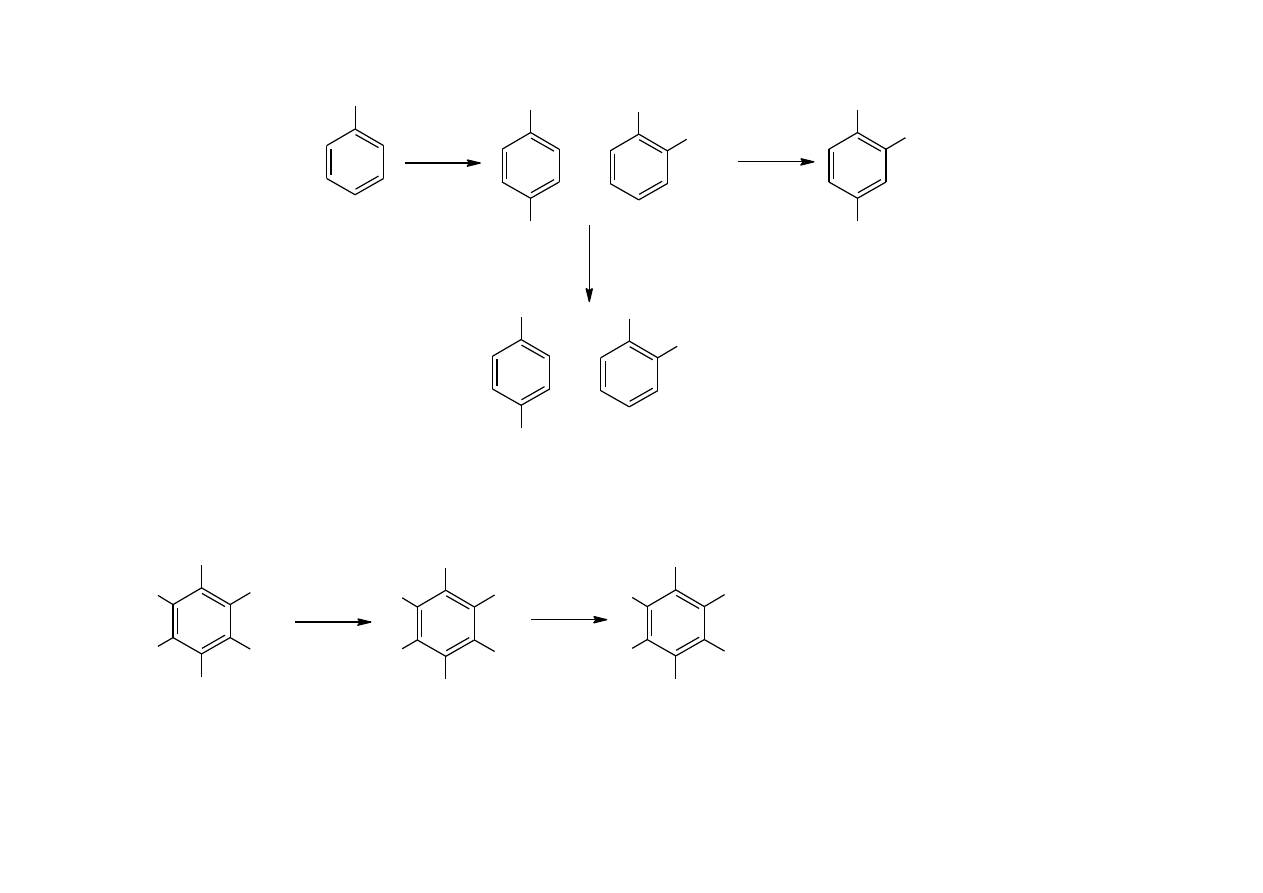
4
Cl
+
+ HNO
3
Cl
NO
2
- Cl
-
+ OH
-
Cl
NO
2
NO
2
Cl
NO
2
+ HNO
3
+
OH
NO
2
OH
NO
2
chlorofenole
- Cl
-
+ OH
-
+ NaOH
Cl
Cl
Cl
Cl
Cl
Cl
Cl
Cl
Cl
Cl
Cl
OH
- H
2
O
Cl
Cl
Cl
Cl
Cl
ONa

5
alkohol allilowy
2 CH
2
=CHCH
2
Cl + Na
2
CO
3
2 CH
2
=CHCH
2
OH + 2 NaCl + CO
2

6
HYDROLIZA CHLOROWCOPOCHODNYCH
Halogenki alkilowe
Dla przeprowadzenia procesu zwykle używa się wodne roztwory zasad – NaOH, Ca(OH)
2
czy Na
2
CO
3
– przy ich działaniu reakcja jest nieodwracalna.
Przy hydrolizie zasadowej ubocznym produktem reakcji jest eter:
RCl + OH
-
ROH + Cl
-
ROH + OH
-
RO
-
+ H
2
O
RCl + RO
-
ROR + Cl
-
Duże obniżenie selektywności procesu zachodzi przy hydrolizie silnymi zasadami, gdyż
alkoholany są bardziej aktywne niż jon OH
-
. Przy hydrolizie Na
2
CO
3
reakcja z CO
3
2-
daje
tylko alkohol, a eter może tworzyć się tylko w reakcji z alkoholem lub alkoholanem,
tworzącym się z jonu OH
-
- produktu hydrolizy Na
2
CO
3
wodą.

7
Hydroliza chlorków arylowych r-rem NaOH (
wymagana podwójna ilość zasady
!!!).
ArCl
ArO
-
+ OH
-
- HCl
ArOAr
2 ArOH
2 ArO
-
+ ArCl
+H
2
O
- Cl
-
- 2 H
+
Warunki hydrolizy chlorowcopochodnych
temperatura - od 120-125
o
C (hydroliza chlorku alkilowego) do 300-350
o
C (hydroliza
chlorobenzenu)
ciśnienie od 0,5-1,0 do 10 MPa (konieczność utrzymania mieszaniny reakcyjnej w
fazie ciekłej .
czas reakcji zmienia się od kilku do 20-30 min.

8
Hydratacja olefin
RCH=CH
2
+ H
2
O
RCHCH
3
OH
R- rodnik alkilowy lub wodór
Katalizatory – kwasy fosforowy, siarkowy, kwaśne żywice jonowymienne.
Alkohole otrzymywane w procesie hydratacji olefin: etanol, alk. izopropylowy, alk.
t-butylowy, alk. sec-butylowy.
9
Hydratacja metodą pośrednią
+
RCH=CH
2
+ H
+
RCHCH
3
+
+ HSO
4
-
+ H
2
O
RCHCH
3
CH OSO
2
OH
R
CH
3
CH OSO
2
O
R
CH
3
_
+ H
+
+
RCHCH
3
CH OSO
2
O
R
CH
3
CH
CH
3
R
RCHCH
3
OH
+ H
2
O
H
2
SO
4

10
Hydratacja metodą bezpośrednią
+
RCH=CH
2
+ H
+
(z H
3
PO
4
)
RCHCH
3
+
+ H
+
RCHCH
3
+ H
2
O
RCHCH
3
OH

11
ETANOL SYNTETYCZNY Z ETYLENU
CH
2
=CH
2
+ H
2
O
CH
3
CH
2
OH
Metoda pośrednia
surowiec węglowodorowy - frakcja etanowo-etylenowej, która zawiera 56-60%
etylenu,
ciśnienie - ok. 2,5 MPa,
temperatura - 70-75
o
C,
96-98% H
2
SO
4
,
Wydajność - 85%.
12
Produkty uboczne w metodzie pośredniej
kwas etionowy
+ H
2
SO
4
+ SO
3
CH
2
CH
2
CH
2
OSO
3
H
CH
2
SO
3
H
kwas izoetionowy
+ H
2
SO
4
+ H
2
O
CH
2
OSO
3
H
CH
2
SO
3
H
CH
2
OH
CH
2
SO
3
H

13
Metoda bezpośrednia
surowiec węglowodorowy – czysty etylen (>98%),
temperatura - 265-300
o
C,
ciśnienie - 7,5-8 MPa,
molowy stosunek H
2
O:C
2
H
4
- 0,4-0,9,
katalizator - kwas fosforowy na nośniku,
bardzo niski (4,5-5%) stopień przereagowania w jednym „przejściu” przez reaktor
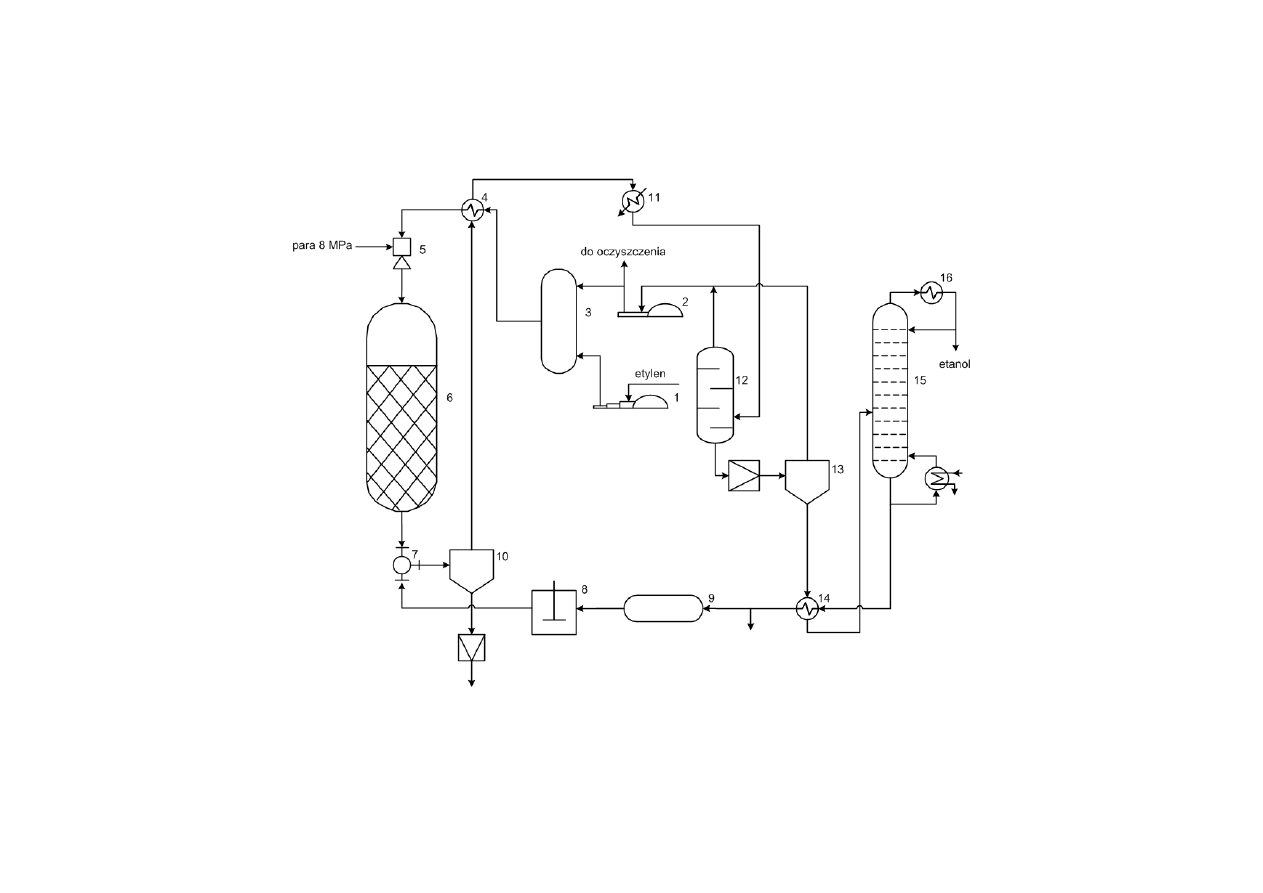
14
Schemat instalacji produkującej etanol metodą bezpośredniej
hydratacji etylenu
1 – sprężarka do świeżego etylenu, 2 – sprężarka do powrotnego etylenu, 3 – mieszalnik, 4 – wymiennik ciepła,
5 – injektor, 6 – reaktor, 7 – trójnik, 8 – pompa, 9 – zbiornik r-ru ługu, 10 – rozdzielacz, 11 – kondensator, 12 –
rozdzielacz wysokiego ciśnienia, 13 – rozdzielacz niskiego ciśnienia, 14 – wymiennik ciepła, 15 – kolumna
rektyfikacyjna, 16 – chłodnica-kondensator

15
Inne metody otrzymywania etanolu
Procesy fermentacyjne
Hydroliza celulozy zawartej w drewnie
(C
6
H
10
O
5
)
x
+ x H
2
O
x C
6
H
12
O
6
H
+
(z H
2
SO
4
)
2 C
2
H
5
OH + 2 CO
2
C
6
H
12
O
6
16
ZASTOSOWANIE ETANOLU
Etanol
dehydratacja
i odwodornienie
1,3-butadien
eter dietylowy
RNH
2
monoetylo- i dietyloaminy
niekiedy
aceton
octan etylu - cenny rozpuszczalnik w produkcji lakierów
+CH
3
COOH
akroleina
alkohol allilowy i aldehyd octowy
kwas octowy
chloroform
dehydratacja
chlorowanie
chloral
odwodornienie
lub utlenienie
aldehyd octowy
17
Hydratacja tlenku etylenu
Z tlenku etylenu
CH
2
CH
2
O
+
O
H
2
HOCH
2
CH
2
OH
H<0 (-80 kJ/mol)
Warunki procesu:
reaktor kolumnowy o wysokości ok. 10 m,
proces w fazie ciekłej,
około 10-20-krotnym molowym nadmiar wody,
temperatura - 50-70
o
C, w obecności katalizatorów kwaśnych (H
2
SO
4
, H
3
PO
4
, kwas
szczawiowy; ciśnienie bliskie atmosferycznego), lub 140-230
o
C (bezkatalitycznie, pod
ciśnieniem 2-4 MPa; wysokie ciśnienie jest konieczne aby utrzymać reagującą mieszaninę w
fazie ciekłej).
wodny roztwór surowego glikolu
zawiera ok.
12% glikolu monoetylenowego oraz ok. 2%
DEG i TEG; zatęża się go w wyparkach do ok. 70% i poddaje destylacji frakcjonowanej w
szeregu kolumn próżniowych; czystość wymagana dla poliestrów - 99,9% wag.,
selektywność do monoglikolu etylenowego tylko ok. 90%; ubocznie powstaje ok. 9% diglikolu,
1% triglikolu i wyższych glikoli etylenowych. Łączna wydajność glikoli wynosi 95-96%.
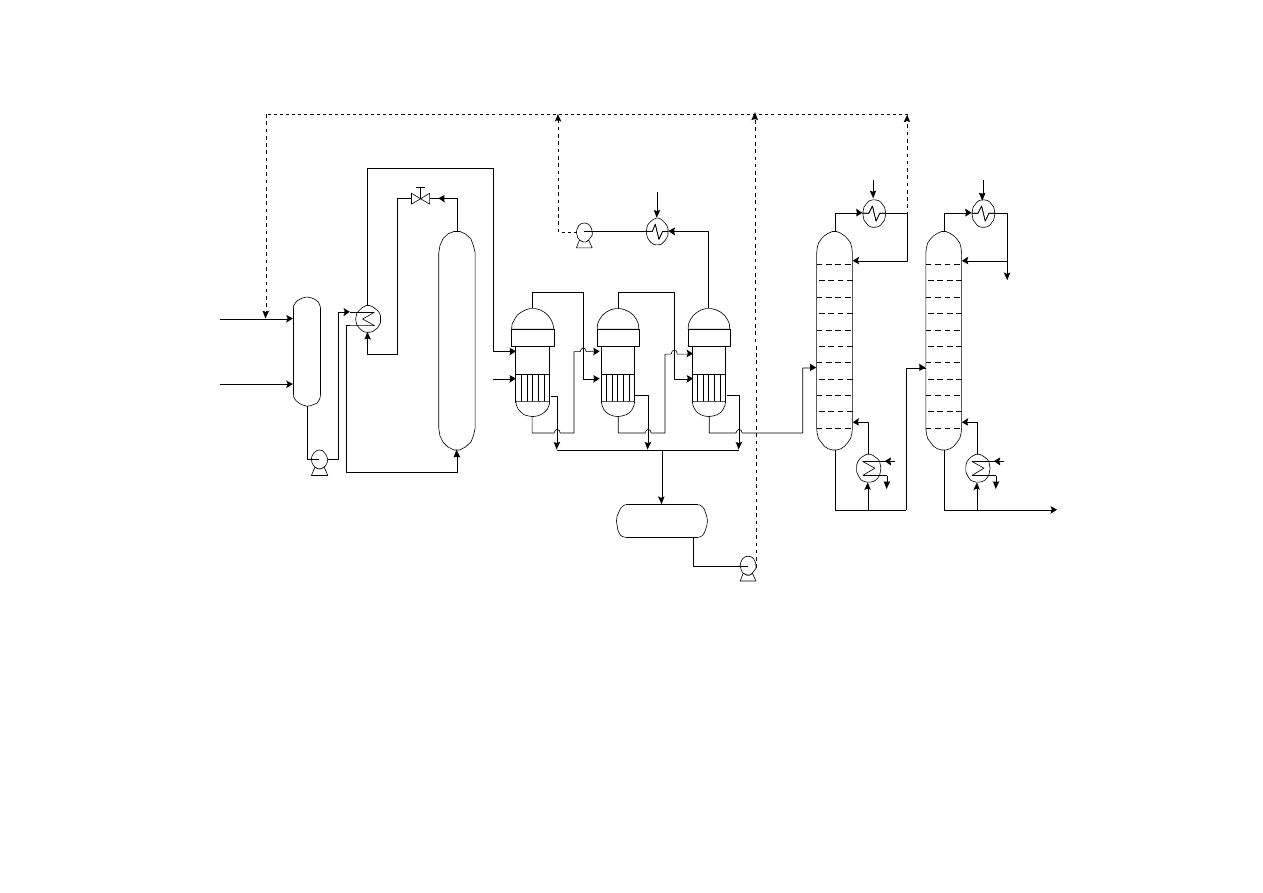
18
H
2
O
H
2
O
H
2
O
woda
tlenek etylenu
1
2
3
4
para
para
para
5a
5b
5c
2
6a
9
2
7a
7b
glikol etylenowy
6b
6c
DEG + TEG
woda z domieszką glikoli
Schemat instalacji produkującej glikol etylenowy z tlenku etylenu.
1 - mieszalnik, 2 - pompy, 3 - wymiennik ciepła, 4 - kolumnowy reaktor hydratacji, 5 - wyparki, 6 -
chłodnice wodne, 7 - próżniowe kolumny rektyfikacyjne, 8 - kotły parowe, 9 - zbiornik skroplin
wodnych zawierających nieco glikoli, DEG - glikol dietylenowy, TEG - glikol trietylenowy
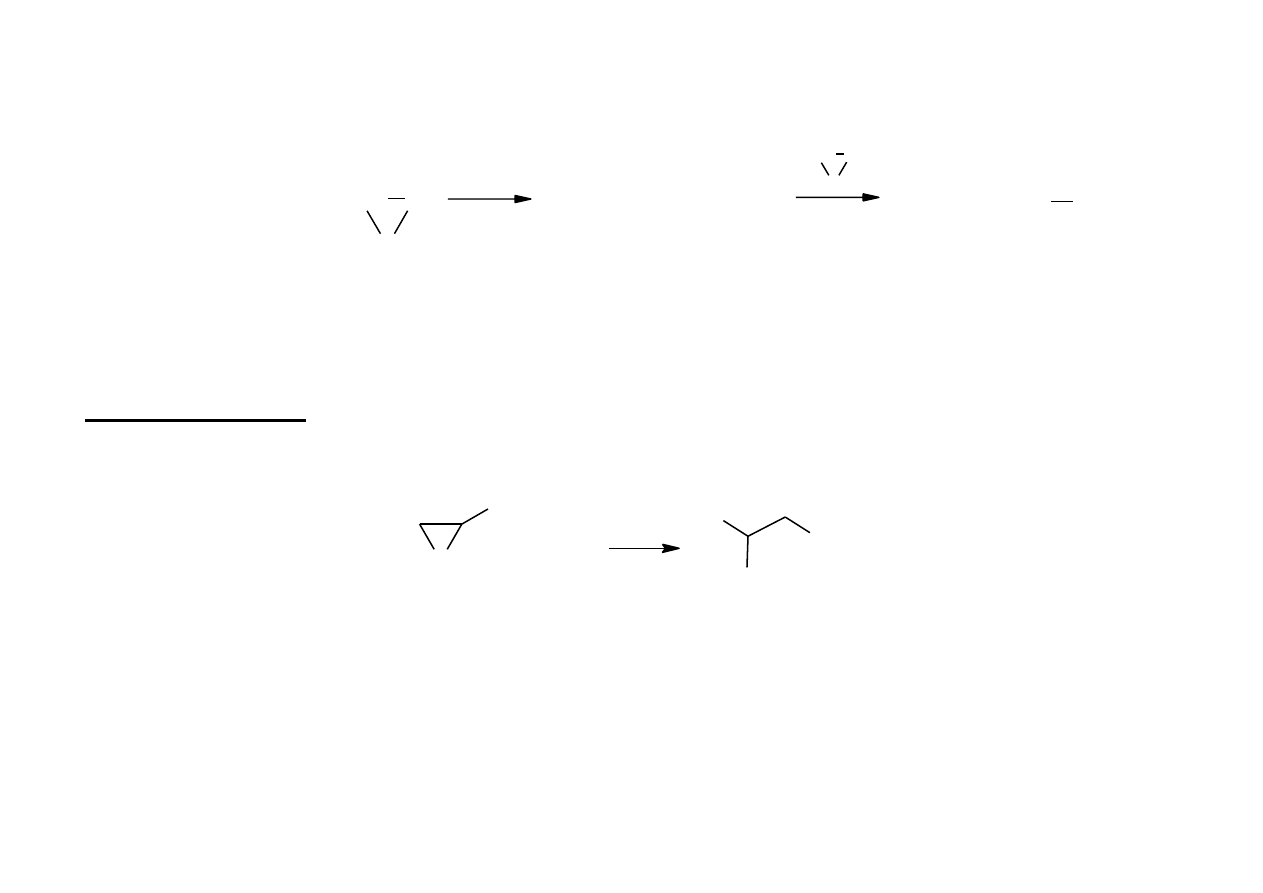
19
Przy mniejszym nadmiarze wody wytwarzają się di-, tri- i polietylenowe glikole.
CH
2
CH
2
O
+
HOCH
2
CH
2
OH
HOCH
2
CH
2
OCH
2
CH
2
OH
CH
2
CH
2
O
n
HO(CH
2
CH
2
O)
n+2
H
Proces pokrewny
Hydratacja tlenku propylenu do glikolu propylenowego
O
CH
3
O
H
OH
C
H
3
+ H
2
O

20
DEHYDRATACJA
Dehydratacja alkoholi - dawniej źródło czystych olefin.
wobec H
2
SO
4
w fazie ciekłej w 100-160
0
C
w fazie gazowej w 350-400
0
C przy udziale Al
2
O
3
.
Usuwanie izobutenu z frakcji C
4
po krakingu lub pirolizie w obecności
H
2
SO
4
lub sulfokationitu.
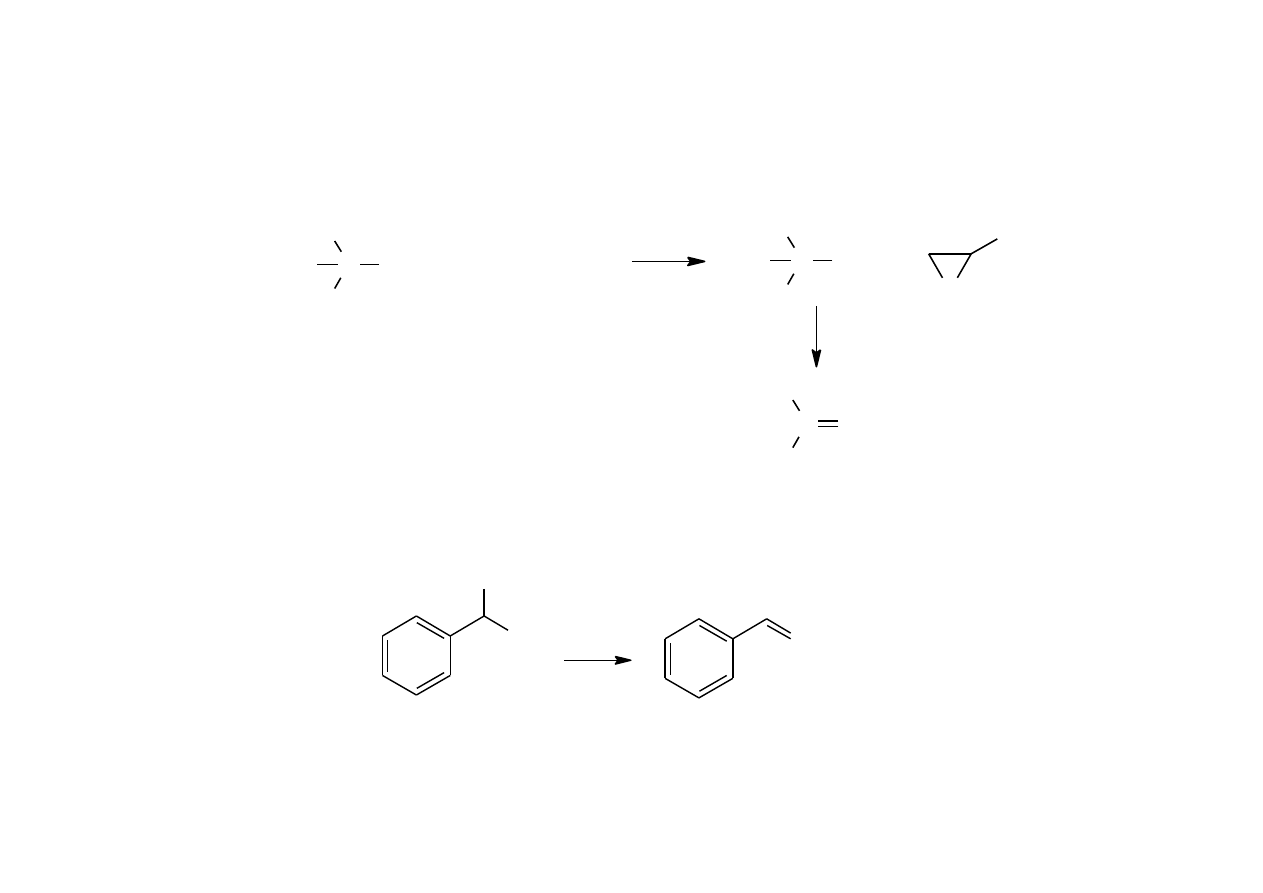
21
Dehydratacja alkoholu tert-butylowego
- H
2
O
+ CH
3
CH=CH
2
+
C
OOH
C
H
3
C
H
3
C
H
3
C
CH
2
C
H
3
C
H
3
C
OH
C
H
3
C
H
3
C
H
3
O
CH
3
Dehydratacja 1-fenyloetanolu
+ H
2
O
CH
3
OH
CH
2
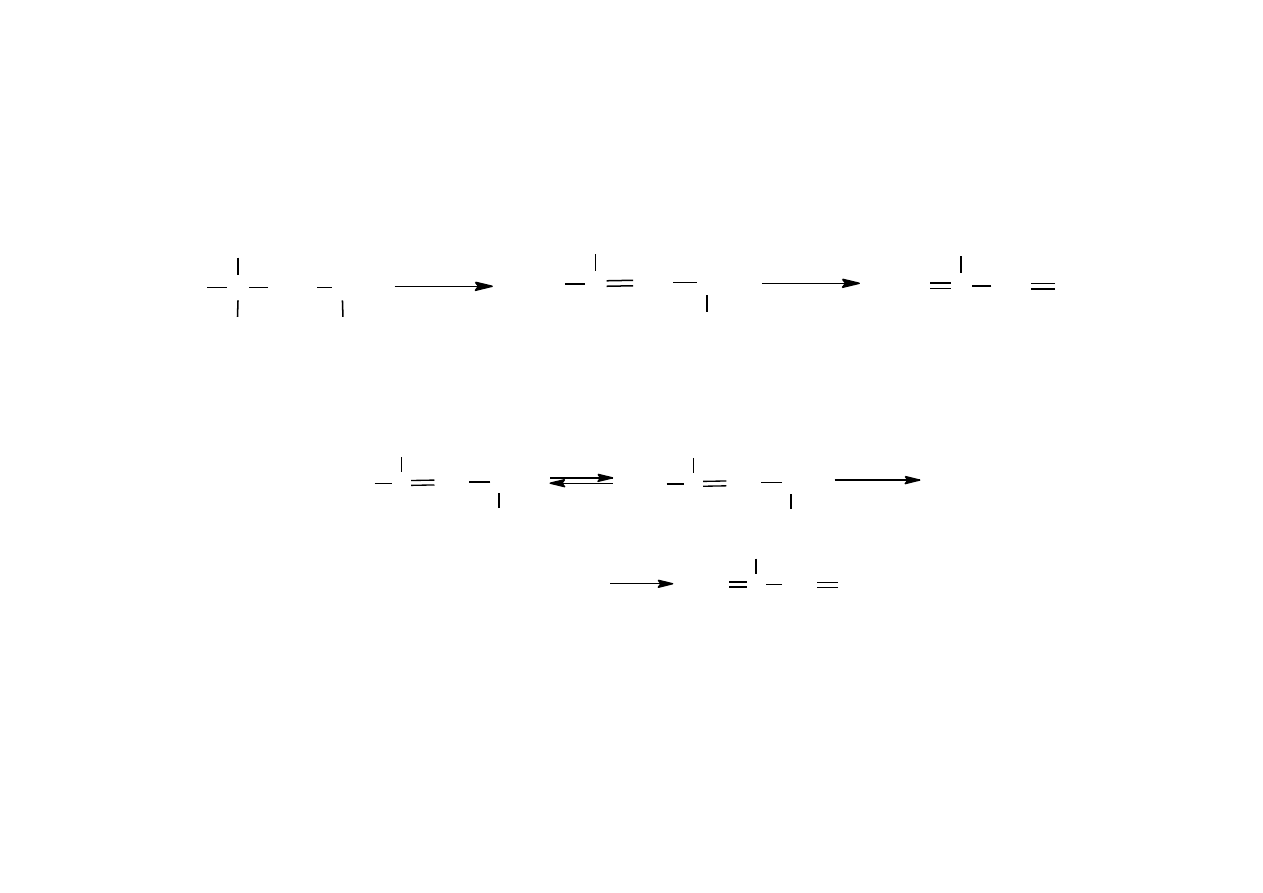
22
Dehydratacją diolu przy syntezie izoprenu z izobutenu i formaldehydu
- H
2
O
C
CH
2
CH
3
OH
C
H
3
CH
2
OH
C
CH
CH
3
C
H
3
CH
2
OH
- H
2
O
C
CH
CH
3
C
H
2
CH
2
- H
2
O
[(CH
3
)
2
C=CH=CH
2
]
+
- H
+
+
+ H
+
C
CH
CH
3
C
H
3
CH
2
OH
C
CH
CH
3
C
H
2
CH
2
C
CH
CH
3
C
H
3
CH
2
OH
2
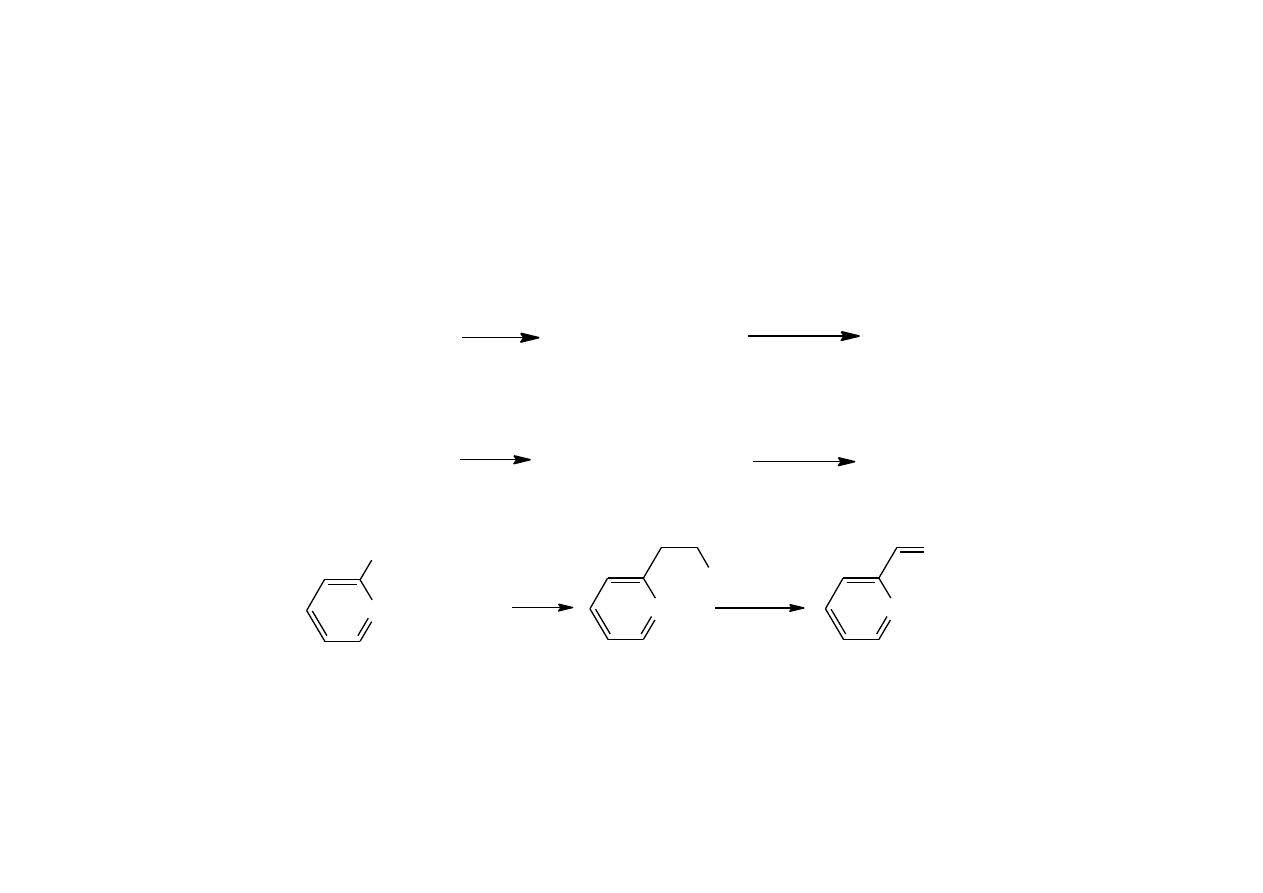
23
Wprowadzenie grupy winylowej na drodze reakcji typu kondensacji
aldolowej z następną dehydratacją.
CH
3
NO
2
+ HCHO
OH
-
HOCH
2
CH
2
NO
2
-H
2
O
CH
2
=CHNO
2
CH
3
COCH
3
+ HCHO
OH
-
CH
3
COCH
2
CH
2
OH
-H
2
O
CH
3
COCH=CH
2
+ HCHO
OH
-
-H
2
O
N
CH
3
N
OH
N
CH
2
24
Dehydratacja jako etap otrzymywania niektórych I-rz. alkoholi
OH
-
2 CH
3
CHO
-H
2
O
CH
3
CHCH
2
CHO
CH
3
CH=CHCHO
+ H
2
OH
CH
3
CH
2
CH
2
CH
2
OH

25
Dehydratacja z tworzeniem eterów
2 C
2
H
5
OH
C
2
H
5
OC
2
H
5
+ H
2
O
temperatura ok. 250
o
C, katalizator Al
2
O
3
.
Większość eterów otrzymuje się w fazie ciekłej, przy niższej temperaturze,
z zastosowaniem kwaśnych katalizatorów takich jak: H
2
SO
4
, H
3
PO
4
,
arylosulfonowe kwasy.
3 ROH + 3 R`OH
R
2
O + R`
2
O + ROR` + 3 H
2
O

26
Mała wydajność mieszanych eterów
Eter
,
-dichloroetylowy - rozpuszczalnik i ekstrahent, produkt
wyjściowy do otrzymywania polisiarczkowych polimerów.
2 ClCH
2
CH
2
OH
(ClCH
2
CH
2
)
2
O + H
2
O
27
Etery cykliczne:
dioksan
-H
2
O
(HOCH
2
CH
2
)
2
O
O
O
morfolina
-H
2
O
(HOCH
2
CH
2
)
2
NH
NH
O
tetrahydrofuran
-H
2
O
O
OH
O
H

28
PRODUKCJA BENZYN Z METANOLU (PROCES MOBIL MTG)
gaz ziemny
gaz syntezowy
metanol
benzyna
n CH
3
OH
-(CH
2
)-
n
+ n H
2
O
2 CH
3
OH
-H
2
O
CH
3
OCH
3
węglowodory
-H
2
O

29
Warunki procesu:
Temperatura 330-420
0
C; ciśnienie ok. 2 MPa.
Katalizator zeolitowy w warstwie stacjonarnej lub fluidalnej.
Ciepło reakcji odbiera się dwustopniowo stosując układ dwóch
szeregowych reaktorów adiabatycznych; W pierwszym tworzy się
eter dimetylowy i wydziela się ok. 20% całej ilości ciepła, w drugim
tworzą się węglowodory
Wydajność benzyny ok. 75% w odniesieniu do przereagowanego
metanolu. LOB (LO badawcza) ok. 95; ponad 80% stanowią
produkty ciekłe (benzyna). Ich wydajność można zwiększyć,
integrując instalację z instalacją alkilowania.
produkty uboczne olefiny C
3
-C
4
. Są to surowce procesu alkilowania.
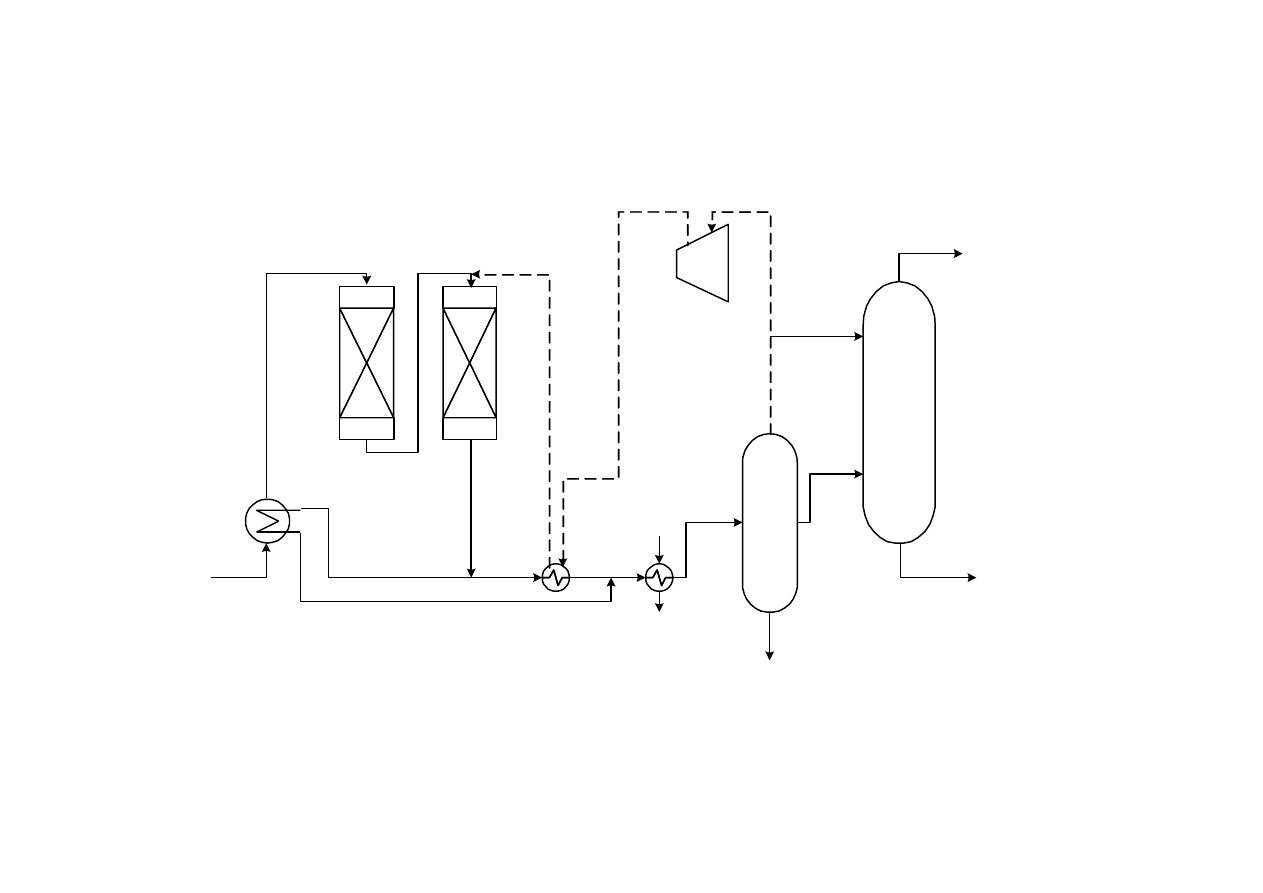
30
Benzyna z metanolu (PROCES MOBIL)
CH
3
OH
1a
2a
2b
1b
1c
H
2
O
H
2
O
H
2
O
3
4
Gaz opałowy
Surowa benzyna
5
1 – wymienniki ciepła, 2 – reaktory a – pierwszego stopnia, b – drugiego
stopnia, 3 – separator, 4 – sprężarka, 5 – kolumna rektyfikacyjna

31
Dehydratacja metanolu w kierunku olefin:
Temperatura - 300-400
o
C.
Wydajność etylenu 35-50%, zaś sumy etylenu i propylenu 70-75% w
odniesieniu do przereagowanego metanolu.
(przy pirolizie 850-900
o
C uzyskuje się tylko 28-30% etylenu i 45-50%
sumy etylenu i propylenu).
32
Mechanizm procesu:
CH
3
OH
[:CH
2
] + H
2
O
n [:CH
2
]
n -(CH
2
)-
-H
2
O
n [:CH
2
] + CH
3
OH
CH
3
CH
2
OH
CH
2
=CH
2
2 [:CH
2
]
C
3
H
6
C
2
H
5
OH + [:CH
2
]
C
2
H
5
OCH
3
-H
2
O
CH
2
=CH
2
+ [:CH
2
]
Eter dimetylowy tworzy się na słabo kwaśnych centrach aktywnych
katalizatora, zaś węglowodorów w centrach charakteryzujących się silną
kwasowością.
Wyszukiwarka
Podobne podstrony:
10 hydroliza i hydratacja
Chemizm wód 2, Ochrona Środowiska studia, 3 rok (2008-2009), Semestr V (Rok 3), Hydrologia i gospoda
Bilans wodny, Ochrona Środowiska studia, 3 rok (2008-2009), Semestr V (Rok 3), Hydrologia i gospodar
2009-2010 Cykl hydrologiczny, Cykl hydrologiczny
Hydratacja i hydroliza klinkieru portlandzkiego
Hydratacja i hydroliza (1)
Hydratacja i hydroliza
Wykład 6 2009 Użytkowanie obiektu
Przygotowanie PRODUKCJI 2009 w1
Wielkanoc 2009
przepisy zeglarz 2009
Kształtowanie świadomości fonologicznej prezentacja 2009
zapotrzebowanie ustroju na skladniki odzywcze 12 01 2009 kurs dla pielegniarek (2)
perswazja wykład11 2009 Propaganda
Wzorniki cz 3 typy serii 2008 2009
2009 2010 Autorytet
więcej podobnych podstron