Ć w i c z e n i e 10
WYZNACZANIE STOSUNKU C
P
/C
V
DLA POWIETRZA
METODĄ CLEMENTA - DESORMESA
10.1 Opis teoretyczny
10.1.1. Teoria pojemności cieplnej gazów
Przyjęcie metody statystycznej w fizyce cząsteczkowej doprowadziło do powstania kinetyczno -
molekularnej teorii gazów. Specjalne miejsce zajmuje w niej prawo równomiernego rozkładu ener-
gii pomiędzy stopnie swobody cząsteczki gazu. Liczbą stopni swobody ciała nazywamy najmniej-
szą liczbę współrzędnych (tzw. współrzędnych niezależnych), które należy koniecznie podać, aby
dokładnie określić położenia ciała w przestrzeni.
Cząsteczkę gazu jednoatomowego możemy rozpatrywać jako punkt materialny, gdyż cała jej masa
jest skupiona w bardzo małym jądrze. Ma ona tylko trzy stopnie swobody związane z ruchem po-
stępowym (trzy współrzędne kartezjańskie ). Dla cząsteczek dwu i więcej atomowych nie jest
wszystko jedno, jak są ułożone w przestrzeni. Traktując je jako obiekty sztywne możemy stwier-
dzić, że mogą wykonywać ruchy obrotowe, co zwiększa liczbę współrzędnych koniecznych do do-
kładnego określenia położenia cząsteczki. I tak np. dla cząsteczki dwuatomowej trzeba już ich pię-
ciu (dodatkowo dwa kąty sferyczne określające jej orientację), natomiast cząsteczka gazu o trzech
lub więcej atomach wymaga trzech stopni swobody ruchu postępowego i trzech stopni swobody
ruchu obrotowego (razem sześć). Jeżeli cząsteczka nie jest bezwzględnie sztywna, poszczególne jej
części mogą przemieszczać się względem siebie i wówczas dla pełnego opisu jest konieczne wpro-
wadzenie jeszcze dodatkowych stopni swobody związanych z jej ruchem drgającym.
Zasada równomiernego rozkładu energii między stopnie swobody ( tzw. zasada ekwipartycji ener-
gii) mówi, że na każdy stopień swobody cząsteczki średnio przypada jednakowa energia kinetyczna
równa
2
T
k
. Jeżeli cząsteczka jest obdarzona i-toma stopniami swobody, to jej średnia energia ki-
netyczna E
k
wynosi
2
T
k
i
E
k
=
(10.1.)
gdzie: k - stała Boltzmanna, T - temperatura w skali bezwzględnej.
W gazie doskonałym nie ma sił wzajemnego przyciągania międzycząsteczkowego (powietrze mo-
żemy traktować jako gaz doskonały), a więc energia potencjalna cząsteczek jest równa zeru. Dlate-
go energia wewnętrzna mola gazu doskonałego równa się sumie energii kinetycznych N
A
(liczba
Avogadra) cząsteczek
2
T
R
i
2
T
k
i
N
E
N
U
A
k
A
=
=
=
(10.2)
gdzie: R = k N
A
oznacza uniwersalną stałą gazową.
Jednym z głównych osiągnięć kinetyczno-molekularnej teorii gazów jest możliwość teoretycznego
obliczenia ich pojemności cieplnej. Wielkościami fizycznymi opisującymi pojemność cieplną ga-
zów są: ciepło właściwe wyznaczone przy zachowaniu stałej objętości gazu (w przemianie izocho-
rycznej) oznaczane przez
c
v
oraz ciepło właściwe
c
p
wyznaczane podczas przemiany izobarycznej
gazu (przy stałym ciśnieniu).

Jeżeli znamy ilość ciepła dQ dostarczanego do gazu o masie m, które spowodowało wzrost jego
temperatury o dT, to możemy wyznaczyć ciepło właściwe za pomocą wzorów:
dT
dQ
m
1
c
V
V
=
(10.3)
dT
dQ
m
1
c
P
P
=
(10.4)
gdzie: dQ
V
i dQ
p
oznaczają ilość ciepła, które należy dostarczyć, aby podnieść temperaturę gazu o
dT w warunkach zachowania odpowiednio stałej objętości i stałego ciśnienia.
W przemianie izochorycznej dostarczone ciepło może być magazynowane w gazie tylko w postaci
energii wewnętrznej
dQ
V
=
dU
(10.5)
gdzie dU oznacza zmianę energii wewnętrznej gazu.
W przemianie izobarycznej energia cieplna jest zużywana również na wykonanie pracy przez gaz.
Przy ogrzewaniu, aby zachować warunek stałego ciśnienia p gaz musi zwiększyć swą objętość o dV
i wykonuje wówczas pracę równą p dV. W związku z powyższym możemy zapisać
dQ
p
= dU + p dV
(10.6)
Weźmy masę gazu równą 1 mol i wyznaczymy odpowiednie ciepło molowe (ciepło właściwe doty-
czące masy 1 mola). Wówczas biorąc pod uwagę wyrażenia (10.2), (10.3) i (10.5) otrzymujemy:
2
R
i
dT
dU
c
V
=
=
(10.7)
Z równania gazu doskonałego dla jednego mola pV = RT wynika, że:
p
dV
=
R
dT
(10.8)
Uwzględniając w równaniu (10.4) związki (10.6) i (10.8) otrzymujemy:
R
c
R
dT
dU
dT
dT
R
dU
dT
dV
p
dU
c
V
P
+
=
+
=
+
=
+
=
(10.9)
stąd
2
R
2)
(i
c
P
+
=
(10.10)
Współczynnik adiabaty
κ dla gazu doskonałego jest równy:
i
2
1
i
2
i
c
c
V
P
+
=
+
=
=
κ
(10.11)
W szczególności dla gazu jednoatomowego
κ= 5/3 = 1.67, dla dwuatomowego κ= 7/5 = 1,40, dla
wieloatomowego
κ= 8/6 = 1.33.

T a b e l a 10.1
Gaz lub para
T
[
°C]
c
v
[ J / mol K]
c
p
[ J / mol K]
κ
i
Hel
Neon
Wodór
Azot
Tlen
Tlenek węgla
Dwutlenek węgla
Para wodna
Metan
Para benzenu (C
6
H
6
)
Para alkoholu etylowego
(C
2
H
5
OH)
15
15
0
0
0
0
0
0
0
0
0
12.48
12.44
20.18
20.67
20.84
20.67
27.37
25.04
26.25
64.94
61.36
20.8
20.8
28.41
28.91
29.08
28.95
35.61
33.28
34.53
73.21
69.64
1.67
1.67
1.41
1.40
1.395
1.40
1.305
1.33
1.315
1.13
1.135
3
3
5
5
5
5
6
6
6
6
6
Z tabeli 10.1 wynika, że wartość pojemności cieplnych wielu gazów, wyznaczone w warunkach
normalnych, dobrze zgadzają się z wynikami teoretycznymi i tylko cząsteczki złożone w rodzaju
C
6
H
6
i C
2
H
5
OH wykazują duże rozbieżności między teorią a doświadczeniem.
W klasycznej teorii pojemności cieplnej gazów, z zależności pojemności cieplnej od stopni swobo-
dy cząsteczek wynika, że jest ona niezależna od temperatury. A tak nie jest. Rozpatrując ruch drga-
jący cząsteczek wiemy, że dla gazów dwu - i więcej atomowych częstotliwość drgań cząsteczek
ν
drg
jest bardzo duża (energie h
ν
drg
są bardzo duże w porównaniu ze średnią energią cząsteczek w
temperaturze pokojowej i niższych; h- stała Plancka). W związku z tym dla takich gazów przy obli-
czaniu pojemności cieplnej, w wyżej wymienionych temperaturach, można nie brać pod uwagę
stopni swobody ruchu drgającego cząsteczek, ale w wysokich temperaturach należy je uwzględniać.
Dla niektórych złożonych cząsteczek (np. dla par alkoholu etylowego i benzenu) należy to uczynić
już w temperaturze pokojowej i niższych.
Prawidłowe wyjaśnienie wyników doświadczalnych dotyczących zmian pojemności cieplnej gazów
w szerokim zakresie temperatur otrzymano na podstawie
kwantowej teorii pojemności cieplnej
rozwiniętej w 1905 roku przez A. Einsteina.
10.1.2. Wyznaczanie współczynnika
κ metodą Clementa-Desormesa
Z rozważań przeprowadzonych w punkcie 10.1.1 wynika, że pomiar współczynnika
κ na wyzna-
czenie liczby stopni swobody cząsteczki gazu i na wnioskowanie o jej wewnętrznej budowie.
Współczynnik
κ związany jest z przemianą adiabatyczną gazu (przemianę zachodzącą bez wymia-
ny ciepła między gazem a otoczeniem) opisywaną równaniem Poissona:
p V
κ
=
const
(10.12)
Stanowi to punkt wyjścia metody Clementa-Desormesa: aby wyznaczyć
κ należy koniecznie prze-
prowadzić przemianę adiabatyczną. W omawianej metodzie korzysta się ze szczególnego związku
zachodzącego między trzema przemianami gazowymi, a mianowicie adiabatyczną, izochoryczną i
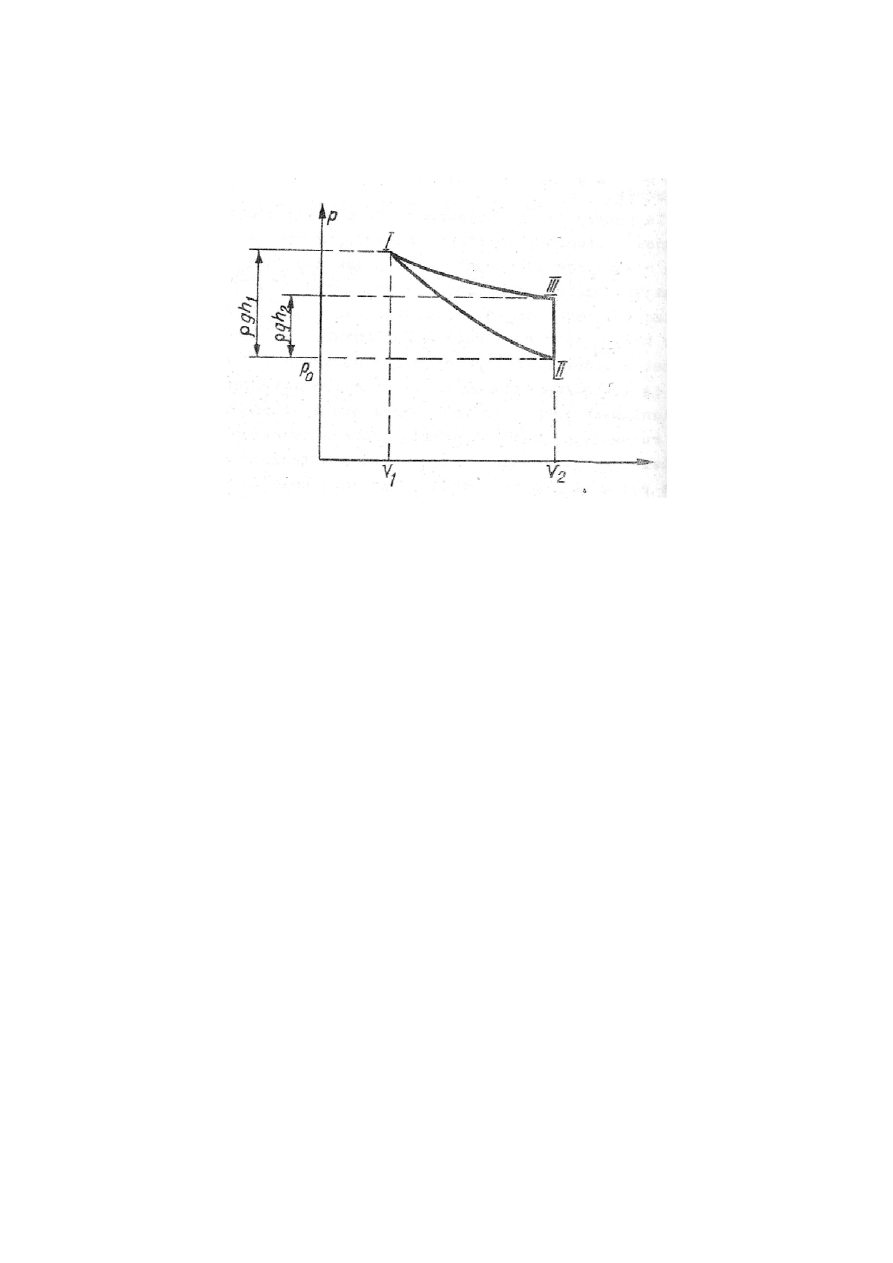
izotermiczną przedstawionego na rys.10.1.
Rys.10.1. Cykl przemian gazowych wykorzystywany przy wyznaczaniu
κ metodą Clementa-
Desormesa
Punktem początkowym doświadczenia jest stan I gazu zdefiniowanego parametrami:
V = V
1
p = p
0
+
ρ g h
1
T = T
1
gdzie: T
1
- temperatura otoczenia, p
0
- aktualne ciśnienie atmosferyczne.
Ciśnienie gazu jest większe od atmosferycznego. Stan I uzyskujemy przez sprężenie pewnej ilości
gazu do objętości V
1
, a o wielkości uzyskanego ciśnienia możemy wnioskować ze wskazań mano-
metru cieczowego różnicowego:
h
1
- różnica poziomów cieczy manometrycznej;
ρ - gęstość
cieczy
manometrycznej.
Manometr różnicowy mierzy różnicę między ciśnieniem sprężonego gazu a ciśnieniem atmosfe-
rycznym.
Na początku doświadczenia musimy zbadać, czy badany gaz uzyskał temperaturę otoczenia. W tym
celu po wstępnym sprężeniu gazu należy odpowiednio długo zaczekać, aby zdążył się on ochłodzić
do temperatury otoczenia. W tym samym czasie na manometrze różnicowym obserwujemy zmniej-
szanie się ciśnienia gazu. Ustalenie się stałego ciśnienia jest znakiem, że wymagane warunki (stan I
gazu) zostały osiągnięte. Teraz możemy przeprowadzić przemianę adiabatyczną przez szybkie jego
rozprężenie do ciśnienia atmosferycznego i przejście do stanu II gazu określanego następującymi
parametrami:
V = V
2
> V
1
p = p
0
T = T
2
< T
1
Krzywa łącząca stany I i II na rys.10.1. jest adiabatą. Między parametrami gazu zachodzi więc za-
leżność:
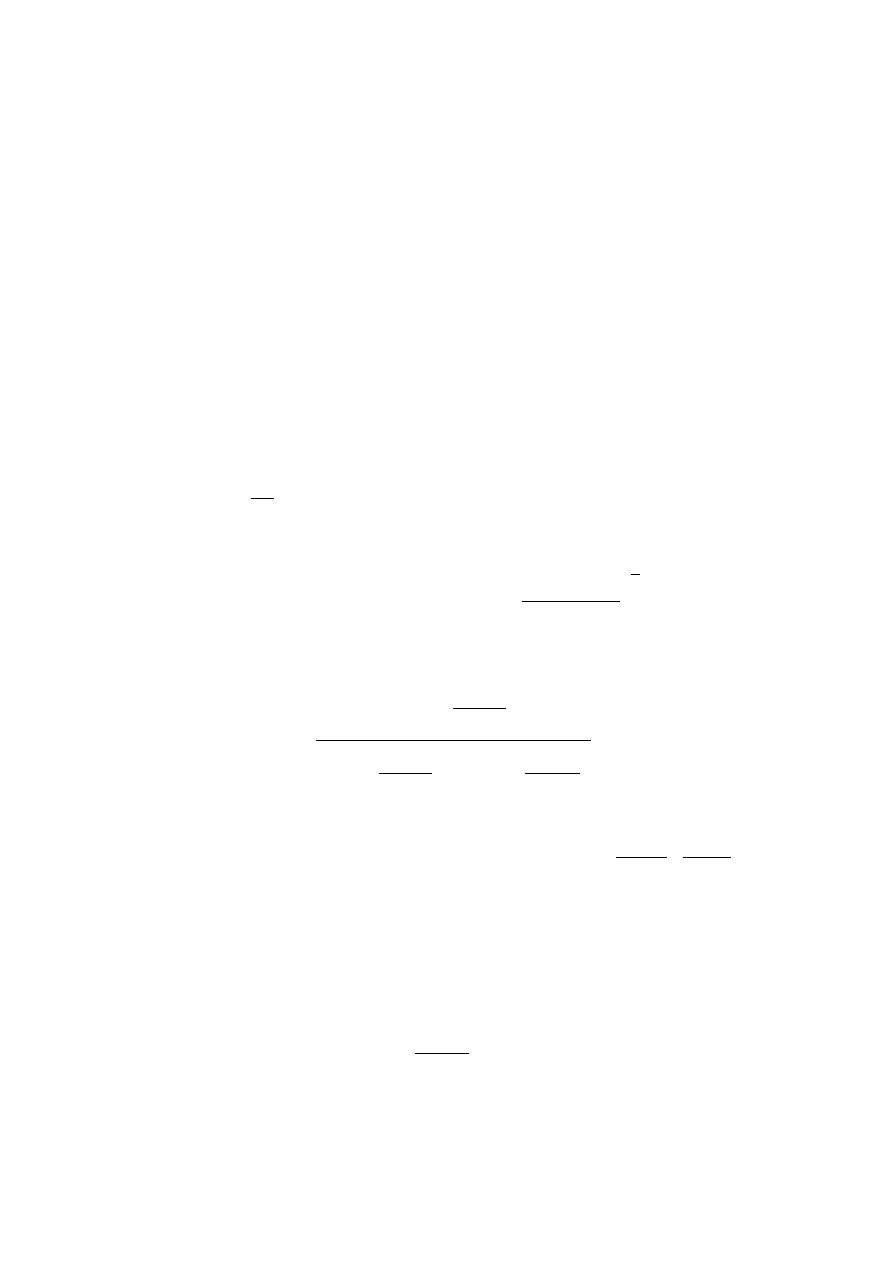
(p
0
+
ρ g h
1
)V
1
κ
= p
0
V
2
κ
(10.13)
Podczas rozprężania adiabatycznego gaz się oziębił do temperatury T
2
. Możemy go teraz ogrzać do
temperatury otoczenia T
1
w przemianie izochorycznej (prosta łącząca stany II i III). Ciśnienie gazu
rośnie aż do osiągnięcia stanu III gazu o parametrach:
V = V
2
p = p
0
+
ρ g h
2
< p
0
+
ρ g h
1
( h
2
< h
1
)
.
T = T
1
Stany I i III posiadają tę samą temperaturę (otoczenia), a więc leżą na jednej izotermie (hiperbole
łączące stany I i III na rys.10.1).
Ze stanu I można również przejść do stanu III przeprowadzając przemianą izotermiczną. Zgodnie z
równaniem Boyle
'
a-Mariotte
`
a można napisać zależność:
(p
0
+
ρ g h
1
) V
1
= (p
0
+
ρ g h
2
) V
2
(10.14)
Wyliczając stosunek
1
2
V
V
niezależnie z dwu równań (10.13), (10.14) i przyrównując otrzymane
wyrażenia do siebie otrzymujemy zależność:
(
)
κ
1
0
1
0
2
0
1
0
p
h
g
ρ
p
h
g
ρ
p
h
g
ρ
p
+
+
=
+
(10.15)
i stąd:
+
−
+
+
=
0
2
0
1
0
1
p
h
g
ρ
1
ln
p
h
g
ρ
1
ln
p
h
g
ρ
1
ln
κ
(10.16)
Ponieważ w warunkach eksperymentu
ρgh
2
<ρgh
1
<<p
0
, a więc inaczej
1
p
h
g
ρ
p
h
g
ρ
0
1
0
2
〈〈
〈
,
moż-
na skorzystać z następującego rozwinięcia w szereg:
ln ( 1+x ) = x – x
2
/2 + x
3
/3 – x
4
/4 + ...
Ograniczając się tylko do pierwszego wyrazu rozwinięcia otrzymujemy ostatecznie bardzo prostą
zależność:
2
1
1
h
h
h
−
=
κ
(10.17)
Ze wzoru tego wynika, że w opisanej metodzie wystarczy zmierzyć przyrosty ciśnień h
1
, i h
2
(mie-
rzone przyrostem słupa cieczy w manometrze ) w stosunku do ciśnienia atmosferycznego, aby z
dobrą dokładnością wyznaczyć wartość szukanego stosunku c
P
/ c
v
.
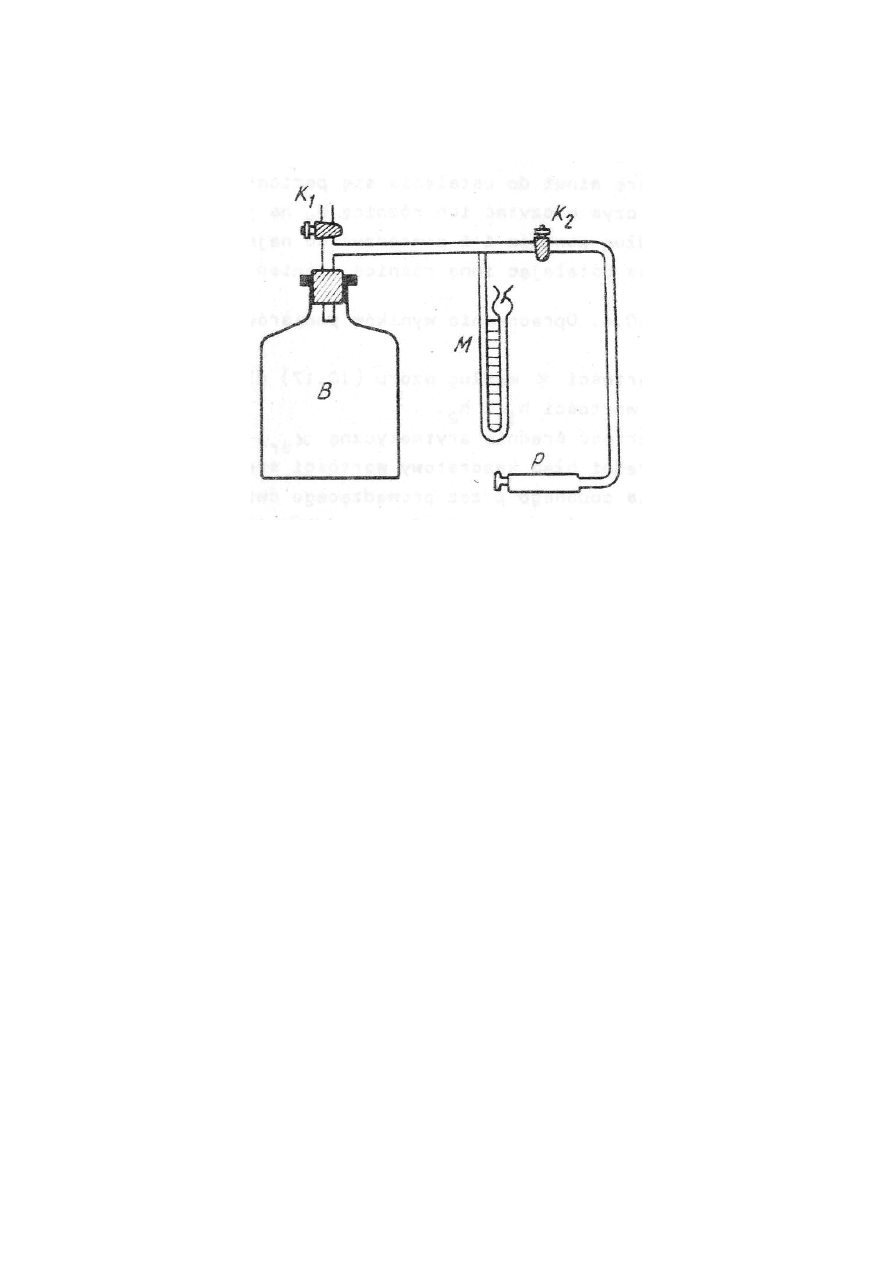
10.2. Opis układu pomiarowego
Schemat układu pozwalający wyznaczyć
κ wyżej opisaną metodą przedstawiony jest na rys. 10.2.
Rys.10.2 Aparatura do wyznaczania
κ
Stan I gazu osiąga się przez wtłoczenie do butli B (o objętości kilkudziesięciu litrów) odpowiedniej
ilości powietrza za pomocą niewielkiej ręcznej pompki P. Operację tę przeprowadza się przy otwar-
tym kranie K
2
i zamkniętym K
1
. Po zamknięciu kranu K
2
i wyrównaniu temperatury powietrza we-
wnątrz butli z temperaturą otoczenia T
1
, różnicę ciśnień
ρ g h
1
pomiędzy ciśnieniem atmosferycz-
nym p
0
i ciśnieniem w butli można wyznaczyć za pomocą manometru M po odczytaniu wartości h
1
na jego skali. Stan II osiąga się poprzez krótkotrwałe otwarcie kranu K
1
w celu umożliwienia roz-
prężenia powietrza zawartego w butli do ciśnienia p
0
. Po zamknięciu kranu temperatura w butli,
która przy rozprężeniu adiabatycznym spadła do T
2
. Ciśnienie wzrośnie wtedy do p
0
+
ρ g h
2
. War-
tość h
2
zostanie odczytana na skali manometru napełnionego denaturatem.
.
10.3. Przebieg pomiarów
1. Otworzyć kran K
2 ,
zamknąć K
1
.
2. Za pomocą pompki zwiększyć ciśnienie o 20-25 cm słupa cieczy,
3. Zamknąć kran K
2
i odczekać parę minut, aż ustali się różnica poziomów cieczy w manometrze,
po czym odczytać tę różnicę h
1
.
4 Otworzyć kran K
1
na stosunkowo krótki okres (~2-3s), aby zrównać ciśnienie w butli z c
niem atmosferycznym, a potem go zamknąć.
iśnie-
5 Odczekać parę minut do ustalenia się poziomów cieczy w manometrze, po czym odczytać ich
różnicę h
2
na jego skali.
6 Pomiary
według punktów 1-5 powtórzyć co najmniej 10 razy, za każdym razem ustalając inną
różnicę ciśnień h
1
.

10.4. Opracowanie wyników pomiarów.
1. Obliczyć wartość
κ według wzoru (10.17) dla kolejno uzyskanych par wartości h
1
i h
2
.
2. Obliczyć wartość średnią arytmetyczną
κ
śr
.
3. Obliczyć średni błąd kwadratowy wartości średniej
Śr
κ
σ
.
10.5. Pytania kontrolne
1. Omówić kinetyczno-molekularną teorię gazów.
2. Omówić I zasadę termodynamiki dla przemiany izochorycznej i izobarycznej.
3. Krótko scharakteryzować przemiany gazowe.
4. Wyprowadzić wyrażenia na c
v
i c
p
.
5. Omówić metodę Clemensa-Desormesa.
L i t e r a t u r a
[1] Jaworski B., Dietłaf D., Miłkowska L., Siergiejew G.: Kurs fizyki, t.1 PWN, Warszawa 1974.
[2] Jeżewski M.: Fizyka. PWN, Warszawa 1970.
Wyszukiwarka
Podobne podstrony:
Cw 20 - Wyznaczanie stosunku cp-cv dla powietrza metoda Clementa-Desormesa, Studia, Budownictwo UTP,
Wyznaczanie stosunku Cp,Cv dla powietrza metodą Clemensa Desormesa
Wyznaczanie stosunku Cp Cv dla powietrza metodą Clementa Desormesa
6 Wyznaczanie stosunku Cp Cv dla powietrza metodą Clementa Desormesa
Wyznaczanie stosunku Cp Cv dla powietrza metodą Clementa De
Ćwiczenie 18, Wyznaczanie stosunku Cp/Cv dla powietrza metodą Clémenta-Desormesa
Ćwiczenie 18, Wyznaczanie stosunku Cp/Cv dla powietrza metodą Clémenta-Desormesa
Wyznaczenie stosunku Cp Cv dla powietrza metod Clementa Desormesa
Cw20-2 - Wyznaczanie stosunku cp-cv dla powietrza metoda Cle, PRENTKI PIOTR
106, LAB106M(1), ˙w.nr.106 Temat: Wyznaczanie stosunku H=Cp/Cv dla powietrza metod˙
102, 102, Temat : Wyznaczanie stosunku Cp/Cv metodą Clementa - Desormesa
115, #115A, Temat : Wyznaczanie stosunku Cp/Cv metodą Clementa - Desormesa
Wyznaczanie stosunku Cp Cv metodą Clementa-Desormesa, Wyznaczanie stosunku Cp Cv metodą Clementa Des
106, 106OLA, Temat : Wyznaczanie stosunku Cp/Cv metodą Clementa - Desormesa
Wyznaczanie stosunku Cp Cv metodą Clementa-Desormesa, Sprawozdanie z fizyki
więcej podobnych podstron