
CEMENT PORTLANDZKI

Pierwsze materiały podobne do cementu uzyskano w drugiej
połowie XVIII w.
Patent na „cement portlandzki" przyznano w 1824 Josephowi
Aspdinowi, murarzowi z Leeds.
Historia
Cement rzeczywiście odpowiadający dzisiejszemu
cementowi portlandzkiemu uzyskał w 1845 Isaac Johnson,
który ustalił właściwą temperaturę wypalania surowców.
P.Łukowski, 2

Jedne z pierwszych pieców
cementowych
Cementownia w
Grodźcu (1857) –
pierwsza na
ziemiach polskich,
piąta na świecie!
P.Łukowski, 3
Historia

klinkier cementu
portlandzkiego
cement
portlandzki
wypał
przemiał
+ gips surowy
surowce
skała wapienna – źródło CaCO
3
glina – źródło Al
2
O
3
ruda żelaza – źródło Fe
2
O
3
piasek – źródło SiO
2
P.Łukowski, 4
Otrzymywanie

Symbole stosowane w chemii cementu
Zapis tlenkowy:
CaSiO
3
≡
CaO ⋅ SiO
2
krzemian wapnia
Ca
3
SiO
5
≡
3CaO ⋅ SiO
2
krzemian trójwapnia
Notacja skrócona:
C ≡ CaO
S ≡ SiO
2
A ≡ Al
2
O
3
F ≡ Fe
2
O
3
H ≡ H
2
O
ż ≡ SO
3
Zapis tlenkowy za pomocą notacji skróconej:
C
3
S ≡ 3CaO ⋅ SiO
2
C
3
A ≡ 3CaO ⋅ Al
2
O
3
CżH
2
≡
CaO ⋅ SO
3
⋅
2H
2
O ≡ CaSO
4
⋅
2H
2
O
(gips dwuwodny)
P.Łukowski, 5

Temperatura w kolejnych strefach pieca obrotowego wzrasta
do 1450°C. Kolejnymi fazami produkcji klinkieru są:
P.Łukowski, 6
Otrzymywanie
- do 450°°°°C – dehydratacja; odparowanie zawartej w
surowcach wody swobodnej, kapilarnej i krystalizacyjnej,
- 450÷
÷
÷
÷
1300°°°°C – kalcynacja; rozkład surowców na proste
tlenki: CaO, SiO
2
, Al
2
O
3
, Fe
2
O
3
,
- 1300-1450°°°°C – klinkieryzacja; synteza minerałów klinkieru
(następuje w fazie ciekłej):
2CaO + SiO
2
→
2CaO ⋅ SiO
2
2CaO ⋅ SiO
2
+ CaO → 3CaO ⋅ SiO
2
3CaO + Al
2
O
3
→
3CaO ⋅ Al
2
O
3
itd.
- schłodzenie do 1200°°°°C i krystalizacja produktów.

klinkier cementu
portlandzkiego
cement
portlandzki
wypał
przemiał
+ gips surowy
surowce
P.Łukowski, 7
Otrzymywanie
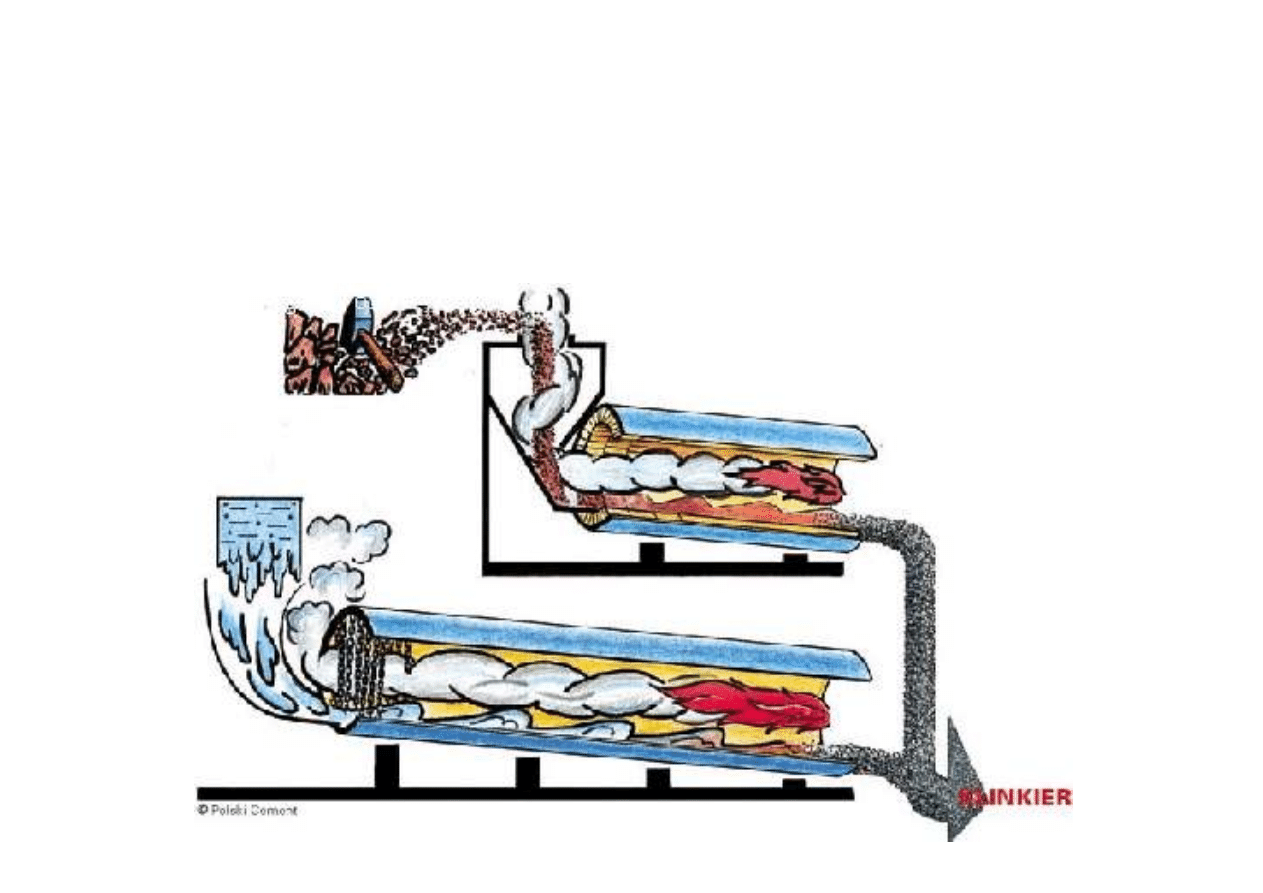
Metoda mokra: surowce dostarczane do pieca w postaci szlamu.
Metoda sucha: surowce dostarczane do pieca bez użycia wody.
P.Łukowski, 8
Otrzymywanie: metoda mokra i sucha

P.Łukowski, 9
Metoda mokra:
Zaleta: łatwość przygotowania i transportu mieszaniny
surowcowej.
Wada: duże zużycie energii, ok. 9 MJ/t (konieczność
odparowania dużej ilości wody).
Metoda sucha:
Zaleta: małe zużycie energii, ok. 3,5 MJ/t (niższy koszt
produkcji).
Wada: otrzymywany cement zawiera więcej alkaliów
(podatność na korozję alkaliczną).
Otrzymywanie: metoda mokra i sucha
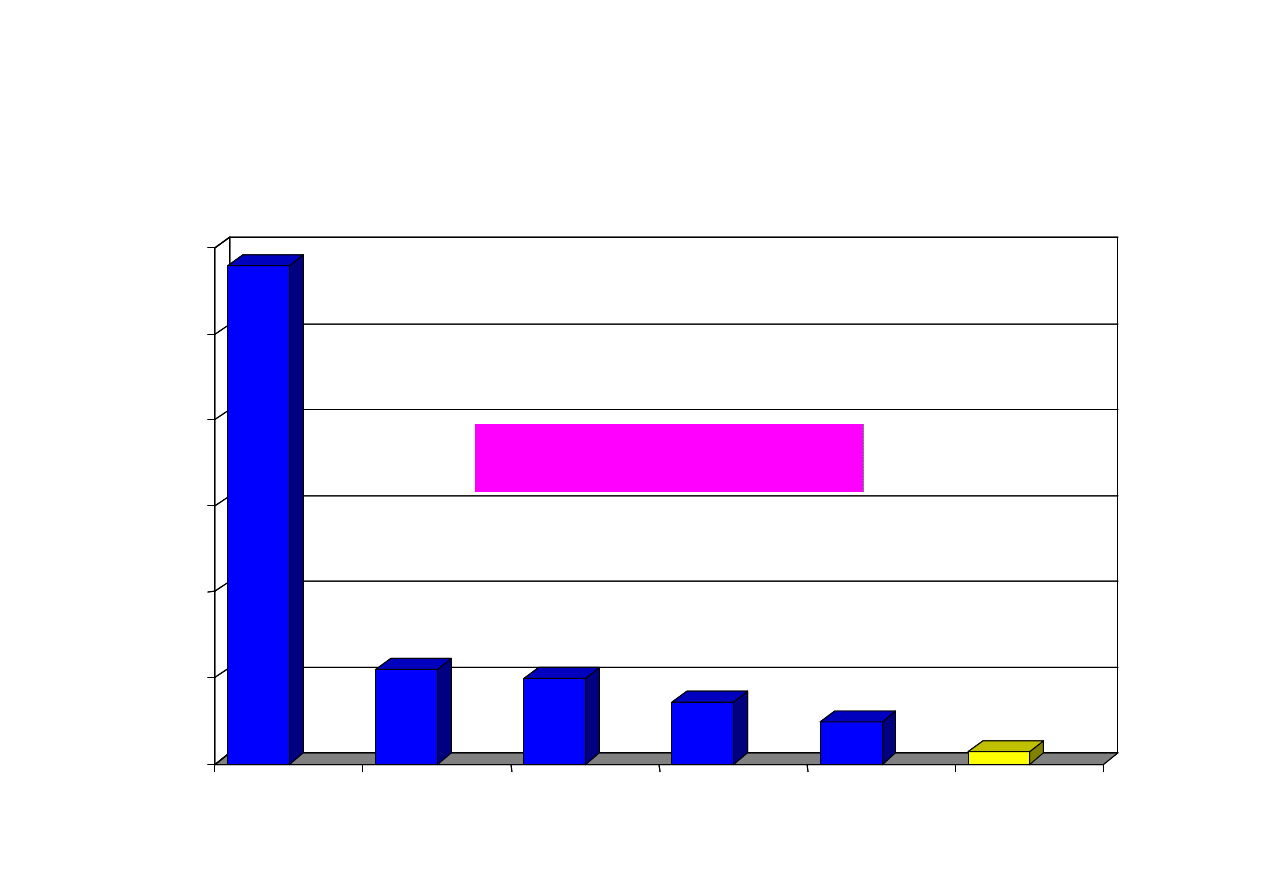
581,0
109,5
99,6
72,3
48,0
14,3
0,0
100,0
200,0
300,0
400,0
500,0
600,0
Chiny
USA
Indie
Japonia
Korea
Polska
2000 rok
581,0
109,5
99,6
72,3
48,0
14,3
0,0
100,0
200,0
300,0
400,0
500,0
600,0
Chiny
USA
Indie
Japonia
Korea
Polska
2000 rok
P.Łukowski, 10
Produkcja cementu portlandzkiego na świecie
(w mln ton)

Symbol
Zawartość, % mas.
CaO
62 ÷ 68
SiO
2
18 ÷ 25
Al
2
O
3
4 ÷ 8
Fe
2
O
3
3 ÷ 4
MgO
0,5 ÷ 2,5
Na
2
O + K
2
O
0,4 ÷ 3
SO
3
0,8 ÷ 3
P.Łukowski, 11
Skład chemiczny

Wzór chemiczny w
zapisie tlenkowym
Wzór
skrócony
Nazwa związku
chemicznego
Nazwa
zwyczajowa
minerału
Zawartość,
% mas.
3CaO⋅SiO
2
C
3
S
krzemian
trójwapnia
alit
30 ÷ 65
2CaO⋅SiO
2
C
2
S
krzemian
dwuwapnia
belit
15 ÷ 45
3CaO⋅Al
2
O
3
C
3
A
glinian
trójwapnia
celit
5 ÷ 15
4CaO⋅Al
2
O
3
⋅
Fe
2
O
3
C
4
AF
żelazoglinian
czterowapnia
braunmilleryt
5 ÷ 15
CaO⋅SO
3
⋅
2H
2
O
lub CaO⋅SO
3
CżH
2
Cż
siarczan wapnia
dwuwodny
siarczan wapnia
gips surowy
anhydryt
3 ÷ 5
P.Łukowski, 12
Skład mineralogiczny

Niezwiązane (wolne) wapno, CaO:
korzystne w niewielkiej
ilości (poprawia urabialność mieszanki betonowej),
szkodliwe
w nadmiarze – w wyniku reakcji z wodą prawie dwukrotnie
zwiększa swoją objętość.
MgO:
przy uwodnieniu zwiększa swoją objętość.
Siarczany (jony SO
3
2-
i SO
4
2-
):
mogą zapoczątkować korozję
siarczanową betonu.
Alkalia:
mogą wchodzić w szkodliwe reakcje z niektórymi
kruszywami (korozja wewnętrzna betonu).
Chlorki (jony Cl
-
):
zagrożenie korozją stali zbrojeniowej.
P.Łukowski, 13
Składniki drugorzędne

Wiązanie spoiwa cementowego ≡ zbiór reakcji chemicznych
i procesów fizycznych zachodzących po zmieszaniu cementu
z wodą.
Początkowo
zaczyn
cementowy
jest
zawiesiną
ziaren
cementu w wodzie zarobowej, następnie składniki cementu
zaczynają reagować z wodą.
Reakcje
zachodzące
w
czasie
wiązania
cementu
to
hydratacja i hydroliza (czasem następujące jednocześnie).
P.Łukowski, 14
Wiązanie

Najbardziej reaktywny w stosunku do wody jest glinian
trójwapnia. Gdyby nie obecny w cemencie gips dwuwodny,
reakcja uwodnienia glinianu zachodziłaby bardzo szybko i
wiązanie cementu przebiegałoby gwałtownie. W obecności
gipsu glinian trójwapnia reaguje z wodą znacznie wolniej:
3CaO⋅Al
2
O
3
+ 3(CaSO
4
⋅
2H
2
O) + 26H
2
O →
→
6CaO⋅Al
2
O
3
⋅
3SO
3
⋅
32H
2
O
(etryngit, sól Candlota)
P.Łukowski, 15
Wiązanie

Dopiero po wyczerpaniu gipsu lub anhydrytu zachodzi
szybka reakcja powstawania hydrogarnetu
(sześciowodnego glinianu trójwapnia):
3CaO⋅Al
2
O
3
+ 6H
2
O → 3CaO⋅Al
2
O
3
⋅
6H
2
O.
P.Łukowski, 16
Wiązanie

Żelazoglinian czterowapnia reaguje z wodą podobnie jak
glinian trójwapnia, z utworzeniem etryngitu i hydrogarnetu
oraz tzw. fazy ferrytowej, zawierającej m.in. uwodniony
żelazian wapnia CaO⋅Fe
2
O
3
⋅
H
2
O.
Gips dwuwodny (lub anhydryt) pełni więc w cemencie
rolę regulatora – opóźniacza wiązania.
Wiązanie
szybko powstające, duże
kryształy uwodnionego
glinianu C
3
AH
6
P.Łukowski, 17

Krzemiany wapnia – alit i belit – ulegają hydratacji i hydrolizie.
Jako pierwszy reaguje krzemian trójwapnia, bardziej reaktywny
w stosunku do wody:
alit:
2(3CaO⋅SiO
2
) + 6H
2
O → 3CaO⋅2SiO
2
⋅
3H
2
O + 3Ca(OH)
2
belit: 2(2CaO⋅SiO
2
) + 4H
2
O → 3CaO⋅2SiO
2
⋅
3H
2
O + Ca(OH)
2
Produktami są uwodniony krzemian wapnia i wodorotlenek
wapnia (portlandyt).
P.Łukowski, 18
Wiązanie
W zapisie skróconym:
2C
3
S +6H → C
3
S
2
H
3
+ 3CH
2C
2
S +4H → C
3
S
2
H
3
+ CH

Portlandyt tworzy kryształy,
natomiast uwodnione
krzemiany wapnia tworzą fazę
amorficzną, tzw. żel C-S-H, który
objętościowo dominuje w
stwardniałym zaczynie
cementowym (> 50 % objętości)
i który jest najważniejszym
składnikiem zaczynu – „klejem”
spajającym pozostałe składniki
betonu.
P.Łukowski, 19
Wiązanie

Wiązanie – rozwój fazy CSH
zdjęcia dzięki uprzejmości prof. W. Kurdowskiego, AGH
30 minut
6 godzin
7 dni
3 miesiące
P.Łukowski, 20
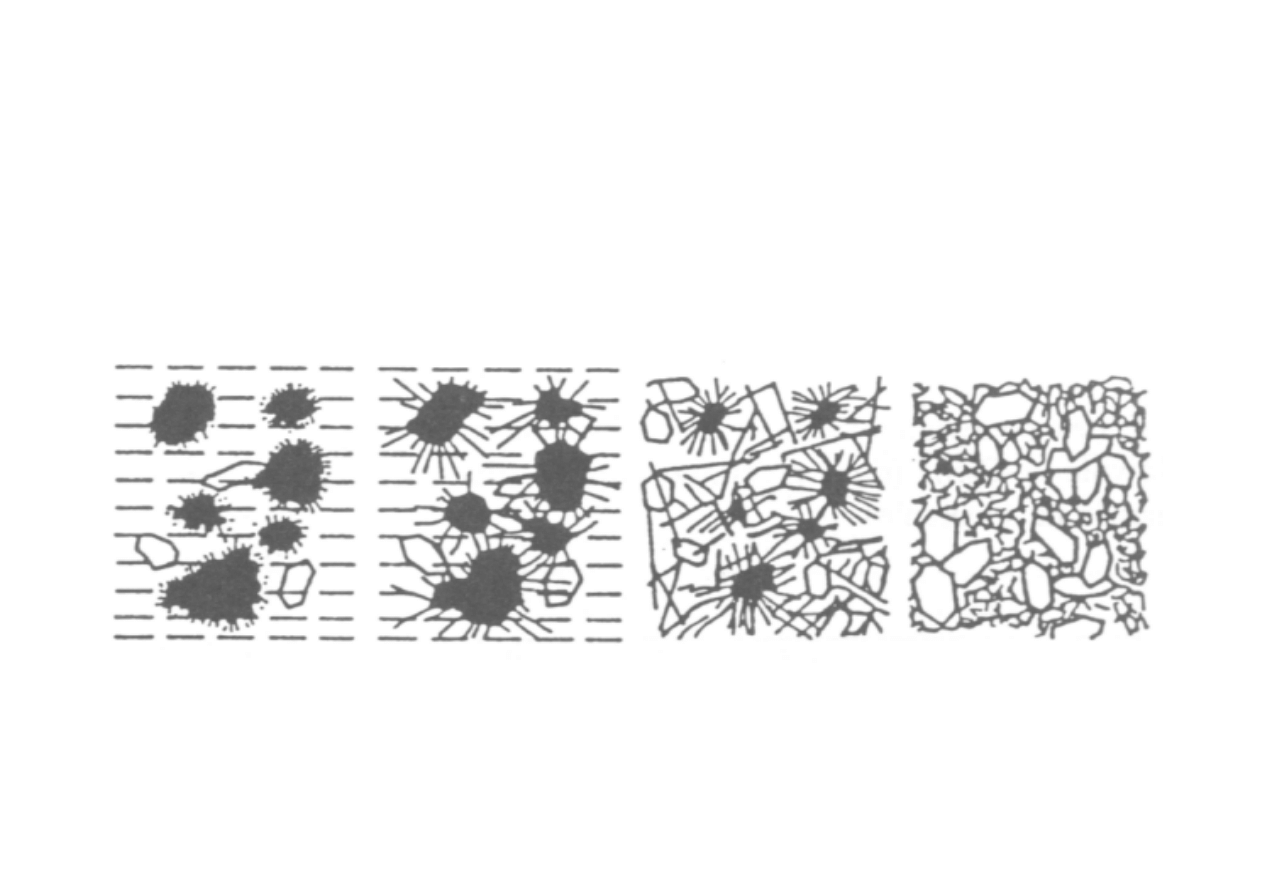
Ostatecznie powstaje stabilny układ, w którym stwardniały
zaczyn cementowy spaja ziarna kruszywa w „sztuczny kamień”
– beton lub zaprawę o odpowiedniej wytrzymałości
mechanicznej.
struktura
plastyczna
struktura
nietrwała
związana
struktura
wyjściowa
struktura
stabilna
P.Łukowski, 21
Wiązanie – rozwój fazy CSH
Wyszukiwarka
Podobne podstrony:
Cement portlandzki, BUDOWNICTWO, chemia
14 cementyid 15666
CEMENT PORTLANDZKI
Identyfikacja cementów portlandzkich produkowanych w Polsce na podstawie zawartości składników akces
badanie spoiw budowlanych (cement portlandzki) v sprawozdanie
badanie spoiw budowlanych ( cement portlandzki ) SPRAWOZDANIE, politechnika lubelska, budownictwo,
Sprawozdanie - Cement Portlandzki1, STUDIA, Budownictwo UZ, Semestr II, Chemia Budowlana [Świderski]
14-cementy
02 cement portlandzki, zaczynid Nieznany
Cement portlandzki i wiązanie betonu
Oddziaływania wybranych domieszek do betonu na hydratację cementu portlandzkiego
Cement portlandzki, BUDOWNICTWO, chemia
14 cementyid 15666
14 cementy
3 14 cw cement bz
3 4 5 14 cw cement unlocked id Nieznany (2)
więcej podobnych podstron