
Opcje terapeutyczne dla os
Opcje terapeutyczne dla os
ó
ó
b
b
przewlekle zaka
przewlekle zaka
ż
ż
onych HBV
onych HBV
Waldemar Halota
Waldemar Halota
Katedra i Klinika Chor
Katedra i Klinika Chor
ó
ó
b Zaka
b Zaka
ź
ź
nych i Hepatologii
nych i Hepatologii
Collegium Medicum im. L. Rydygiera w Bydgoszczy
Collegium Medicum im. L. Rydygiera w Bydgoszczy
Uniwersytetu Miko
Uniwersytetu Miko
ł
ł
aja Kopernika w Toruniu
aja Kopernika w Toruniu

LIVER DAMAGE
LIVER DAMAGE
healthy
healthy
liver
liver
damage
damage
inflammation
inflammation
+
+
fibrosis
fibrosis
cirrhosis
cirrhosis
damage
damage
HCC
HCC
readily reversible
repetitive, 2nd hit

Algorytm diagnozowania
Algorytm diagnozowania
Przebieg choroby
Przebieg choroby
Surowica
Surowica
Bioptat
Bioptat
w
w
ą
ą
troby
troby
Serologia
Serologia
Wielko
Wielko
ść
ść
wiremii
wiremii
Analiza sekwencyjna genomu
Analiza sekwencyjna genomu
Histologia,
Histologia,
immunohistochemia
immunohistochemia
Wewn
Wewn
ą
ą
trzw
trzw
ą
ą
trobowy
trobowy
HBV
HBV
-
-
DNA
DNA
Wewn
Wewn
ą
ą
trzw
trzw
ą
ą
trobowy
trobowy
ccc DNA
ccc DNA
Genotypy
Genotypy
Mutanty
Mutanty
YF Liaw et al. Asian-Pacific Consensus statement on the management of chronic hepatitis B:
A 2005 update. Liver International 2005:
Biochemia
Biochemia

Cel terapii pzw B
Cel terapii pzw B
•
•
zahamowanie i regresja zmian morfologicznych
zahamowanie i regresja zmian morfologicznych
w w
w w
ą
ą
trobie
trobie
1.
1.
ust
ust
ą
ą
pienie wiremii HBV i ryzyka
pienie wiremii HBV i ryzyka
karcynogenezy
karcynogenezy
2.
2.
normalizacja biochemiczna choroby
normalizacja biochemiczna choroby
3.
3.
serokonwersja HBeAg/anty
serokonwersja HBeAg/anty
-
-
HBe, ust
HBe, ust
ą
ą
pienie HBsAg
pienie HBsAg
4.
4.
lekooporno
lekooporno
ść
ść
↓↓↓↓
↓↓↓↓
•
•
cccDNA
cccDNA
?
?
•
•
ograniczenie transmisji zaka
ograniczenie transmisji zaka
ż
ż
enia
enia
•
•
poprawa jako
poprawa jako
ś
ś
ci
ci
ż
ż
ycia i wyd
ycia i wyd
ł
ł
u
u
ż
ż
enie prze
enie prze
ż
ż
ywalno
ywalno
ś
ś
ci
ci

1.
1.
HBV
HBV
-
-
DNA
DNA
w surowicy krwi
w surowicy krwi
replikacja HBV = choroba
replikacja HBV = choroba
•
•
redukcja wiremii wyprzedza odpowied
redukcja wiremii wyprzedza odpowied
ź
ź
biochemiczn
biochemiczn
ą
ą
i histologiczn
i histologiczn
ą
ą
•
•
nawr
nawr
ó
ó
t wiremii
t wiremii
-
-
utrata odpowiedzi biochemicznej
utrata odpowiedzi biochemicznej
i histologicznej
i histologicznej
•
•
HBV
HBV
-
-
DNA w surowicy krwi
DNA w surowicy krwi
-
-
najlepszy wyk
najlepszy wyk
ł
ł
adnik
adnik
replikacji HBV
replikacji HBV
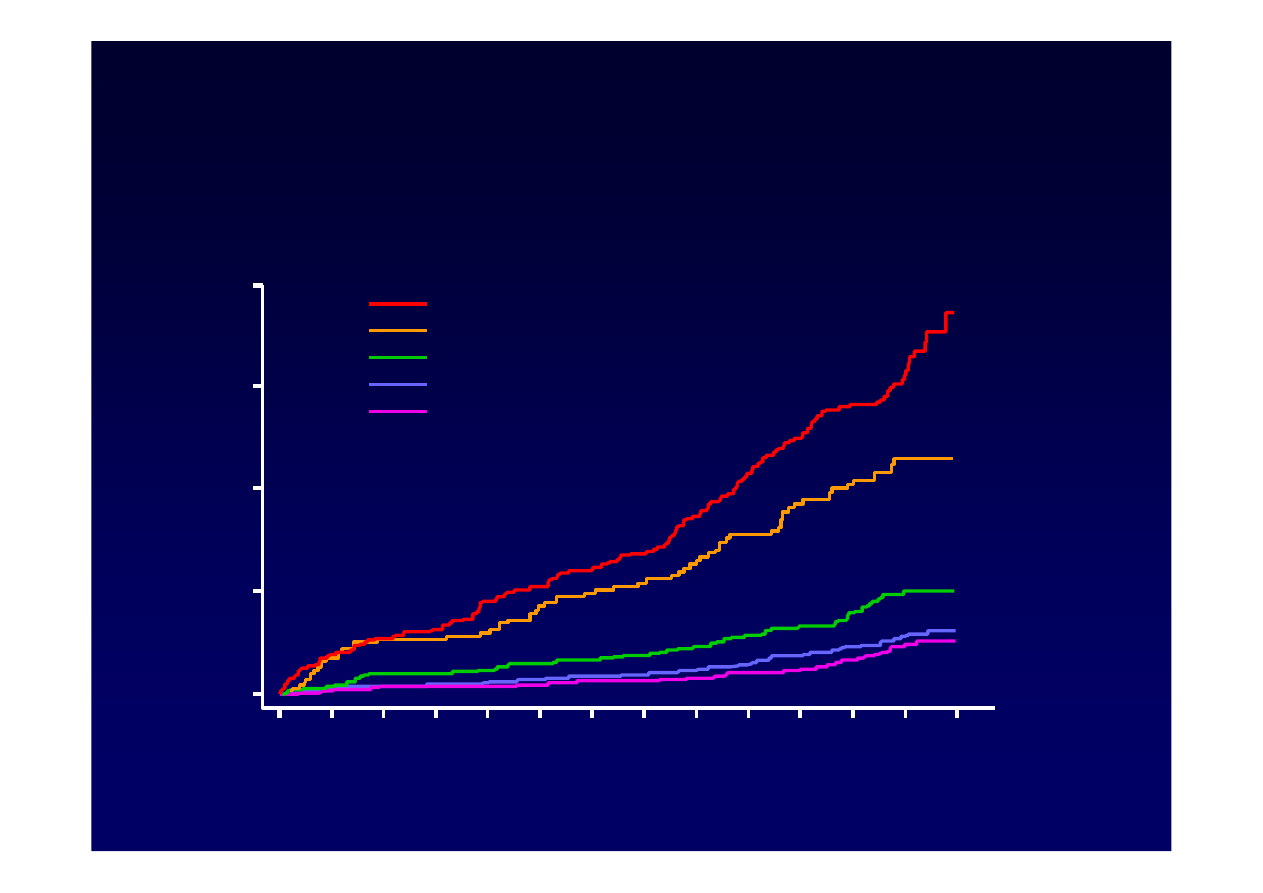
Wyj
Wyj
ś
ś
ciowy poziom
ciowy poziom
HBV DNA
HBV DNA
0.1
0.1
0.2
0.2
0.3
0.3
0.4
0.4
0
0
1
1
2
2
3
3
4
4
5
5
6
6
7
7
8
8
9
9
10
10
11
11
12
12
13
13
Lata (
Lata (
follow
follow
-
-
up
up
)
)
C
z
C
z
ę
ę
s
to
s
to
ś
ć
ś
ć
w
y
s
t
w
y
s
t
ę
ę
p
o
w
a
n
ia
m
a
rs
k
o
p
o
w
a
n
ia
m
a
rs
k
o
ś
ś
c
i
c
i
≥
≥
1.0X10
1.0X10
6
6
1.0
1.0
-
-
9.9X10
9.9X10
5
5
1.0
1.0
-
-
9.9X10
9.9X10
4
4
300
300
-
-
9.9X10
9.9X10
3
3
<300
<300
p
p
<0.001
<0.001
Chen CJ at all. JAMA, January 4,2006-Vol 295, No.1
1.
1.
HBV DNA
HBV DNA
→
→
→
→
→
→
→
→
marsko
marsko
ść
ść
w
w
ą
ą
troby
troby
0
0
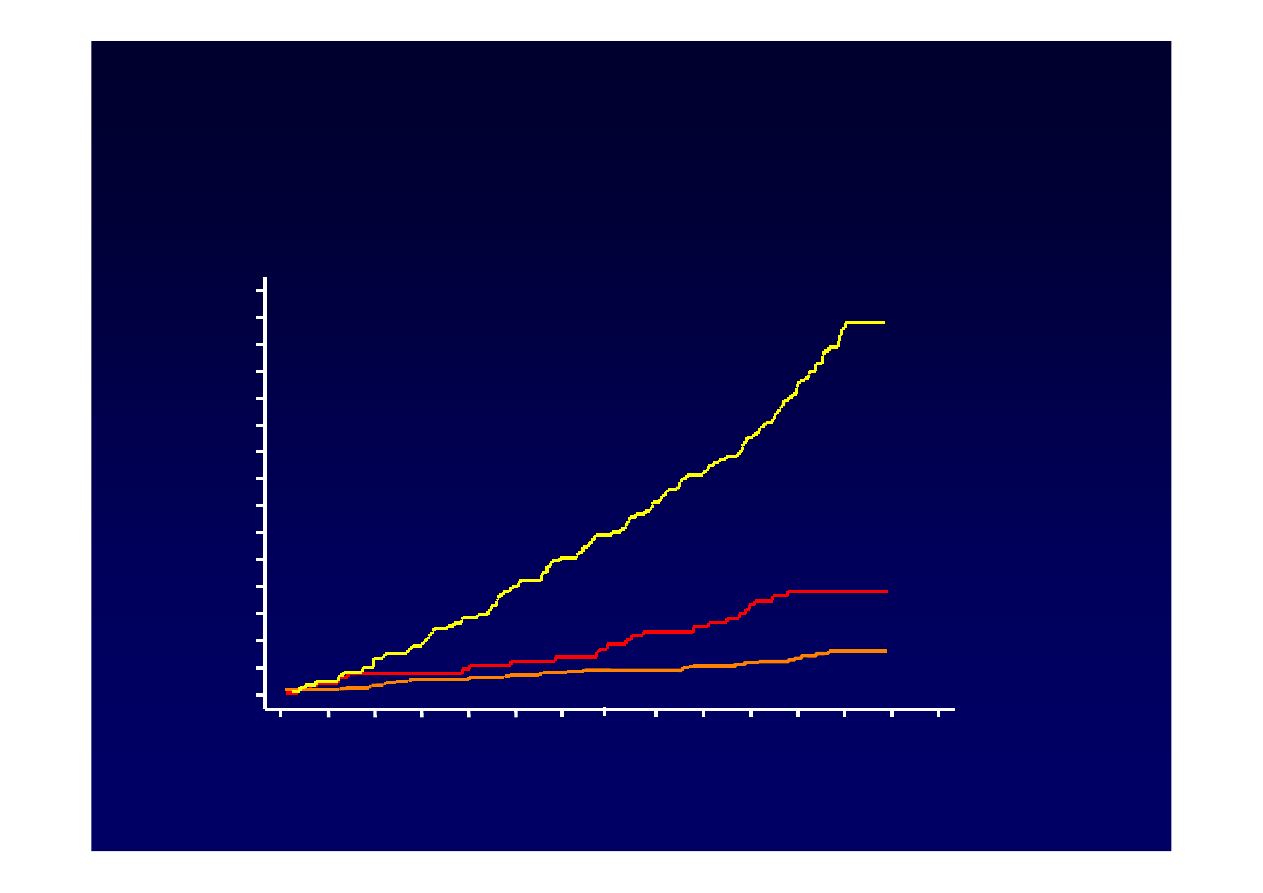
Chen CJ at all. JAMA, January 4,2006-Vol 295, No.1
0
0
1
1
2
2
3
3
4
4
5
5
6
6
7
7
8
8
9
9
10
10
11
11
12
12
13
13
14
14
0
0
0.02
0.02
0.04
0.04
0.06
0.06
0.08
0.08
0.12
0.12
0.14
0.14
0.1
0.1
C
z
C
z
ę
ę
s
to
s
to
ś
ć
ś
ć
w
y
s
t
w
y
s
t
ę
ę
p
o
w
a
n
ia
H
C
C
p
o
w
a
n
ia
H
C
C
Lata (
Lata (
follow
follow
-
-
up
up
)
)
≥≥≥≥
≥≥≥≥
10
10
5
5
10
10
4
4
to <10
to <10
5
5
<10
<10
4
4
p
p
<0.01
<0.01
Wyj
Wyj
ś
ś
ciowy poziom
ciowy poziom
HBV DNA
HBV DNA
1. HBV DNA
1. HBV DNA
→
→
→
→
→
→
→
→
rak w
rak w
ą
ą
trobowokom
trobowokom
ó
ó
rkowy
rkowy
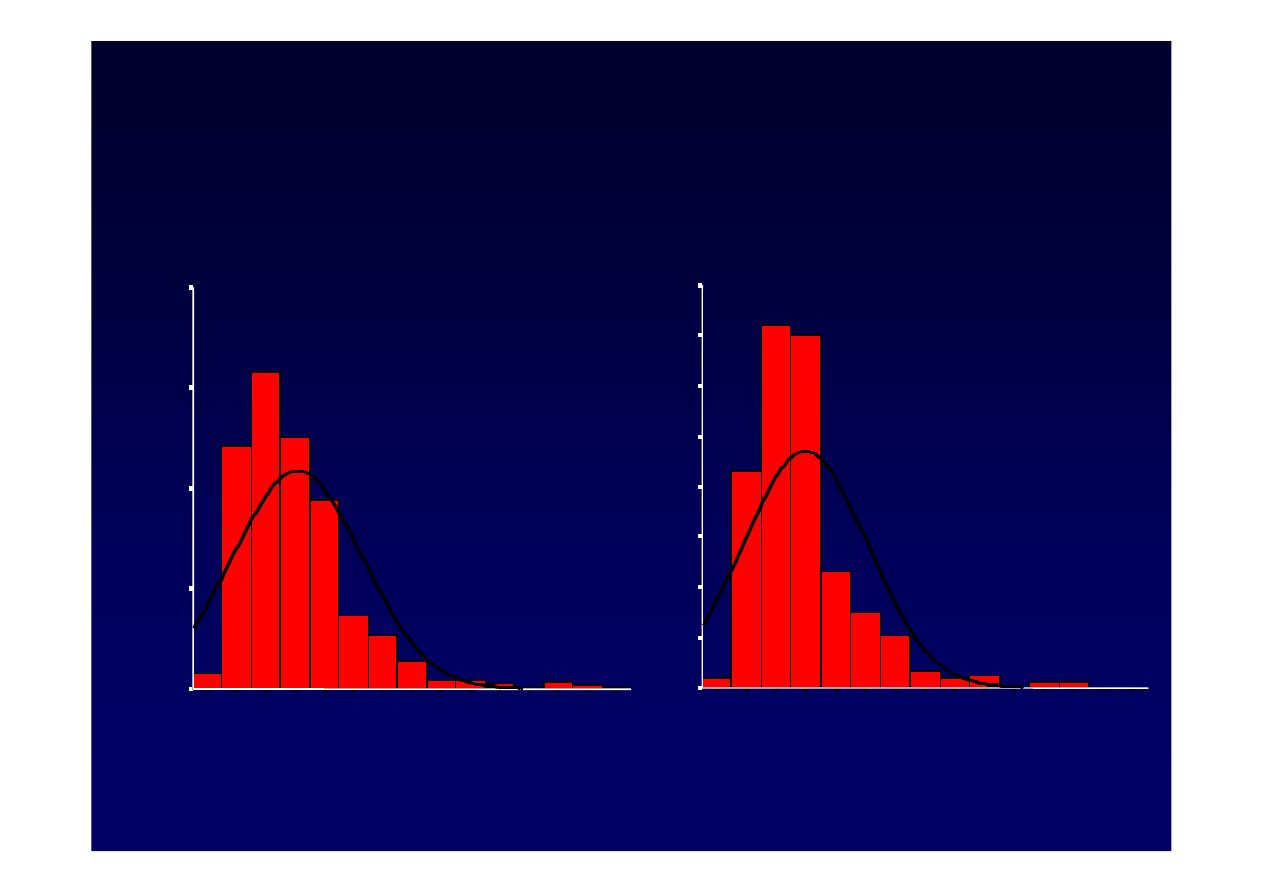
2. Normalizacja biochemiczna?
2. Normalizacja biochemiczna?
Warto
Warto
ś
ś
ci
ci
A
A
lA
lA
T
T
w populacji zdrowych
w populacji zdrowych
M
M
(n=3815)
(n=3815)
67,7
63,0
58,3
53,7
49,0
44,3
39,7
35,0
30,3
25,7
21,0
16,3
11,7
7,0
2,3
400
300
200
100
0
A
lA
T
(
IU
/L
)
48,3
45,0
41,7
38,3
35,0
31,7
28,3
25,0
21,7
18,3
15,0
11,7
8,3
5,0
1,7
160
140
120
100
80
60
40
20
0
F (n=804)
F (n=804)
Hatemi I, et al. 38th EASL Meeting, 3–6 July 2003, Geneva, Switzerland. poster presentation.
J.Hepatol. 2003; 38(suppl 2):216-7 (Abstract 716).
A
lA
T
(
IU
/L
)
Ista
Ista
m
m
bu
bu
ł
ł
,
,
Tur
Tur
cja
cja
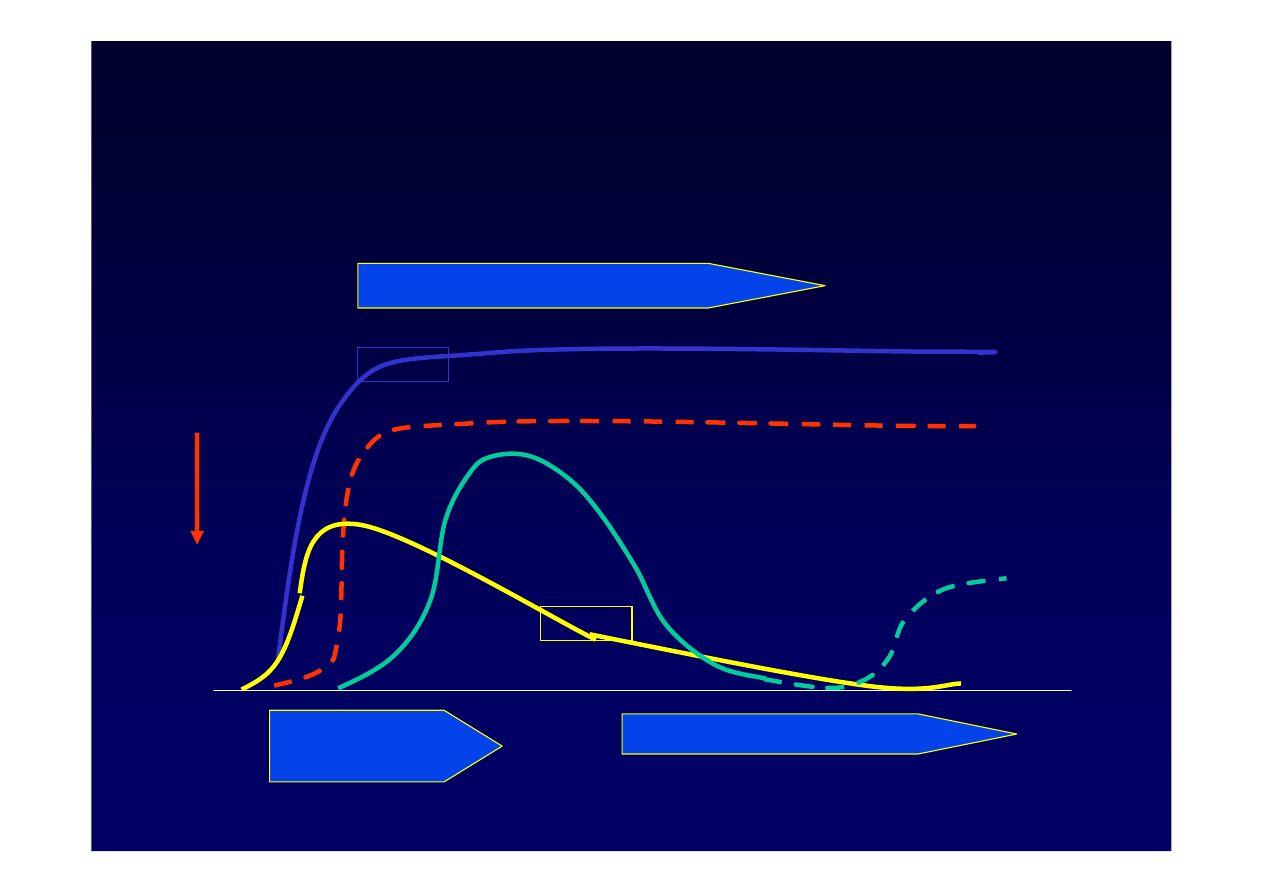
3.
3.
„
„
Nosicielstwo
Nosicielstwo
”
”
HBsAg. Markery zaka
HBsAg. Markery zaka
ż
ż
enia
enia
od fazy ostrej do fazy zaka
od fazy ostrej do fazy zaka
ż
ż
enia przewlek
enia przewlek
ł
ł
ego
ego
HBV DNA
Zaka
ż
enie ostre
Zaka
ż
enie przewlekłe
CZAS
H
B
V
HBsAg
anty
anty
-
-
HBc
HBc
anty
anty
-
-
HBe
HBe
anty
anty
-
-
HBc
HBc
IgM
IgM
HBeAg

4. Przyczyny lekooporno
4. Przyczyny lekooporno
ś
ś
ci
ci
•
•
brak adherencji
brak adherencji
•
•
selekcja szczep
selekcja szczep
ó
ó
w opornych
w opornych
•
•
nieskuteczna
nieskuteczna
supresja
supresja
wiremii
wiremii
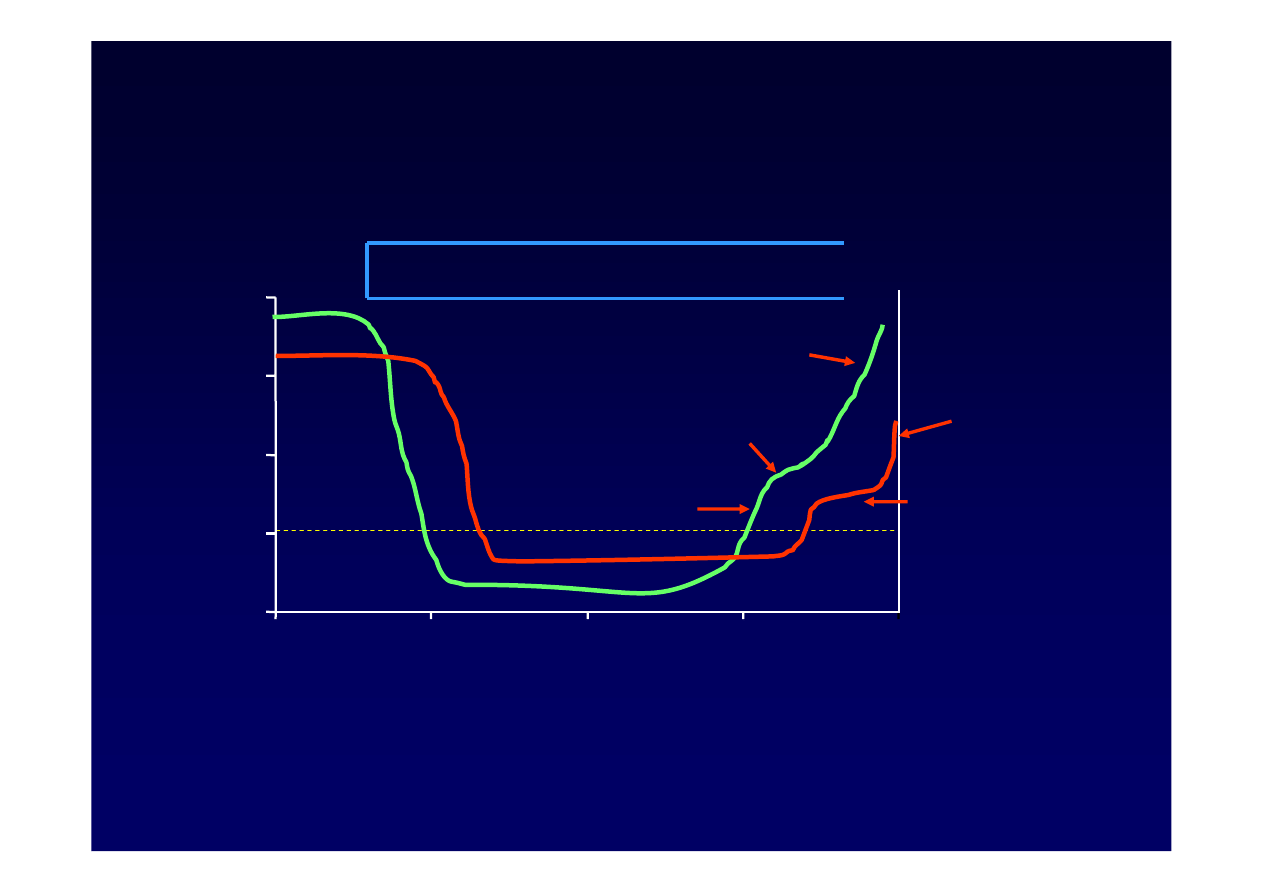
4. Konsekwencje lekooporno
4. Konsekwencje lekooporno
ś
ś
ci
ci
•
•
utrata remisji histologicznej
utrata remisji histologicznej
•
•
reinfekcja przeszczepu w
reinfekcja przeszczepu w
ą
ą
troby
troby
•
•
transmisja lekooporno
transmisja lekooporno
ś
ś
ci
ci
H
B
V
D
N
A
(
lo
g
H
B
V
D
N
A
(
lo
g
1
0
1
0
IU
/
IU
/
m
L
m
L
)
)
A
A
lA
lA
T
(
U
/L
)
T
(
U
/L
)
Prze
Prze
ł
ł
om
om
b
b
iochemiczny
iochemiczny
ULN
ULN
Prze
Prze
ł
ł
om
om
wirusologiczny
wirusologiczny
0
0
1
1
2
2
3
3
lata
lata
Leczenie antywirusowe
Leczenie antywirusowe
0
0
2
2
4
4
6
6
8
8
Hepatitis flare
Hepatitis flare
Nawr
Nawr
ó
ó
t
t
wiremii
wiremii
Oporno
Oporno
ść
ść
genotypowa
genotypowa
-
-
1
1

4. Kliniczne konsekwencje
4. Kliniczne konsekwencje
lekooporno
lekooporno
ś
ś
ci wirusa HBV
ci wirusa HBV
•
•
nawr
nawr
ó
ó
t wiremii
t wiremii
•
•
zaostrzenia aktywno
zaostrzenia aktywno
ś
ś
ci
ci
A
A
lA
lA
T
T
•
•
progresja zmian histologicznych
progresja zmian histologicznych
•
•
d
d
e
e
kompensacja i zgony u pacjent
kompensacja i zgony u pacjent
ó
ó
w z marsko
w z marsko
ś
ś
ci
ci
ą
ą
•
•
nawroty zapalenia w
nawroty zapalenia w
ą
ą
troby u pacjent
troby u pacjent
ó
ó
w po transplantacjach
w po transplantacjach
narz
narz
ą
ą
du
du
•
•
ograniczenie przysz
ograniczenie przysz
ł
ł
ych opcji leczenia
ych opcji leczenia
•
•
transmisja szczep
transmisja szczep
ó
ó
w lekoopornych
w lekoopornych
HBV
HBV
Fung et al. Antivir Ther 2004; 9:1013–26
Charakterystyka lek
Charakterystyka lek
ó
ó
w I rzutu
w I rzutu
•
•
silna i trwa
silna i trwa
ł
ł
a odpowied
a odpowied
ź
ź
przeciwwirusowa
przeciwwirusowa
•
•
biochemiczna, serologiczna i histologiczna poprawa
biochemiczna, serologiczna i histologiczna poprawa
•
•
skuteczno
skuteczno
ść
ść
wobec ca
wobec ca
ł
ł
ej populacji HBV
ej populacji HBV
•
•
brak lekooporno
brak lekooporno
ś
ś
ci
ci
•
•
bezpiecze
bezpiecze
ń
ń
stwo
stwo
•
•
wygoda
wygoda
•
•
cena
cena
IFN 1992 LAM 1998 ADV 2002 ETV 2005
IFN 1992 LAM 1998 ADV 2002 ETV 2005
LdT
LdT
2007
2007

•
•
d
d
ł
ł
ugie leczenie
ugie leczenie
•
•
lekooporno
lekooporno
ść
ść
•
•
wysokie koszty przy d
wysokie koszty przy d
ł
ł
ugiej
ugiej
terapii
terapii
•
•
dzia
dzia
ł
ł
ania niepo
ania niepo
żą
żą
dane
dane
•
•
i
i
n
n
i
i
e
e
kcje
kcje
•
•
wy
wy
ż
ż
sze koszty
sze koszty
•
•
s
s
ł
ł
aba
aba
supresja
supresja
wiremii
wiremii
•
•
przeciwwskazany
przeciwwskazany
w niewydolno
w niewydolno
ś
ś
ci w
ci w
ą
ą
troby
troby
wady
wady
•
•
silne hamowanie wiremii
silne hamowanie wiremii
•
•
dobra tolerancja
dobra tolerancja
•
•
doustne
doustne
•
•
ni
ni
ż
ż
sze koszty
sze koszty
•
•
okre
okre
ś
ś
lony czas leczenia
lony czas leczenia
•
•
brak lekooporno
brak lekooporno
ś
ś
ci
ci
zalety
zalety
nukleoz(t)ydy
nukleoz(t)ydy
IFN
IFN
IFN czy pochodne
IFN czy pochodne
nukleoz(t)ydowe
nukleoz(t)ydowe
?
?

Proste dawkowanie i
Proste dawkowanie i
„
„
adherencja
adherencja
”
”
•
•
Proste dawkowanie
Proste dawkowanie
–
–
l
l
ami
ami
w
w
ud
ud
yna
yna
,
,
adefo
adefo
w
w
ir
ir
,
,
telbi
telbi
w
w
ud
ud
yna
yna
i
i
ente
ente
kawir
kawir
1 tab. na dob
1 tab. na dob
ę
ę
–
–
p
p
egyl
egyl
owany
owany
interferon:
interferon:
jedno wstrzykni
jedno wstrzykni
ę
ę
cie podsk
cie podsk
ó
ó
rne
rne
1 x na tydzie
1 x na tydzie
ń
ń
•
•
Tolerancja i prosta droga podania maj
Tolerancja i prosta droga podania maj
ą
ą
zasadnicze
zasadnicze
znaczenie dla
znaczenie dla
„
„
adherencji
adherencji
”
”
•
•
„
„
Adherencja
Adherencja
”
”
–
–
wp
wp
ł
ł
ywa na skuteczno
ywa na skuteczno
ść
ść
leczenia
leczenia
–
–
zmniejsza ryzyko lekooporno
zmniejsza ryzyko lekooporno
ś
ś
ci
ci
Locarnini S, et al. Antiviral Therapy. 2004;9:679-93.
Zeffix SPC, Hepsera SPC, Baraclude SPC, Pegasys SPC (available at
http://www.emea.eu.int/htms/human/epar/a.htm)
Tyzeka US PI, (available at http://www.accessdata.fda.gov/scripts/cder/drugsatfda/index.cfm)

Interferon (1)
Interferon (1)
TYPY
TYPY
•
•
interferon alfa
interferon alfa
–
–
monocyty, makrofagi, limfocyty
monocyty, makrofagi, limfocyty
–
–
leukocytarny
leukocytarny
(
(
Le
Le
-
-
IFN
IFN
αααα
αααα
)
)
–
–
limfoblastoidalny
limfoblastoidalny
(
(
Ly
Ly
-
-
IFN
IFN
αααα
αααα
)
)
•
•
interferon beta
interferon beta
–
–
fibroblasty
fibroblasty
•
•
interferon gamma
interferon gamma
–
–
limfocyty T
limfocyty T
•
•
interferon omega
interferon omega
przeciwwirusowe,
przeciwwirusowe,
immunomodulacyjne
immunomodulacyjne
i
i
antyproliferacyjne
antyproliferacyjne

PEGYLOWANE CZ
PEGYLOWANE CZ
Ą
Ą
STECZKI
STECZKI
•
•
wyd
wyd
ł
ł
u
u
ż
ż
ony okres p
ony okres p
ó
ó
ł
ł
trwania w surowicy
trwania w surowicy
•
•
oboj
oboj
ę
ę
tne chemicznie
tne chemicznie
•
•
rozpuszczalne w wodzie
rozpuszczalne w wodzie
•
•
nietoksyczne
nietoksyczne
•
•
wielko
wielko
ść
ść
zale
zale
ż
ż
y od ilo
y od ilo
ś
ś
ci przy
ci przy
łą
łą
czonych grup
czonych grup
oksyetylenowych
oksyetylenowych
O
CH
3
-
(OCH
2
CH
2
)
n
-
O
-
C
-
N protein
H
m
Interferon (2)
Interferon (2)

Mechanizmy dzia
Mechanizmy dzia
ł
ł
ania
ania
przeciwwirusowego
przeciwwirusowego
i
i
immunomodulacyjnego
immunomodulacyjnego
IFN
IFN
•
•
replikacja RNA
replikacja RNA
•
•
translacja i degradacja mRNA
translacja i degradacja mRNA
•
•
synteza i elongacja bia
synteza i elongacja bia
ł
ł
ek
ek
•
•
dojrzewanie wirion
dojrzewanie wirion
ó
ó
w
w
•
•
dojrzewanie i proliferacja kom
dojrzewanie i proliferacja kom
ó
ó
rek
rek
efektorowych
efektorowych
typu NK
typu NK
i makrofag
i makrofag
ó
ó
w oraz cytotoksycznych T
w oraz cytotoksycznych T
•
•
synteza dope
synteza dope
ł
ł
niacza
niacza
•
•
proliferacja i dojrzewanie kom
proliferacja i dojrzewanie kom
ó
ó
rek linii B
rek linii B
•
•
ekspresja antygen
ekspresja antygen
ó
ó
w zgodno
w zgodno
ś
ś
ci tkankowej klasy I i II
ci tkankowej klasy I i II
Interferon (3)
Interferon (3)

Lamiwudyna
Lamiwudyna
(1)
(1)
•
jest inhibitorem odwrotnej transkryptazy -
metabolizowana w komórce do trifosforanu lamiwudyny
lek powszechnie stosowany, skuteczny, bezpieczny i łatwy
w przyjmowaniu
•
już po roku jej stosowania lekooporność dotyczy 17% a po
4-5 latach wzrasta do 70%
•
u jej podłoża leży mutacja w motywie YMDD polimerazy
DNA
•
po dodaniu do niej adefowiru odzyskuje się efekt
terapeutyczny u zakażonych szczepami
lamiwudynoopornymi
Lamiwudyna
Lamiwudyna
(2)
(2)
Hadziyannis S, et al. Hepatology 2005; 42 (suppl 1):754A (Abstract LB14)
S
k
u
m
u
lo
w
a
n
a
c
zę
st
o
ś
ć
le
k
o
o
p
o
rn
o
ś
ci
n
a
L
A
M
(%
)
Czas leczenia (lata)
65
23
46
55
71
0
10
20
30
40
50
60
70
80
90
100
1
2
3
4
5
Lekooporno
Lekooporno
ść
ść

Telbiwudyna
Telbiwudyna
(1)
(1)
-
-
charakterystyka
charakterystyka
•
•
Telbiwudyna
Telbiwudyna
(
(
Ldt
Ldt
)
)
jest nukleozydowym analogiem
jest nukleozydowym analogiem
tymidyny, inhibitorem replikacji HBV
tymidyny, inhibitorem replikacji HBV
•
•
W
W
ł
ł
asno
asno
ś
ś
ci
ci
–
– skuteczny przeciwko szczepom dzikim
skuteczny przeciwko szczepom dzikim
–
– hamuje polimeraz
hamuje polimeraz
ę
ę
HBV
HBV
-
-
DNA
DNA
–
– po fosforylacji bardziej skuteczny ni
po fosforylacji bardziej skuteczny ni
ż
ż
tradycyjne
tradycyjne
nukleozydy
nukleozydy
•
•
Dawkowanie 600mg/doba
Dawkowanie 600mg/doba

Telbiwudyna
Telbiwudyna
(2)
(2)
Phase
Phase
IIb
IIb
Efficacy
Efficacy
Results
Results
at
at
52
52
Weeks
Weeks
15%
15%
22%
22%
31%
31%
HBeAg seroconversion
HBeAg seroconversion
17%
17%
28%
28%
33%
33%
HBeAg
HBeAg
loss
loss
78%
78%
63%
63%
86%
86%
ALT
ALT
normalization
normalization
49%
49%
32%
32%
61%
61%
Undetectable
Undetectable
HBV DNA by
HBV DNA by
PCR
PCR
5,99
5,99
4,57
4,57
6,01
6,01
Mean
Mean
HBV DNA
HBV DNA
↓↓↓↓
↓↓↓↓
(log
(log
10
10
copies/m
copies/m
L)
L)
41
41
19
19
44
44
n
n
Lamivudine
Lamivudine
+
+
Telbivudine
Telbivudine
Lamivudine
Lamivudine
Telbivudine
Telbivudine
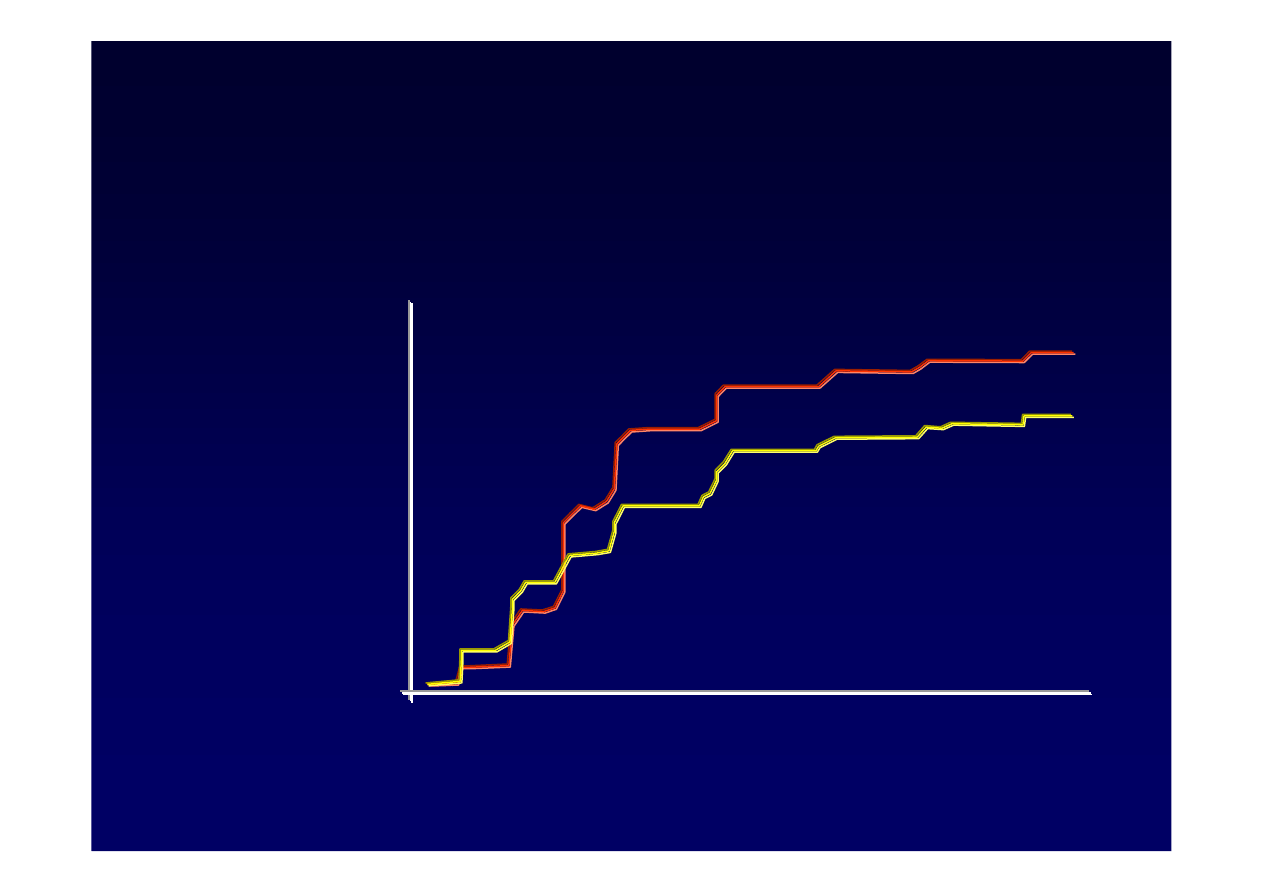
Telbiwudyna
Telbiwudyna
(3)
(3)
Serum HBV DNA:
Serum HBV DNA:
time
time
to PCR
to PCR
nondetectability
nondetectability
in
in
HBeAg
HBeAg
-
-
negative
negative
patients
patients
Weeks
Weeks
Serum HBV DNA
Serum HBV DNA
Maintained
Maintained
PCR
PCR
Nondetectable
Nondetectable
Payients
Payients
%
%
100
100
80
80
60
60
40
40
20
20
0
0
0
0
4
4
8
8
12
12
16
16
24
24
32
32
40
40
48
48
52
52
p < 0,01
p < 0,01
versus
versus
lamivudine
lamivudine
Lamivudine
Lamivudine
Telbivudine
Telbivudine
88%
88%
71%
71%

Adefowir
Adefowir
(1)
(1)
•
•
Dipiwoksyl
Dipiwoksyl
adefowiru
adefowiru
→
→
→
→
→
→
→
→
analog
analog
monofosforanu
monofosforanu
deoksyadenozyny
deoksyadenozyny
(posta
(posta
ć
ć
czynna)
czynna)
→
→
→
→
→
→
→
→
difosforan
difosforan
(
(
wewnatrzkom
wewnatrzkom
ó
ó
rkowa
rkowa
fosforylacja)
fosforylacja)
•
•
inhibitor odwrotnej transkryptazy DNA HBV
inhibitor odwrotnej transkryptazy DNA HBV
(HBV, HIV,
(HBV, HIV,
Herpes
Herpes
)
)
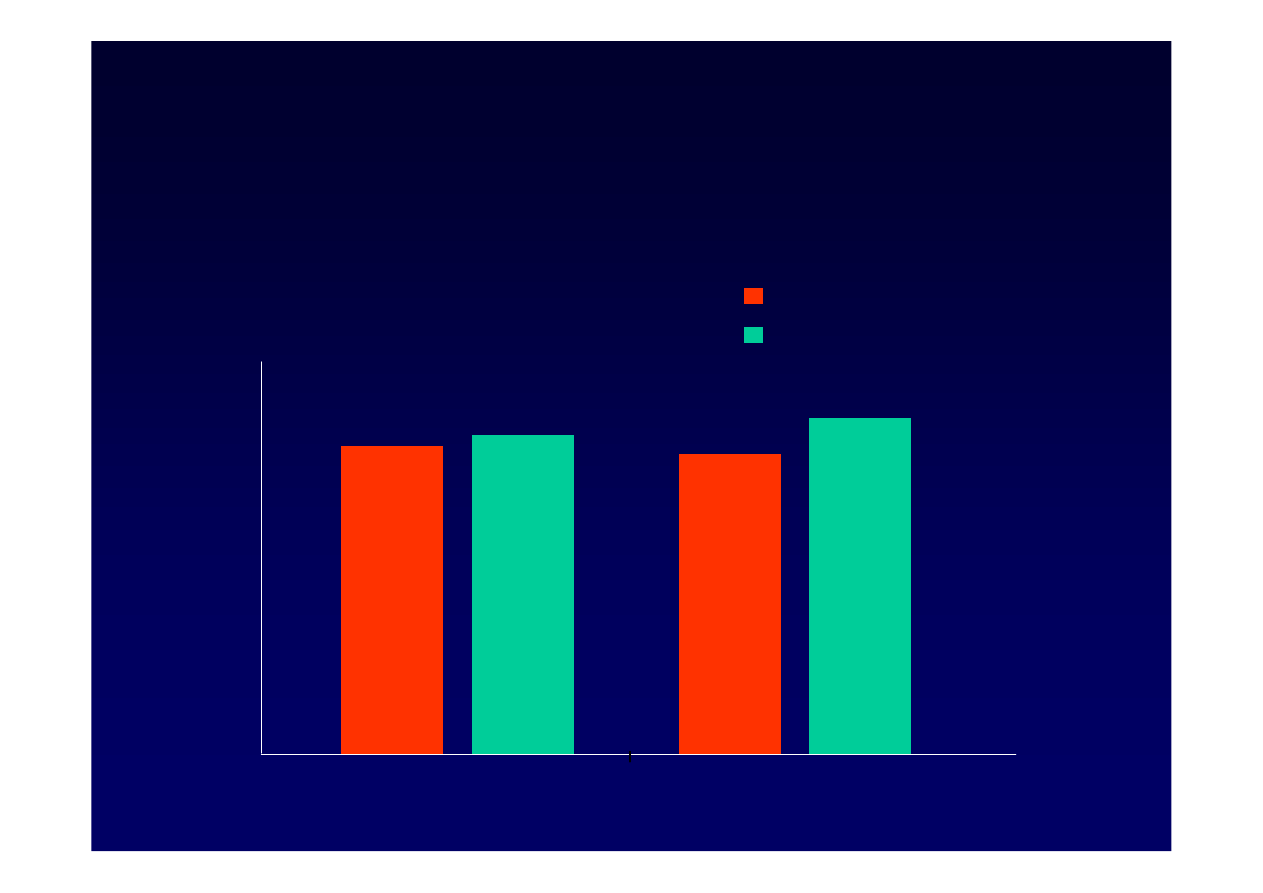
Hadziyannis
Hadziyannis
S. EASL 2006
S. EASL 2006
79%
79%
82%
82%
77%
77%
86%
86%
4 lata
4 lata
5 lat
5 lat
0
0
100
100
80
80
60
60
40
40
20
20
%
p
a
c
je
n
t
%
p
a
c
je
n
t
ó
ó
w
w
HBV DNA < 1.000 kopii/ml
HBV DNA < 1.000 kopii/ml
normalizacja AlAT
normalizacja AlAT
Hepsera
Hepsera
–
–
4/5 lat HBeAg(
4/5 lat HBeAg(
-
-
)
)
(odpowied
(odpowied
ź
ź
wirusologiczna i biochemiczna)
wirusologiczna i biochemiczna)
Adefowir
Adefowir
(2)
(2)
Adefowir
Adefowir
(3)
(3)
0
0
50
50
40
40
30
30
20
20
10
10
%
s
k
u
m
u
lo
w
a
n
e
%
s
k
u
m
u
lo
w
a
n
e
p
ra
w
d
o
p
o
d
o
b
ie
p
ra
w
d
o
p
o
d
o
b
ie
ń
ń
s
tw
o
s
tw
o
1
1
2
2
3
3
4
4
5
5
lata
lata
0%
0%
3%
3%
11%
11%
18%
18%
29%
29%
Hadziyannis
Hadziyannis
S. EASL 2006
S. EASL 2006
Hepsera
Hepsera
–
–
5 lat HBeAg(
5 lat HBeAg(
-
-
)
)
skumulowane prawdopodobie
skumulowane prawdopodobie
ń
ń
stwo oporno
stwo oporno
ś
ś
ci
ci
rtN236T lub rtA181V
rtN236T lub rtA181V

Entekawir
Entekawir
•
•
Ente
Ente
k
k
a
a
w
w
ir
ir
(ETV)
(ETV)
jest nukleozydowym analogiem
jest nukleozydowym analogiem
dezoksyguaniny
dezoksyguaniny
, inhibitorem replikacji HBV
, inhibitorem replikacji HBV
W
W
ł
ł
asno
asno
ś
ś
ci
ci
•
•
skuteczny przeciwko szczepom dzikim i opornym na LAM
skuteczny przeciwko szczepom dzikim i opornym na LAM
•
•
hamuje polimeraz
hamuje polimeraz
ę
ę
HBV
HBV
-
-
DNA
DNA
•
•
po fosforylacji bardziej skuteczny ni
po fosforylacji bardziej skuteczny ni
ż
ż
tradycyjne
tradycyjne
nukleozydy
nukleozydy
Dawkowanie
Dawkowanie
•
•
HBeAg(
HBeAg(
-
-
)
)
0.5 mg/d
0.5 mg/d
ziennie
ziennie
ETV
ETV
•
•
HBeAg(+)
HBeAg(+)
0.5 mg/d
0.5 mg/d
ziennie
ziennie
ETV
ETV
•
•
HBeAg(+)
HBeAg(+)
oporne na LAM
oporne na LAM
1 mg/d
1 mg/d
ziennie
ziennie
ETV
ETV

Ente
Ente
k
k
a
a
w
w
ir
ir
lub
lub
lamiwudyna
lamiwudyna
u
u
HBeAg(
HBeAg(
-
-
)
)
•
•
ETV
ETV
-
-
027
027
–
– wieloo
wieloo
ś
ś
rodkowe, podw
rodkowe, podw
ó
ó
jnie
jnie
ś
ś
lepe badanie fazy III
lepe badanie fazy III
•
•
638
638
HBeAg(
HBeAg(
-
-
)
)
nie leczeni
nie leczeni
–
– ETV
ETV
0.5 mg/d
0.5 mg/d
ziennie
ziennie
-
-
LAM
LAM
100 mg/d
100 mg/d
ziennie
ziennie
NS
NS
81
81
86
86
A
A
lA
lA
T
T
-
-
n
n
, %
, %
.014
.014
61
61
(n = 287)
(n = 287)
70
70
(n = 296)
(n = 296)
poprawa histologiczna
poprawa histologiczna
, %
, %
NS
NS
38
38
(n = 287)
(n = 287)
36
36
(n = 296)
(n = 296)
w
w
ł
ł
ó
ó
knienie wg
knienie wg
Ishak
Ishak
, %
, %
< .0001
< .0001
70
70
89
89
HBV
HBV
-
-
DNA < 200
DNA < 200
k
k
/
/
mL
mL
, %
, %
< .0001
< .0001
73
73
91
91
HBV
HBV
-
-
DNA < 400
DNA < 400
k
k
/
/
mL
mL
, %
, %
p
p
LAM
LAM
(n = 313)
(n = 313)
ETV
ETV
(n = 325)
(n = 325)
48
48
tygodni
tygodni
Shouval D, et al. AASLD 2004. Abstract LB-07

p
p
LAM
LAM
(n = 3
(n = 3
55
55
)
)
ETV
ETV
(n = 35
(n = 35
4
4
)
)
48
48
tygodni
tygodni
NS
NS
18
18
21
21
serokonwersja
serokonwersja
HBeAg, %
HBeAg, %
< .0001
< .0001
38
38
69
69
HBV
HBV
-
-
DNA < 400
DNA < 400
k
k
/
/
mL
mL
, %
, %
< .0001
< .0001
65
65
91
91
HBV
HBV
-
-
DNA < 0.7
DNA < 0.7
mEq/mL
mEq/mL
, %
, %
< .0001
< .0001
-
-
5.46
5.46
-
-
6.98
6.98
HBV
HBV
-
-
DNA, log
DNA, log
10
10
k
k
/
/
mL
mL
(mediana)
(mediana)
.0085
.0085
62
62
72
72
poprawa histologiczna
poprawa histologiczna
, %
, %
Chang T, et al. AASLD 2004. Abstract 70
Ente
Ente
k
k
a
a
w
w
ir
ir
lub
lub
lamiwudyna
lamiwudyna
u
u
HBeAg(
HBeAg(
+
+
)
)
•
•
ETV
ETV
-
-
022 (
022 (
BEHoLD
BEHoLD
Study Group)
Study Group)
–
– wieloo
wieloo
ś
ś
rodkowe, podw
rodkowe, podw
ó
ó
jnie
jnie
ś
ś
lepe badanie fazy III
lepe badanie fazy III
•
•
709
709
HBeAg(+)
HBeAg(+)
–
– ETV
ETV
0.5 mg/d
0.5 mg/d
ziennie
ziennie
-
-
LAM
LAM
100 mg/d
100 mg/d
ziennie
ziennie

Entekawir
Entekawir
lub
lub
lamiwudyna
lamiwudyna
u LAM
u LAM
-
-
opornych,
opornych,
HBeAg(+)
HBeAg(+)
•
•
ETV
ETV
-
-
026
026
–
– wieloo
wieloo
ś
ś
rodkowe, podw
rodkowe, podw
ó
ó
jnie
jnie
ś
ś
lepe badanie fazy III
lepe badanie fazy III
•
•
286
286
LAM
LAM
-
-
opornych
opornych
HBeAg(+)
HBeAg(+)
–
– ETR
ETR
1 mg/
1 mg/
dziennie,
dziennie,
lami
lami
w
w
ud
ud
yna
yna
100 mg/d
100 mg/d
ziennie
ziennie
.06
.06
3
3
8
8
serokonwersja
serokonwersja
, %
, %
.028
.028
3
3
10
10
utrata
utrata
HBeAg, %
HBeAg, %
< .0001
< .0001
23
23
75
75
A
A
lA
lA
T
T
-
-
normalizacja
normalizacja
%
%
< .0001
< .0001
-
-
0.48
0.48
-
-
5.14
5.14
ś
ś
r
r
. zmiany
. zmiany
HBV
HBV
-
-
DNA, log
DNA, log
k
k
/
/
mL
mL
< .0001
< .0001
4
4
55
55
HBV
HBV
-
-
DNA(
DNA(
-
-
)
)
,
,
AlA
AlA
T
T
-
-
n
n
, %
, %
.0019
.0019
16
16
34
34
regresja w
regresja w
ł
ł
ó
ó
knienia,
knienia,
%
%
< .0001
< .0001
28
28
55
55
poprawa histologiczna
poprawa histologiczna
, %
, %
p
p
LAM
LAM
(n = 145)
(n = 145)
ETR
ETR
(n = 141)
(n = 141)
48
48
tygodni
tygodni
Sherman M, et al. AASLD 2004. Abstract 1152

Sero
Sero
k
k
on
on
wersja w uk
wersja w uk
ł
ł
adzie HBe
adzie HBe
(1)
(1)
Entecavir
Entecavir
Trial AI463022
Trial AI463022
(2)
(2)
Liaw
Liaw
et al, Gastroenterology 2000 Jul;119(1):172
et al, Gastroenterology 2000 Jul;119(1):172
-
-
180 Chang et al J Gastro
180 Chang et al J Gastro
Hepatol
Hepatol
2004 Nov;19(11):1276
2004 Nov;19(11):1276
-
-
82
82
(3)
(3)
Chang TT et al.
Chang TT et al.
Hepatology
Hepatology
2004; 40(4,1):193A
2004; 40(4,1):193A
(4)
(4)
Lau et al,
Lau et al,
Hepatology
Hepatology
; Vol. 40, No. 4, Suppl.1, 2004: 171
; Vol. 40, No. 4, Suppl.1, 2004: 171
27
27
-
-
29%
29%
(2)
(2)
18%
18%
(1)
(1)
Lami
Lami
w
w
ud
ud
y
y
n
n
a
a
32
32
%
%
(4)
(4)
21%
21%
(3)
(3)
12%
12%
(3)
(3)
Serokonwersja
Serokonwersja
H
H
Be
Be
Ag
Ag
po
po
1
1
roku
roku
N/A
N/A
31%
31%
29%
29%
(3)
(3)
Serokonwersja
Serokonwersja
HBeAg
HBeAg
po
po
2
2
latach
latach
Pegylowany
Pegylowany
Interferon
Interferon
alfa
alfa
-
-
2a
2a
Ente
Ente
k
k
a
a
w
w
ir
ir
Adefo
Adefo
w
w
ir
ir
+
+
n: % a (
n: % a (
48
48
tyg.leczenia
tyg.leczenia
+24
+24
tyg.follow
tyg.follow
up
up
);
);

(1)
(1)
Chang TT et al.
Chang TT et al.
Hepatology
Hepatology
2004; 40(4,1):193A;
2004; 40(4,1):193A;
Shouval
Shouval
D et al.
D et al.
Hepatology
Hepatology
2004; 40(4,1):728A
2004; 40(4,1):728A
Histologic
Histologic
improvement
improvement
defined as
defined as
>
>
2 point decrease in
2 point decrease in
Knodell
Knodell
Necroinflammation
Necroinflammation
Score from baseline with no worsening of the
Score from baseline with no worsening of the
Knodell
Knodell
Fibrosis
Fibrosis
score.
score.
(2)
(2)
Marcellin
Marcellin
et al. 2003. New
et al. 2003. New
Engl
Engl
J Med; 348:808
J Med; 348:808
-
-
16;
16;
Hadziyannis
Hadziyannis
et al; NEJM 2003; 348; 800
et al; NEJM 2003; 348; 800
-
-
807.
807.
Histologic
Histologic
improvement
improvement
defined as
defined as
>
>
2 point decrease in
2 point decrease in
Knodell
Knodell
Necroinflammation
Necroinflammation
Score from baseline with no worsening of
Score from baseline with no worsening of
Knodell
Knodell
Fibrosis score.
Fibrosis score.
(3)
(3)
Lau G et al.
Lau G et al.
Hepatology
Hepatology
2004; 40(4,1):171A;
2004; 40(4,1):171A;
Marcellin
Marcellin
P et al. N
P et al. N
Engl
Engl
J Med 2004; 351:1206
J Med 2004; 351:1206
-
-
1217
1217
Pacjenci
Pacjenci
HBeAg
HBeAg
-
-
Pacjenci
Pacjenci
HBeAg+
HBeAg+
61%
61%
(1)
(1)
62%
62%
(1)
(1)
Lami
Lami
w
w
ud
ud
y
y
n
n
a
a
49%
49%
(3)+
(3)+
72%
72%
(1)
(1)
53%
53%
(2)
(2)
Poprawa histologiczna
Poprawa histologiczna
po 1 roku
po 1 roku
59%
59%
(3)+
(3)+
70%
70%
(1)
(1)
64%
64%
(2)
(2)
Pegylowany
Pegylowany
interferon alfa
interferon alfa
-
-
2a
2a
Ente
Ente
k
k
a
a
w
w
ir
ir
Adefo
Adefo
w
w
ir
ir
+n: % (
+n: % (
48
48
tyg. leczenia
tyg. leczenia
+24
+24
tyg. .
tyg. .
follow
follow
-
-
up
up
);
);
Regresja zmian morfologicznych
Regresja zmian morfologicznych
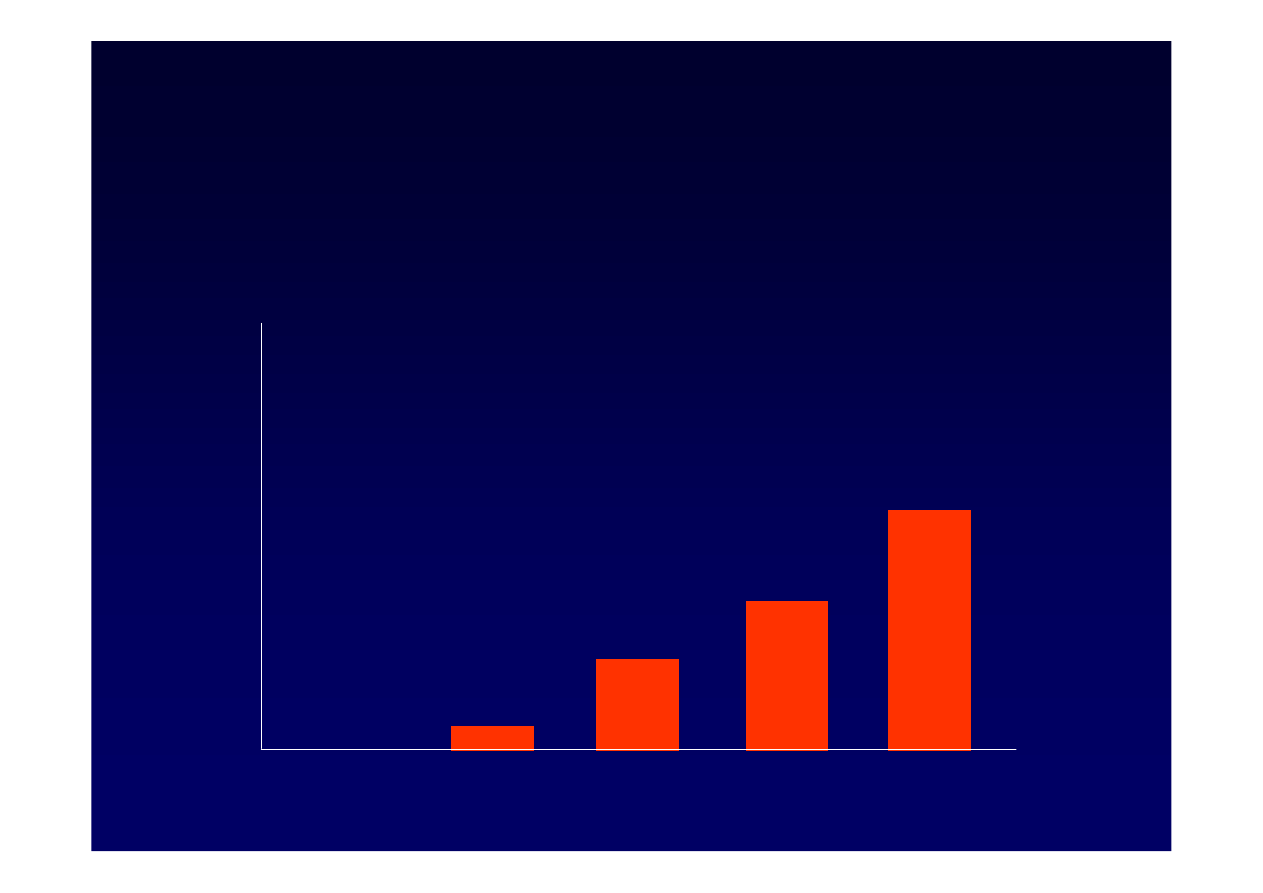
40
39
29
40
48
67
80
60
56
25
0
20
40
60
80
100
Leczenie a
Leczenie a
supresja
supresja
wiremii HBV u nie leczonych,
wiremii HBV u nie leczonych,
HBeAg(+)
HBeAg(+)
1. Lai CL, et al. Hepatology. 2006;44(4, suppl 1):222A (91); 2. Marcellin P, et al. J Hepatol. 2005;42:31-2 (73);
3. Chang TT, et al. N Eng J Med. 2006; 354:1001-10. 4. Gish R, et al. Hepatology. 2005; 42(S1):267-8A (181);
5. Lau GKK, et al. N Eng J Med. 2005; 352:2682-95;
1
1
2
2
1
1
3
3
2
2
Telbi
Telbi
wudyna
wudyna
1
1
PCR
PCR
ujemne
ujemne
Lami
Lami
w
w
ud
ud
yna
yna
1
1
<
<
300
300
kopii
kopii
/
/
mL
mL
Adefo
Adefo
w
w
ir
ir
2
2
<
<
1000
1000
kopii
kopii
/
/
mL
mL
Ente
Ente
kawir
kawir
3
3
-
-
4
4
<
<
300
300
kopii
kopii
/
/
mL
mL
D
D
ł
ł
ugo
ugo
ść
ść
leczenia
leczenia
(
(
lata
lata
)
)
1
1
2*
2*
1
1
2
2
Peg
Peg
-
-
IFN
IFN
5
5
<
<
400
400
kopii
kopii
/
/
mL
mL
1
1
*
*
dane skumulowane
dane skumulowane
Badania zebrane
Badania zebrane
P
a
c
je
n
c
i
z
P
a
c
je
n
c
i
z
n
ie
o
z
n
a
c
z
a
ln
y
m
n
ie
o
z
n
a
c
z
a
ln
y
m
H
B
V
D
N
A
(
%
)
H
B
V
D
N
A
(
%
)
Kryteria wł
ą
czenia: HBV DNA >10
8
kopii/mL
N=69
E
E
nte
nte
kawir
kawir
i
i
adefo
adefo
w
w
ir
ir
-
-
wczesna
wczesna
supresja
supresja
wiremii
wiremii
<300
300–<10
3
10
3
–<10
4
10
4
–<10
5
≥
10
5
ETV
12 tydz.
H
B
V
D
N
A
(
k
o
p
ii
/m
L
)
ETV
24 tydz.
ADV
12 tydz.
ADV
24 tydz.
45%
21%
24%
0%
13%
19%
19%
50%
66%
3%
9%
13%
12%
15%
24%
30%
18%
3%
6%
9%
Leung N, et al. 57th Annual AASLD meeting, October 27–31, 2006, Boston, Poster 982. Hepatology. 2006; 44(S1): 554A
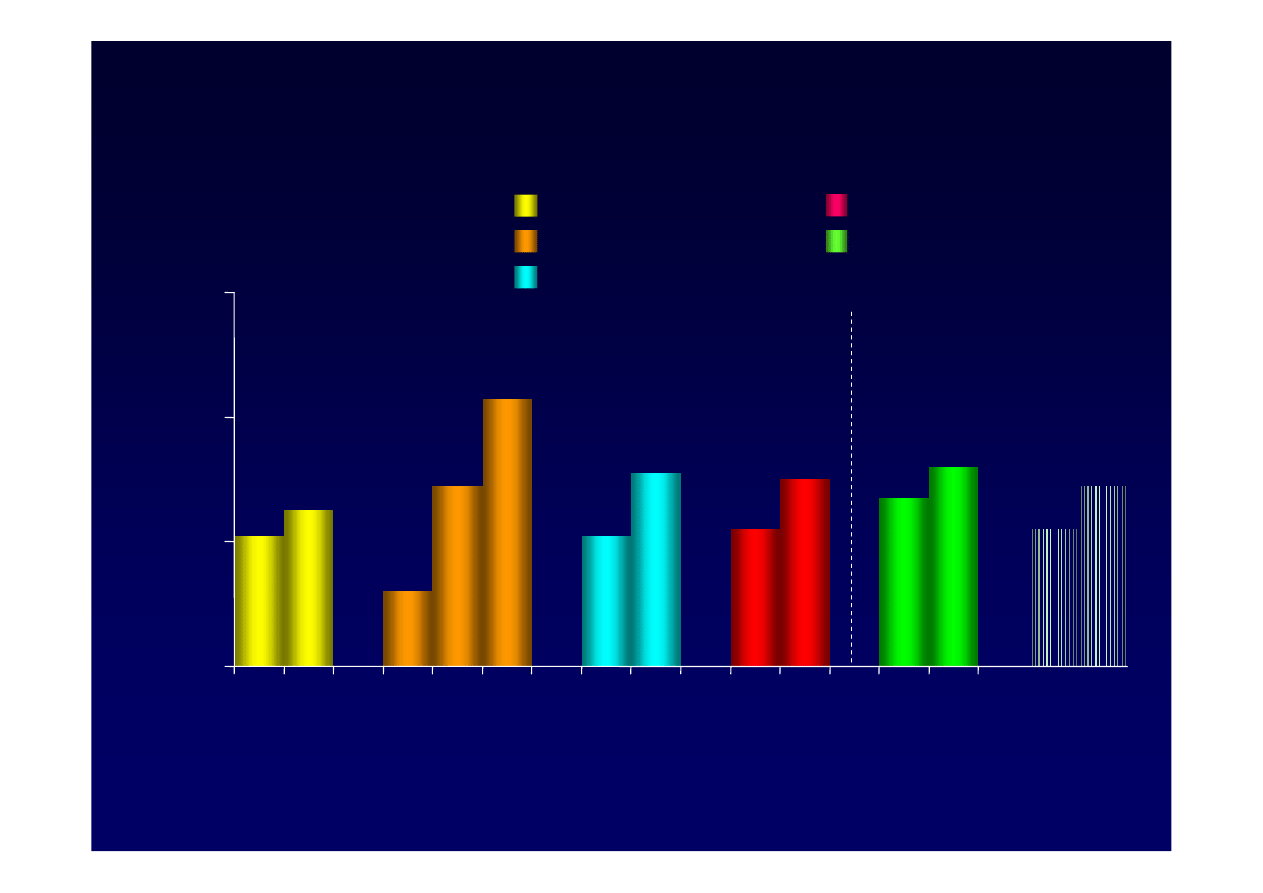
21
25
12
29
43
21
31
22
30
27
32
0
20
40
60
Zebrane badania
Zebrane badania
Telbi
Telbi
wudyna
wudyna
1
1
1
1
†
†
3
3
†
†
2
2
†
†
Lami
Lami
w
w
ud
ud
yna
yna
1
1
Adefo
Adefo
w
w
ir
ir
2
2
Ente
Ente
kawir
kawir
3
3
–
–
4
4
S
e
ro
k
o
n
w
e
rs
ja
S
e
ro
k
o
n
w
e
rs
ja
H
B
e
A
g
(
%
)
H
B
e
A
g
(
%
)
D
D
ł
ł
ugo
ugo
ść
ść
leczenia
leczenia
(
(
lata
lata
)
)
Cz
Cz
ę
ę
sto
sto
ść
ść
serokonwersji
serokonwersji
HBeAg
HBeAg
1
1
2
2
1
1
2*
2*
1
1
2
2
Peg
Peg
-
-
IFN
IFN
5
5
1. Lai CL, et al. Hepatology. 2006; 44(4, suppl 1):222A (91); 2. Marcellin P, et al. J Hepatol. 2005; 40(S2):S31-2 (73);
3. Chang TT, et al. N Eng J Med. 2006; 354:1001-10; 4. Gish R, et al. Hepatology. 2005; 42(S1):267-8A (181);
5. Lau GKK, et al. N Eng J Med. 2005; 352:2682-95;
*
*
skumulowane
skumulowane
†
†
Analiza
Analiza
Kaplan
Kaplan
-
-
Meier
Meier
1
1
Follow
Follow
-
-
up
up
‡
‡
-
-
26 tyg.
26 tyg.
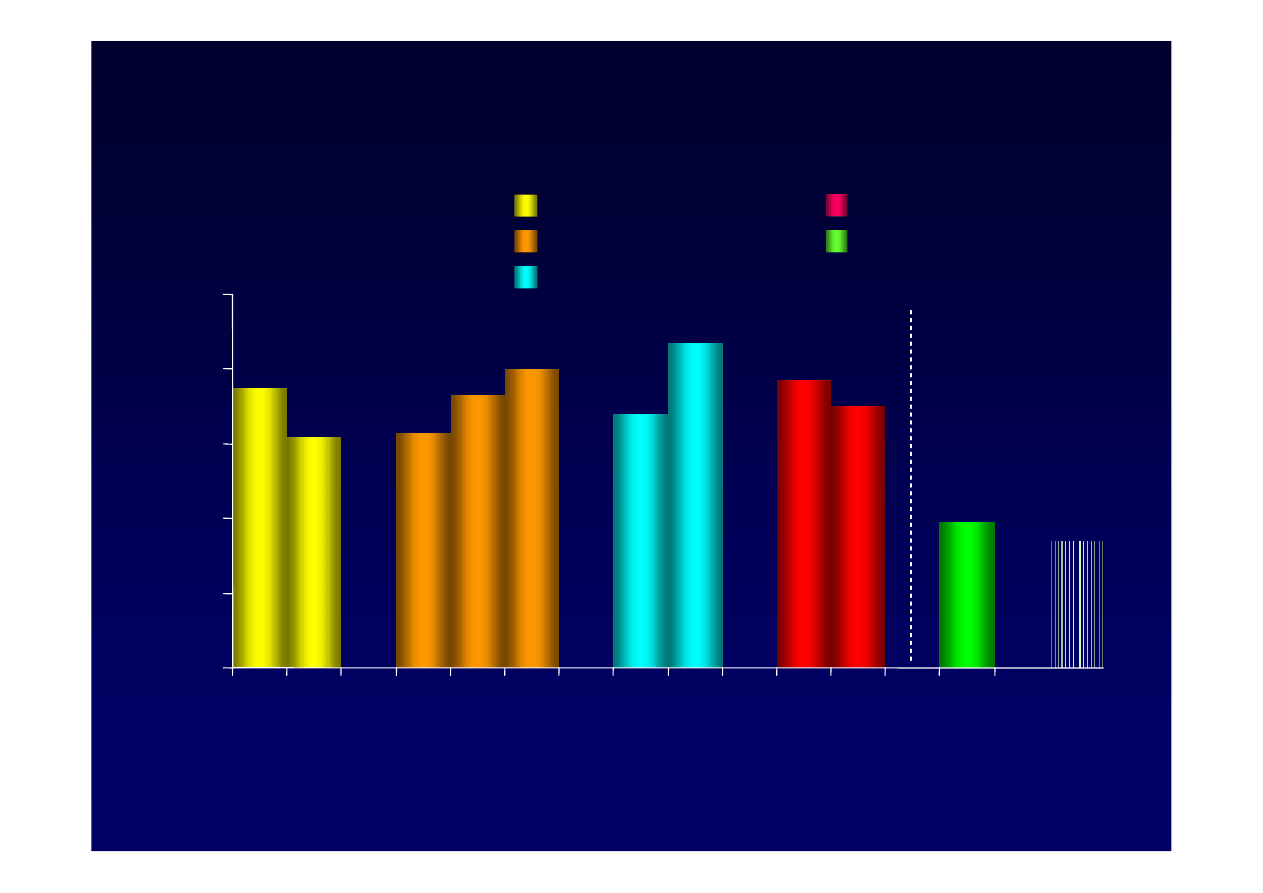
75
62
63
73
80
68
87
77
70
39
0
20
40
60
80
100
*
*
dane
dane
skumolowane
skumolowane
1. Lai CL, et al. Hepatology. 2006; 44(4, suppl 1):222A (91); 2. Marcellin P, et al. J Hepatol. 2005; 42:31-2 (73);
3. Chang TT, et al. N Eng J Med. 2006; 354:1001-10. 4. De Man R, et al. J Clin Virol. 2006; 36(Suppl 2):S89 (P.090);
5. Lau GKK, et al. N Eng J Med. 2005; 352:2682-95
Badania zebrane
Badania zebrane
1
1
2*
2*
1
1
2
2
1
1
2
2
1
1
3
3
2
2
N
o
rm
a
li
z
a
c
ja
N
o
rm
a
li
z
a
c
ja
A
A
l
l
A
A
T
(
%
)
T
(
%
)
D
D
ł
ł
ugo
ugo
ść
ść
leczenia
leczenia
(
(
lata
lata
)
)
Leczenie a AlAT u wcze
Leczenie a AlAT u wcze
ś
ś
niej nie leczonych,
niej nie leczonych,
HBeAg(+)
HBeAg(+)
1
1
Telbi
Telbi
wudyna
wudyna
1
1
Lami
Lami
w
w
ud
ud
yna
yna
1
1
Adefo
Adefo
w
w
ir
ir
2
2
Ente
Ente
kawir
kawir
3
3
–
–
4
4
Peg
Peg
-
-
IFN
IFN
5
5
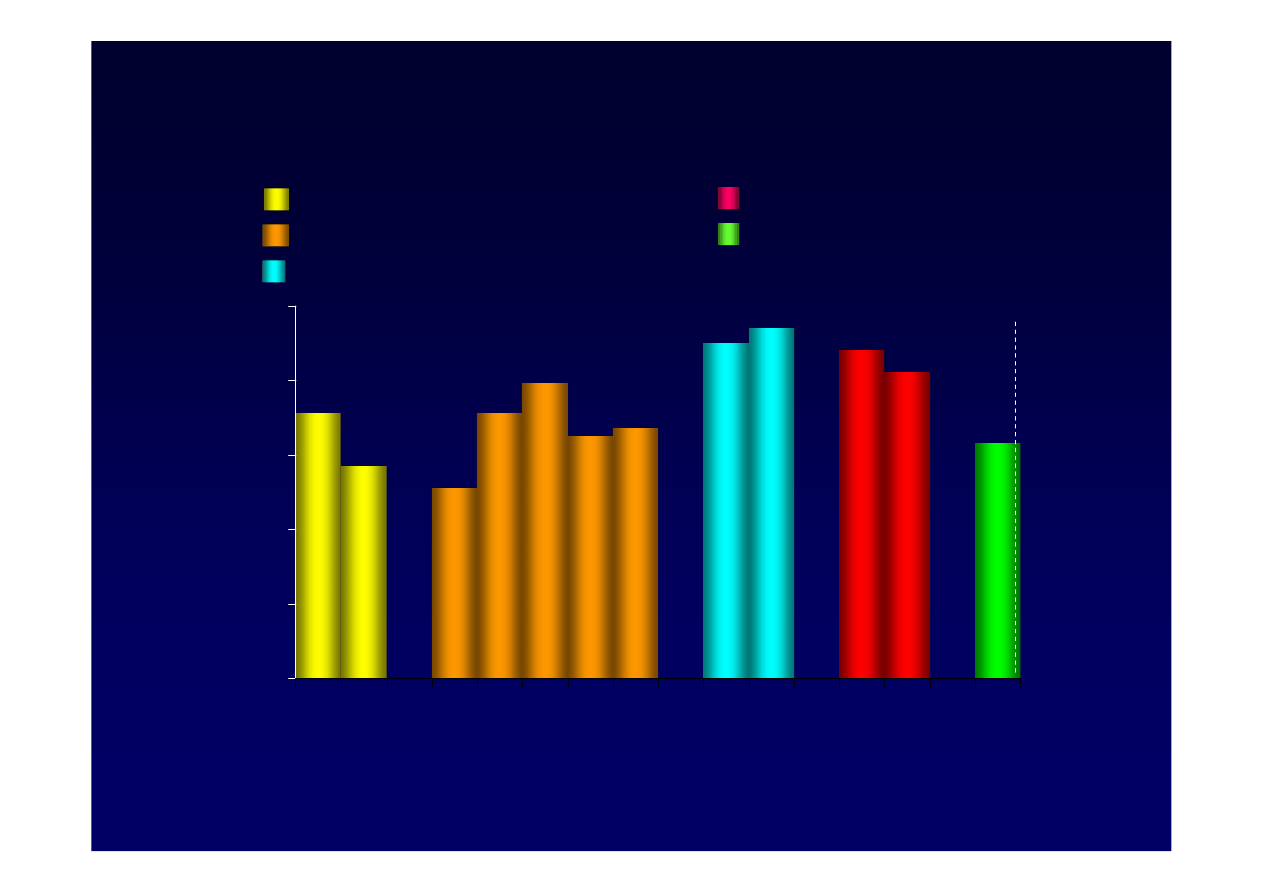
Leczenie a
Leczenie a
supresja
supresja
wiremii HBV u wcze
wiremii HBV u wcze
ś
ś
niej
niej
nie leczonych,
nie leczonych,
HBeAg(
HBeAg(
-
-
)
)
1. Lai CL, et al. Hepatology. 2006; 44(4, suppl 1):222A (91); 2. Hadziyannis SJ, et al. N Eng J Med. 2003; 348:800-7;
3. Hadziyannis SJ, et al. N Eng J Med. 2005; 352:2673-81; 4. Hadziyannis SJ, et al. Hepatology. 2005; 42 (s 1):754A (LB14);
5. Lai CL, et al. N Eng J Med. 2006; 354:1011-20; 6. Shouval D, et al. J Hepatol. 2006; 44(suppl 2):S21-2 (45);
7. Marcellin P, et al. N Eng J Med. 2004; 351:1206-17.
71
57
51
71
79
65 67
90
94
88
82
63
0
20
40
60
80
100
Duration of therapy (years)
Duration of therapy (years)
1
1
2
2
1
1
3
3
2
2
1
1
5
5
2*
2*
1
1
2
2
1
1
4
4
*Cumulative confirmed analysis
*Cumulative confirmed analysis
P
a
ti
e
n
ts
w
it
h
P
a
ti
e
n
ts
w
it
h
u
n
d
e
te
c
ta
b
le
H
B
V
D
N
A
(
%
)
u
n
d
e
te
c
ta
b
le
H
B
V
D
N
A
(
%
)
Collation of currently available data
Collation of currently available data
–
–
not from head
not from head
-
-
to
to
-
-
head studies
head studies
Telbi
Telbi
wudyna
wudyna
1
1
< 300 kopii/
< 300 kopii/
mL
mL
Lami
Lami
w
w
ud
ud
yna
yna
1
1
<
<
300
300
kopii
kopii
/
/
mL
mL
Adefo
Adefo
w
w
ir
ir
2
2
-
-
4
4
<
<
1000
1000
kopii
kopii
/
/
mL
mL
Ente
Ente
kawir
kawir
5,6
5,6
<
<
300
300
kopii
kopii
/
/
mL
mL
Peg
Peg
-
-
IFN
IFN
7
7
<
<
400
400
kopii
kopii
/
/
mL
mL
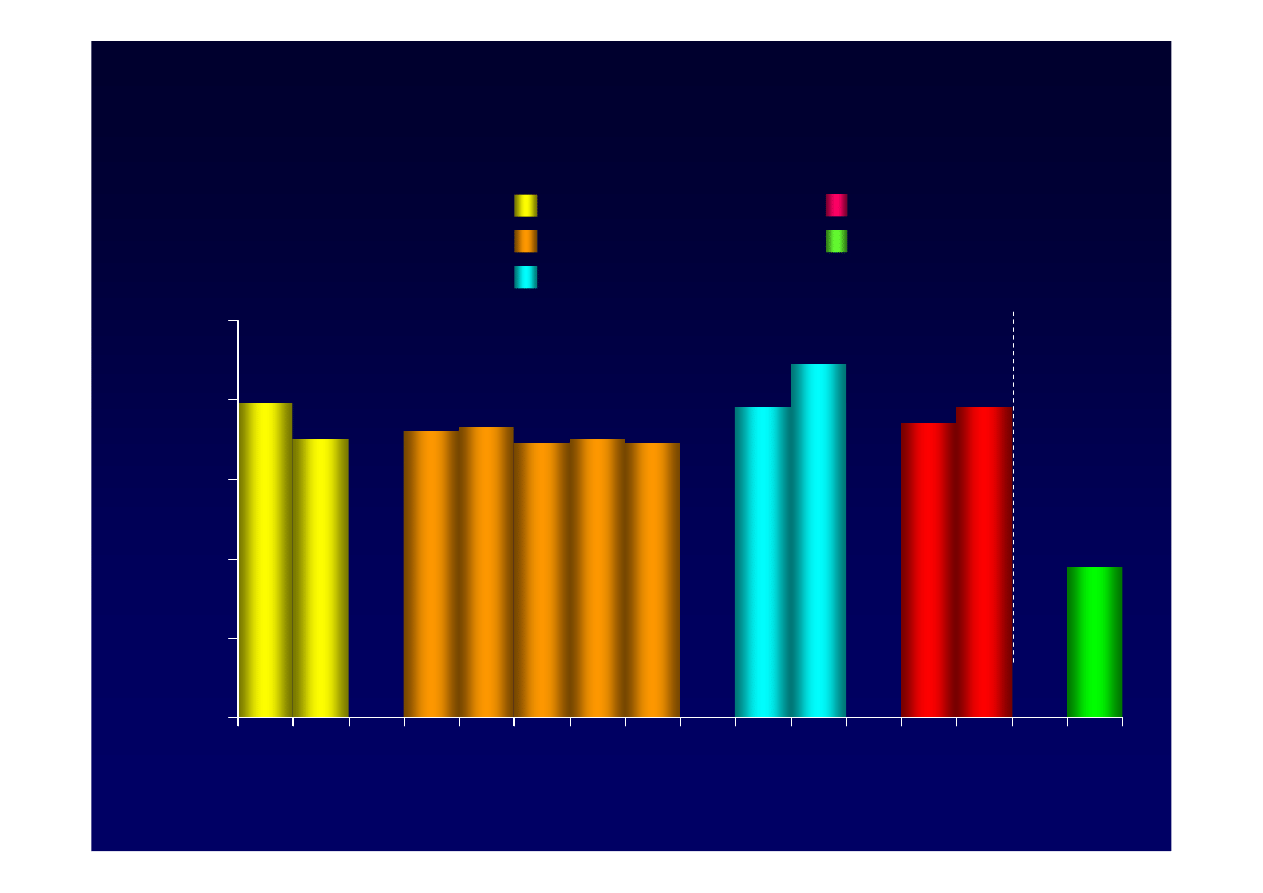
79
70
72
73
69
70
69
78
89
74
78
38
0
20
40
60
80
100
1
1
3
3
2
2
4
4
5
5
1
1
2
2
1
1
2*
2*
1
1
2
2
1. Lai CL, et al. Hepatology. 2006; 44(4, suppl 1):222A (91); 2. Hadziyannis SJ, et al. N Eng J Med. 2003; 348:800-7;
3. Hadziyannis SJ, et al. N Eng J Med. 2005; 352:2673-81; 4. Hadziyannis SJ, et al. Hepatology. 2005; 42(s 1):754A (LB14);
5. Lai CL, et al. N Eng J Med. 2006; 354:1011-20; 6. Shouval D, et al. J Hepatol. 2006; 44(suppl 2):S21-2 (45);
6. Marcellin P, et al. N Eng J Med. 2004; 351:1206-17.
Leczenie a AlAT u wcze
Leczenie a AlAT u wcze
ś
ś
niej nie leczonych,
niej nie leczonych,
HBeAg(
HBeAg(
-
-
)
)
*
*
dane skumulowane
dane skumulowane
N
o
rm
a
li
z
a
c
ja
N
o
rm
a
li
z
a
c
ja
A
A
l
l
A
A
T
(
%
)
T
(
%
)
D
D
ł
ł
ugo
ugo
ść
ść
leczenia
leczenia
(
(
lata
lata
)
)
1
1
Badania zebrane
Badania zebrane
Telbi
Telbi
wudyna
wudyna
1
1
Lami
Lami
w
w
ud
ud
yna
yna
1
1
Adefo
Adefo
w
w
ir
ir
2
2
-
-
4
4
Ente
Ente
kawir
kawir
5,6
5,6
Peg
Peg
-
-
IFN
IFN
6
6
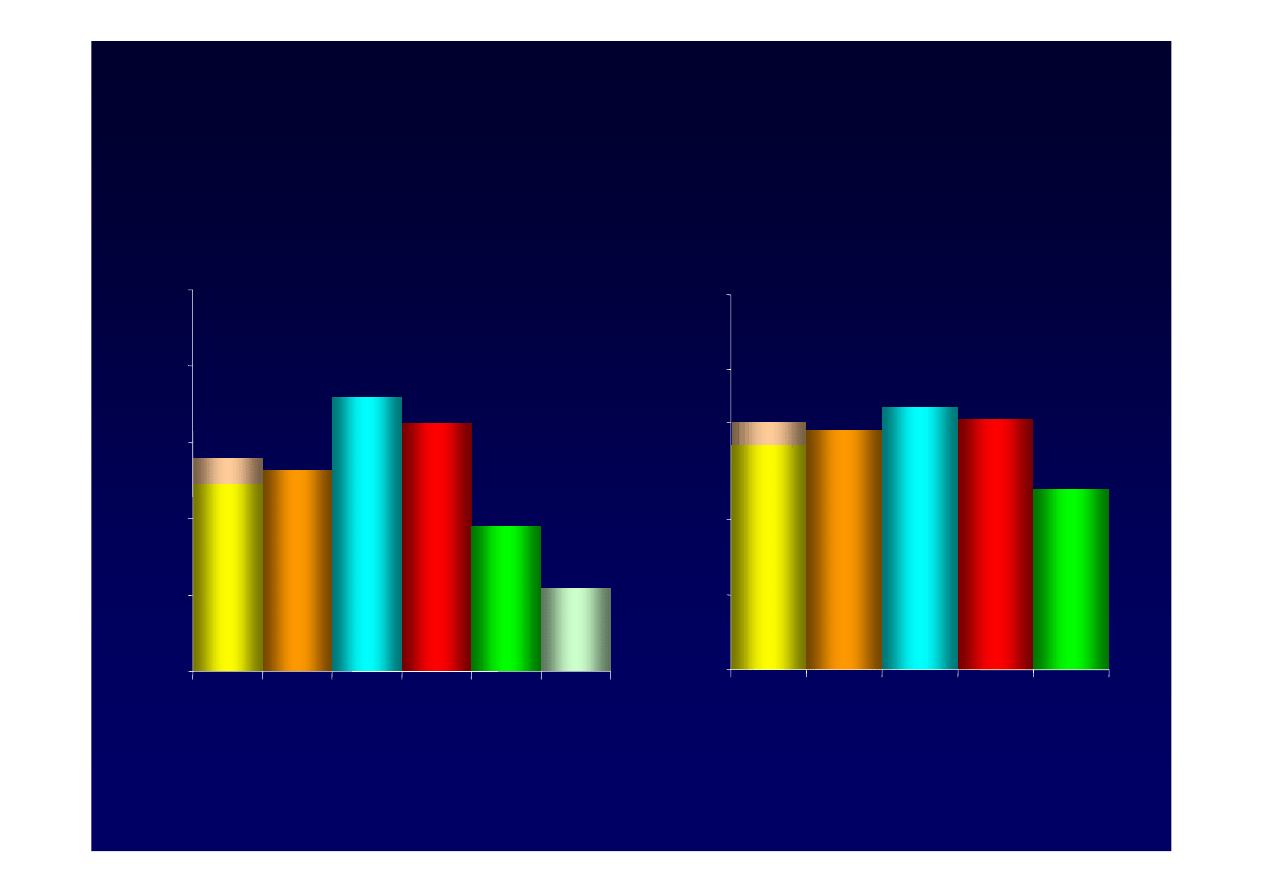
Leczenie a regresja morfologiczna
Leczenie a regresja morfologiczna
HBeAg
HBeAg
dodatni
dodatni
HBeAg
HBeAg
ujemni
ujemni
P
o
p
ra
w
a
h
is
to
lo
g
ii
P
o
p
ra
w
a
h
is
to
lo
g
ii
(%
)
(%
)
LAM
ADV
ETV LdT PegIFN*
* 48 tyg. leczenia, biopsja wykonana w 72 tyg.
LAM
ADV
ETV
LdT PegIFN*
0
20
40
60
80
100
70
67
48
64
60-66
0
20
40
60
80
100
P
o
p
ra
w
a
h
is
to
lo
g
ii
P
o
p
ra
w
a
h
is
to
lo
g
ii
(%
)
(%
)
1.
Lok ASF & McMahon BJ. Hepatology. 2007; 45:507–39;
2. Janssen H et al. Lancet. 2005; 365:123-9.
22
49-56
53
38
65
72
Peg IFN
alfa-2b
2

Podsumowanie
Podsumowanie
1.
1.
Entekawir
Entekawir
jest bezpiecznym i skutecznym w leczeniu
jest bezpiecznym i skutecznym w leczeniu
przewlek
przewlek
ł
ł
ego zapalenia w
ego zapalenia w
ą
ą
troby typu B:
troby typu B:
–
–
HBeAg(
HBeAg(
-
-
)
)
–
–
HBeAg(+)
HBeAg(+)
–
–
HBeAg(+)
HBeAg(+)
u LAM
u LAM
-
-
opornych
opornych
2.
2.
St
St
ęż
ęż
enie toksyczne 8.000 razy wy
enie toksyczne 8.000 razy wy
ż
ż
sze od dawki
sze od dawki
terapeutycznej.
terapeutycznej.
3.
3.
W do
W do
ś
ś
wiadczeniach na zwierz
wiadczeniach na zwierz
ę
ę
tach nie wykazano
tach nie wykazano
lekooporno
lekooporno
ś
ś
ci w ci
ci w ci
ą
ą
gu trzech lat leczenia.
gu trzech lat leczenia.
4.
4.
Potencja
Potencja
ł
ł
terapeutyczny 30 razy wi
terapeutyczny 30 razy wi
ę
ę
kszy od LAM.
kszy od LAM.

Leczenie
Leczenie
:
:
bezpiecze
bezpiecze
ń
ń
stwo i profil tolerancji
stwo i profil tolerancji
nie
nie
•
•
og
og
ó
ó
lnie dobra tolerancja
lnie dobra tolerancja
•
•
wzrost kreatyniny
wzrost kreatyniny
•
•
stopie
stopie
ń
ń
3/4
3/4
u
u
~9%
~9%
pacjent
pacjent
ó
ó
w
w
Telbi
Telbi
w
w
ud
ud
yn
yn
a
a
nie
nie
•
•
dobra tolerancja
dobra tolerancja
,
,
por
por
ó
ó
wnywalna
wnywalna
do lamiwudyny
do lamiwudyny
Ente
Ente
kawir
kawir
funkcja nerek co 12 tyg.
funkcja nerek co 12 tyg.
•
•
og
og
ó
ó
lnie dobra tolerancja
lnie dobra tolerancja
•
•
rzadko
rzadko
nefrotoksyczno
nefrotoksyczno
ść
ść
Adefo
Adefo
w
w
ir
ir
nie
nie
•
•
i
i
n general, well tolerated
n general, well tolerated
Lami
Lami
w
w
ud
ud
yn
yn
a
a
•
•
morfologia
morfologia
•
•
ocena w
ocena w
ą
ą
troby co
troby co
4 tyg.
4 tyg.
•
•
TSH
TSH
co 12 tygodni
co 12 tygodni
•
•
objawy grypopodobne
objawy grypopodobne
•
•
niestabilno
niestabilno
ść
ść
emocjonalna
emocjonalna
:
:
niepok
niepok
ó
ó
j
j
,
,
rozdra
rozdra
ż
ż
nienie
nienie
,
,
depres
depres
ja
ja
IFN
IFN
-
-
αααα
αααα
/
/
PEG
PEG
-
-
IFN
IFN
-
-
αααα
αααα
Wymagany dodatkowy
Wymagany dodatkowy
monitoring
monitoring
1
1
Bezpiecze
Bezpiecze
ń
ń
stwo
stwo
/
/
tolerancja
tolerancja
1
1
Standardowe testy
Standardowe testy
:
:
ocena w
ocena w
ą
ą
troby co 12 tyg.
troby co 12 tyg.
; HBV DNA
; HBV DNA
co 1
co 1
2
2
–
–
24
24
tygodnie
tygodnie
;
;
g
g
dy
dy
HBeAg
HBeAg
-
-
dodatnie
dodatnie
,
,
HBeAg/ant
HBeAg/ant
y
y
-
-
HBe
HBe
co
co
24
24
tyg
tyg
.
.
Lok ASF & McMahon BJ. Hepatology. 2007; 45:507-39; Hepsera SPC, Pegasys SPC (available at
http://www.emea.eu.int/htms/human/epar/a.htm
). Tyzeka US PI, (available at
http://www.accessdata.fda.gov/scripts/cder/drugsatfda/index.cfm)

Kwalifikacja do leczenia pzw B
Kwalifikacja do leczenia pzw B
Polska Grupa Ekspertów HBV 2006
HBV-DNA
< 20.000 IU/mL - HBeAg (+)
< 2.000 IU/mL - HBeAg (-)
> 20.000 IU/mL - HBeAg (+)
> 2.000 IU/mL - HBeAg (-)
AlAT
biopsja w
ą
troby
bez
zmian
zapalenie i/lub
włóknienie
+
podwy
ż
szone AlAT
LMV+ADV
PegIFN
αααα
-2a
ENT
podwy
ż
szona
prawidłowa
LMV+ADV
PegIFN
αααα
-2a
ENT
biopsja w
ą
troby
bez
zmian
zapalenie
i/lub
włóknienie
LMV+ADV
ENT

D
D
ł
ł
ugo
ugo
ść
ść
leczenia
leczenia
•
•
Pacjenci
Pacjenci
HBeAg(+)
HBeAg(+)
–
–
Peg IFN: 1
Peg IFN: 1
rok
rok
–
–
przeciwwirusowe
przeciwwirusowe
:
:
≥≥≥≥
≥≥≥≥
1
1
roku
roku
⇒
⇒
⇒
⇒
⇒
⇒
⇒
⇒
leczenie powinno by
leczenie powinno by
ć
ć
kontynuowane co najmniej
kontynuowane co najmniej
6
6
miesi
miesi
ę
ę
cy po serokonwersji
cy po serokonwersji
–
–
pacjenci, kt
pacjenci, kt
ó
ó
rzy nie uzyskaj
rzy nie uzyskaj
ą
ą
serokonwersji po
serokonwersji po
1
1
lub
lub
2
2
latach leczenia wymagaj
latach leczenia wymagaj
ą
ą
d
d
ł
ł
ugotrwa
ugotrwa
ł
ł
ej terapii
ej terapii
•
•
Pacjenci
Pacjenci
HBeAg(
HBeAg(
-
-
)
)
–
–
Peg IFN: 1
Peg IFN: 1
rok
rok
⇒
⇒
⇒
⇒
⇒
⇒
⇒
⇒
wi
wi
ę
ę
kszo
kszo
ść
ść
ma nawr
ma nawr
ó
ó
t po
t po
1
1
roku
roku
leczenia
leczenia
i wymaga d
i wymaga d
ł
ł
ugotrwa
ugotrwa
ł
ł
ego leczenia
ego leczenia
przeciwwirusowego
przeciwwirusowego
–
–
przeciwwirusowe
przeciwwirusowe
: >
: >
1
1
roku
roku
(
(
mo
mo
ż
ż
e ca
e ca
ł
ł
e
e
ż
ż
ycie
ycie
)
)
Lok ASF & McMahon BJ. Hepatology. 2007; 45:507-39

Rekomendacje
Rekomendacje
AASLD
AASLD
•
•
Leczenie u pacjent
Leczenie u pacjent
ó
ó
w uprzednio nie leczonych mo
w uprzednio nie leczonych mo
ż
ż
na
na
rozpocz
rozpocz
ąć
ąć
jednym z wymienionych preparat
jednym z wymienionych preparat
ó
ó
w
w
:
:
–
–
i
i
nterferon
nterferon
,
,
adefo
adefo
w
w
ir
ir
,
,
ente
ente
kawir
kawir
,
,
lami
lami
w
w
ud
ud
yna
yna
lub
lub
telbi
telbi
wudyna
wudyna
.
.
“
“
Lami
Lami
w
w
ud
ud
yna
yna
i
i
telbi
telbi
w
w
ud
ud
yna
yna
nie s
nie s
ą
ą
preferowane z powodu wysokiej lekooporno
preferowane z powodu wysokiej lekooporno
ś
ś
ci
ci
”
”
•
•
Pacjenci b
Pacjenci b
ę
ę
d
d
ą
ą
cy na leczeniu lamiwudyn
cy na leczeniu lamiwudyn
ą
ą
:
:
–
–
„
„
przy dost
przy dost
ę
ę
pno
pno
ś
ś
ci nowych terapii z niskim ryzykiem
ci nowych terapii z niskim ryzykiem
lekooporno
lekooporno
ś
ś
ci
ci
,
,
rozwa
rozwa
ż
ż
y
y
ć
ć
przej
przej
ś
ś
cie na alternatywne
cie na alternatywne
leczenie
leczenie
,
,
szczeg
szczeg
ó
ó
lnie u pacjent
lnie u pacjent
ó
ó
w, kt
w, kt
ó
ó
rzy otrzymuj
rzy otrzymuj
ą
ą
lamiwudyn
lamiwudyn
ę
ę
powy
powy
ż
ż
ej 2 lat
ej 2 lat
”
”
Lok ASF & McMahon BJ. Hepatology. 2007; 45:507-39

HBV DNA <
HBV DNA <
2,000 IU/
2,000 IU/
mL
mL
⇒
⇒
⇒
⇒
⇒
⇒
⇒
⇒
LECZY
LECZY
Ć
Ć
? gdy AlAT > normy
? gdy AlAT > normy
przeszczepienie w
przeszczepienie w
ą
ą
troby
troby
niewyr
niewyr
ó
ó
wnana
wnana
OBSERWOWA
OBSERWOWA
Ć
Ć
wyr
wyr
ó
ó
wnana
wnana
Niewykrywalna
Niewykrywalna
Wykrywalna
Wykrywalna
Wiremia
Wiremia
LECZY
LECZY
Ć
Ć
przeszczepienie w
przeszczepienie w
ą
ą
troby
troby
HBV DNA >
HBV DNA >
2,000 IU/
2,000 IU/
mL
mL
⇒
⇒
⇒
⇒
⇒
⇒
⇒
⇒
LECZY
LECZY
Ć
Ć
Strateg
Strateg
ia
ia
wyr
wyr
ó
ó
wnana
wnana
niewyr
niewyr
ó
ó
wnana
wnana
Zaawansowanie
Zaawansowanie
AASLD:
AASLD:
marsko
marsko
ść
ść
w
w
ą
ą
troby
troby
HBeAg(+)
HBeAg(+)
i
i
HBeAg(
HBeAg(
-
-
)
)
Lok ASF & McMahon BJ. Hepatology. 2007; 45:507-39
Wyszukiwarka
Podobne podstrony:
Podziekowanie dla pracownika za Nieznany
Program terapeutyczny dla osób z podwójną diagnozą
instrukcja bhp dla osob zatrudn Nieznany
Rachunkowosc dla malej firmy Za Nieznany
angielski dla opiekunow osob st Nieznany
Informacja dla osob, ktore chca Nieznany
INSTRUKCJA BHP DLA OSÓB ODPOWIEDZIALNYCH ZA ZIMOWE
Dla wyjeźdżających za granice
BIZNESPLAN dla programu promocj Nieznany (11)
Indywidualny program terapeutyczny dla uczniów upośledzonych, DOKUMENTY AUTYZM< REWALIDACJA, re
Grupa narkomani, Studia licencjackie- Resocjalizacja, Metodyka resocjalizacji - przykładowy plan zaj
Program terapeutyczny dla uczniów ryzyka dysleksji, szkoła, Rady Pedagogiczne, wychowanie, profilakt
Scenariusz zajęć terapeutycznych dla dzieci z nadpobudliwością psychoruchową
angielski dla sanitariuszy id 6 Nieznany
edukacja dla bezpieczenstwa id Nieznany
Informacja dla osób które nie zdały egzaminu
więcej podobnych podstron