1
NOMENKLATURA ZWIĄZKÓW NIEORGANICZNYCH
1) Nazwy i symbole atomów
Nazwa
Symbol
Nazwa
Symbol
Nazwa
Symbol
aktyn
ameryk
antymon
argon
arsen
astat
azot
bar
berkel
beryl
bizmut
bohr
bor
brom
cer
cez
chlor
chrom
cyna
cynk
cyrkon
darmstadt
dubn
dysproz
einstein
erb
europ
ferm
fluor
fosfor
frans
gadolin
gal
german
glin
hafn
has
hel
holm
Ac
Am
Sb
Ar
As
At
N
Ba
Bk
Be
Bi
Bh
B
Br
Ce
Cs
Cl
Cr
Sn
Zn
Zr
Ds
Db
Dy
Es
Er
Eu
Fm
F
P
Fr
Gd
Ga
Ge
Al
Hf
Hs
He
Ho
ind
iryd
iterb
itr
jod
kadm
kaliforn
kiur
kobalt
krzem
krypton
ksenon
lantan
lit
lorens
lutet
magnez
mangan
meintner
mendelew
miedź
molibden
neodym
neon
neptun
nikiel
niob
nobel
ołów
osm
pallad
platyna
pluton
polon
potas
prazeodym
promet
protaktyn
rad
In
Ir
Yb
Y
I
Cd
Cf
Cm
Co
Si
Kr
Xe
La
Li
Lr
Lu
Mg
Mn
Mt
Md
Cu
Mo
Nd
Ne
Np
Ni
Nb
No
Pb
Os
Pd
Pt
Pu
Po
K
Pr
Pm
Pa
Ra
radon
ren
rod
roentgen
rtęć
rubid
ruten
rutherford
samar
seaborg
selen
siarka
skand
sód
srebro
stront
tal
tantal
technet
tellur
terb
tlen
tor
tul
tytan
ununbi (pierwiastek 112)
ununheks (pierwiastek 116)
ununkwad (pierwiastek 114)
ununokt (pierwiastek 118)
ununpent (pierwiastek 115)
ununtri (pierwiastek 113)
uran
wanad
wapń
węgiel
wodór
wolfram
złoto
żelazo
Rn
Re
Rh
Rg
Hg
Rb
Ru
Rf
Sm
Sg
Se
S
Sc
Na
Ag
Sr
Tl
Ta
Tc
Te
Tb
O
Th
Tm
Ti
Uub
Unh
Uuq
Uuo
Uup
Uut
U
V
Ca
C
H*
W
Au
Fe
* Dla izotopów wodoru o liczbach masowych dwa i trzy stosuje się odpowiednio nazwy i
symbole: deuter D,
2
H i tryt T,
3
H.
Nazwy grup pierwiastków od pierwszego pierwiastka w grupie (wyjątek wodór); grupa 3 –
skandowce; tradycyjnie: Sc, Y, La, Ac; obecnie: Sc, Y, Lu, Lr

2
Symbole grup: Ln – lantanowce i An - aktynowce
2) Nazwy systematyczne i symbole atomów o liczbie atomowej powyżej 100 tworzy się w
oparciu o liczbę atomową pierwiastka, stosując następujące rdzenie liczbowe:
0 = nil 1 = un 2 = bi 3 = tri 4 = kwad 5 = pent 6 = heks 7 = sept
8 = okt
9 = enn
Rdzenie łączy się w takiej kolejności, w jakiej cyfry występują w liczbie atomowej. Symbole tych
pierwiastków składają się z pierwszych liter rdzeni tworzących nazwę.
Przykład:
liczba atomowa: 121, nazwa: Unbiun, symbol: Ubu
3) Oznaczenia liczby atomowej, liczby masowej i ilości atomów w cząsteczce za pomocą
wskaźników
liczba masowa A
liczba atomowa Z
ilość atomów danego pierwiastka w cząsteczce
Wskaźnik lewy górny
wskaźnik lewy dolny
wskaźnik prawy dolny
liczba arabska
liczba arabska
liczba arabska
Przykład:
16
8
O
2
– dwuatomowa cząsteczka tlenu/cząsteczka ditlenu zbudowana z atomów tlenu o liczbie
atomowej 8 i liczbie masowej 16
4) Stopień utlenienia pierwiastka przyjmuje wartości całkowite lub ułamkowe, dodatnie, ujemne
lub równe zero i zapisuje się go liczbą rzymską (znak podaje się przed wartością stopnia
utlenienia; pomija się znak plus). We wzorach stopień utlenienia umieszcza się jako prawy, górny
wskaźnik.
Przykłady:
H
I
F
–I
Ca
II
S
–II
Na
I
3
P
V
O
–II
4
Stopień utlenienia pierwiastków w stanie wolnym przyjmuje się za równy 0
Przykłady:
Cu
0
Cl
2
0
C
0
5) Ładunek jonu przyjmuje wartości dodatnie lub ujemne, zapisuje się go liczbą arabską (znak
plus lub minus podaje się po wartości ładunku) i umieszcza jako prawy górny wskaźnik.
Przykłady:
S
2–
Al
3+
CO
3
2–
6) We wzorach chemicznych na pierwszym miejscu umieszcza się zawsze składnik bardziej
elektrododatni a na drugim składnik bardziej elektroujemny. Podając nazwę związku składniki
wymienia się w odwrotnej kolejności.
W przypadku binarnych (dwuskładnikowych) związków najpierw umieszcza się symbol
pierwiastka zajmującego wcześniejszą pozycję w poniższym szeregu:
(metale), Rn, Xe, Kr, B, Si, C, Sb, As, P, N, H, Te, Se, S, At, I, Br, Cl, O, F.
Do nazwy składnika bardziej elektroujemnego dodaje się końcówkę „-ek” lub „-ik”.
Przykłady związków niemetali:
H
2
Te
PH
3
OF
2
7) Proporcje składników w związkach określa się następująco:

3
w systemie Stocka – w nazwach podaje się stopień utlenienia w nawiasie (bez odstępu!) po
nazwie pierwiastka, grupy pierwiastków, związku. Jeżeli pierwiastek ma tylko jeden stopień
utlenienia nie podaje się go. System zalecany przez Komisję Nomenklatury Chemicznej
Polskiego Towarzystwa Chemicznego;
przykłady:
SO
3
– tlenek siarki(VI),
FePO
4
– fosforan(V) żelaza(III),
LiBr – bromek litu
8) Nazewnictwo jonów
a) kationy
Słowa jon i kation stosuje się zamiennie.
Przykłady:
Cu
2+
– jon miedzi(II), jon miedzi(2+),
Hg
2
2+
– jon dirtęci(I), jon dirtęci(2+),
H
+
– jon wodoru(I), hydron
-nazwę stosuje się gdy nie jest znana lub ważna ilość przyłączonych cząsteczek
wody,
H
3
O
+
– jon oksoniowy, oksonium; nazwa niezalecana: jon hydroniowy,
NH
4
+
– jon amonowy, kation amonu, amonium, azanium,
PH
4
+
– jon fosfoniowy, fosfonium,
NO
+
– kation nitrozylu,
NO
2
+
– kation nitroilu,
SO
2+
– kation sulfinylu (zwyczajowo: kation tionylu),
SO
2
2+
– kation sulfonylu (zwyczajowo: kation sulfurylu),
C
2
H
5
+
– kation etylowy, etylium,
UO
2
2+
– jon uranylowy(VI), jon dioksouranu(VI), kation dioksouranu(2+), kation uranylu(2+).
b) aniony
Słowa jon i anion stosuje się zamiennie.
Przykłady:
H
–
– jon wodorkowy,
OH
–
– anion wodorotlenkowy; nazwa niezalecana: jon hydroksylowy,
S
2–
– jon siarczkowy,
C
4–
– jon węglikowy,
C
2
2–
– jon diwęglikowy(2–), nazwa dopuszczalna: anion acetylenkowy,
CH
3
–
– anion metylowy, anion metanidowy,
O
2
–
– jon ditlenkowy(1–), nazwa dopuszczalna: anion ponadtlenkowy,
O
2
2–
– jon ditlenkowy(2–), nazwa dopuszczalna: anion nadtlenkowy,
O
3
–
– jon tritlenkowy(1–), nazwa dopuszczalna: anion ozonkowy,
N
3
–
– jon triazotkowy(1–), nazwa dopuszczalna: anion azydkowy,
NO
3
–
– jon azotanowy(V), anion trioksoazotanowy(V),
HSO
4
–
– jon wodorosiarczanowy(VI), anion wodorotetraoksosiarczanowy(VI),
CH
3
COO
–
– jon octanowy, anion etanianowy,
[Al(OH)
6
]
3–
– jon heksahydroksoglinianowy.
9) Nazewnictwo tlenków
a) nazwy tlenków prostych tworzy się łącząc słowo „tlenek” z nazwą pierwiastka w dopełniaczu,
a w nawiasie podaje się jego stopień utlenienia, o ile jest to konieczne (system Stocka)
Przykłady:

4
CO – tlenek węgla(II),
N
2
O
5
– tlenek azotu(V),
Al
2
O
3
– tlenek glinu.
b) nazwy tlenków mieszanych
– zawierających jeden pierwiastek na różnych stopniach utlenienia połączony z tlenem tworzy się
wymieniając je w kolejności rosnącego stopnia utlenienia
Przykład
Pb
II
2
Pb
IV
O
4
tlenek diołowiu(II) ołowiu(IV).
– zawierających różne pierwiastki (metale) połączone z tlenem tworzy się wymieniając je w
kolejności alfabetycznej
Przykład
CaWO
4
(CaO
.
WO
3
) – tetratlenek wapnia wolframu(VI).
c) nazwy nadtlenków i ponadtlenków tworzy się jak nazwy tlenków
Przykłady:
BaO
2
– nadtlenek baru,
KO
2
– ponadtlenek potasu.
10) Nazewnictwo wodorków
a) nazwy i wzory wodorków binarnych tworzy się zgodnie z zasadą zawartą w punkcie 6). Do
nazwy składnika bardziej elektroujemnego dodaje się końcówkę „-ek”.
Przykłady:
KH – wodorek potasu
HCl – chlorek wodoru
b) nazwy wodorków lotnych (z wyjątkiem wodorków fluorowców, tlenu i azotu) tworzy się
dodając do rdzenia nazwy pierwiastka końcówkę „-an”.
Przykłady:
SiH
4
– silan
NH
3
– azan
N
2
H
4
– diazan
PH
3
– fosfan
AsH
3
– arsan
H
2
O – oksydan
H
2
S – sulfan
H
2
Se – selan
H
2
Te – tellan
nazwa dopuszczalna i zalecana: amoniak
nazwa dopuszczalna i zalecana: hydrazyna
nazwa dopuszczalna: fosfina
nazwa dopuszczalna: arsyna
nazwa dopuszczalna i zalecana: woda
nazwa dopuszczalna i zalecana: siarkowodór
nazwa dopuszczalna i zalecana: selenowodór
nazwa dopuszczalna i zalecana: tellurowodór
c) nazwy wodorków boru tworzy się stosując różne systemy, m.in.: (1) nazwy typu „boran” i (2)
nazwy typu „borowodór”
Przykłady:
B
2
H
6
B
4
H
10
diboran(6)
tetraboran(10)
diborowodór(6)
tetraborowodór(10)
d) nazwy wodorków fluorowców podano w punkcie 12a).
11) Nazewnictwo wodorotlenków
nazwy wodorotlenków prostych tworzy się łącząc słowo „wodorotlenek” z nazwą pierwiastka w
dopełniaczu, a w nawiasie podaje się jego stopień utlenienia, o ile jest to konieczne (system
Stocka)
Przykłady:
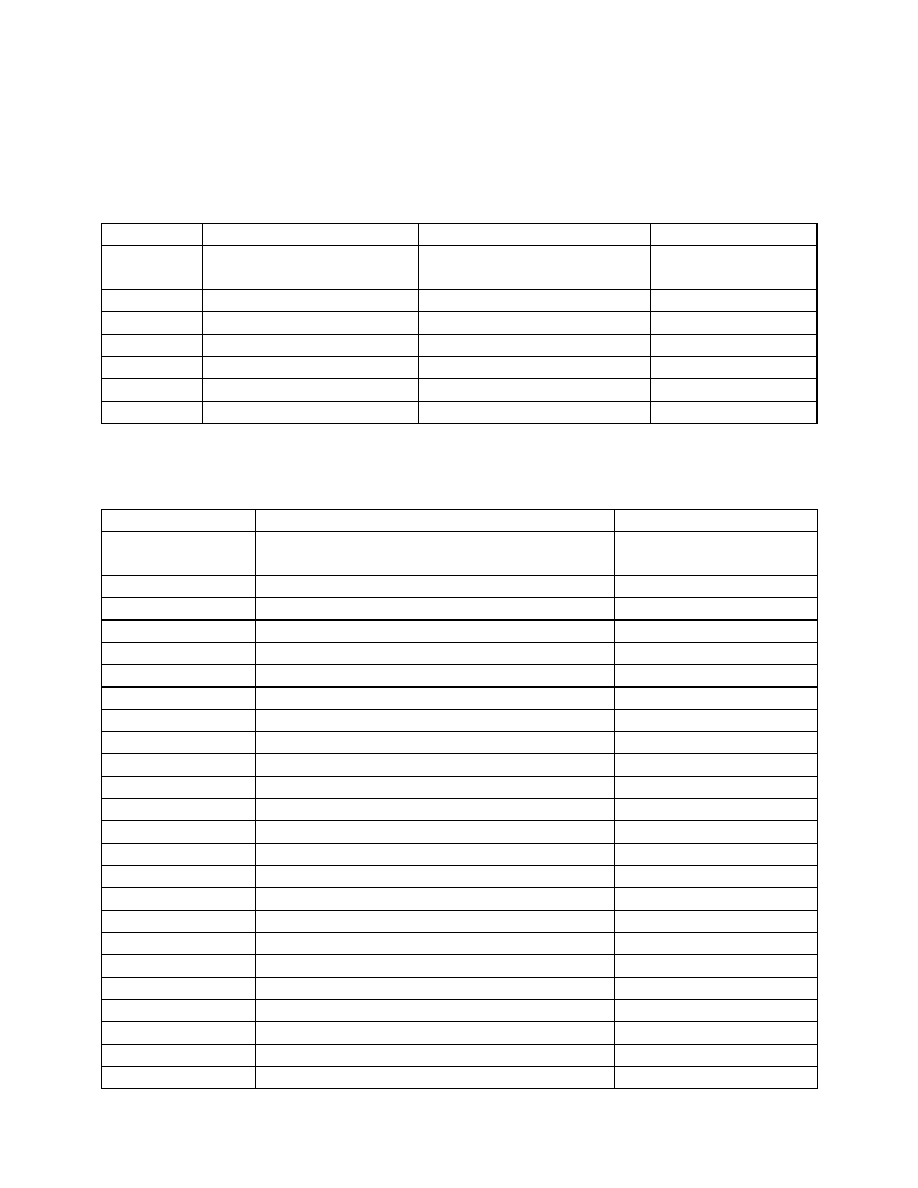
5
KOH – wodorotlenek potasu
Cu(OH)
2
– wodorotlenek miedzi(II)
12) Nazewnictwo kwasów
a) kwasy beztlenowe
Nazwy anionów kwasów beztlenowych mają charakterystyczną końcówkę „-kowy”, a soli tych
kwasów „-ek”
wzór kwasu
Nazwa systematyczna
Nazwa dopuszczalna
nazwa soli
HF
fluorek wodoru
kwas fluorowodorowy
fluorek
(anion fluorkowy)
HCl
chlorek wodoru
kwas chlorowodorowy
chlorek
HBr
bromek wodoru
kwas bromowodorowy
bromek
HI
jodek wodoru
kwas jodowodorowy
jodek
H
2
S
siarczek diwodoru
kwas siarkowodorowy
siarczek
HCN
cyjanek wodoru
kwas cyjanowodorowy
cyjanek
HN
3
azydek wodoru
kwas azotowodorowy
azydek
b) wybrane kwasy tlenowe (oksokwasy)
Nazwy kwasów tlenowych mają charakterystyczną końcówkę „-owy”, nazwy ich anionów „-
anowy”, zaś nazwy soli tych kwasów „-an”.
wzór kwasu
nazwa w systemie Stocka
nazwa soli*
H
3
AsO
3
kwas arsenowy(III)
arsenian(III)
(anion arsenianowy(III))
H
3
AsO
4
kwas arsenowy(V)
arsenian(V)
HNO
2
kwas azotowy(III)
azotan(III)
HNO
3
kwas azotowy(V)
azotan(V)
(HBO
2
)
n
kwas metaborowy
metaboran
H
3
BO
3
kwas ortoborowy
ortoboran
HClO
kwas chlorowy(I)
chloran(I)
HClO
2
kwas chlorowy(III)
chloran(III)
HClO
3
kwas chlorowy(V)
chloran(V)
HClO
4
kwas chlorowy(VII)
chloran(VII)
H
2
CrO
4
kwas chromowy(VI)
chromian(VI)
H
2
Cr
2
O
7
kwas dichromowy(VI)
dichromian(VI)
H
3
PO
3
/ H
2
PHO
3
kwas fosforowy(III) / kwas fosfonowy
fosforan(III) / fosfonian
(HPO
3
)
n
kwas metafosforowy(V)
metafosforan(V)
H
3
PO
4
kwas (orto)fosforowy(V)
(orto)fosforan(V)
H
4
P
2
O
7
kwas difosforowy(V)
difosforan(V)
HIO
4
kwas (meta)jodowy(VII)
(meta)jodan(VII)
H
5
IO
6
kwas ortojodowy(VII)
ortojodan(VII)
H
4
SiO
4
kwas ortokrzemowy
ortokrzemian
(H
2
SiO
3
)
n
kwas metakrzemowy
metakrzemian
HMnO
4
kwas manganowy(VII)
manganian(VII)
H
2
MnO
4
kwas manganowy(VI)
manganian(VI)
H
2
SO
3
kwas siarkowy(IV)
siarczan(IV)
H
2
SO
4
kwas siarkowy(VI)
siarczan(VI)

6
H
2
S
2
O
7
kwas disiarkowy(VI)
disiarczan(VI)
H
2
S
2
O
8
kwas peroksodisiarkowy(VI)
peroksodisiarczan(VI)
H
2
S
2
O
3
kwas tiosiarkowy(VI)
tiosiarczan(VI)
H
2
CO
3
kwas węglowy
węglan
HOCN
kwas cyjanowy
cyjanian
HNCO**
kwas izocyjanowy
izocyjanian
* W przypadku kwasów wieloprotonowych obecne są również aniony zawierające kationy
wodorowe; przykład: HSO
4
–
– anion wodorosiarczanowy(VI); sól – wodorosiarczan(VI)
** Kwas izocyjanowy nie jest oksokwasem, gdyż atom wodoru nie jest związany bezpośrednio z
atomem tlenu
Uwaga!
Nie zaleca się stosowania nazw kwasów z końcówką -awy i ich soli z końcówką -yn (-in)
np. NO
2
–
azotyn, SO
3
2–
siarczyn, ClO
2
–
chloryn
oraz nazw kwasów i soli z przedrostkami nad- i pod-, np. ClO
–
podchloryn, MnO
4
–
nadmanganian
13) Nazewnictwo soli
– sole obojętne nazywa się podając kolejno nazwy jonów budujących sól i uwzględniając (jeśli to
konieczne) stopnie utlenienia;
przykłady:
KBr – bromek potasu,
Au
2
S
3
– siarczek złota(III),
BaCO
3
– węglan baru,
CuSO
4
– siarczan(VI) miedzi(II),
– wodorosole powstają przez niecałkowite zastąpienie kationów wodoru(I) kwasu; nazywa się je
podając przedrostek liczebnikowy (podający ilość wymienialnych atomów wodoru), przedrostek
„wodoro”, nazwę anionu i kationu;
przykłady:
NaHCO
3
– wodorowęglan sodu,
KH
2
PO
4
– diwodorofosforan(V) potasu,
– sole podwójne i potrójne zawierają dwa lub trzy różne kationy i/lub aniony; wzór chemiczny i
nazwę tworzy się wymieniając składniki poszczególnych grup w kolejności alfabetycznej (stąd
możliwe różnice wymieniania składników we wzorze chemicznym i nazwie);
przykłady:
KLiCO
3
– węglan litu-potasu,
CaBrCl – bromek-chlorek wapnia,
– hydroksosole powstają przez niecałkowite zastąpienie anionów wodorotlenkowych
wodorotlenku; nazywa się je stosując reguły dla soli podwójnych, zawierających aniony OH
–
;
aniony wymienia się w kolejności alfabetycznej;
przykłady:
AlF(OH)
2
– fluorek-diwodorotlenek glinu,
Cu
2
Cl(OH)
3
– chlorek-triwodorotlenek dimiedzi(II),
– sole zawierające wodę krystalizacyjną; wymienia się kolejno składniki rozdzielając je długą
kreską, a na końcu nazwy w nawiasie okrągłym podaje się stosunek molowy składników;
przykłady:
CuSO
4
.
5H
2
O – siarczan(VI) miedzi(II)
––––
woda(1/5),
AlK(SO
4
)
2
.
12H
2
O – siarczan(VI) glinu-potasu
––––
woda(1/12),

7
Al
2
(SO
4
)
3
.
K
2
SO
4
.
24H
2
O – siarczan(VI) glinu
––––
siarczan(VI) potasu
––––
woda(1/1/24).
14) Nazewnictwo związków koordynacyjnych
We wzorach chemicznych najpierw wymienia się atom centralny, a następnie dołączone do niego
ligandy (najpierw jonowe, następnie obojętne); cały wzór ujęty jest w nawiasie kwadratowym.
Nazywając postępuje się odwrotnie; ligandy w nazwie i wzorze wymienia się w kolejności
alfabetycznej(!), poprzedzając je w razie potrzeby przedrostkami liczebnikowymi greckimi (di-,
tri-, tetra-, penta-, heksa- ... dla ligandów prostych i bis-, tris-, ... dla ligandów złożonych).
Ładunek jonu kompleksowego jest sumą ładunków wszystkich składników.
Nazwy ligandów anionowych kończą się na „-o”:
np. S
2–
- tio, H
–
- hydrydo, Cl
–
- chloro, OH
–
- hydrokso, O
2–
- okso, CN
–
- cyjano, CH
3
COO
–
-
octano (etaniano; ac);
nazwy ligandów obojętnych: H
2
O - akwa, NH
3
- amina, CO – karbonyl, NO - nitrozyl
ac – octano, tart – winiano, acan – acetyloacetoniano; ox – szczawiano, cp – cyklopentadienylo,
edta - etylenodiaminotetraoctano
Przykłady:
K
3
[Fe(CN)
6
] – heksacyjanożelazian(III) potasu,
Na
2
[Zn(OH)
4
] – tetrahydroksocynkan sodu,
[Cr(H
2
O)
6
]Cl
3
– chlorek heksaakwachromu(III),
Na
3
[Ag(S
2
O
3
)
2
] – bis(tiosiarczano(VI))srebrzan(I) sodu,
[Fe(CO)
5
] – pentakarbonylżelazo(0).
Uwaga! Aniony wielu oksokwasów można traktować jako jony kompleksowe, dlatego np.
związek o wzorze H
2
SO
4
można nazwać: „tetraoksosiarczan(VI)/
tetraoksosiarczan(2-)
wodoru” lub
„kwas siarkowy(VI)”; kwasy fosforu: tetraoksofosforowy(V) H
3
PO
4
, heptaoksodifosforowy(V)
H
4
P
2
O
7
, trioksofosforowy(V) HPO
3
NOMENKLATURA ZWIĄZKÓW ORGANICZNYCH
1) Nazewnictwo węglowodorów alifatycznych
a) alkany
Dla pierwszych czterech węglowodorów obowiązują nazwy zwyczajowe, dla pozostałych nazwy
tworzy się przez połączenie rdzenia (pochodzącego od liczebnika greckiego) z końcówką „-an”:
liczba atomów węgla w cząsteczce
liczebnikowe rdzenie nazw
1
2
3
4
5
6
7
8
9
10
11
12
20
30
meta-
eta-
propa-
buta-
penta-
heksa-
hepta-
okta-
nona-
deka-
undeka-
dodeka-
eikoza-
triakonta-
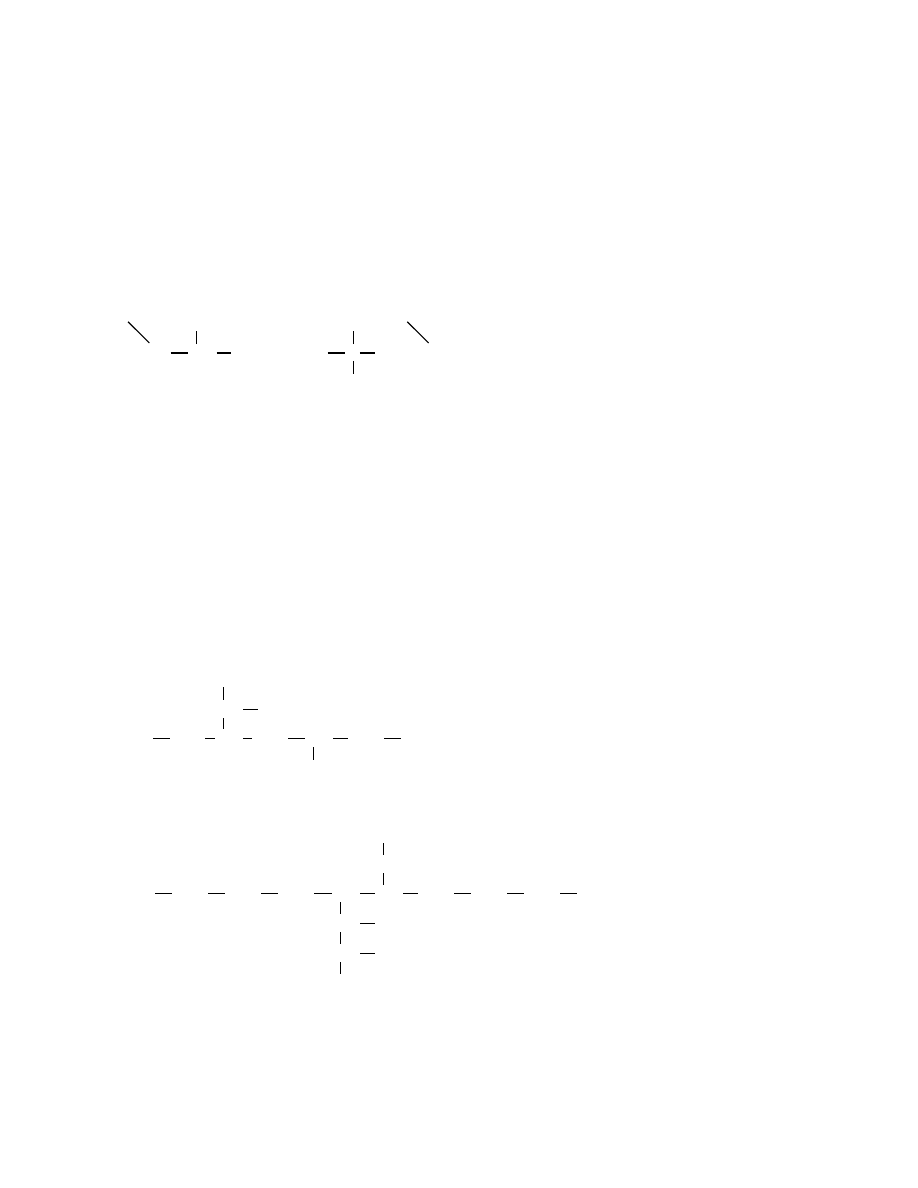
8
40
100
tetrakonta-
hekta-
Uwaga! W przypadku zastosowania końcówki rozpoczynającej się samogłoską należy pominąć
literę „a” rdzenia.
Dla grup węglowodorowych wywodzących się od danego typu węglowodorów stosuje się
końcówkę „-yl”.
W przypadku alkanów o łańcuchach rozgałęzionych, wybiera się łańcuch główny (najdłuższy), a
atomy węgla numeruje tak, by ciąg lokantów (liczb będących numerami atomów węgla) był
ciągiem mniejszych lokantów tj. by pierwszy wyraz ciągu był najmniejszy (suma lokantów nie
musi być najmniejsza!); łańcuch stanowi podstawę nazwy węglowodoru.
Przykład:
CH
3
CH
CH
3
CH
2
CH
2
CH
2
C
CH
3
CH
3
CH
2
CH
3
1
8
8
1
2,6,6-trimetylooktan - nazwa poprawna
(suma lokantów większa, ciąg lokantów mniejszy)
3,3,7-trimetylooktan - nazwa niepoprawna
(suma lokantów mniejsza, ciąg lokantów większy)
W przypadku znalezienia kilku równych łańcuchów wybiera się ten, który posiada najwięcej
łańcuchów bocznych, a przy ich jednakowej liczbie ten mający najmniej rozgałęzionych
łańcuchów bocznych (podstawników). Podstawniki wymienia się w kolejności alfabetycznej,
podając przed nazwą: lokanty i krotności (di-, tri-, ... dla prostych i bis-, tris-, ... dla
rozgałęzionych). Nazwy podstawników mają końcówkę „-o”.
Przykłady:
3-etylo-2,5-dimetyloheptan
CH
3
CH
2
CH
2
CH
2
CH CH CH
2
CH
2
CH
2
CH
3
CH
2
CH
CH
CH
3
CH
3
CH
3
CH
3
1
10
6-(1,2-dimetylopropylo)-5-etylodekan
("1,2-dimetylopropylo" to pelna nazwa podstawnika)
/
CH
2
CH
3
CH
2
CH
CH
3
CH
2
CH
3
CH
CH
3
CH
CH
3
1
7
b) alkeny
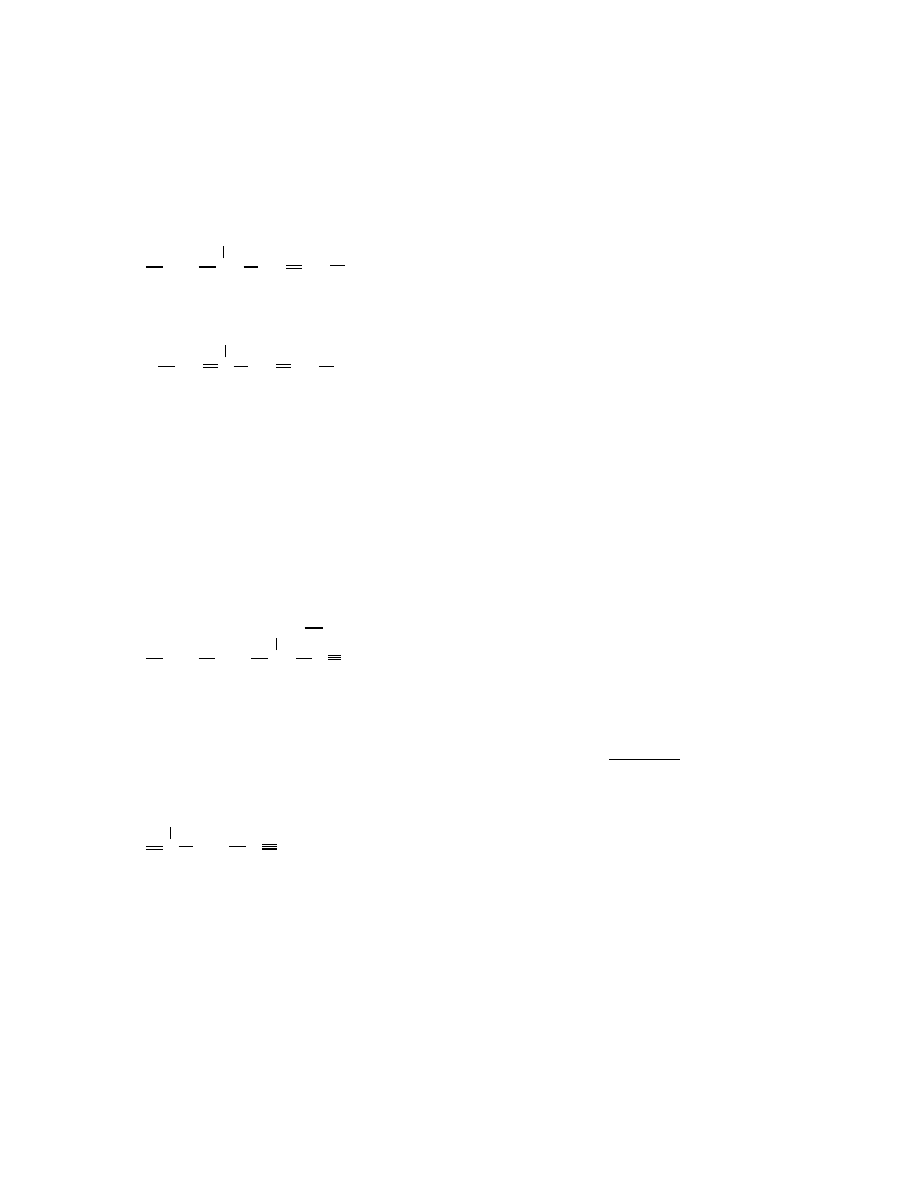
9
Numerację łańcucha węglowego prowadzi się tak, by lokant atomu węgla rozpoczynającego
wiązanie podwójne był jak najmniejszy. W nazwie podaje się w kolejności: rdzeń nazwy, lokant,
końcówkę „-en”. W przypadku alkenów o łańcuchu rozgałęzionym, łańcuchem głównym jest
łańcuch zawierający wiązanie podwójne. W przypadku większej liczy wiązań wielokrotnych,
łańcuch numeruje się tak, by lokanty węgli rozpoczynających te wiązania były jak najmniejsze.
Zachowano niektóre nazwy zwyczajowe, np: etylen – eten
Przykłady:
4-metyloheksa-2,4-dien
4-metyloheks-2-en
C CH CH CH
3
CH
3
CH
CH
3
CH
3
CH
2
CH CH CH CH
3
CH
3
c) alkiny
Numerację łańcucha węglowego prowadzi się tak, by lokant atomu węgla rozpoczynającego
wiązanie potrójne był jak najmniejszy. W nazwie podaje się w kolejności: rdzeń nazwy, lokant,
końcówkę „-yn” lub „-in” po spółgłoskach: g, k, l, ch, f. W przypadku alkenów o łańcuchu
rozgałęzionym, łańcuchem głównym jest łańcuch zawierający wiązanie potrójne. W przypadku
większej liczby wiązań wielokrotnych, łańcuch numeruje się tak, by lokanty węgli
rozpoczynających te wiązania były jak najmniejsze.
Zachowano nazwę zwyczajową: acetylen – etyn
Przykład:
CH
3
CH
2
CH
2
CH
CH
2
CH
3
C CH
3-etyloheks-1-yn
W przypadku węglowodoru zawierającego wiązanie podwójne i potrójne numerację łańcucha
prowadzi się tak, by lokant atomu węgla rozpoczynającego wiązanie podwójne był jak najniższy.
W nazwie w pierwszej kolejności wymienia się wiązanie podwójne.
Przykład:
2-metylopent-1-en-4-yn
CH
2
C
CH
3
CH
2
C CH
d) węglowodory cykliczne
d1) węglowodory monocykliczne
Nazwy cykloalkanów, cykloalkenów i cykloalkinów tworzy się przez połączenie przedrostka
„cyklo-” z nazwą węglowodoru łańcuchowego o takiej samej liczbie atomów węgla. W
przypadku obecności wiązania wielokrotnego numerację pierścienia prowadzi się tak, by lokant
atomu węgla rozpoczynającego wiązanie wielokrotne był najniższy. W celu utworzenia nazwy
węglowodoru wielopodstawionego atomy węgla należy ponumerować tak, by suma lokantów
była jak najmniejsza. Podstawniki wymienia się w kolejności alfabetycznej, podając przed nazwą:
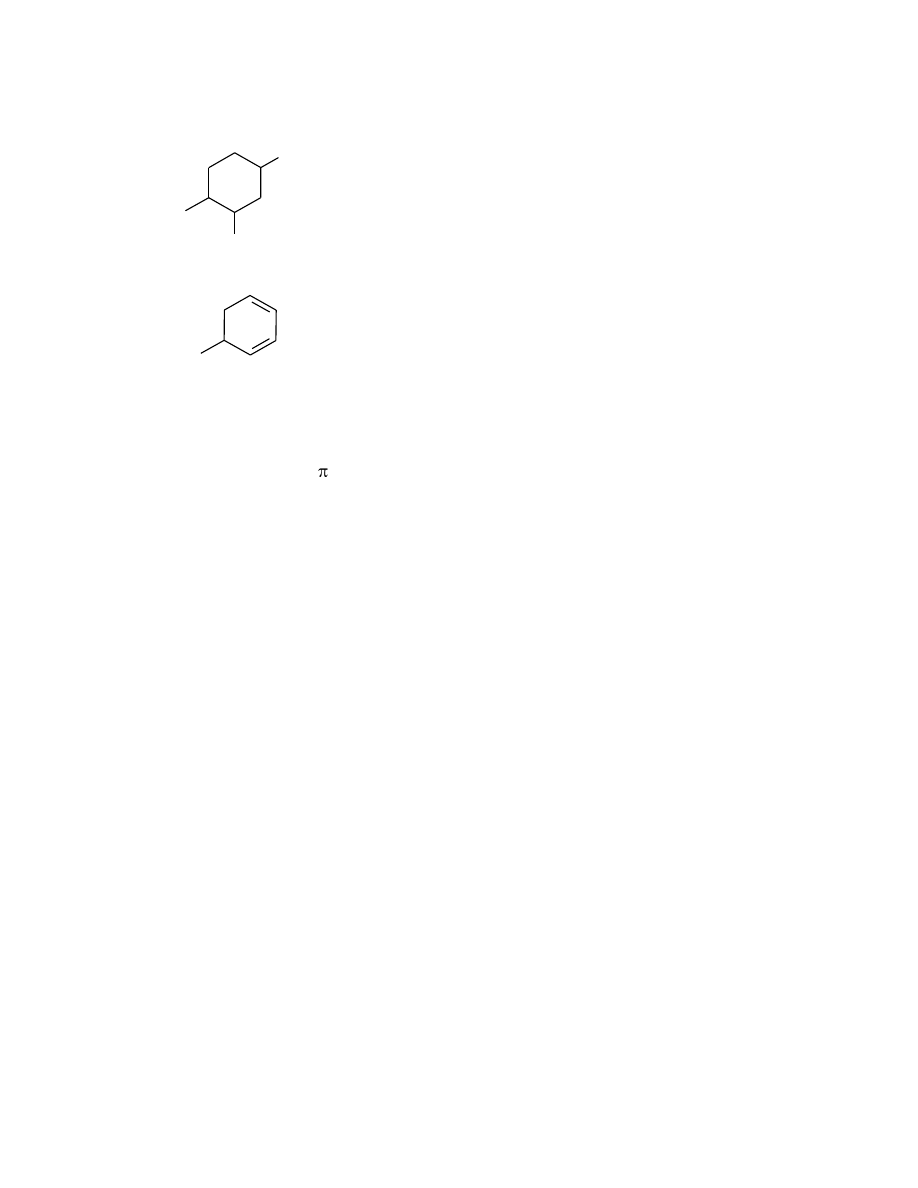
10
lokanty i krotności (di-, tri-, ... dla prostych i bis-, tris-, ... dla rozgałęzionych). Nazwy
podstawników mają końcówkę „-o”.
Przykłady:
5-etylocykloheksa-1,3-dien
C
2
H
5
CH
3
CH
3
C
2
H
5
1-etylo-2,4-dimetylocykloheksan.
Dla arenów (węglowodorów aromatycznych) niepodstawionych stosuje się nazwy zwyczajowe.
Zachowano nazwy zwyczajowe: benzen i fenyl (grupa C
6
H
5
-).
Dla zaznaczenia elektronów aktualne postanowienia IUPAC (International Union of Pure and
Applied Chemistry) zalecają stosowanie wzorów z oddzielnymi wiązaniami podwójnymi.
Dopuszczalne, ale nie zalecane są „wzory z kółkiem” wewnątrz pierścienia, nie można ich jednak
stosować dla arenów o skondensowanych pierścieniach.
Dla arenów podstawionych obowiązują następujące reguły:
– areny monopodstawione nazywa się podając nazwę podstawnika z końcówką „-o” i nazwę
arenu. Zachowano niektóre nazwy zwyczajowe: toluen – metylobenzen, benzyl (grupa C
6
H
5
CH
2
-)
i styren – etenylobenzen lub winylobenzen
– areny dipodstawione o identycznych podstawnikach; nazwy tworzy się podając lokanty
podstawników lub ich tradycyjne określenia, przedrostek krotności „di-”, nazwę podstawnika z
końcówką „-o” i nazwę arenu. Określenia położenia:
1,2 – orto (o-),
1,3 – meta (m-),
1,4 – para (p-).
Zachowano nazwę zwyczajową: ksylen (izomery orto, meta i para) – dimetylobenzen (izomery
1,2; 1,3 i 1,4)
– areny wielopodstawione o identycznych podstawnikach nazywa się podając lokanty
podstawników, właściwy przedrostek krotności, nazwę podstawnika z końcówką „-o” i nazwę
arenu. W przypadku związków z różnymi podstawnikami postępuje się podobnie wymieniając
podstawniki w kolejności alfabetycznej, przez co zostaje narzucona numeracja atomów węgla w
arenie.
Zachowano nazwę zwyczajową mezytylen – 1,3,5-trimetylobenzen
Przykłady:
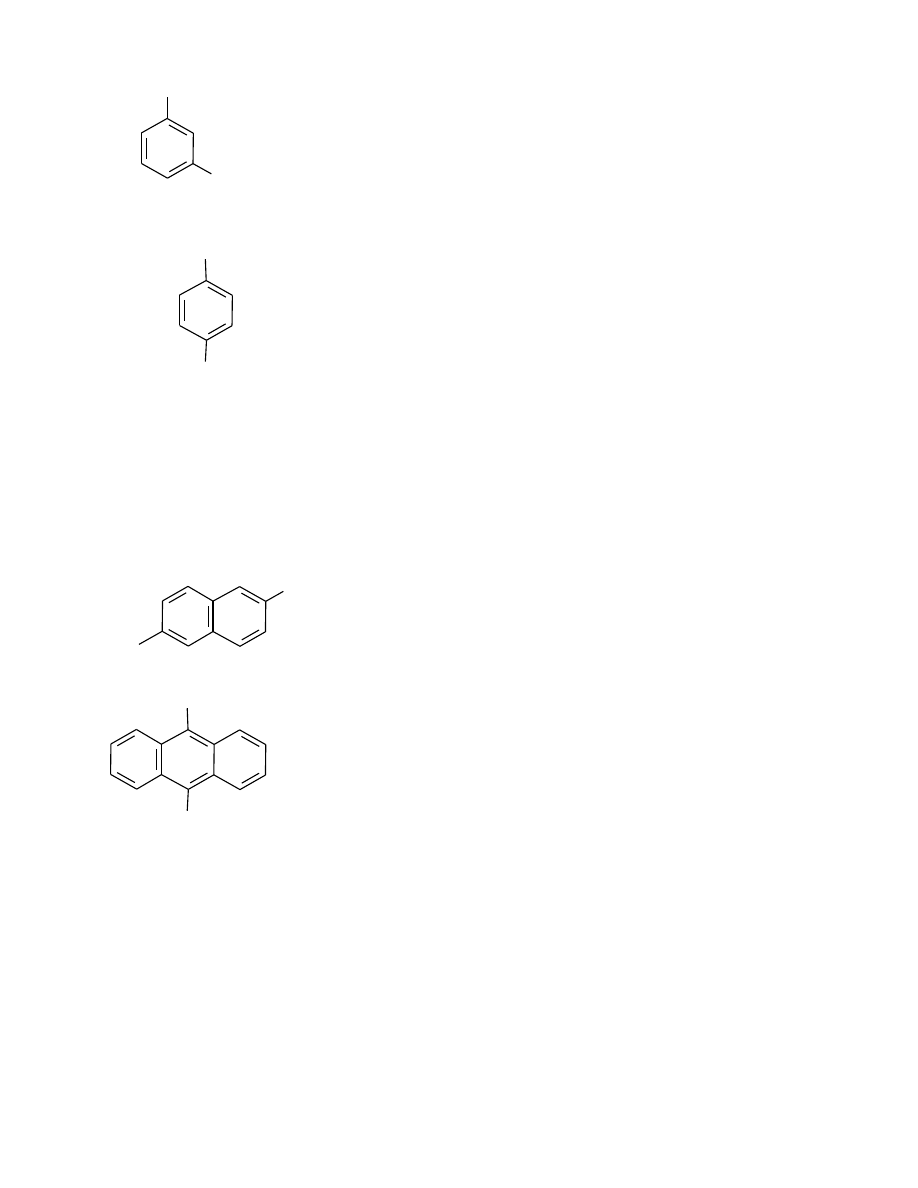
11
1,4-dimetylobenzen lub p-ksylen
CH
3
CH
3
CH
3
C
4
H
9
1-butylo-3-metylobenzen
.
d2) węglowodory policyklczne
Dla węglowodorów zbudowanych z 2–4 skondensowanych pierścieni benzenowych stosuje się
nazwy zwyczajowe: naftalen, antracen, naftacen.
Nazwy węglowodorów zbudowanych z więcej niż czterech liniowo skondensowanych pierścieni
benzenowych tworzy się przez złożenie rdzenia nazwy i końcówki „-acen”.
Nazywając alkilopochodne węglowodorów policyklicznych postępuje się jak w przypadku
węglowodorów monocyklicznych, z tym że numeracja atomów węgla w pierścieniach
skondensowanych jest następująca:
9,10-dimetyloantracen
2,6-dimetylonaftalen
CH
3
CH
3
1
2
3
4
5
6
7
8
9
10
CH
3
CH
3
1
2
3
4
5
6
8
7
.
3) Nazewnictwo związków heterocyklicznych
Nazwy systematyczne tworzy się przez połączenie przedrostka określającego rodzaj heteroatomu
i końcówki określającej wielkość pierścienia.
Dla wielu związków zachowano nazwy zwyczajowe:
12
indol puryna
N
H
N
N
N
N
H
pirazol imidazol dioksan pirymidyna
N
N
O
O
N
N
H
N
N
H
furan tetrahydrofuran tiofen pirol pirolidyna
N
H
O
S
N
H
O
-piran -piran pirydyna piperydyna
N
H
O
H
H
N
O
H
H
4) Nazewnictwo związków zawierających grupy funkcyjne
Nazwy związków z grupami funkcyjnymi tworzy się podając lokant (możliwie jak najmniejszy)
atomu węgla związanego z grupą funkcyjną oraz nazwę odpowiednią dla danej grupy funkcyjnej.
W przypadku obecności kilku grup funkcyjnych nazwę tworzy się na podstawie grupy mającej
pierwszeństwo, pozostałe grupy podaje się za pomocą przedrostków wymienianych w porządku
alfabetycznym.
Tabela ważniejszych grup funkcyjnych, uszeregowanych według ich pierwszeństwa.
Grupa funkcyjna
Klasa związku
Przedrostek
Końcówka
rodnik
ylo-
-yl
kation
...ylio-
-ium, ...-iowy
R
–
R-COO
–
R-SO
3
–
RO- lub ArO
–
anion węglowodoru
anion kwasu karboksylowego
anion kwasu sulfonowego
alkoholi i fenoli
...ido-
karboksylano-
sulfoniano-
oksydo
-id
-an
-sulfonian
-olan
-COOH
kwasy karboksylowe
karboksy-
kwas -owy
-SO
3
H
kwasy sulfonowe
sulfo-
kwas -sulfonowy
-COOR
estry
R-oksykarbonylo-
-an R
-COX
halogenki kwasowe
fluorowcoformylo-
halogenek acylu
-CONH
2
amidy
karbamilo-
-amid
-CN
nitryle
cyjano-
-nitryl
-CHO
aldehydy
formylo-
-al
13
C O
ketony
okso-
-on
-OH
alkohole
hydroksy-
-ol
-OH
fenole
hydroksy-
-ol
-SH
tiole
merkapto-
-tiol
-NH
2
aminy
amino-
-amina
-NO
2
związki nitrowe
nitro-
-
-OR
etery
R-oksy-
R-oksyalkan
-X
fluorowcopochodne
nazwa anionu fluorowca
-
Przykłady:
3-aminofenol
NH
2
OH
kwas 3-nitrobenzeno-1,2-dikarboksylowy
COOH
COOH
NO
2
CH
3
CH
CHO
CH
2
CH
2
COOH
kwas 4-formylopentanowy
.
C
6
H
5
-NH
3
+
Cl
–
chlorek anilinium (nazwa dopuszczalna: chlorek aniliniowy)
(CH
3
-NH
2
-C
2
H
5
)
+
I
–
jodek etylometyloamonium (nazwa dopuszczalna: jodek etylometyloamoniowy)
a) fluorowcopochodne węglowodorów
Halogenopochodne węglowodorów można nazywać stosując dwa systemy:
– system podstawnikowy – wymienia się lokanty atomów węgla związanych z podstawnikiem,
właściwy przedrostek krotności, nazwę podstawnika z końcówką „-o” i nazwę odpowiedniego
węglowodoru.
– system grupowo-funkcyjny – nazwę tworzymy łącząc nazwę anionu fluorowca z nazwą grupy
powstałej przez formalne oderwanie z cząsteczki związku atomu fluorowca.
Przykłady:
14
1-chloro-3-metylobenzen
(3-chlorotoluen lub m-chlorotoluen)
CH
3
Cl
1-fluoropropan lub fluorek propylu
CH
3
CH
2
CH
2
F
2-bromo-4-jodo-2-metyloheksan
CH
3
CH
2
CH CH
2
C CH
3
CH
3
I
Br
b) alkohole
Alkohole monowodorotlenowe można nazywać stosując dwa systemy:
– system podstawnikowy – wymienia się nazwę odpowiedniego węglowodoru, lokant atomu
węgla związanego z grupą hydroksylową, końcówkę „-ol”.
– system grupowo-funkcyjny – nazwę tworzy się łącząc słowo „alkohol” z nazwą grupy
wywodzącej się od danego węglowodoru z końcówką „-owy”.
Nazwy alkoholi nienasyconych tworzy się podając rdzeń nazwy węglowodoru, lokant atomu
węgla rozpoczynającego wiązanie wielokrotne, końcówkę charakterystyczną dla typu wiązania,
lokant atomu węgla połączonego z grupą hydroksylową i końcówkę „-ol”. Numerację łańcucha
prowadzi się tak by lokant grupy hydroksylowej był jak najmniejszy.
Nazwy alkoholi nasyconych o rozgałęzionych łańcuchach tworzy się podając kolejno: lokanty
podstawników, właściwy przedrostek krotności, nazwę łańcucha bocznego z końcówką „-o”,
nazwę alkanu, lokanty atomów węgla związanych z grupami hydroksylowymi, właściwy
przedrostek krotności, końcówkę „-ol”. Łańcuch główny numeruje się tak by lokanty grup
hydroksylowych były jak najmniejsze.
Przykłady:
pent-3-yn-2-ol
CH
3
C C CH CH
3
OH
fenylometanol (alkohol benzylowy)
CH
2
OH
4-etylo-2-metyloheptan-3-ol
CH
3
CH
2
CH
2
CH CH CH CH
3
CH
3
C
2
H
5
OH
Alkohole wielowodorotlenowe
15
– system podstawnikowy – wymienia się nazwę odpowiedniego węglowodoru, lokanty atomów
węgla związanych z grupą hydroksylową, właściwy przedrostek krotności, końcówkę „-ol”.
Przykład:
CH
3
CH
CH
CH
3
OH
OH
butano-2,3-diol
Alkoholany
Nazwy alkoholanów tworzy się podając nazwę systematyczną alkoholu z końcówką „-an” i
nazwę kationu.
c) fenole
Fenol to nazwa zwyczajowa; nazwa systematyczna najprostszego fenolu to hydroksybenzen.
Nazwy pochodnych fenolu tworzy się podobnie jak w przypadku arenów, podając na końcu
wyraz „fenol”. Dopuszczono do użycia niektóre nazwy zwyczajowe:
OH
OH
OH
OH
OH
OH
1,2-dihydroksybenzen 1,3-dihydroksybenzen 1,4-dihydroksybenzen
pirokatechina rezorcyna hydrochinon
OH
CH
3
2-metylofenol
o-krezol
Fenolany
Nazwy fenolanów tworzy się podając nazwę systematyczną danego fenolu z końcówką „-an” i
nazwę kationu.
d) aldehydy
Nazwy aldehydów łańcuchowych tworzy się dodając do nazwy odpowiedniego węglowodoru
końcówkę „-al”. Tworząc nazwy aldehydów o rozgałęzionych łańcuchach postępuje się podobnie
jak dla alkoholi o łańcuchach rozgałęzionych. Numerację atomów węgla prowadzi się od atomu
węgla grupy aldehydowej. Nazwę w systemie grupowo-funkcyjnym tworzy się zastępując
słowem „aldehyd” słowo „kwas” w nazwie zwyczajowej kwasu karboksylowego.
Nazwy innych aldehydów tworzy się dodając końcówkę „-karboaldehyd” do nazwy
macierzystego węglowodoru.
Przykłady:

16
aldehyd benzoesowy
C
O
H
cyklopentanokarboaldehyd
C
O
H
CH
3
CH
2
CH
2
C
O
H
butanal lub aldehyd masłowy
.
e) ketony
Nazwy ketonów alifatycznych i cykloalifatycznych tworzy się dodając do nazwy odpowiedniego
węglowodoru końcówkę „-on” (numerację atomów węgla prowadzi się tak by atom węgla grupy
karbonylowej miał jak najniższy lokant) lub ze słowa „keton” i alfabetycznie wymienianych nazw
grup związanych z grupą karbonylową (pierwsza z końcówką „-owo”, druga „-owy”).
Dopuszczono do stosowania nazwy zwyczajowe: aceton – propanon, benzofenon – keton
difenylowy i acetofenon – keton fenylowo-metylowy)
Przykład
CH
3
CH
2
C
O
CH
2
CH
2
CH
3
heksan-3-on lub keton etylowo-propylowy
f) kwasy karboksylowe
Nazwy kwasów tworzy się stosując wyraz „kwas” i nazwę węglowodoru zawierającego tyle
atomów węgla ile jest w cząsteczce kwasu (łącznie z węglem grupy karboksylowej), właściwy
przedrostek krotności i końcówkę „-owy”. Dla kwasów nienasyconych po słowie „kwas” podaje
się rdzeń nazwy, lokant atomu węgla rozpoczynającego wiązanie wielokrotne licząc od grupy
karboksylowej, końcówkę charakterystyczną dla danego wiązania wielokrotnego i końcówkę „-
owy”. Nazwy kwasów aromatycznych – po słowie „kwas” podaje się nazwę arenu z końcówką „-
o” i końcówkę „-karboksylowy”. Dopuszczalne jest stosowanie wielu nazw zwyczajowych.
Przykłady:

17
kwas (Z)-oktadec-9-enowy lub kwas oleinowy
CH
3
(CH
2
)
7
CH CH
(CH
2
)
7
COOH
COOH
kwas benzenokarboksylowy
(kwas benzoesowy)
C
3
H
7
COOH
kwas butanowy lub kwas masłowy
Sole kwasów karboksylowych
Nazwy soli tworzy się podając nazwę anionu z końcówką „-an” i nazwę kationu w dopełniaczu.
Przykład:
CH
3
COOLi
etanian (octan) litu
g) estry
Nazwy estrów tworzy się podobnie jak nazwy soli, zastępując nazwę kationu nazwą alkilu lub
arylu. W przypadku estrów o różnych grupach wymienia się je w kolejności alfabetycznej; dla
estrów o tych samych grupach alkilowych lub arylowych stosuje się dodatkowo właściwy
przedrostek krotności.
Przykłady:
HCOOC
4
H
9
metanian (mrówczan) butylu
CH
3
OOC-COOCH
3
etanodionian (szczawian) dimetylu
S
O
O
O
O
CH
3
C
3
H
7
siarczan(VI) metylu-propylu
P O
O
O
O
H
CH
3
CH
3
wodorofosforan(V) dimetylu
h) aminy
Nazwy amin pierwszorzędowych tworzy się podając nazwę grupy z łącznikiem „-o” i końcówkę
„-amina”. Nazwy amin drugorzędowych tworzy się podając przedrostek krotności „di-”, nazwę
grupy z łącznikiem „-o” lub wymieniając podstawniki w kolejności alfabetycznej i końcówkę „-
amina”. Nazwy amin trzeciorzędowych tworzy się podając (1) przedrostek krotności „tri-”, nazwę
grupy z łącznikiem „-o”; (2) przedrostek krotności „di-”, nazwę grupy z łącznikiem „-o” i
najbardziej złożony podstawnik połączony z końcówką „-amina”; (3) wymieniając dwa
podstawniki w kolejności alfabetycznej poprzedzone symbolem „N” i najbardziej złożony
podstawnik połączony z końcówką „-amina”

18
Dopuszczalne jest stosowanie nazw zwyczajowych: anilina – fenyloamina i toluidyny (izomery
orto, meta i para).
N-etylo-N-metylopropyloamina
N
CH
3
C
2
H
5
C
3
H
7
N,N-dimetyloanilina
N
C
4
H
9
C
4
H
9
H
N
CH
3
C
4
H
9
butylometyloamina
.
i) amidy
Nazwy amidów pierwszorzędowych tworzy się w systemie podstawnikowym przez dodanie do
nazwy odpowiedniego węglowodoru z łącznikiem „-o” końcówki „-amid” dla węglowodorów
alifatycznych i „-karboksyamid” dla aromatycznych, a systemie grupowo-funkcyjnym łącząc
słowo „amid” z nazwą kwasu karboksylowego, z którego pochodzi. Nazwy amidów drugo- i
trzeciorzędowych tworzy się z nazw amidów pierwszorzędowych wymieniając grupy
węglowodorowe poprzedzone symbolem „N”.
Przykłady:
N,N-dietyloetanoamid
N-etyloetanoamid
CH
3
C
O
N C
2
H
5
C
2
H
5
CH
3
C
O
N H
C
2
H
5
benzenokarboksyamid
lub amid kwasu benzoesowego
C
O
NH
2
C
2
H
5
C
O
NH
2
propanoamid
lub amid kwasu propionowego
.

19
j) hydroksykwasy
Nazwy hydroksykwasów tworzy się podając słowo „kwas”, lokant atomu węgla z dołączoną
grupą hydroksylową, przedrostek „hydroksy-” i nazwę kwasu. Numerację atomów węgla
prowadzi się od węgla grupy karboksylowej. Dopuszcza się stosowanie wielu nazw
zwyczajowych.
Przykład
C
2
H
5
CH COOH
OH
kwas 2-hydroksybutanowy
k) oksokwasy
Nazwy oksokwasów tworzy się identycznie jak hydroksykwasów używając przedrostka „okso-
”dla oznaczenia grupy ketonowej.
Przykład
C
2
H
5
C CH
2
CH
2
COOH
O
kwas 4-oksoheksanowy
l) aminokwasy
Nazwy aminokwasów tworzy się identycznie jak hydroksykwasów używając przedrostka „amino-
” dla oznaczenia grupy aminowej.
W nomenklaturze aminokwasów białkowych stosuje się głównie nazwy zwyczajowe.
Przykład
C
2
H
5
CH COOH
NH
2
kwas 2-aminobutanowy
ł) peptydy
We wzorach fragment z wolną grupą aminową (N-końcową, N-terminalną) zapisuje się po lewej
stronie, a z wolną grupą karboksylową (C-końcową, C-terminalną) po stronie prawej. Nazwę
peptydu tworzy się w oparciu o nazwy zwyczajowe aminokwasów. Wymienia się je w kolejności
występowania we wzorze z końcówką „-ylo” rozpoczynając od reszty N-końcowej i kończąc
nazwą aminokwasu C-końcowego. Często stosuje się odpowiednie skróty.
Przykład
H
3
N CH CO NH CH
2
CO NH CH COO
CH
3
CH
2
OH
+
_
alanyloglicyloseryna Ala-Gly-Ser
m) węglowodany
W nomenklaturze obowiązują nazwy zwyczajowe o wspólnej końcówce „-oza”. Monosacharydy
zawierają w swoich cząsteczkach grupy aldehydowe lub ketonowe stąd podział na aldozy i
ketozy. Cukry, w zależności od ilości atomów węgla w cząsteczkach, dzieli się na: triozy, tetrozy,
pentozy itd.
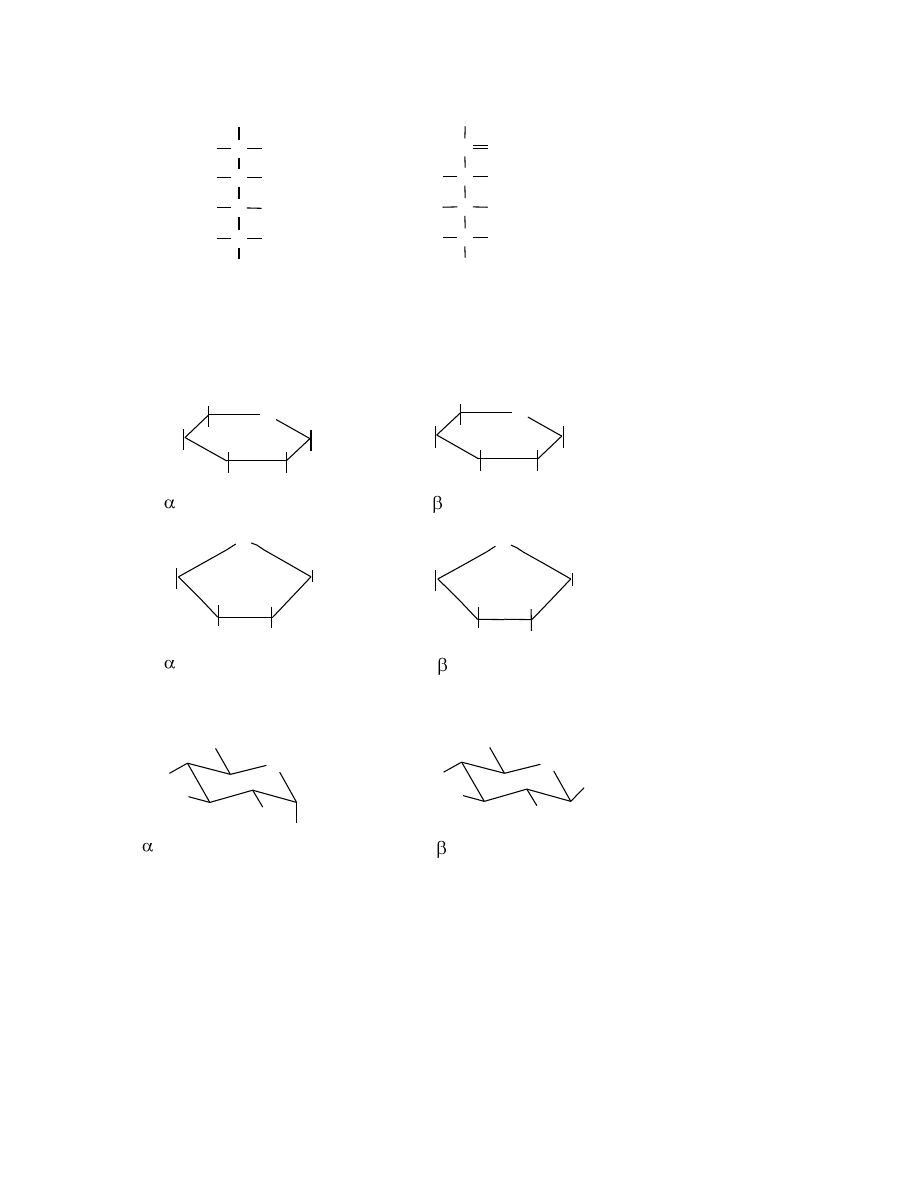
Dla dokładniejszego przedstawienia struktury stosuje się szereg dodatkowych oznaczeń:
– „D” lub „L” (we wzorach w projekcji Fischera), które opisują podobieństwo konfiguracji
węglowodanu do konfiguracji aldehydu glicerynowego przez określenie położenia grupy

20
hydroksylowej przy ostatnim węglu asymetrycznym (najbardziej oddalonym od węgla grupy
aldehydowej lub ketonowej). Jeżeli we wzorze aldozy lub ketozy grupa hydroksylowa znajduje
się po prawej stronie ostatniego asymetrycznego atomu węgla to danemu związkowi przypisuje
się konfigurację „D”, jeżeli zaś po lewej stronie to danemu związkowi przypisuje się konfigurację
„L”.
– „+” lub „–”, opisujące rzeczywistą, doświadczalnie wyznaczoną, skręcalność optyczną danego
związku; oznaczenia te są niezależne od przynależności do szeregu „D” lub „L”.
– „ ” lub „ ”(we wzorach w projekcji Hawortha), rozróżniające anomery – stereoizomery o
różnej konfiguracji przy atomie węgla C-1 dla aldoz i atomie węgla C-2 dla ketoz.
Stosując wzory w projekcji Hawortha nazwy węglowodanów opiera się na nazwach związków
heterocyklicznych. Związki o pierścieniu pięcioczłonowym to furanozy, a o pierścieniu
sześcioczłonowym to piranozy. Dla pokazania ułożenia atomów (z uwzględnieniem kątów
między wiązaniami) w cząsteczkach piranoz stosuje się wzory przestrzenne (zwykle szkieletowe)
oparte na konformacji krzesełkowej cykloheksanu.
Przykłady:
21
C
C
C
C
C H
2
O H
O H
O H
H
H
H
H O
O
C H
2
O H
w z o r y w p r o j e k c j i F i s c h e r a :
D - ( - ) - f r u k t o z a
( k e t o h e k s o z a )
w z o r y w p r o j e k c j i H a w o r t h a :
O
O H
O H
O H
O H
C H
2
O H
C H
2
O H
O H
O H
O H
O H
O
- D - ( + ) - g l u k o p i r a n o z a
- D - ( + ) - g l u k o p i r a n o z a
1
1
1
O
O H
H O
O H
C H
2
O H
H O H
2
C
1
O H
C H
2
O H
1
H O H
2
C
H O
O H
O
- D - ( - ) - f r u k t o f u r a n o z a
- D - ( - ) - f r u k t o f u r a n o z a
w z o r y p r z e s t r z e n n e a n o m e r o w g l u k o z y :
C H O
C
C
C
C
C H
2
O H
O H
O H
O H
H
H
H
H
H O
D - ( + ) - g l u k o z a
( a l d o h e k s o z a )
1
,
O
O H
H O
H O
O H
C H
2
O H
O
O H
O H
H O
H O
C H
2
O H
- D - ( + ) - g l u k o p i r a n o z a
- D - ( + ) - g l u k o p i r a n o z a
Literatura:
1. Nomenklatura chemii nieorganicznej, Polskie Towarzystwo Chemiczne, red. nauk. Z. Stasicka,
Wydawnictwo Uniwersytetu Wrocławskiego, Wrocław 1998.
2. Z. Kluz, M.M. Poźniczek, Nomenklatura związków chemicznych. Poradnik dla nauczycieli,
Wydawnictwo Uniwersytetu Wrocławskiego, Wrocław 1999.
3. W. Danikiewicz, Zmiany w nazewnictwie związków organicznych, „Chemia w Szkole”, 3
(1997), 153.
22
4. Kompendium terminologii chemicznej, Polskie Towarzystwo Chemiczne, red. nauk. Z.
Stasicka i O. Achmatowicz, Zamkom, Kraków 2005.
K. Sommer, K.H. Wünsch, M. Zettler, Matura bez problemów. Chemia, tłum. z niem, MUZA
S.A. Edukacja, Warszawa 1999.
5. T. Mizerski, Tablice chemiczne, Wyd. Adamantan, Warszawa 2004.
6. T. Mizerski, Recenzja książki Nazwy związków chemicznych J. Kalembkiewicz, J. Lubczak, R.
Lubczak, „Chemia w Szkole”, 5 (2000), 282.
Równanie reakcji:
A + B (tu jest jeden z poniższych znaków) C + D
reagenty (!)
produkty
=
dla wyrażenia stosunków stechiometrycznych
→
dla wskazania kierunku przebiegu całkowitej reakcji
dla reakcji przebiegających w obu kierunkach
dla równowagi chemicznej
zamiast stosujemy
Izomeria:
cis-trans – położenie po tej samej lub różnych stronach płaszczyzny odniesienia/wiązania
podwójnego/płaszczyzny pierścienia; cis – ta sama strona; trans – różne strony
cis trans
Cl
Cl
C
C
Cl
Cl
H
H
Cl
Cl
C
C
Cl
H
Cl
H
E-Z – konfiguracja dwóch najstarszych podstawników względem wiązania podwójnego
Z (razem) – po jednej stronie; E (osobno) – po przeciwnych stronach
Z E
C
C
Cl
Cl
H
H
C
C
Cl
H
Cl
H
Wyszukiwarka
Podobne podstrony:
potrafie korzystac z internetu Nieznany (7)
1 katastyrofy chemiczneid 9337 Nieznany (2)
posrednik internetowy Nieznany
Gruszecki,P Podlaczamy Interne Nieznany
potrafie korzystac z internetu Nieznany (6)
Physical and chemical character Nieznany
potrafie korzystac z internetu Nieznany (8)
marketing wirusowy w internecie Nieznany
nomenklatura 1 id 320705 Nieznany
potrafie korzystac z internetu Nieznany
Potrafie korzystac z Internetu Nieznany (12)
Zwiazki chemiczne pierwistakow Nieznany
Projektowanie strony internetow Nieznany
Potrafie korzystac z Internetu Nieznany (3)
Potrafie korzystac z Internetu Nieznany (5)
09 Stosowanie chemicznych proce Nieznany (2)
Potrafie korzystac z Internetu Nieznany (2)
potrafie korzystac z internetu Nieznany (14)
więcej podobnych podstron