Władysław Walkowiak Podstawy Chemii Nieorganicznej PChN_WPC2002w - (PWr)
Wykład 9. Pierwiastki d- i f- elektronowe i ich związki chemiczne
1
Wykład 9.
Pierwiastki d- i f-elektronowe oraz ich
związki chemiczne
1. Właściwości pierwiastków d-elektronowych
Pierwiastki d - elektronowe:
na
zerowym
stopniu
utlenienia zawierają od 1 do 10 elektronów d, są to więc
pierwiastki grup pobocznych, tj. od grupy 3-ciej do 12-tej
(w sumie 10 grup).
Pierwiastki przejściowe - atomy lub jony pierwiastków
posiadające niecałkowicie wypełnione orbitale typu d lub f:
a) zewnątrz przejściowe
→
→
→
→
niecałkowicie wypełnione orbitale d
b) wewnątrz przejściowe
→
→
→
→
niecałkowicie wypełnione orbitale f
Cynkowce nie są więc pierwiastkami przejściowymi!
Władysław Walkowiak Podstawy Chemii Nieorganicznej PChN_WPC2002w - (PWr)
Wykład 9. Pierwiastki d- i f- elektronowe i ich związki chemiczne
2
Szczególna trwałość konfiguracji
oraz
↑
↑
↑
↑
↑
↑↓
↑↓
↑↓
↑↓
↑↓
f:
↑
↑
↑
↑
↑
↑
↑
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
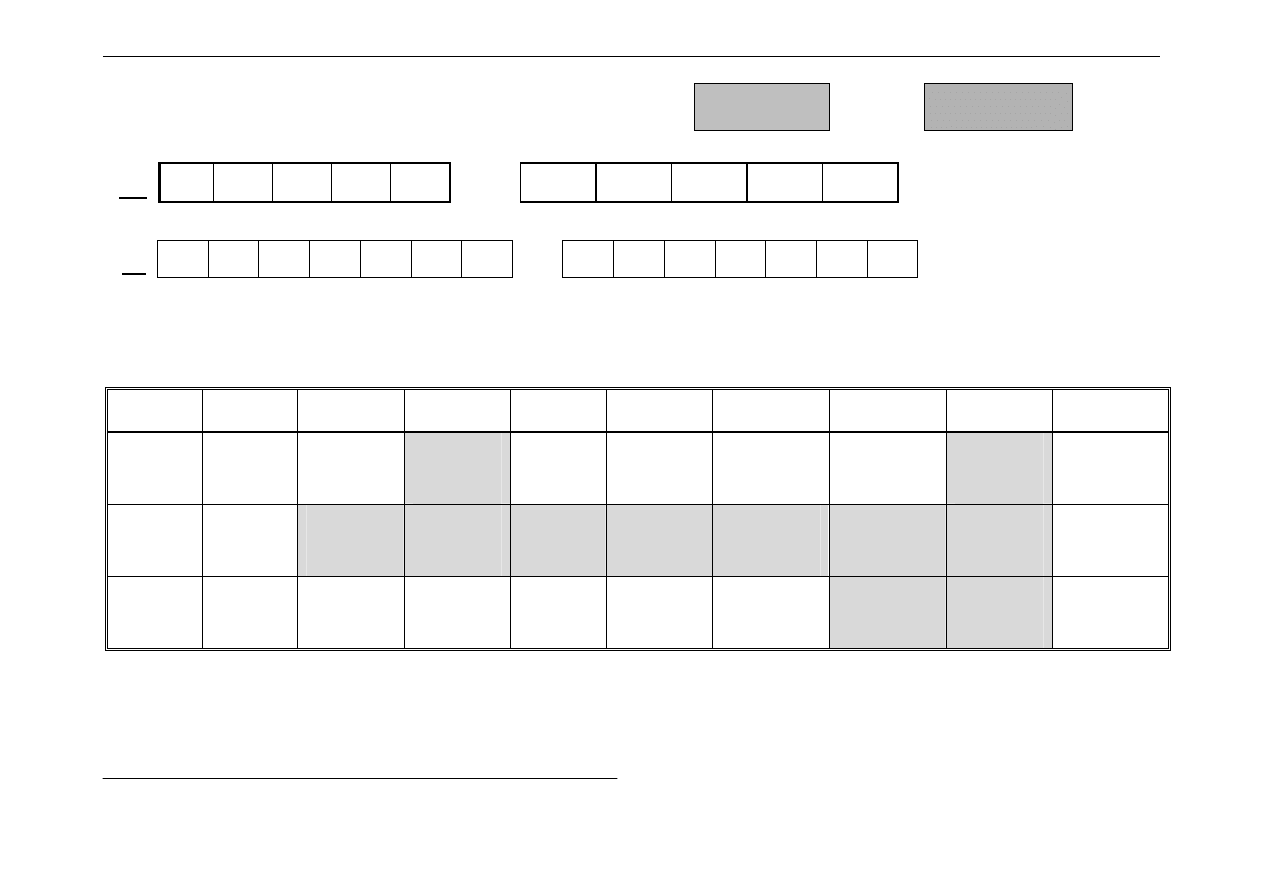
Konfiguracje poszczególnych pierwiastków d-elektronowych
na zerowym stopniu utlenienia:
3
4
5
6
7
8
9
10
11
12
Sc
3d
1
4s
2
Ti
3d
2
4s
2
V
3d
3
4s
2
Cr
3d
5
4s
1
Mn
3d
5
4s
2
Fe
3d
6
4s
2
Co
3d
7
4s
2
Ni
3d
8
4s
2
Cu
3d
10
4s
1
Zn
3d
10
4s
2
Y
4d
1
5s
2
Zr
4d
2
5s
2
Nb
4d
4
5s
1
Mo
4d
5
5s
1
Tc
4d
6
5s
1
Ru
4d
7
5s
1
Rh
4d
8
5s
1
Pd
4d
10
5s
0
Ag
4d
10
5s
1
Cd
4d
10
5s
2
La
5d
1
6s
2
Hf
5d
2
6s
2
Ta
5d
3
6s
2
W
5d
4
6s
2
Re
5d
5
6s
2
Os
5d
6
6s
2
Ir
5d
7
6s
2
Pt
5d
9
6s
1
Au
5d
10
6s
1
Hg
5d
10
6s
2
Pola
zaciemnione
oznaczają
anomalie
w
strukturze
elektronowej
pierwiastków.
d
5
i d
10
d:
f
7
i f
14
Władysław Walkowiak Podstawy Chemii Nieorganicznej PChN_WPC2002w - (PWr)
Wykład 9. Pierwiastki d- i f- elektronowe i ich związki chemiczne
3
2. Stopnie
utlenienia
i
formy
jonowe
pierwiastków
d- elektronowych
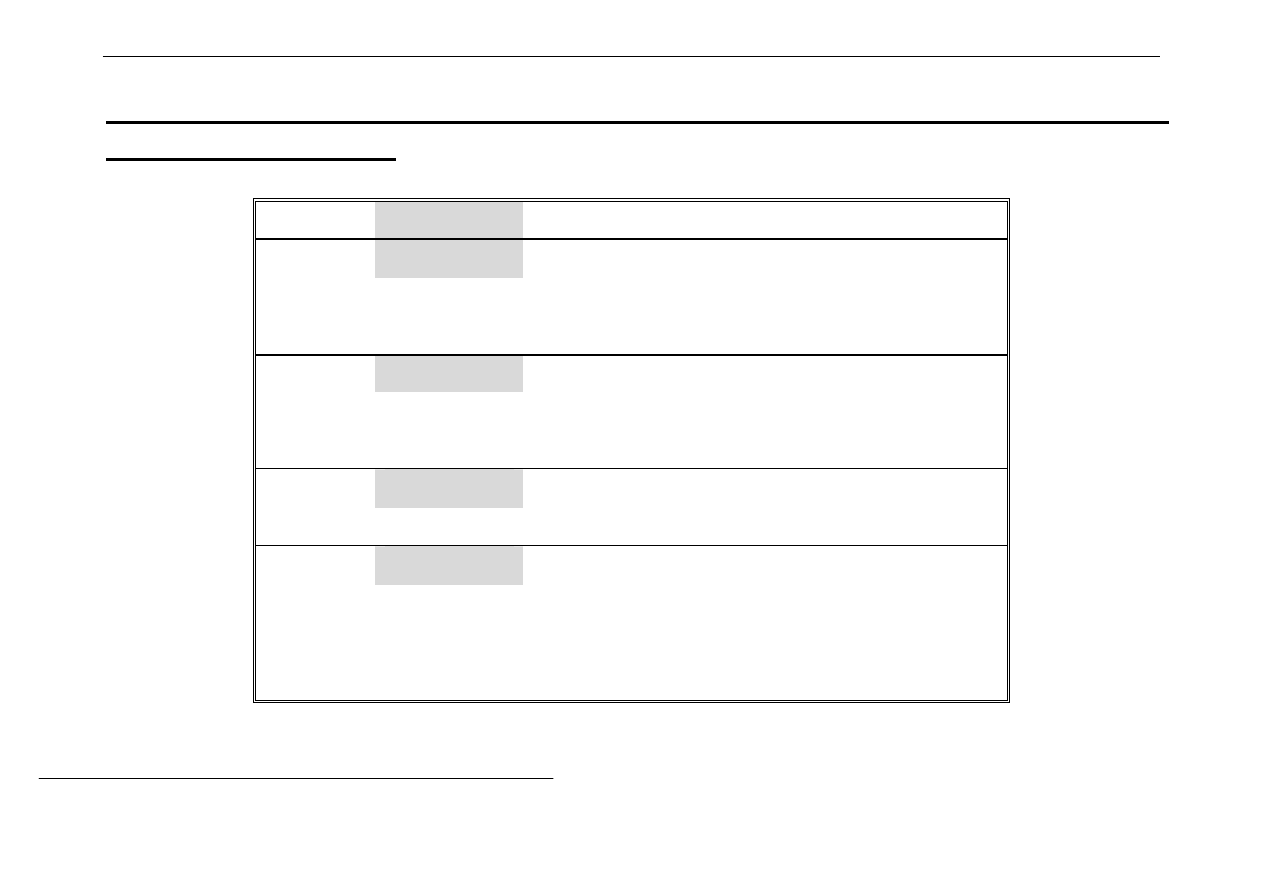
Grupa 3
+3
→
→
→
→
Sc
3+
Grupa 4
+4
→
→
→
→
Ti
4+
+3
→
→
→
→
Ti
3+
+2
→
→
→
→
Ti
2+
Grupa 5
+5
→
→
→
→
VO
3
-
+4
→
→
→
→
VO
2+
+2
→
→
→
→
V
2+
Grupa 6
+6
→
→
→
→
CrO
4
2-
+3
→
→
→
→
Cr
3+
Grupa 7
+7
→
→
→
→
MnO
4
-
+6
→
→
→
→
MnO
4
2-
+4
→
→
→
→
MnO
2
+2
→
→
→
→
Mn
2+
-
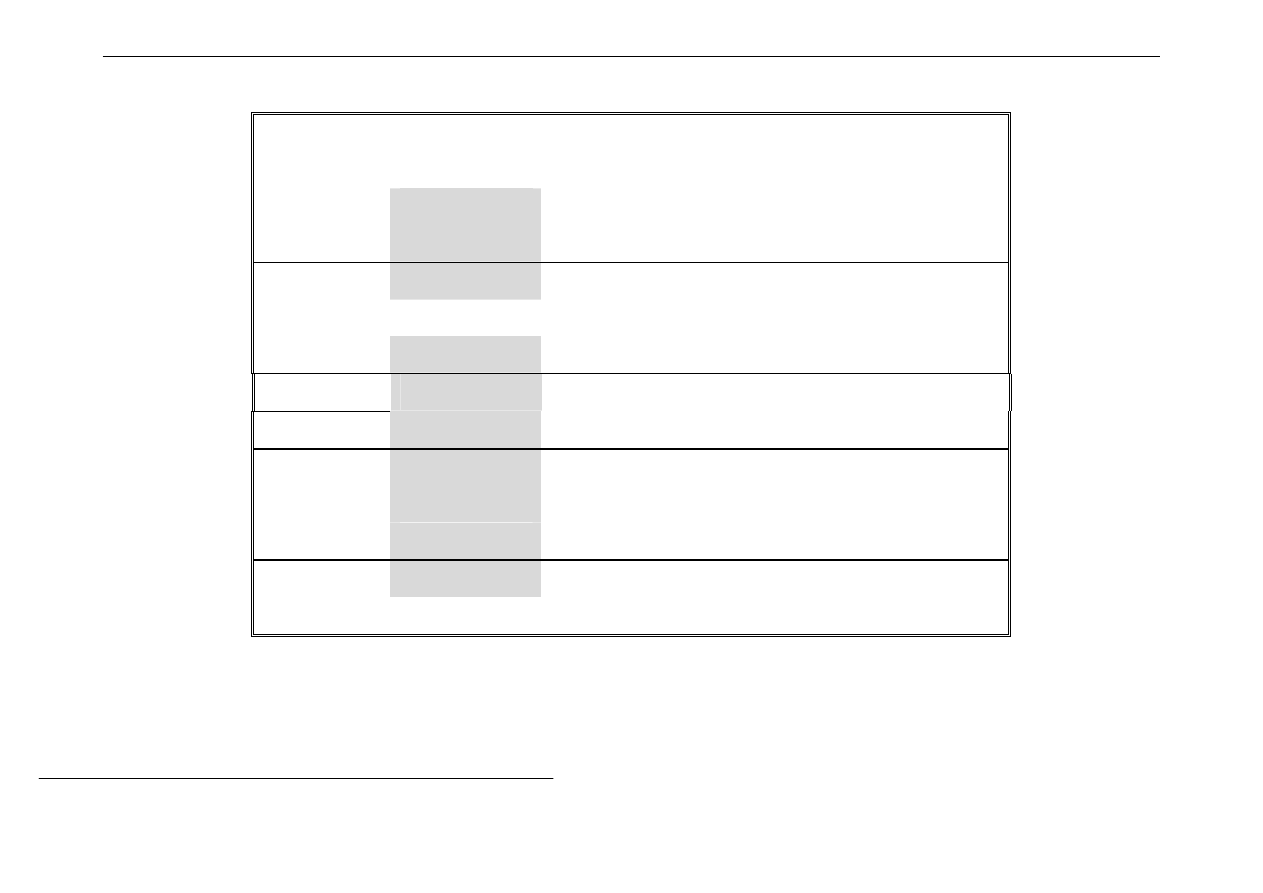
Władysław Walkowiak Podstawy Chemii Nieorganicznej PChN_WPC2002w - (PWr)
Wykład 9. Pierwiastki d- i f- elektronowe i ich związki chemiczne
4
Najtrwalsze stopnie utlenienia
→
→
→
→
pola zaciemnione
Niskie stopnie utlenienia
→
→
→
→
raczej związki jonowe
Grupa 8
+8
→
→
→
→
RuO
4
, OsO
4
+6
→
→
→
→
[FeO
4
]
2-
+3
→
→
→
→
Fe
3+
+2
→
→
→
→
Fe
2+
Grupa 9
+4
→
→
→
→
IrCl
6
2-
+3
→
→
→
→
[Co(CN)
6
]
3-
+2
→
→
→
→
Co
2+
Grupa 10
+4
→
PdCl
6
2-
, PtCl
6
2-
+2
→
→
→
→
PdCl
4
2-
, PtCl
4
2-
, Ni
2+
Grupa 11
+3
→
→
→
→
AuCl
4
-
+2
→
→
→
→
Cu
2+
+1
→
→
→
→
Ag
+
Grupa 12
+2
→
→
→
→
Zn
2+
, Cd
2+
, Hg
2+
+1
→
→
→
→
Hg
2
2+

Władysław Walkowiak Podstawy Chemii Nieorganicznej PChN_WPC2002w - (PWr)
Wykład 9. Pierwiastki d- i f- elektronowe i ich związki chemiczne
5
Wysokie stopnie utlenienia
→
→
→
→
związki kowalencyjne
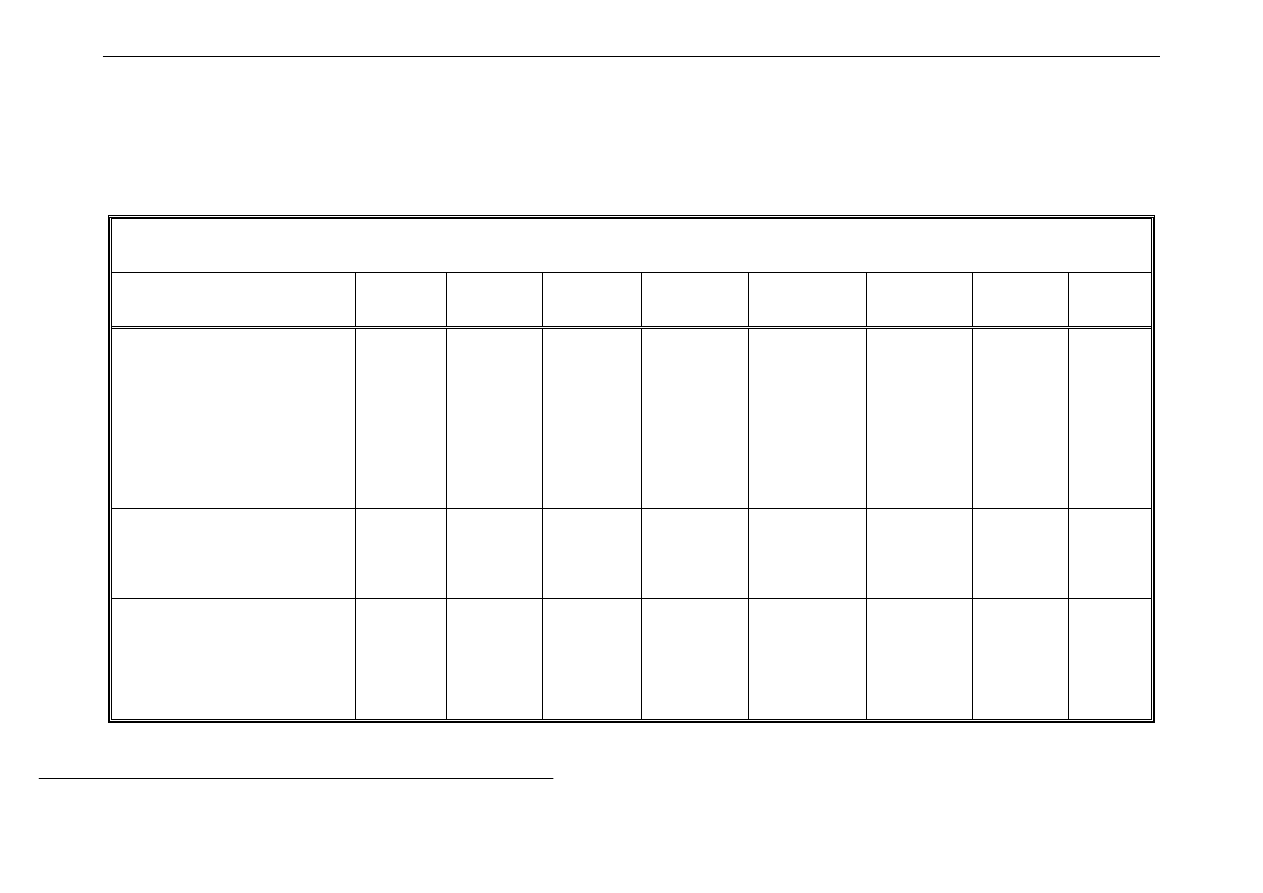
Pierwiastki d-elektronowe zawierają na zewn. orbitalach
typu s 1 lub 2 elektrony:
- wszystkie są metalami,
- występują niemal wszystkie na +2 st. utl. (struktura
s
2
),
a niektóre na +1 st. utl. (miedziowce),
- zawierają elektrony na orbitalach typu d i dlatego
występują na wyższych stopniach utlenienia, np.
Cr(VI), Mn(VII), Pt(IV), Au(III), Os(VIII),
- puste orbitale typu d są powodem silnej skłonności
tych pierwiastków do tworzenia związków
kompleksowych (koordynacyjnych) np. z ligandami
cyjankowymi lub korbonylkowymi.
Władysław Walkowiak Podstawy Chemii Nieorganicznej PChN_WPC2002w - (PWr)
Wykład 9. Pierwiastki d- i f- elektronowe i ich związki chemiczne
6
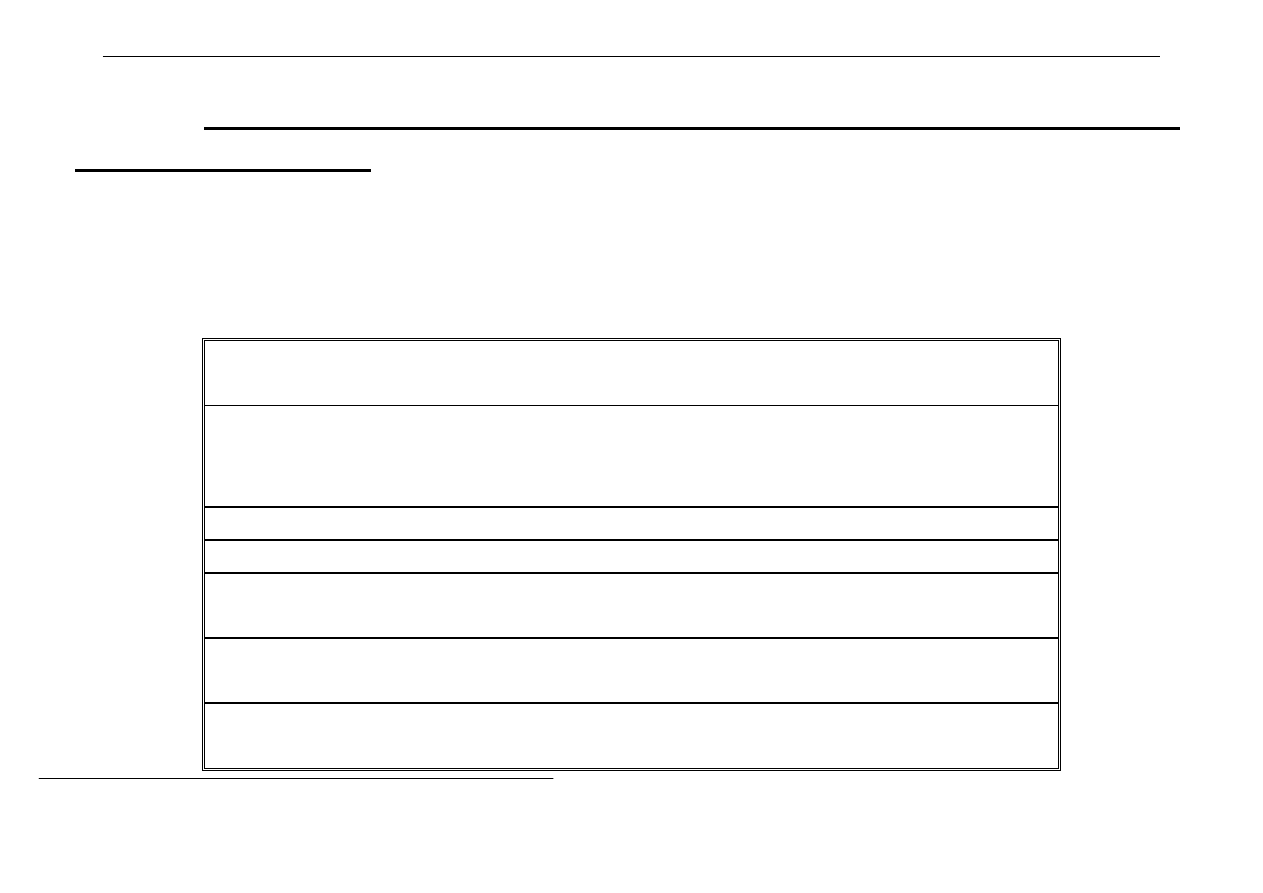
Typy tlenków i jonów pierwiastków d-elektronowych na różnych
stopniach utlenienia występujące w roztworach wodnych
Stopnie utlenienia:
0
+1
+2
+3
+4
+5
+6
+7
+8
Oksoaniony
MO
2
2-
MO
3
3-
MO
2
-
-
MO
4
4-
-
MO
3
2-
MO
3
-
MO
4
2-
MO
4
-
Tlenki
M
2
O
MO
M
2
O
3
MO
2
M
2
O
5
MO
3
M
2
O
7
MO
4
Kationy proste
Oksokationy
M
+
M
2+
M
3+
MO
+
M
4+
MO
2+
MO
2
+
MO
2
2+
M – metal
Władysław Walkowiak Podstawy Chemii Nieorganicznej PChN_WPC2002w - (PWr)
Wykład 9. Pierwiastki d- i f- elektronowe i ich związki chemiczne
7
Właściwości
kwasowo
-
zasadowe
pierwiastków
d-elektronowych
- niższe stopnie utlenienia
→
→
→
→
właściwości zasadowe
- wyższe stopnie utlenienia
→
→
→
→
właściwości kwasowe
- pośrednie stopnie utlenienia
→
→
→
→
właściwości amfoteryczne
Przykłady:
Chrom
+6
CrO
4
2-
- kwaśne
+3
Cr
2
O
3,
Cr(OH)
3
- amfoteryczne
Mangan
+7
MnO
4
-
- kwaśne
+4
MnO
2
- amfoteryczne
+2
Mn(OH)
2
- zasadowe
Cynk
+2
ZnO, Zn(OH)
2
- amfoteryczne
Skand
+3
Sc(OH)
3
- zasadowe
śelazo
+2
Fe(OH)
2
, FeO
- zasadowe
+3
Fe(OH)
3
Fe
2
O
3
- zasadowe
Kobalt
+2
Co(OH)
2
- zasadowe
+3
CoO
- zasadowe
Nikiel
+2
Ni(OH)
2
- zasadowe
+3
NiO
- zasadowe
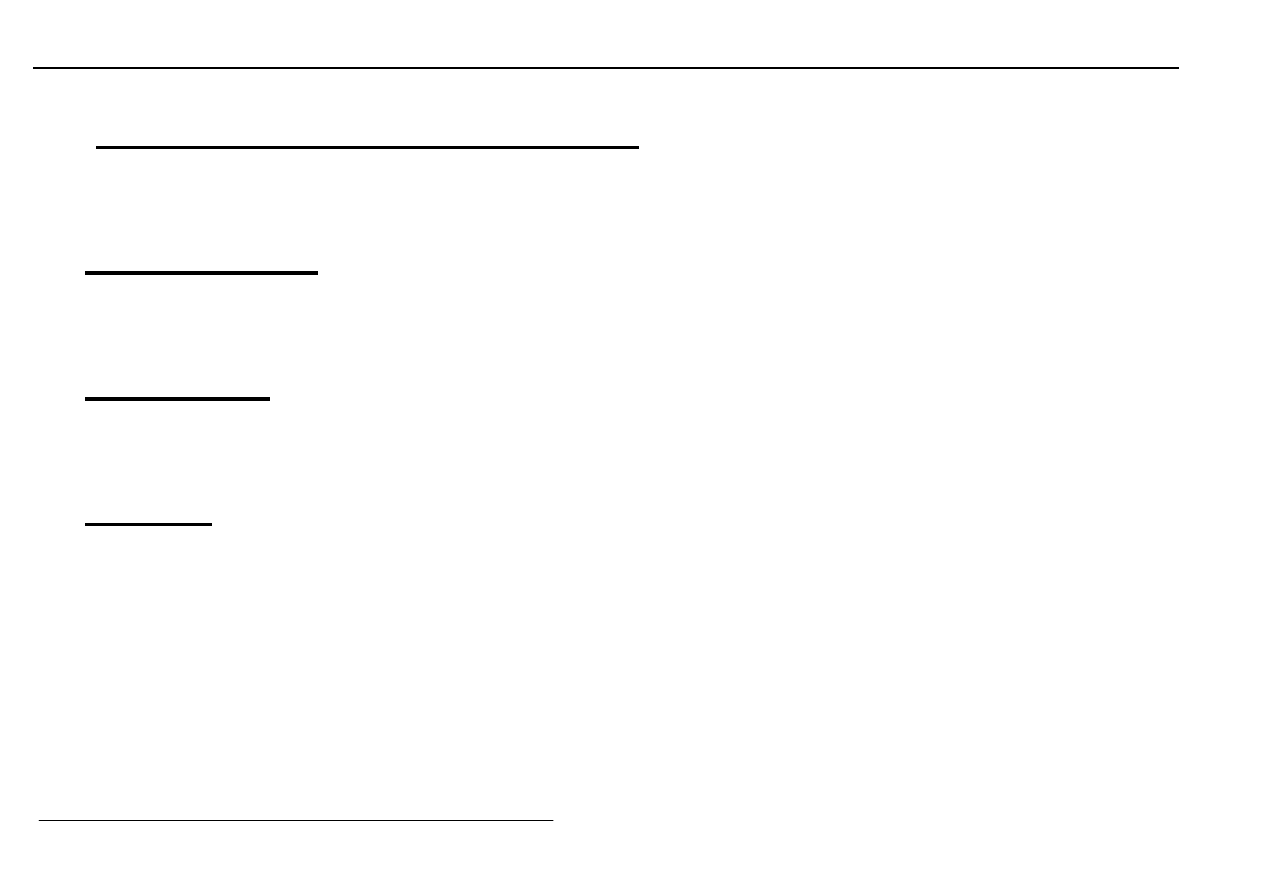
Władysław Walkowiak Podstawy Chemii Nieorganicznej
- kurs WPC2002w
Wykład 9. Pierwiastki d- i f- elektronowe i ich związki chemiczne
8
3. Barwa związków chemicznych
Wiele związków pierwiastków grup pobocznych wyróżnia się
zabarwieniem
→
→
→
→
absorpcja w obszarze widzialnym
→
→
→
→
niewielkie
różnice energetyczne poziomów orbitali d
Bezbarwne są: d
0
i d
10
- elektronowe
Np: Ti
4+
, Sc
3+
, Ag
+
, Zn
2+
, Cd
2+
, Hg
2+
Barwne : od 1 do 9 elektronów na orbitalach typu d
Przykłady:
V
3+
zielony
Cr
3+
zielony
Ni
2+
zielony
Mn
2+
różowy
Cu
2+
niebieski
Fe
2+
zielony
Co
2+
różowy
Władysław Walkowiak Podstawy Chemii Nieorganicznej
- kurs WPC2002w
Wykład 9. Pierwiastki d- i f- elektronowe i ich związki chemiczne
9
4. Inne właściwości pierwiastków d-elektronowych
••••
Typowe właściwości metaliczne:
- połysk metaliczny,
- dobre przewodnictwo cieplne i elektryczne (szczególnie
miedziowce),
- wytrzymałość mechaniczna,
- kowalność.
••••
Krystalizują w 3 typach sieci metalicznych, tj. A
1
, A
2
, A
3
••••
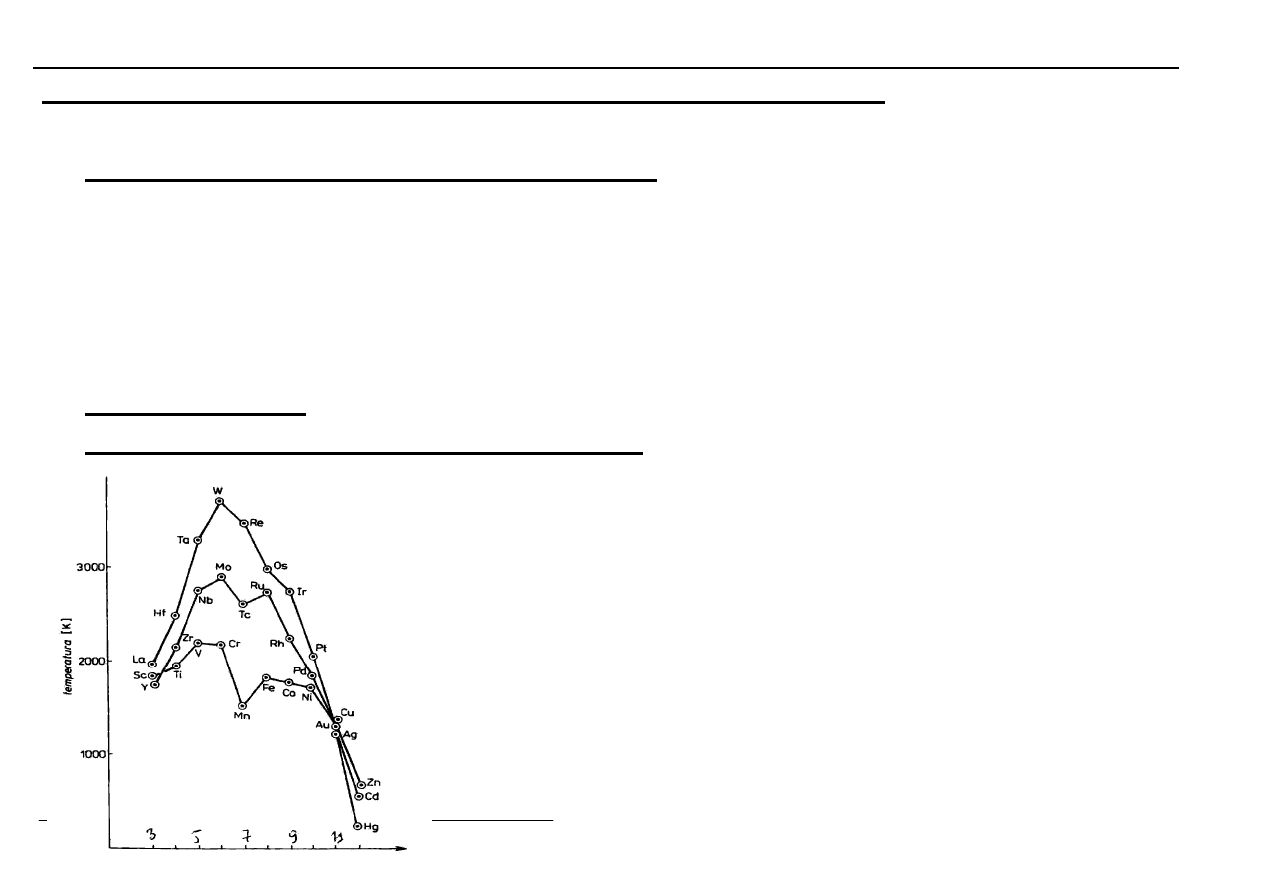
Wysokie temperatury topnienia:
Rekordzista: - wolfram +3410
o
C.
Cynkowce - wyjątkowo niskie.
Pozostałe mają wysokie temp.
topnienia.
W gr. głównych powyżej 1250 K
temp. topn. posiadają tylko:
Be, B, C i Si
Władysław Walkowiak Podstawy Chemii Nieorganicznej
- kurs WPC2002w
Wykład 9. Pierwiastki d- i f- elektronowe i ich związki chemiczne
10
••••
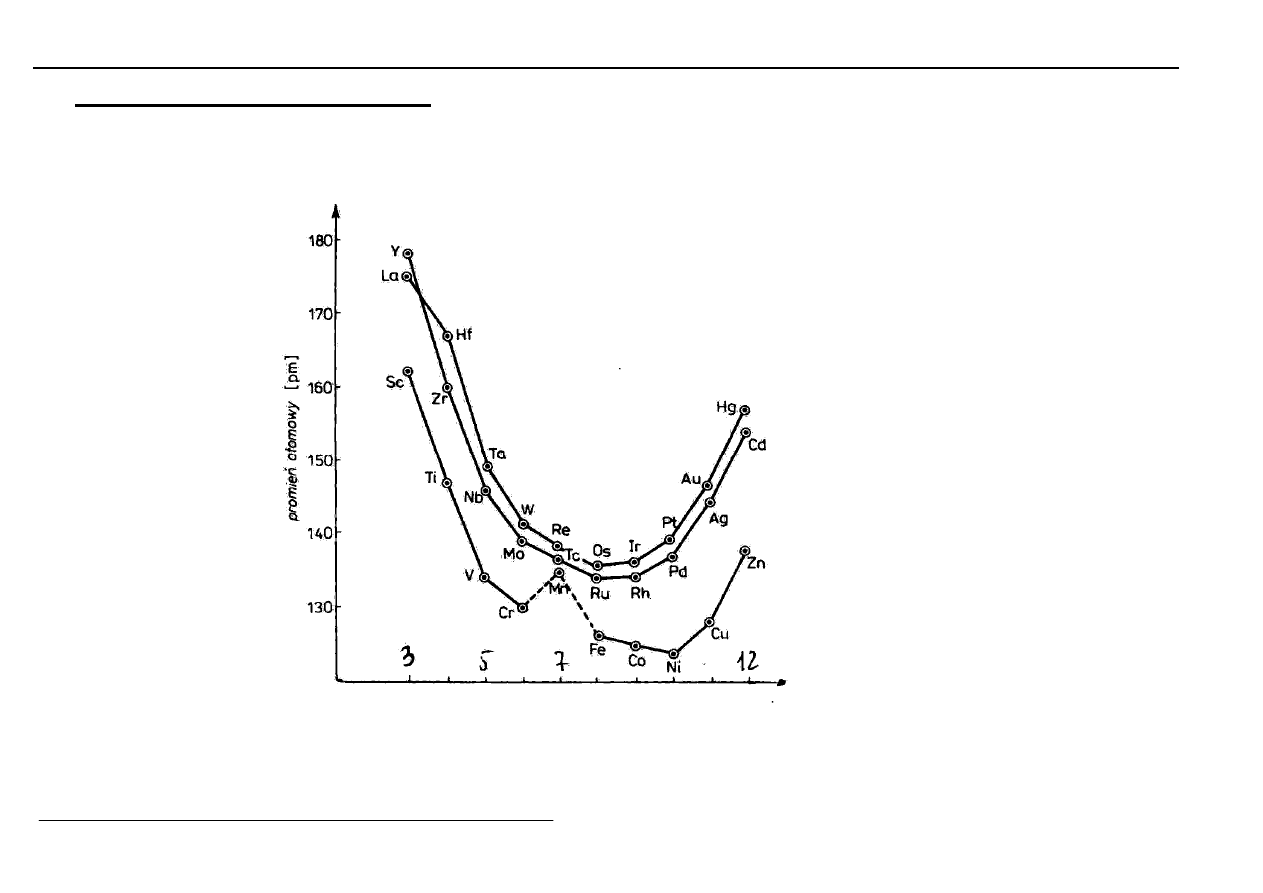
Promienie atomowe - minima dla grup 5
÷÷÷÷
10
Władysław Walkowiak Podstawy Chemii Nieorganicznej
- kurs WPC2002w
Wykład 9. Pierwiastki d- i f- elektronowe i ich związki chemiczne
11
••••
Z wyjątkiem skandu (
δδδδ
= 3,0 kg/dm
3
), itru (4,47 kg/dm
3
) oraz
tytanu (4,54 kg/dm
3
) ich gęstości przekraczają wartości
5,0 kg/dm
3
, tzn. są metalami ciężkimi.
osm
-
22,6 kg/dm
3
iryd
-
22,7 kg/dm
3
platyna -
21,5 kg/dm
3
••••
Wysoki ładunek i mały promień - wysokie wartości potencjału
jonowego (Z
i
/r
i
) - silna tendencja do tworzenia związków
(jonów) kompleksowych.
Elektroujemność rośnie w okresach od 3-ciej do 11-tej grupy.
Np.: okres 4: Sc (1,3), Ti (1,3), Mn (1,7), Fe (1,9), Cu (1,9),
Zn(1,6).
}}}}
maksymalne
gęstości
Władysław Walkowiak Podstawy Chemii Nieorganicznej
- kurs WPC2002w
Wykład 9. Pierwiastki d- i f- elektronowe i ich związki chemiczne
12
Niska elektroujemność oznacza raczej metale nieszlachetne:
Sc (1,3), Fe (1,9), Mn (1,7), Zn (1,6).
Wysoka
elektroujemność
oznacza
metale
szlachetne:
Au (2,4), Pt (2,2), Pd (2,2), Ir (2,2).
Ale metalami szlachetnymi są też: Cu (1,9), Ag (1,9),
Hg (1,9).
••••
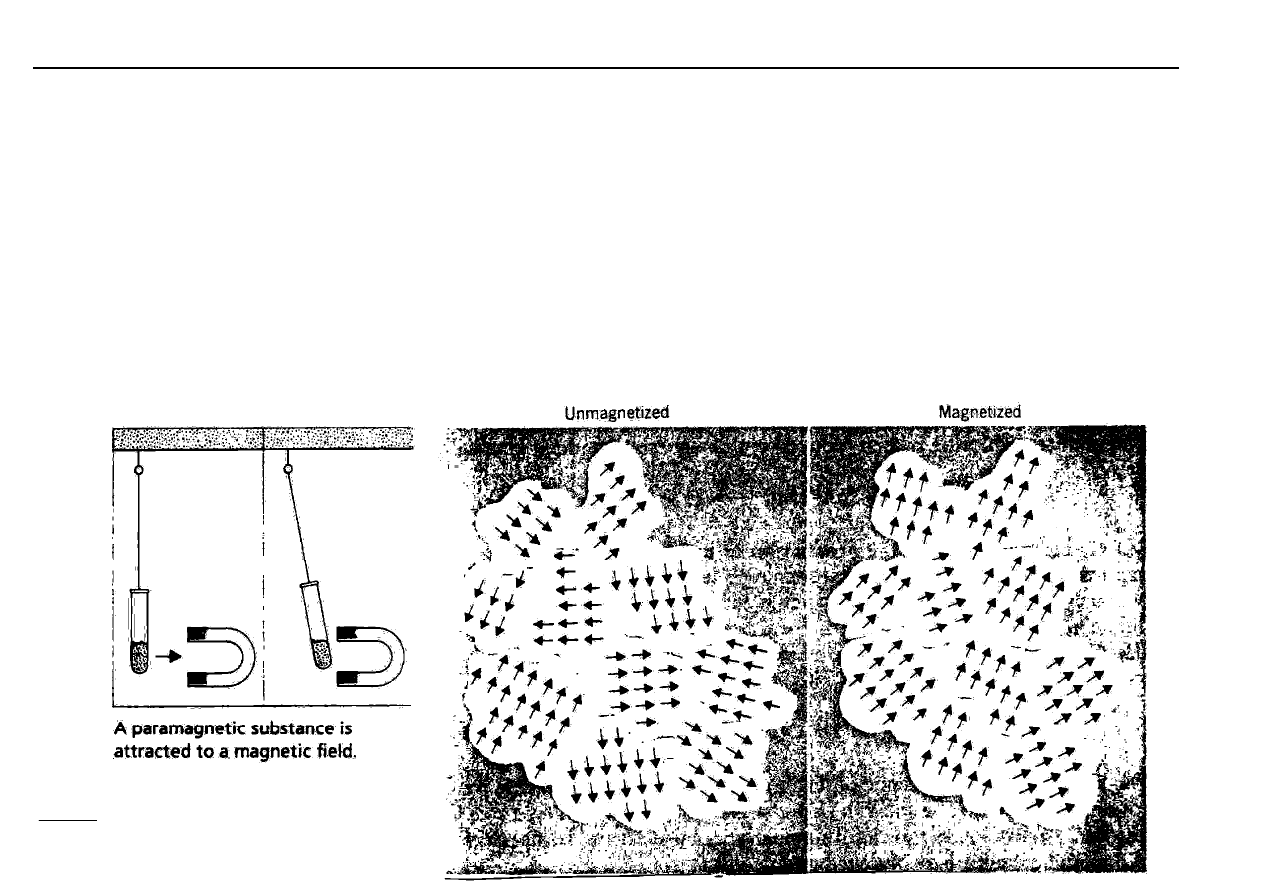
Właściwości magnetyczne
paramagnetyzm
→
→
→
→
niesparowane spiny elektronowe
diamagnetyzm
→
→
→
→
brak niesparowanych spinów elektronowych
Przykłady :
Sc
3+
d
0
-
właściwości diamagnetyczne
Ti
3+
d
1
V
3+
d
2
}}}}
właściwości
paramagnetyczne
Władysław Walkowiak Podstawy Chemii Nieorganicznej
- kurs WPC2002w
Wykład 9. Pierwiastki d- i f- elektronowe i ich związki chemiczne
13
Ni
2+
d
8
Cu
2+
d
9
Zn
2+
d
10
-
właściwości diamagnetyczne
Szczególny rodzaj paramagnetyzmu to ferromagnetyzm
→
→
→
→
istnienie domen jednakowego ułożenia spinów elektronowych:
Fe, Co, Ni, Gd (i ich stopy).
Władysław Walkowiak Podstawy Chemii Nieorganicznej
- kurs WPC2002w
Wykład 9. Pierwiastki d- i f- elektronowe i ich związki chemiczne
14
4. Związki międzymetaliczne
Metale d-elektronowe tworzą liczne stopy
Stopy żelaza:
żeliwo
96 - 97 % Fe 3 - 4 % C
stal
98 - 99,5 % Fe 0,5 - 2,0 % C
stal nierdzewna 73 - 79 % Fe 14 - 18 % Cr 7 - 9% Ni
Stopy miedzi – brązy i mosiądze
Rodzaje stopów:
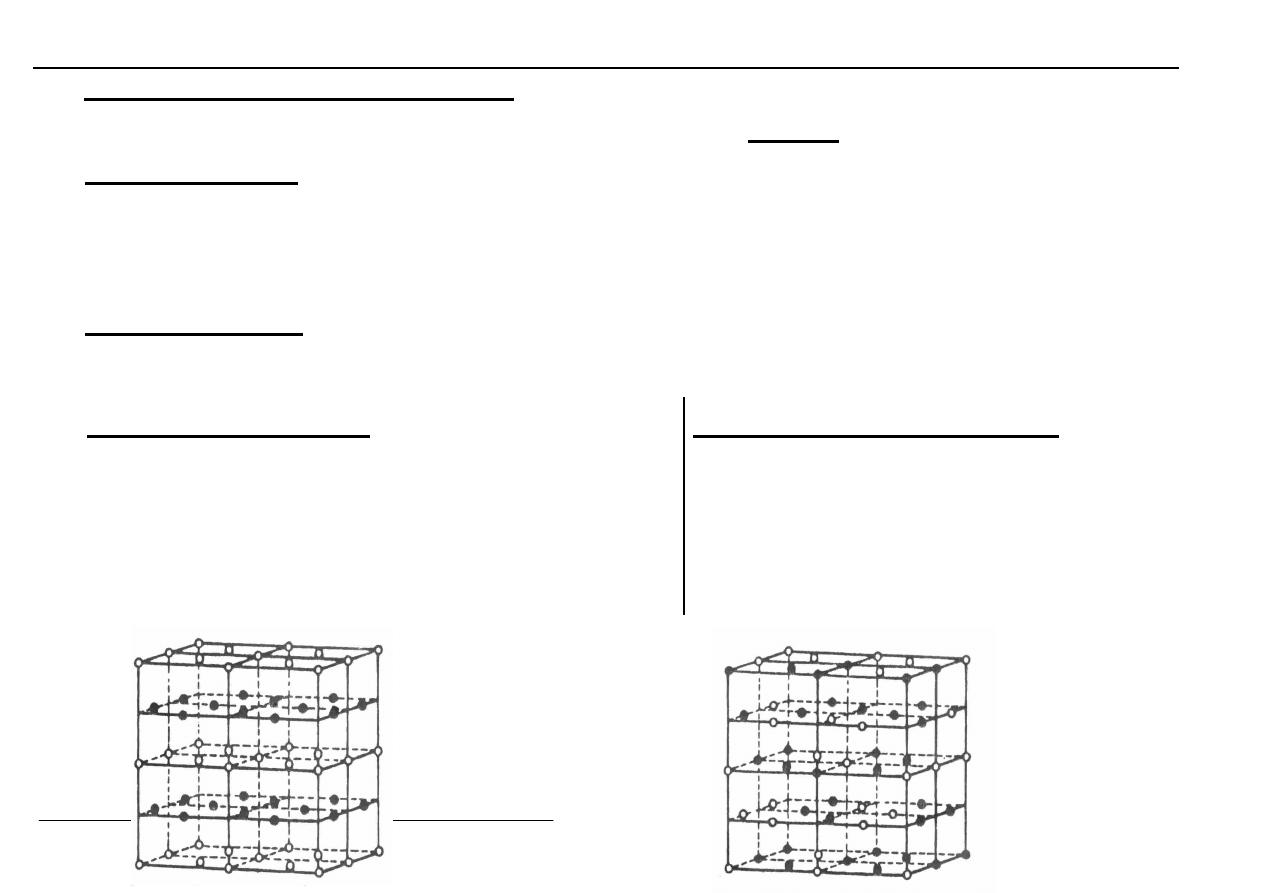
1) Substytucyjne
Atomy 2 różnych metali zajmują
równocenne pozycje w sieci.
Tutaj można wyróżnić dwie podsieci
- atomów A i atomów B
2) Nieuporządkowane
Rozmieszczenie atomów B
w sieci metalu A jest
przypadkowe
Władysław Walkowiak Podstawy Chemii Nieorganicznej
- kurs WPC2002w
Wykład 9. Pierwiastki d- i f- elektronowe i ich związki chemiczne
15
Rodzaj stopu zależy także od sposobu jego otrzymywania:
- stopy szybko ochładzane mają strukturę nieuporządkowaną,
- długotrwałe ogrzewanie prowadzi do stopów
substytucyjnych.
5. Międzywęzłowe związki metali d-elektronowych: wodorki,
węgliki, azotki i borki
Związki te wykazują podobne właściwości do metali :
- połysk metaliczny,
- dobre przewodnictwo - obniża się w miarę podwyższania
temp., tak jak u metali,
- cechuje je znaczna twardość - szczególnie wysokie
temperatury topnienia.
Władysław Walkowiak Podstawy Chemii Nieorganicznej
- kurs WPC2002w
Wykład 9. Pierwiastki d- i f- elektronowe i ich związki chemiczne
16
J a k a s i e ć ?
Promienie atomowe pierwiastków d-elektronowych są rzędu
120 - 180 pm
Atomy
niemetalu
-
w
lukach
→
→
→
→
zajmują
pozycje
międzywęzłowe
Przyczyna - małe promienie atomów niemetali:
H
B
C
N
37 pm
85 pm
77 pm
77 pm
Temperatury topnienia (
o
C):
TiC
3170
HfC
3890
TaC
3880
TaN
3090

Władysław Walkowiak Podstawy Chemii Nieorganicznej
- kurs WPC2002w
Wykład 9. Pierwiastki d- i f- elektronowe i ich związki chemiczne
17
ZrN
2980
TaB
2
3150
ZrB
2
3060
Węglik tytanu (TiC) jest najtwardszym znanym materiałem
obok diamentu i jest bardzo odporny na utlenianie.
Azotki ZrN i NbN są niezwykle ogniotrwałe. Są one
nadprzewodnikami.

Władysław Walkowiak Podstawy Chemii Nieorganicznej
- kurs WPC2002w
Wykład 9. Pierwiastki d- i f- elektronowe i ich związki chemiczne
18
6. Karbonylki pierwiastków d-elektronowych
Związki koordynacyjne metali d-elektronowych z tlenkiem
węgla, jako ligandem, to k a r b o n y l k i
M(CO)
m
- jednordzeniowe
M
n
(CO)
m
- wielordzeniowe
Grupa ukł. okres.
Karbonylki
5
V(CO)
6
6
Cr(CO)
6
Mo(CO)
6
W(CO)
6
7
Mn
2
(CO)
10
Tc
2
(CO)
10
Re
2
(CO)
10
8 - 10
Fe(CO)
5
Fe
2
(CO)
9
Fe
3
(CO)
12
Co
2
(CO)
8
Co
4
(CO)
12
Co
6
(CO)
16
Ni(CO)
4
Ru(CO)
5
Ru
3
(CO)
12
Rh
2
(CO)
8
Rh
4
(CO)
12
Rh
6
(CO)
16
Os(CO)
5
Os
3
(CO)
12
Ir
2
(CO)
8
Ir
4
(CO)
12
Władysław Walkowiak Podstawy Chemii Nieorganicznej
- kurs WPC2002w
Wykład 9. Pierwiastki d- i f- elektronowe i ich związki chemiczne
19
Reguła - "18" - liczba elektronów walencyjnych atomu
centralnego i liczba elektronów dostarczonych przez cząsteczkę
CO wynosi 18 (liczba elektronów atomu helowca - położonego
najbliżej w układzie okresowym).
Przykłady:
Cr(CO)
6
Ni(CO)
4
3d
5
4s
1
→
→
→
→
6
3d
8
4s
2
→
→
→
→
10
6 x 2 el. cz. CO
→
→
→
→
12 4 x 2 el. cz. CO
→
→
→
→
8
= 18
= 18
Uwaga: cząsteczka CO dysponuje wolną parą elektronową przy
atomie węgla (donor 2 elektronów)
Wyjątek : V(CO)
6
- 17 elektronów
Władysław Walkowiak Podstawy Chemii Nieorganicznej
- kurs WPC2002w
Wykład 9. Pierwiastki d- i f- elektronowe i ich związki chemiczne
20
Można przewidzieć istnienie jonów kompleksowych takich jak:
[Mn(CO)
6
]
+
→
→
→
→
Cr(CO)
6
[Co(CO)
4
]
-
→
→
→
→
Ni(CO)
4
W prostych karbonylkach każde wiązanie jest liniowe.
W karbonylkach wielordzeniowych obok liniowo związanych
cząsteczek CO występują też cząsteczki CO tworzące mostek
pomiędzy dwoma atomami metalu.
O
Tutaj: hybrydyzacja atomu
C
węgla typu sp
2
(z 1 atomem tlenu i 2 atomami metalu)
M
M
Władysław Walkowiak Podstawy Chemii Nieorganicznej
- kurs WPC2002w
Wykład 9. Pierwiastki d- i f- elektronowe i ich związki chemiczne
21
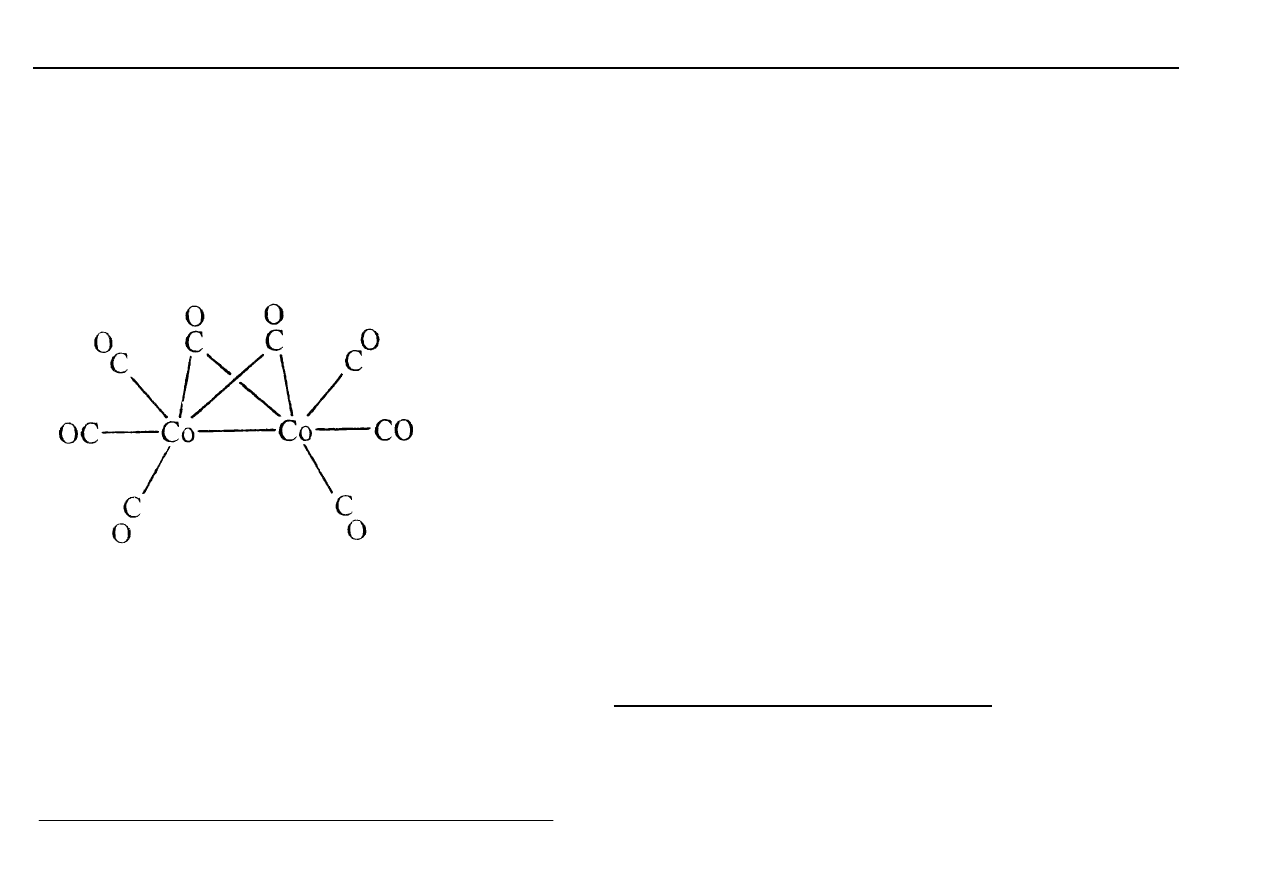
Ponadto często powstają wiązania kowalencyjne pomiędzy
atomami metalu.
Tutaj również zostaje zachowana reguła „18” w stosunku do
każdego atomu metalu osobno.
Co
2
(CO)
8
Oktakarbonyldikobaltu
3 x cząsteczka CO
3 x 2
→
→
→
→
6
2 x cząsteczka CO (mostek)
2 x 1
→
→
→
→
2
wiązanie z sąsiednim atomem kobaltu 1
→
→
→
→
1
atom kobaltu (3d
7
4s
2
)
9 x 1
→
→
→
→
9
Razem
18
Władysław Walkowiak Podstawy Chemii Nieorganicznej
- kurs WPC2002w
Wykład 9. Pierwiastki d- i f- elektronowe i ich związki chemiczne
22
Klastery
metaliczne
-
związki
pierwiastków
d-elektronowych zawierające wiązanie metal-metal
Klastery od CLUSTERS - grona, roje - zawierają dwa lub
więcej atomów metalu, wzajemnie ze sobą powiązanych.
Oprócz karbonylków do klasterów zaliczają się też niektóre
halogenki, np.:
Hg
2
Cl
2
, Mo
6
Cl
12
Karbonylki wielordzeniowe otrzymuje się przez:
ogrzewanie
karbonylków
naświetlanie (nadfiolet) prostych
}}}}

Władysław Walkowiak Podstawy Chemii Nieorganicznej
- kurs WPC2002w
Wykład 9. Pierwiastki d- i f- elektronowe i ich związki chemiczne
23
7. Kompleksy cyjankowe i nitrozylowe
Jony CN
-
i NO
+
są izoelektronowe z cząsteczką CO, gdyż
zawierają po 10 elektronów
→
→
→
→
wykazują podobne właściwości
jako ligandy w związkach koordynacyjnych.
Kompleksy cyjankowe - przykłady :
Au(CN)
2
-
[Co(CN)
5
]
3-
[W(CN)
8
]
2-
Zn(CN)
3
-
[Co(CN)
6
]
3-
Zn(CN)
4
2-
[Mo(CN)
7
]
4-
Kompleksy zawierające, jedynie ligandy nitrozylowe są
bardzo nieliczne.
Znane są natomiast kompleksy karbonylkowo - nitrozylowe:
Mn(CO)(NO)
3
Fe(CO)
2
(NO)
2
Co(CO)
3
NO

Władysław Walkowiak Podstawy Chemii Nieorganicznej
- kurs WPC2002w
Wykład 9. Pierwiastki d- i f- elektronowe i ich związki chemiczne
24
Tu też obowiązuje reguła „18”.
Przykład:
Mn(CO)(NO)
3
, tj. karbonyltrinitrozylmangan:
liczba elektr. walencyjnych Mn:
(d
5
s
2
) = 7
liczba elektronów CO:
1 x 2 = 2
liczba elektronów dla 3 cząsteczek NO: 3 x 3 = 9
Razem = 18 el.
Uwaga: NO jest donorem 3 elektronów.
8. Kompleksy metali przejściowych z węglowodorami
Chemia metaloorganiczna - atom metalu połączony jest z rodnikiem
lub cząsteczką organiczną za pośrednictwem atomu węgla.
Zwyczajowo - nie zalicza się do związków metaloorganicznych
Władysław Walkowiak Podstawy Chemii Nieorganicznej
- kurs WPC2002w
Wykład 9. Pierwiastki d- i f- elektronowe i ich związki chemiczne
25
kompleksów karbonylkowych i cyjankowych.
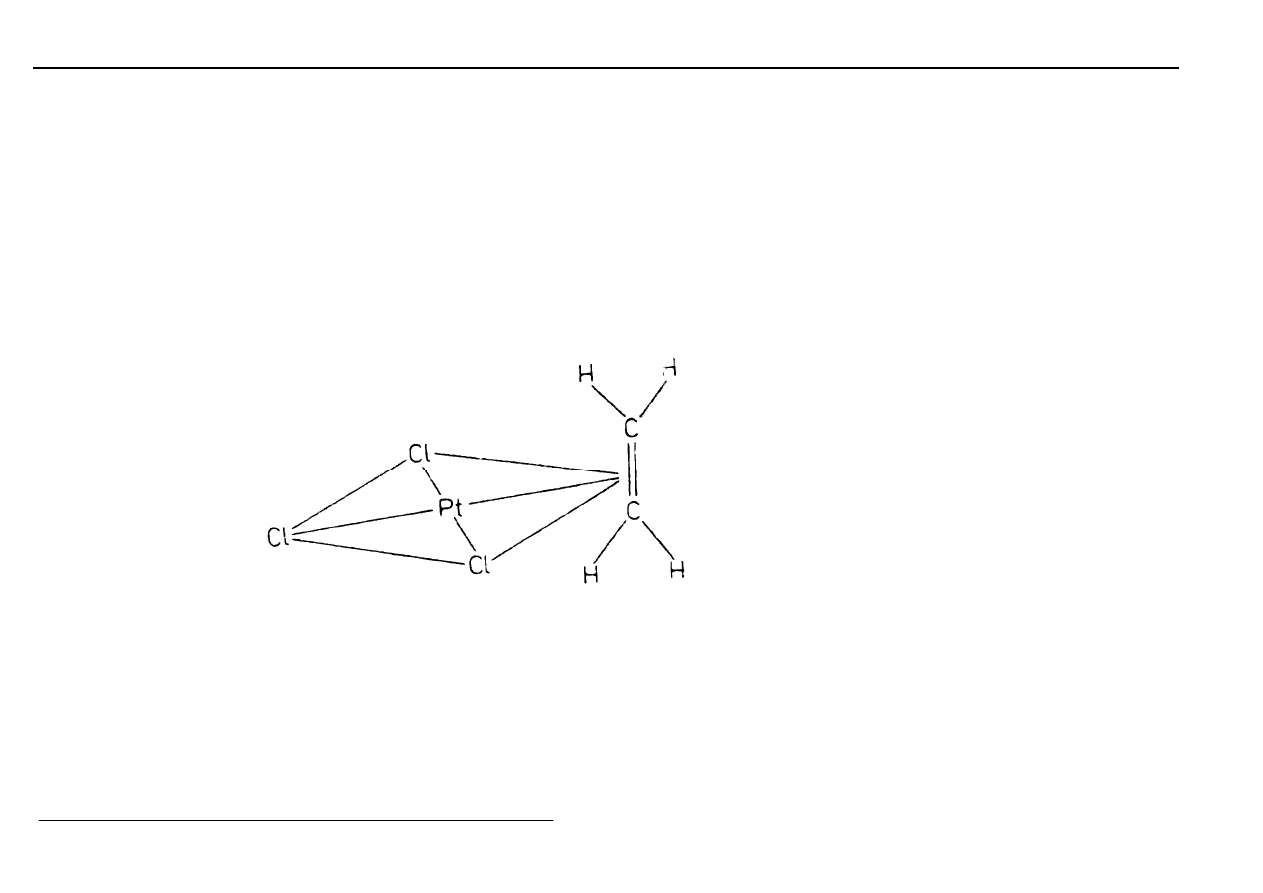
Przykład:
K[Pt(C
2
H
4
)Cl
3
] tj. trichloro(etylen)platynian(II) potasu:
[PtCl
4
]
2-
+ C
2
H
4
= [Pt(C
2
H
4
)Cl
3
]
-
+ Cl
-
Budowa:
Cząsteczka C
2
H
4
⊥
⊥⊥
⊥
do płaszczyzny
PtCl
3
H
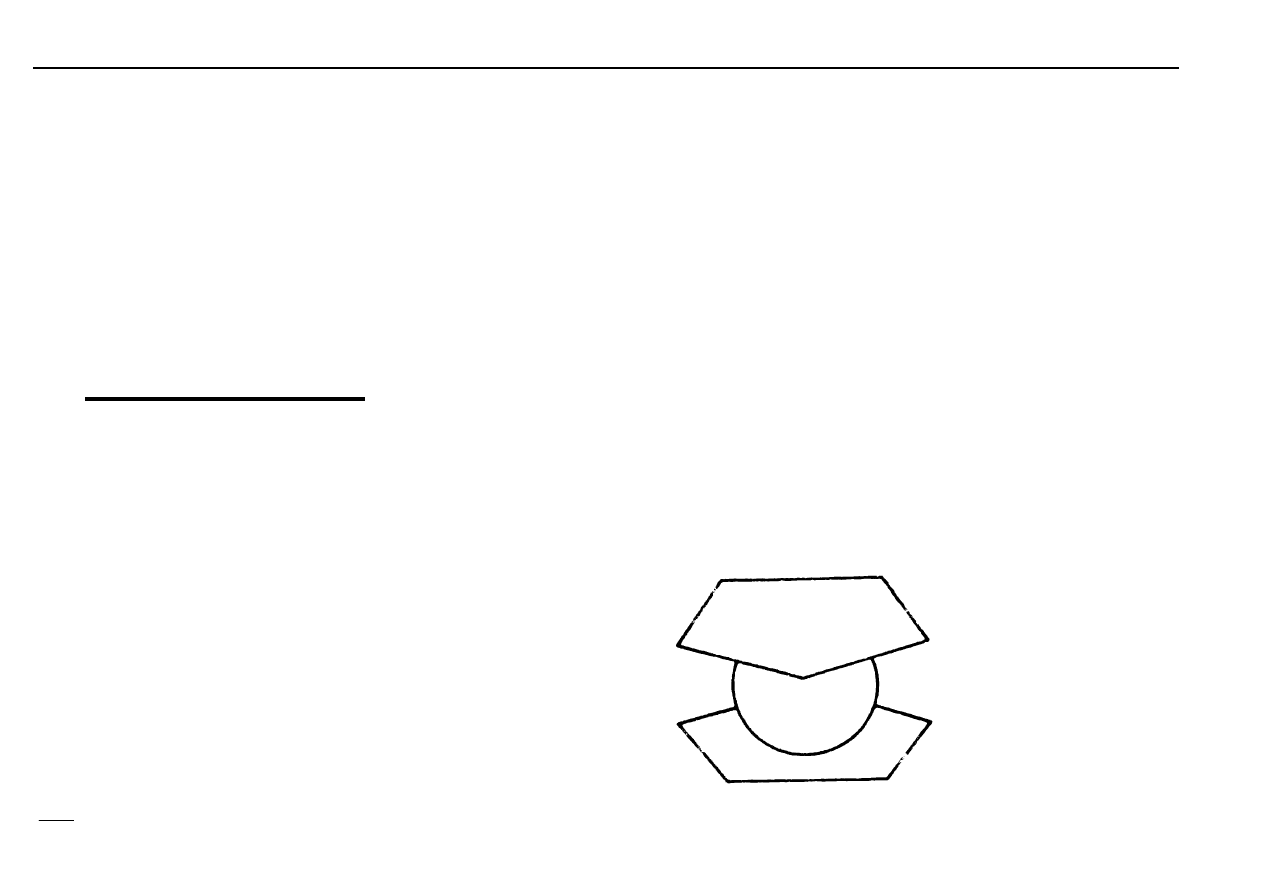
Władysław Walkowiak Podstawy Chemii Nieorganicznej
- kurs WPC2002w
Wykład 9. Pierwiastki d- i f- elektronowe i ich związki chemiczne
26
Typy kompleksów z węglowodorami o wiązaniach podwójnych:
Alkenowe
- 1 podwójne wiązanie
Dienowe
- 2 podwójne wiązania
Polienowe
- 3 lub więcej podwójnych wiązań
Ligandami mogą też być węglowodory aromatyczne.
Pierwszy kompleks powstały z tej grupy to FERROCEN.
Reakcja syntezy:
Fe + 2C
5
H
6
→
→
→
→
Fe(C
5
H
5
)
2
+ H
2
↓↓↓↓
↓↓↓↓
cyklopentadien bis(cyklopentadieno)żelazo
−−−−
5
5
H
C
Fe
2
+
Struktura FERROCENU:
C
5
H
5
-
→
→
→
→
anion cyklopentadienylowy
(cp)
Jest to kompleks typu „sandwich”
(sandwich = kanapka)
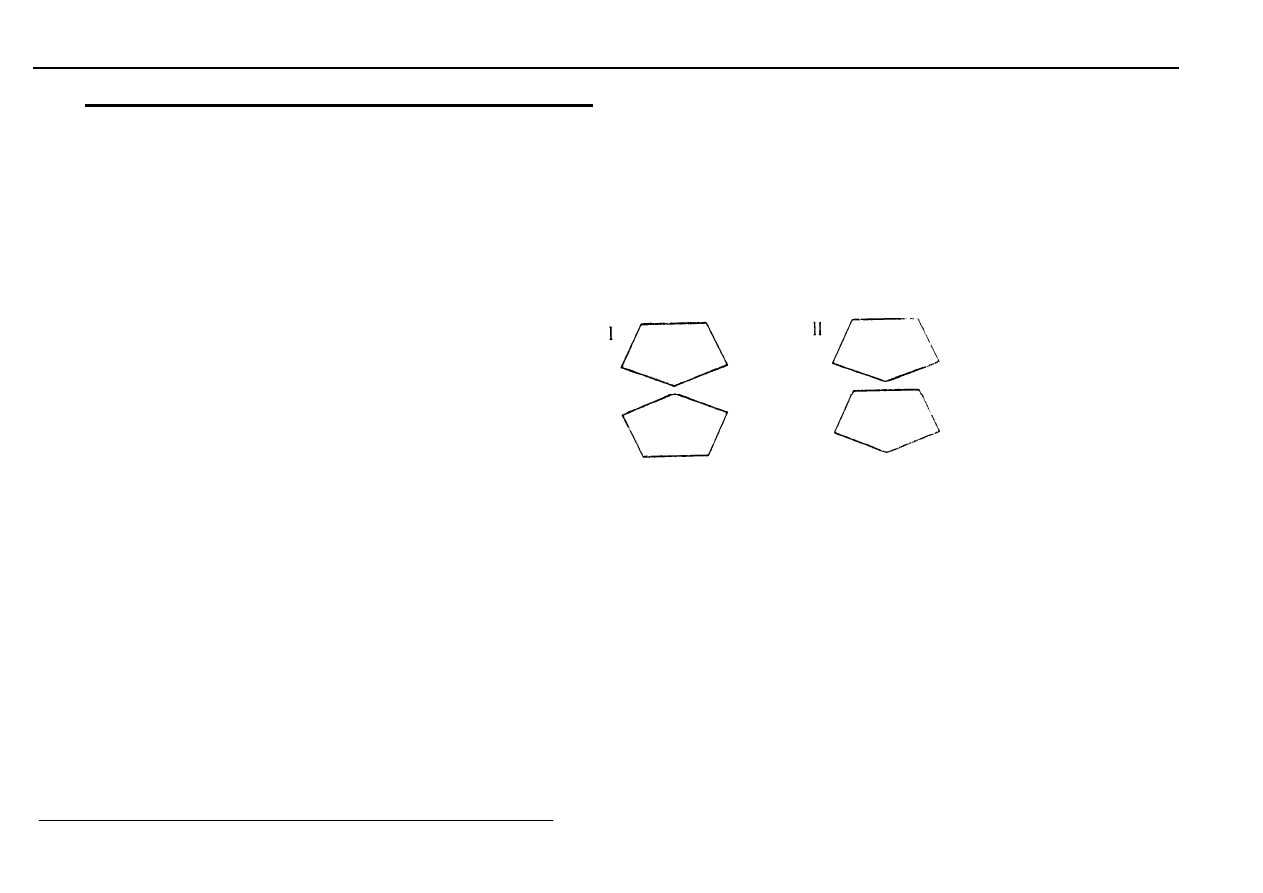
Władysław Walkowiak Podstawy Chemii Nieorganicznej
- kurs WPC2002w
Wykład 9. Pierwiastki d- i f- elektronowe i ich związki chemiczne
27
Inne związki typu „sandwich”:
V(cp)
2
, Cr(cp)
2
, Mn(cp)
2
, Co(cp)
2
, Ni(cp)
2
Związki te są wzajemnie izomorficzne i posiadają zbliżone
temperatury topnienia
Dwie orientacje pierścieni
cyklopentadienylowych:

Władysław Walkowiak Podstawy Chemii Nieorganicznej
- kurs WPC2002w
Wykład 9. Pierwiastki d- i f- elektronowe i ich związki chemiczne
28
9. Pierwiastki f – elektronowe
Stopnie utlenienia skandowców i lantanowców
Skandowce:
Sc
3d
1
4s
2
Y
4d
1
5s
2
La
5d
1
6s
2
Występują wyłącznie na +3 stopniu utlenienia.
Lantanowce – struktura elektronowa: 4f
1-14
5d
1
6s
2
Cer
Ce
Terb
Tb
Prazeodym Pr
Dysproz Dy
Neodym
Nd
Holm
Ho
Promet
Pm
Erb
Er
Samar
Sm
Tul
Tm
Europ
Eu
Iterb
Yb
Gadolin
Gd
Lutet
Lu
Władysław Walkowiak Podstawy Chemii Nieorganicznej
- kurs WPC2002w
Wykład 9. Pierwiastki d- i f- elektronowe i ich związki chemiczne
29
Występują na +3 stopniu utlenienia.
Ponadto dodatkowo:
Ce
4f
1
5d
1
6s
2
→
→
→
→
+4 stopień utlenienia
Eu
4f
7
6s
2
→
→
→
→
+2 stopień utlenienia
Yb
4f
14
6s
2
→
→
→
→
+2 stopień utlenienia
Właściwości lantanowców
Ln
≡≡≡≡
lantanowce
- Na +4 st. utlenienia: Ce0
2
, Ce(NO
3
)
4
.
- Na +2 st. utlenienia: Eu(II) i Yb(II).
- Są to metale srebrzystobiałe, miękkie, kowalne.
- Standardowe potencjały elektrochemiczne:
Ln
⇔
⇔
⇔
⇔
Ln
3+
+ 3e od -2,25 do -2,48 V.
Władysław Walkowiak Podstawy Chemii Nieorganicznej
- kurs WPC2002w
Wykład 9. Pierwiastki d- i f- elektronowe i ich związki chemiczne
30
- Metale te wykazują silne właściwości redukcyjne.
- Tworzą tlenki Ln
2
O
3
, wodorotlenki Ln(OH)
3
, a także chlorki
(LnCl
3
6H
2
O i LnCl
3
7H
2
O).
- Główne zastosowanie - jako tzw. metal mieszany zawierający
mieszaninę lantanowców:
45 – 50 % Ce, 22 – 25 % La, 18 % Nd, 5 % Pr i 1 % Sm.
Aktynowce - struktura elektronowa: 5f
0-14
6d
0-2
7s
2
Tor
Th
Berkel
Bk
Protaktyn
Pa
Kaliforn
Cf
Uran
U
Einstein
Es
Neptun
Np
Ferm
Fm
Pluton
Pu
Mendelew
Md
Ameryk
Am
Nobel
No
Kiur
Cm
Lorens
Lr
Władysław Walkowiak Podstawy Chemii Nieorganicznej
- kurs WPC2002w
Wykład 9. Pierwiastki d- i f- elektronowe i ich związki chemiczne
31
Elektrony 5f są związane w atomach aktynowców słabiej niż
elektrony 4f i dlatego są łatwiej oddawane. Efekt ten występuje
zwłaszcza dla aktynowców lżejszych. Dla cięższych aktynowców
występuje natomiast stopień utlenienia +3
(utrata 2 elektronów 7s i 1 elektronu 6d).
Tor i uran
Konfiguracja elektronowa toru i uranu:
tor
6d
2
7s
2
uran 5f
3
6d
1
7s
2
Stopnie utlenienia toru i uranu:
Th
+4
U
+4, +6
Władysław Walkowiak Podstawy Chemii Nieorganicznej
- kurs WPC2002w
Wykład 9. Pierwiastki d- i f- elektronowe i ich związki chemiczne
32
Związki toru:
ThO
2
- dwutlenek toru
ThCl
4
- czterochlorek toru
Th(NO
3
)
4
12H
2
O
- hydrat azotanu toru(IV)
Th(SO
4
)
2
8H
2
O
- hydrat siarczanu toru(IV)
Związki uranu:
+6 st. utlenienia:
UO
3
- tritlenek uranu
UO
2
2+
- kation uranylowy
UO
2
(NO
3
)
2
6H
2
O
- hydrat azotanu uranylu
UF
6
- sześciofluorek uranu

Władysław Walkowiak Podstawy Chemii Nieorganicznej
- kurs WPC2002w
Wykład 9. Pierwiastki d- i f- elektronowe i ich związki chemiczne
33
+4 st. utlenienia:
UO
2
- ditlenek uranu
Ponadto:
U
3
O
8
- oktatlenek triuranu = blenda smolista
Wyszukiwarka
Podobne podstrony:
Zanieczyszczeniami gleb i gruntów są wszelkie związki chemiczne i pierwiastki promieniotwórczex
zwiazki chemiczne w organizmach Nieznany
Pierwiastki i związki chemiczne a zanieczyszczenia środowiska
PIERWIASTKI I ZWIĄZKI CHEMICZNE
pierwiasti i związki chemiczne
Pierwiastki i związki chemiczne
Związki chemiczne
Związki chemiczne produkty reakcji tlenków z wodą
1 katastyrofy chemiczneid 9337 Nieznany (2)
analiza zwiazkow organiczna id Nieznany (2)
BCh Budowa zwiazkow id 81937 Nieznany (2)
Physical and chemical character Nieznany
Zasady nomenklatury związków chemicznych, Chemia
gr3, Elektroliza - proces rozkładu związków chemicznych i separacji produktów tego rozkładu pod wpły
Gimznazjum Sprawdziany Chemia Związki chemiczne w życiu codziennym test
09 Stosowanie chemicznych proce Nieznany (2)
Barwniki fotosyntetyczne, Barwniki fotosyntetyczne (asymilacyjne) - barwne związki chemiczne odgrywa
więcej podobnych podstron