
Przewodzenie prądu
Przewodzenie prądu
przez roztwory
przez roztwory
elektrolitów
elektrolitów
Konduktometria
Konduktometria

Przewodniki dzielimy na :
•
elektronowe
•
jonowe
W
przewodnikach elektronowych
nośnikiem prądu są
elektrony (czasem też dziury). Przepływowi ładunku
elektrycznego nie towarzyszy ruch masy, ani żadne reakcje
chemiczne. Przewodnictwo ich maleje ze wzrostem
temperatury. Należą tu metale i półprzewodniki.
W
przewodnikach jonowych
nośnikiem prądu są jony.
Przepływowi ładunku towarzyszy ruch masy i mogą zachodzić
reakcje chemiczne. Przewodnictwo ich rośnie wraz ze
wzrostem temperatury. Należą tu kryształy o budowie jonowej,
stopione sole, zjonizowane gazy i
roztwory elektrolitów
.
e
_
+
K
+
A
-
katoda anoda
Elektroliza
K
e
K
→
+
+
A
e
A
→
−
−
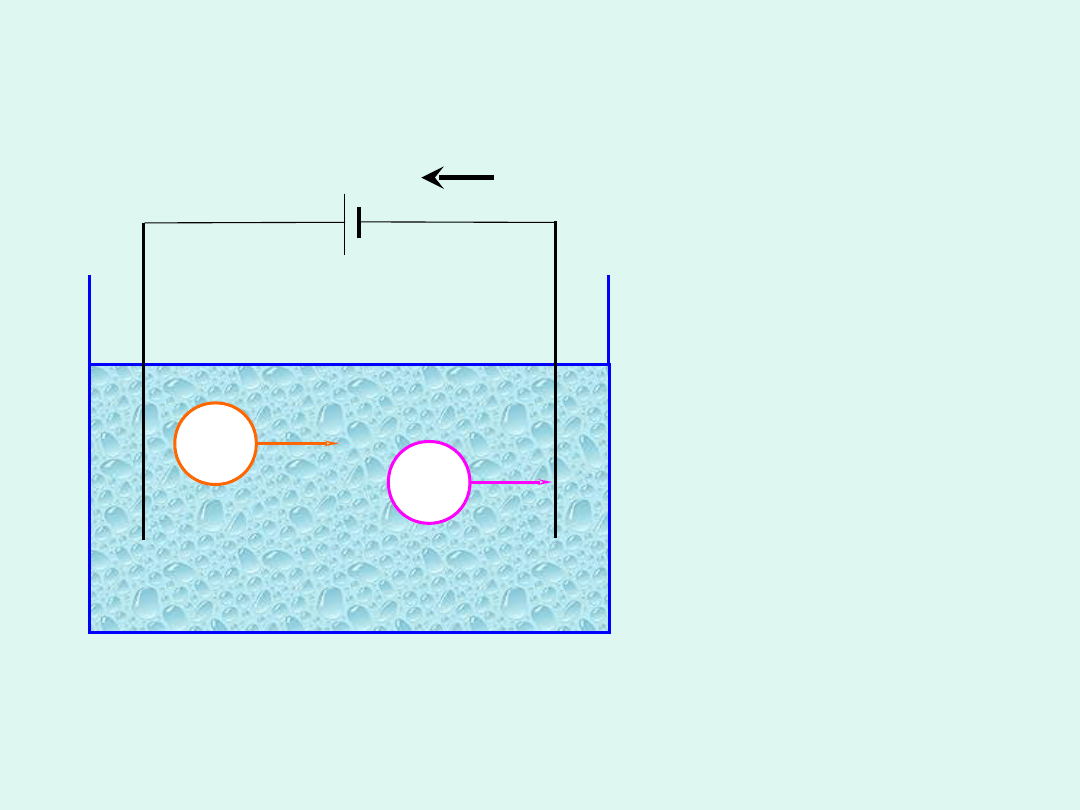
Gdy przez roztwór
elektrolitu płynie prąd
stały, jony wędrują do
odpowiednich
elektrod, gdzie
ulegają rozładowaniu,
wydzielają się
rozmaite substancje.
Zjawisko to nosi
nazwę
elektrolizy
.

Prawa elektrolizy Faraday’a
I
Masa substancji wydzielonej na elektrodzie jest
wprost proporcjonalna do ładunku, jaki przepłynął
przez roztwór.
dla prądu stałego
II
Jeżeli przez roztwory przepłynął ten sam ładunek,
to masy dwu substancji wydzielonych na
elektrodach mają się do siebie jak ich współczynniki
elektrochemiczne.
q
k
m
⋅
=
t
I
k
m
⋅
⋅
=
const
q
gdy
k
k
m
m
2
1
2
1
=
=

Prawa Ohma
I
Natężenie prądu płynącego przez opornik jest
wprost
proporcjonal
ne do
napięcia.
II
Opór opornika jest wprost proporcjonalny do jego
długości, a
odwrotnie
proporcjonal
ny do jego
pola
przekroju
poprzeczneg
o do
kierunku
prądu.
R
I
U
R
U
I
⋅
=
=
A
l
R
ρ
=
ρ
– oporność (dawniej - opór właściwy) ;
l
– długość przewodnika ;
A
– pole przekroju poprzecznego, prostopadłego do kierunku
przepływu prądu
Przewodnictwo
Oporność
Przewodność (dawniej – przewodnictwo właściwe)
1
G
R
=
A
1 A
R
l
G l
ρ =
=
⋅
1
1 l
l
G
R A
A
κ =
=
⋅
=
⋅
ρ
jednostka [
Ω
-1
= S
]
jednostka [
Ω
-1
·m
-1
= S ·m
-1
]
jednostka [
Ω
·m
]

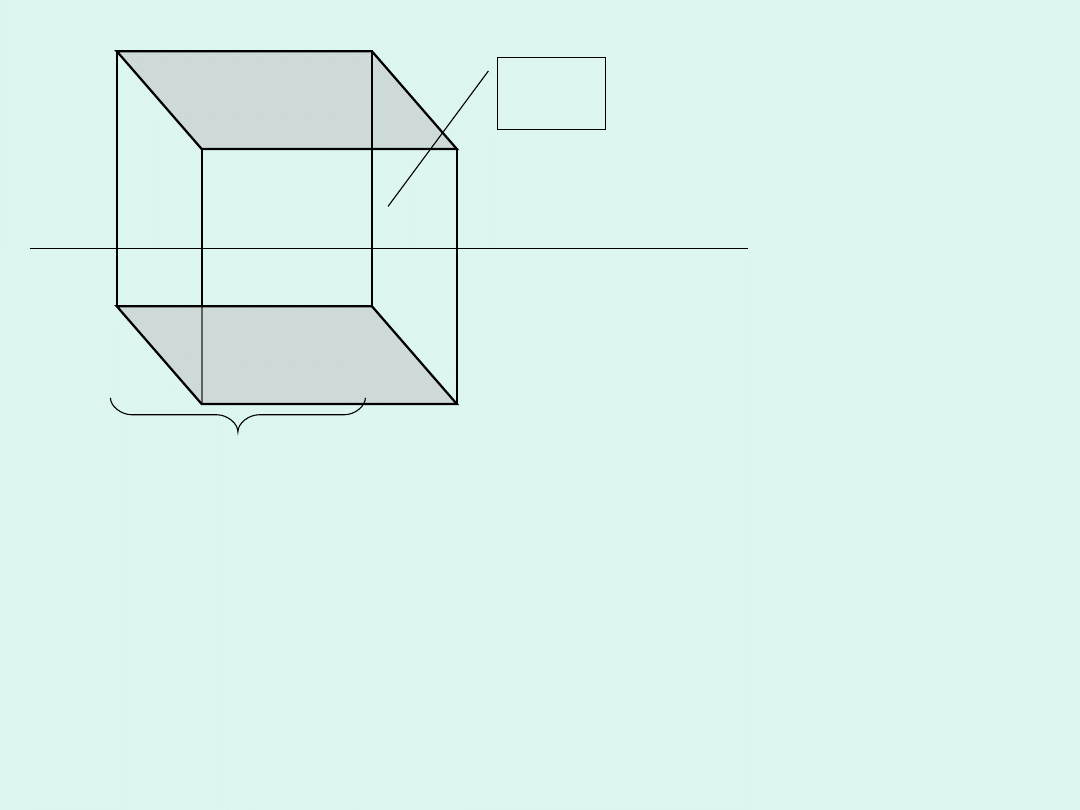
Przewodność elektrolityczna
(dawniej -
przewodnictwo właściwe elektrolitu) jest to
przewodnictwo roztworu elektrolitu zawartego
pomiędzy równoległymi elektrodami odległymi o
jednostkę (1 m) i polu przekroju poprzecznego
słupa
cieczy
zawartego
między
nimi
jednostkowym (1 m
2
), przy czym pole elektryczne
pomiędzy elektrodami jest jednorodne.
1 metr
1 m
2
kierunek
przepływu prądu
Jako przewodność elektrolityczną rozumiemy przewodnictwo
sześcianu o boku jednostkowym, zawierającego roztwór elektrolitu,
umieszczonego w jednorodnym polu elektrycznym.

Do pomiaru przewodności elektrolitycznej używany jest
zmodyfikowany
mostek Wheatstone’a
. Mostek ten jest zasilany
prądem zmiennym (zwykle o częstotliwości 1 kHz, aby :
•
zapobiec polaryzacji elektrod
•
zapobiec elektrolizie roztworu
W trakcie pomiarów naczynko konduktometryczne musi być
termostatowane, ponieważ przewodnictwo roztworów rośnie
silnie wraz ze wzrostem temperatury.
Ponieważ w zmiennym polu elektrycznym naczynko
konduktometryczne wykazuje pozorny opór pojemnościowy, to w
obwód włączony jest kondensator o zmiennej pojemności ,
kompensujący pojemność elektryczną naczynka.
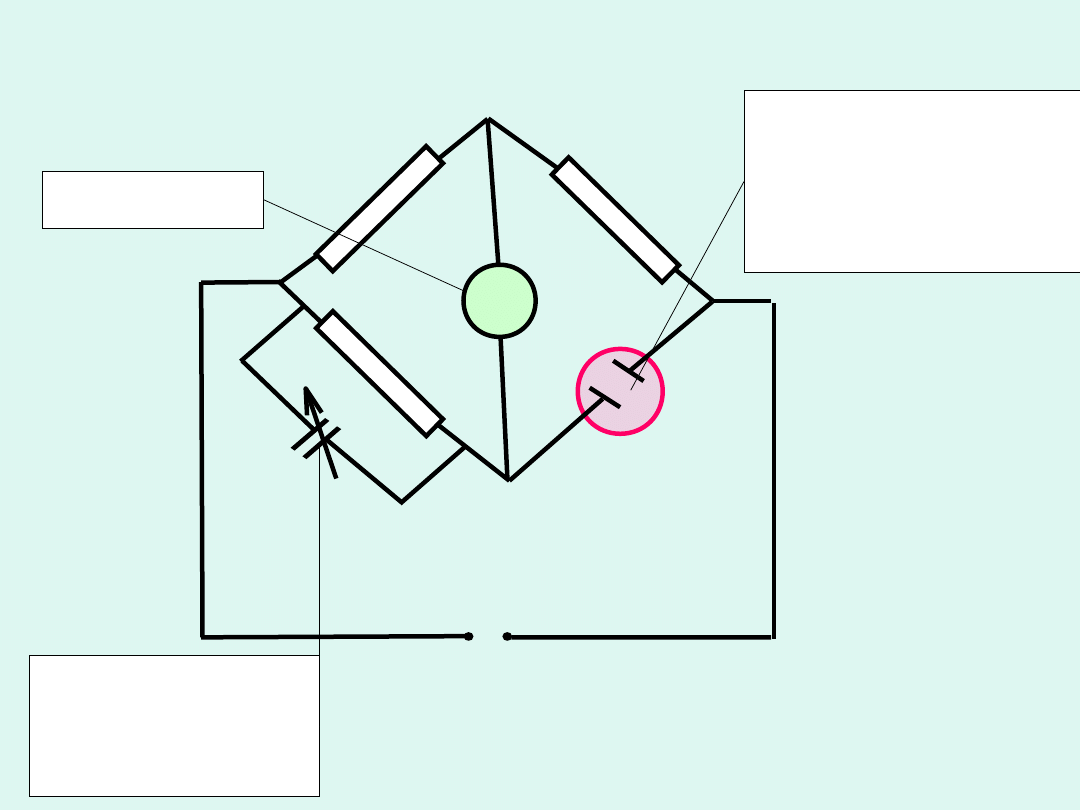
~
prąd zmienny o
częstotliwości 1000
Hz
naczyńko
konduktometryczne
(koniecznie musi być
termostatowane)
kondensator o
zmiennej
pojemności
galwanometr
A
D
C
B
C
2
R
x
R
3
R
2
R
1
C
x
G
Zmodyfikowany mostek Wheatstone’a
Aby zmierzyć opór naczynka napełnionego badanym roztworem
elektrolitu, należy tak dobrać opory
R
1
,
R
2
i
R
3
oraz pojemność
kondensatora
C
2
, aby mostek był w równowadze. Wówczas
potencjały w punktach
B
i
A
są jednakowe i nie płynie pomiędzy
nimi prąd elektryczny, co pokazuje nam galwanometr
G
.
x
3
2
1
I
I
i
I
I
=
=
B
A
1 1
3
3
2
2
x
x
V
V
I R
I R
I R
I R
=
⇓
=
=
I R
I R
I R
I R
R
R
R
R
R
R
R
R
x
x
x
x
1 1
2
2
3 3
1
2
3
3
2
1
=
=
⇒
=

Przykładowe sondy konduktometryczne (naczynka
konduktometryczne)

Ponieważ nie można określić parametrów geometrycznych elektrod (
l/A
)
oraz pole elektryczne w rzeczywistym naczynku nie jest jednorodne, to
pomiar przewodności elektrolitycznej wykonujemy jako pomiar
porównawczy. Stałą naczyńka ustalamy przez pomiar oporu naczynka
napełnionego wzorcowym roztworem elektrolitu.
G
k
R
k
G
R
k
G
k
R
k
x
x
x
wz
wz
wz
wz
wz
wz
wz
⋅
=
=
κ
κ
=
⋅
κ
=
⇒
⋅
=
=
κ
Przewodność elektrolityczna wzorcowych roztwo-
rów KCl
stężenie
[mol/dm
3
]
κ
w 18ºC [Sm
-1
]
κ
w 25ºC [Sm
-1
]
1
9,820
11,173
0,1
1,1192
1,2886
0,01
0,12227
0,14115
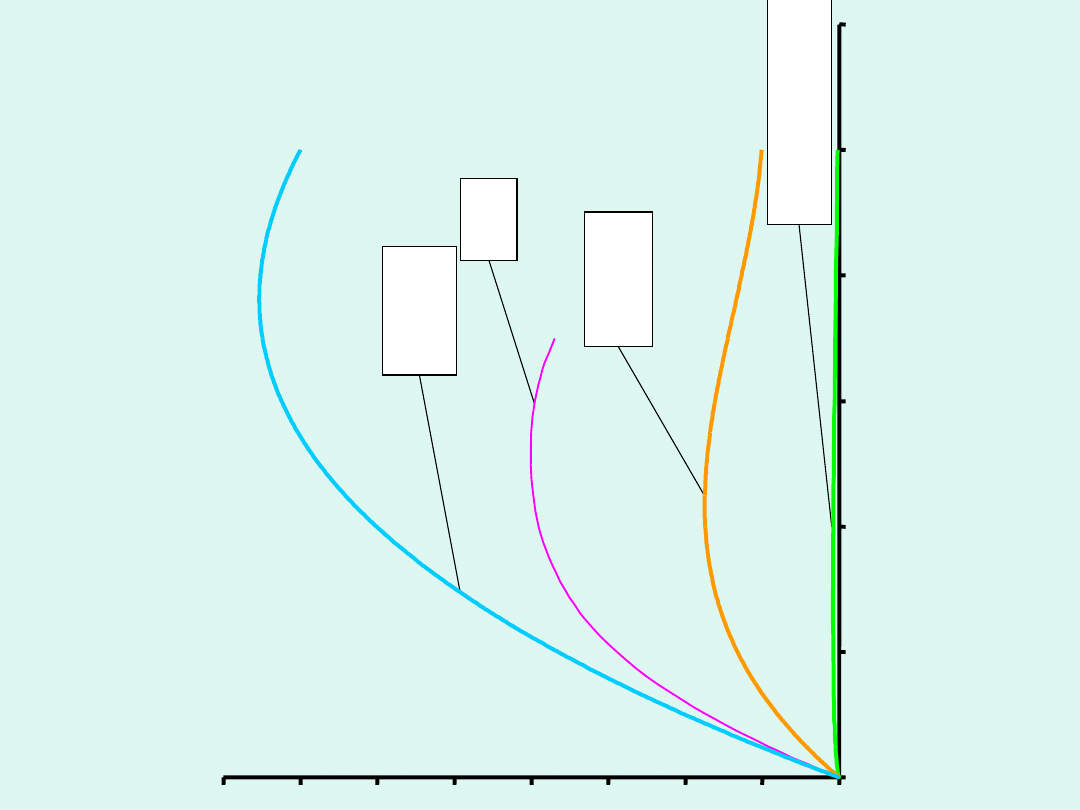
Przykłady zależności przewodności
elektrolitycznej od stężenia
H
2
S
O
4
N
aO
H
H
J
C
H
3
C
O
O
H
x
10
0
20
40
60
80
10
0
12
0
14
0
16
0
0
2
4
6
8
10
12
c
[m
o
l/
d
m
3
]

Można ją obliczyć z poniższego wzoru, przy czym stężenie
podstawiamy wyrażone w mol/m
3
.
jednostka [
Ω
-1
m
2
mol
-1
= S·m
2
mol
-1
]
Przewodność molowa
Λ
(dawniej – przewodnictwo
molowe)
jest to przewodnictwo roztworu elektrolitu
zawartego pomiędzy równoległymi elektrodami
odległymi o jednostkę (1 m) i o takim polu przekroju
poprzecznego słupa cieczy zawartego między nimi, że
w tak utworzonej objętości zawarty jest jeden mol
elektrolitu, przy czym pole elektryczne pomiędzy
elektrodami jest jednorodne.
c
κ
=
Λ
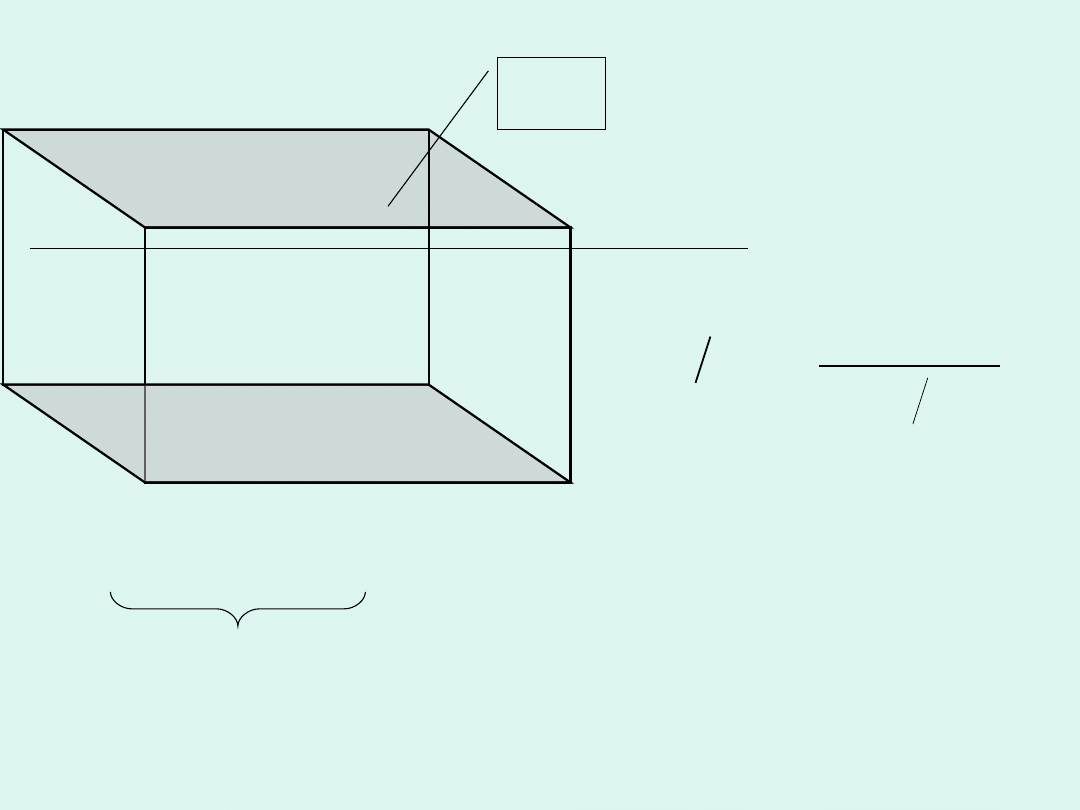
1 metr
A
kierunek
przepływu prądu
Jako przewodność molową rozumiemy
przewodnictwo
prostopadłościanu
zawierającego roztwór elektrolitu, o
jednostkowej grubości i takiej objętości,
że znajduje się w niej 1 mol elektrolitu,
umieszczonego w jednorodnym polu
elektrycznym.
3
3
1
1 A V m mol
c mol m
× =
=

Przewodność równoważnikowa
Λ
eqv
(dawniej –
przewodnictwo równoważnikowe) jest to przewodnictwo
roztworu elektrolitu zawartego pomiędzy równoległymi
elektrodami odległymi o jednostkę (1 m) i o takim polu
przekroju poprzecznego słupa cieczy zawartego między
nimi, że w tak utworzonej objętości zawarty jest jeden
gramorównoważnik elektrolitu, przy czym pole elektryczne
pomiędzy elektrodami jest jednorodne.
eqv
eqv
eqv
i
i
c
z
κ
Λ
=
Λ
Λ
=
ν

Dla mocnych elektrolitów przewodność molowa
zależy od stężenia w sposób, który można opisać
wzorem Kohlrascha
.
c
b
o
−
Λ
=
Λ
Λ
o
– graniczna przewodność molowa
b
– stała
Powyższy wzór jest słuszny dla roztworów o stężeniu
nie przekraczającym 0,01 mol/dm
3
.

Graniczna przewodność molowa
(równoważnikowa)
Λ
o
(
Λ
eqv,o
) to przewodność molowa (równoważnikowa) w
rozcieńczeniu nieskończenie wielkim (gdy stężenie dąży
do zera).
o
c 0
lim
→
Λ =
Λ
Dla mocnych elektrolitów
Λ
o
można wyznaczyć przez
ekstrapolację zależności podanej przez Kohlrauscha do
stężenia zerowego.
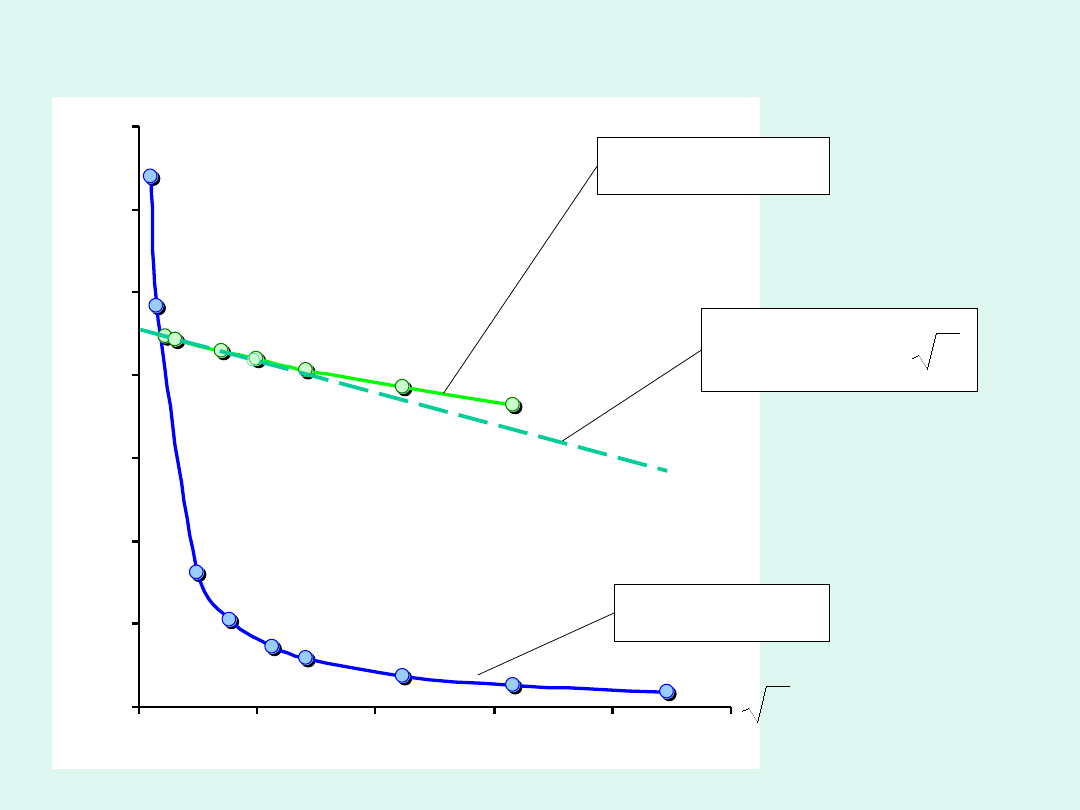
0
0.002
0.004
0.006
0.008
0.01
0.012
0.014
0
0.1
0.2
0.3
0.4
0.5
Λ
[Sm
2
mol
-1
]
Λ
o
CH
3
COOH
CH
3
COONa
[(mol/dm
3
)
1/2
]
c
c
b
o
−
Λ
=
Λ
Przykładowe zależności przewodności molowej od
pierwiastka ze stężenia
mocny elektrolit
słaby elektrolit

Jony w roztworze w polu elektrycznym wędrują
niezależnie od siebie, a przewodnictwo roztworu
elektrolitu jest sumą przewodnictw pochodzących
od poszczególnych jonów (kationów i anionów).
i
eqv,i
i
eqv
eqv,
eqv,
z
+ +
− −
+
−
Λ = ν λ + ν λ
λ
λ
=
Λ
= λ
+ λ
i
i
i
c
κ =
⋅ λ
∑
Prawo niezależnej wędrówki jonów
Kohlrauscha
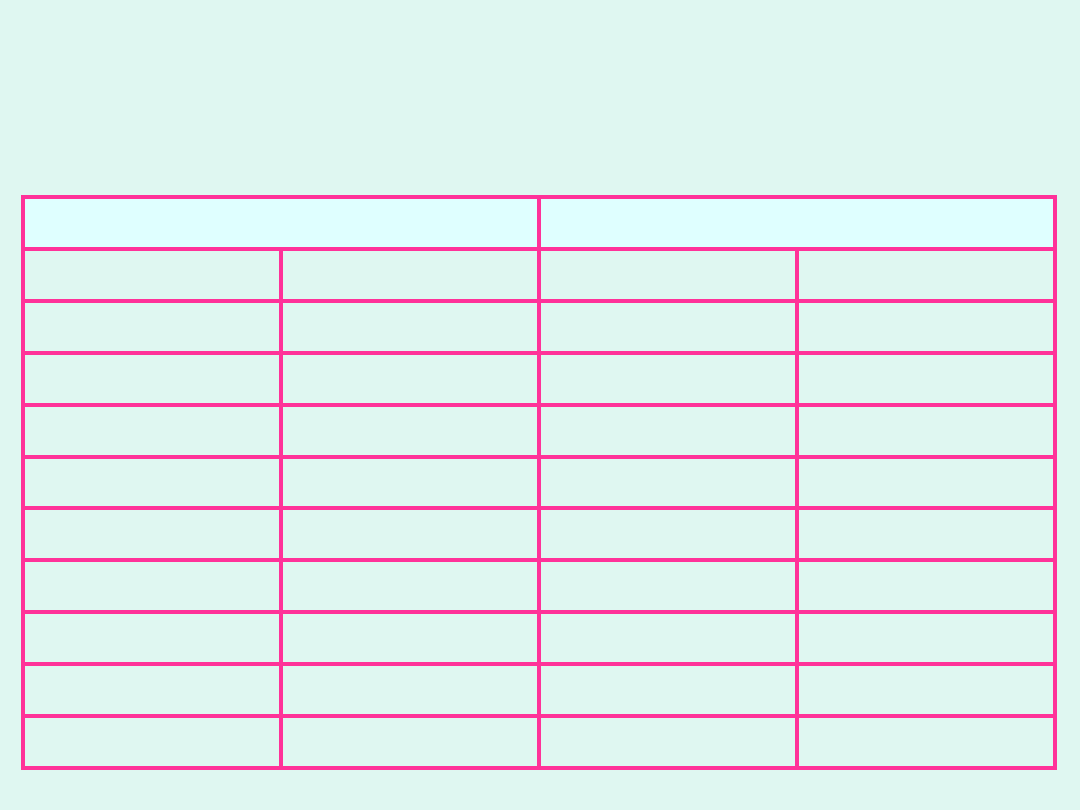
Przykładowe wartości granicznych przewodności równo-
ważnikowych jonów w temperaturze 25°C w roztworach
wodnych [
Ω
-1
m
2
mol
-1
]
kationy
aniony
H
+
349,65·10
-4
OH
-
198·10
-4
Na
+
50,08
·
10
-4
Cl
-
76,31
·
10
-4
K
+
73,48
·
10
-4
Br
-
78,1
·
10
-4
NH
4
+
73,5
·
10
-4
J
-
76,8
·
10
-4
Li
+
38,66
·
10
-4
NO
3
-
71,42
·
10
-4
1/2 Mg
2+
53,0
·
10
-4
CH
3
COO
-
40,9
·
10
-4
1/2 Ca
2+
59,47
·
10
-4
1/2 SO
4
2-
80,0
·
10
-4
1/2 Ba
2+
63,6
·
10
-4
1/2 CO
3
2-
69,3
·
10
-4
1/3 Al
3+
61
·
10
-4
1/3 Fe(CN)
6
3-
100,9
·
10
-4
1/3 Fe
3+
68
·
10
-4
C
10
H
21
SO
4
-
26
·
10
-4

F
el
F
η
Gdy jon porusza się ruchem jednostajnym, to siły działające
na niego się równoważą czyli siła oporu lepkiego jest równa
sile elektrycznej.
E
e
z
F
i
el
⋅
=
i
i
v
r
6
F
η
Π
=
η
i
i
i
i
i
i
el
r
6
e
z
E
v
v
r
6
eE
z
F
F
η
Π
=
η
Π
=
=
η
E
– natężenie pola elektrycznego ;
e
– ładunek elementarny ;
η
–
lepkość rozpuszczalnika ;
r
i
– promień jonu ;
v
i
– szybkość
poruszania się jonu

Ruchliwość jonu
Ruchliwość jonu
to szybkość poruszania się jonu w
polu elektrycznym o natężeniu jednostkowym.
E
v
u
i
i
=
jednostka [
m
2
/V·s
]

Ruchliwość jonu powiązana jest z przewodnością
równoważnikową jonu.
i
i
eqv
u
F
⋅
=
λ
,
Ruchliwość
jonu
zależy
jego
ładunku,
promienia
hydrodynamicznego czyli razem z jego warstwa solwatacyjną,
lepkości rozpuszczalnika, a pośrednio od temperatury, gdyż lepkość
cieczy maleje wraz ze wzrostem temperatury.
i
i
i
r
6
e
z
u
η
Π
=
W wodzie jony powstałe z jej autodysocjacji (H
+
i OH
-
) wyróżniają
się wysoką ruchliwością, co wskazuje, że ich mechanizm migracji
jest inny niż pozostałych jonów.
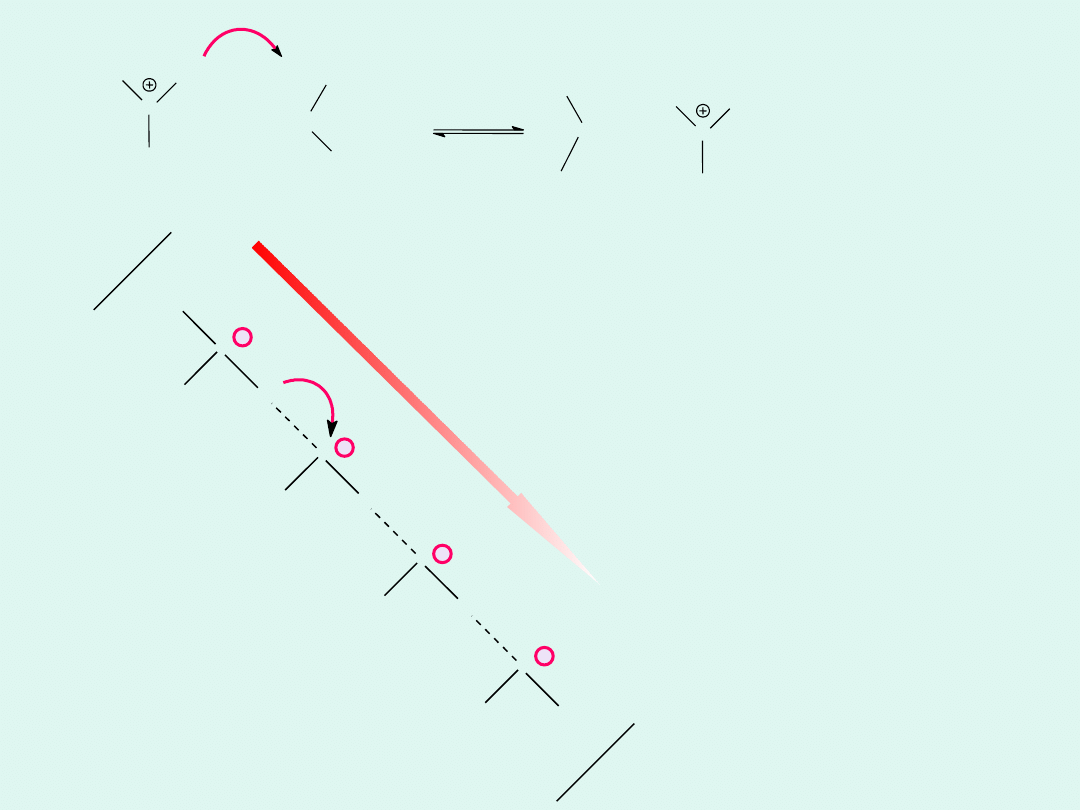
Mechanizm
łańcuchowy
transportu jonów
wodorowych w
wodzie
O
H
H
O
H
H
O
H
H
O
H
H
H
H
+
_
+
+
+
+
+
+
O
H
H
H
+
O
H
H
H
O
H
H
H
+
O
H
H
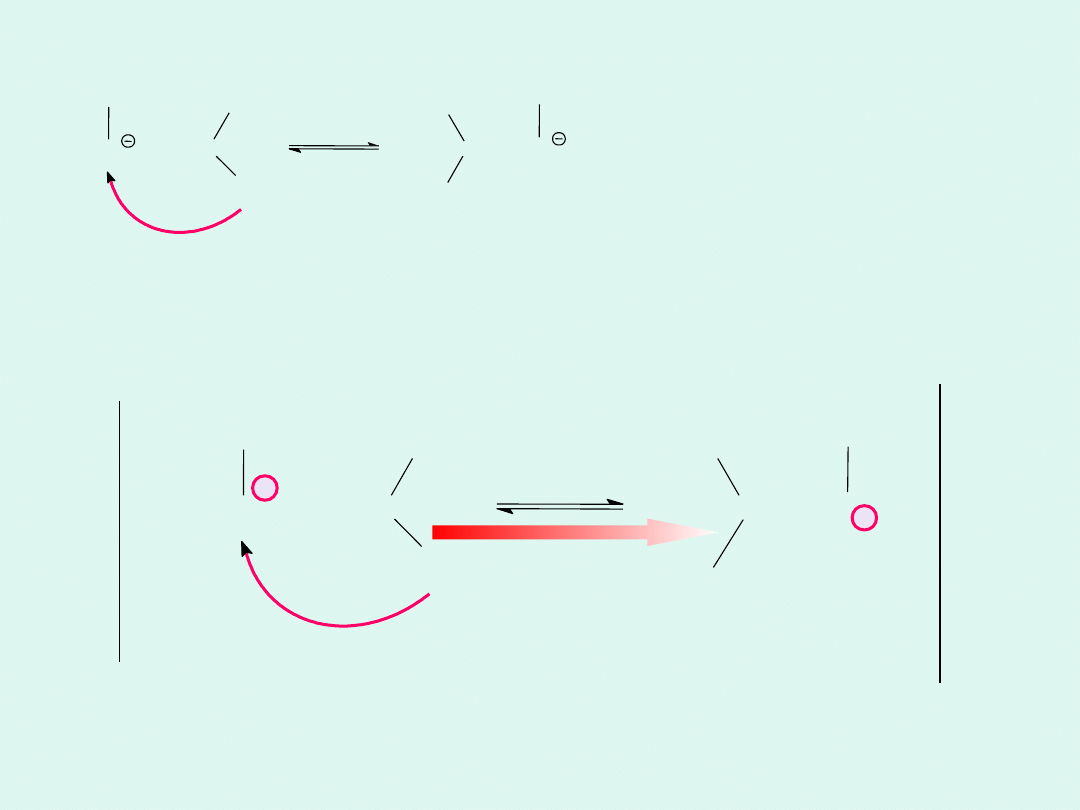
+
O
H
H
H
+
O
H
O
H
+
O
H
H
+
_
+
O
H
H
H
+
O
H
O
H
+
O
H
H
-
-
Mechanizm
transportu jonów
wodorotlenowych w
wodzie

Liczby przenoszenia jonów
Liczby przenoszenia jonu mówią, jaki ułamek ładunku został
przeniesiony przez jony danego znaku.
Liczba przenoszenia
jonu
to stosunek ładunku przeniesionego przez jony danego
znaku do całkowitego ładunku przeniesionego przez roztwór.
+
Q
Q
t
t
t
t
1
Q
Q
+
−
+
−
−
=
=
+
=
Znajomość liczb przenoszenia jest niezbędna do wyznaczenia
przewodności molowych (równoważnikowych) jonów.
eqv,
eqv,
eqv
eqv
t
t
t
t
+
−
+
−
+ +
− −
+
−
λ
λ
=
=
Λ
Λ
ν λ
ν λ
=
=
Λ
Λ
Metody wyznaczania liczb przenoszenia :
•
Metoda Hittorfa
•
Metoda ruchomej granicy
Żeby wyznaczyć przewodności równoważnikowe jonów należy
wyznaczyć przewodność równoważnikową elektrolitu i liczby
przenoszenia jonów w nim.
Wykorzystanie pomiarów
konduktometrycznych
•
Wyznaczanie iloczynu
rozpuszczalności soli trudno
rozpuszczalnych
•
Wyznaczanie iloczynu jonowego
wody
•
Wyznaczanie stałych dysocjacji
słabych elektrolitów
•
Miareczkowanie
konduktometryczne
Omawiane na
ćwiczeniach
rachunkowych
– obowiązuje do
egzaminu !

Miareczkowanie konduktometryczne polega na wyznaczaniu
punktu
równoważnikowego
pośrednio
poprzez
pomiar
przewodnictwa. W tym celu do próbki dodajemy porcjami
roztwór titranta i po każdym dodaniu mierzymy przewodnictwo
roztworu.
Podstawą metody jest prawo niezależnej wędrówki jonów
Kohlrauscha.
W czasie miareczkowania, na skutek zachodzącej reakcji
chemicznej zmienia się stężenie i rodzaj jonów w roztworze, co
powoduje zmiany przewodnictwa.
Metodę
miareczkowania
konduktometrycznego
można
wykorzystać
do
miareczkowań
kwasowo-zasadowych,
strąceniowych i kompleksometrycznych.
Miareczkowanie konduktometryczne
∑
λ
⋅
=
κ
i
i
i
c
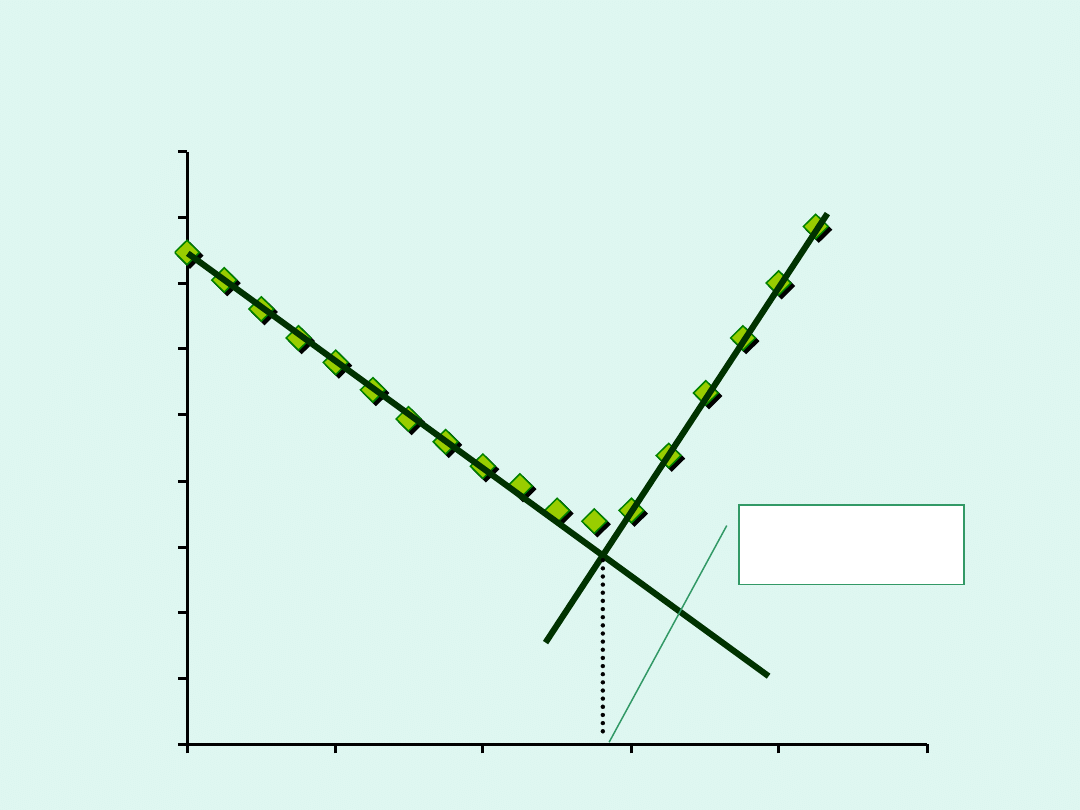
0
0,5
1
1,5
2
2,5
3
3,5
4
4,5
0
2
4
6
8
10
V
0,1 M HCl
[ml]
G [mS]
V
e qv
= 5,65 ml
Miareczkowanie mocnej zasady (NaOH) mocnym kwasem (HCl)
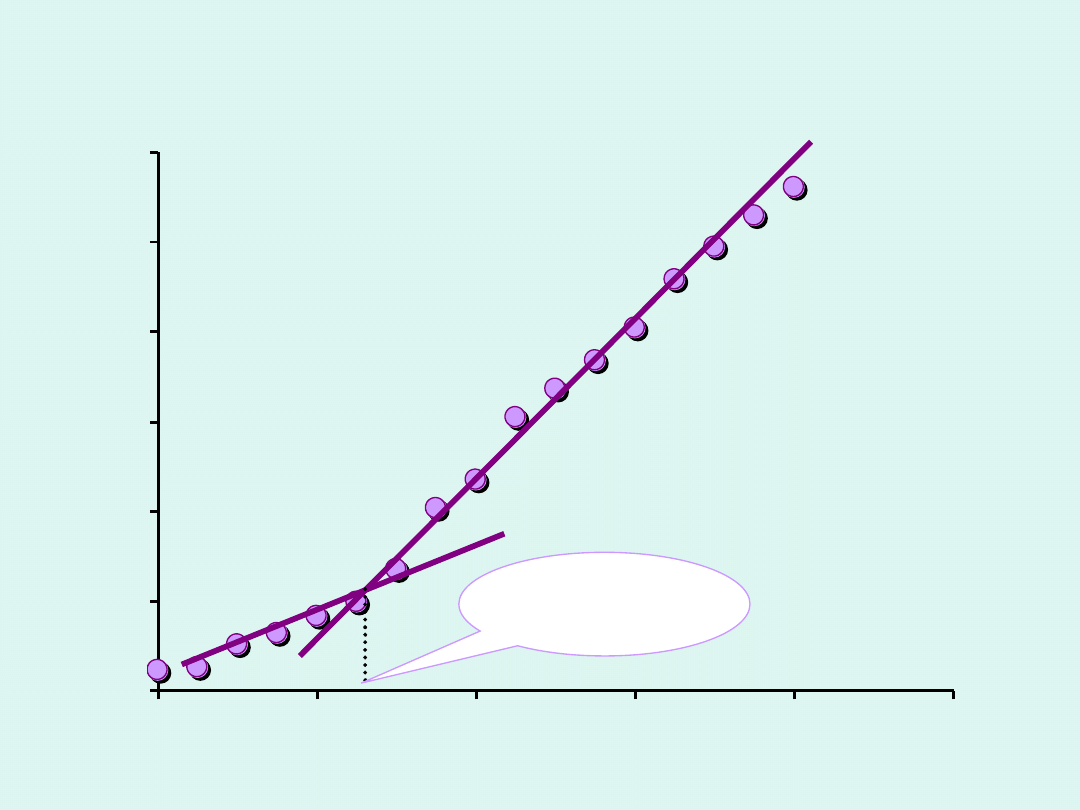
0
0.5
1
1.5
2
2.5
3
0
2
4
6
8
10
V
0,2 M NaOH
[ml]
G [mS]
V
eqv
=2,25 ml
Miareczkowanie słabego kwasu (CH
3
COOH) mocną zasadą
(NaOH)
Document Outline
- Slajd 1
- Slajd 2
- Slajd 3
- Slajd 4
- Slajd 5
- Slajd 6
- Slajd 7
- Slajd 8
- Slajd 9
- Slajd 10
- Slajd 11
- Slajd 12
- Slajd 13
- Slajd 14
- Slajd 15
- Slajd 16
- Slajd 17
- Slajd 18
- Slajd 19
- Slajd 20
- Slajd 21
- Slajd 22
- Slajd 23
- Slajd 24
- Slajd 25
- Slajd 26
- Slajd 27
- Slajd 28
- Slajd 29
- Slajd 30
- Slajd 31
- Slajd 32
- Slajd 33
Wyszukiwarka
Podobne podstrony:
13 Doladowanieid 14449 Nieznany
cw 13 id 121763 Nieznany
13 0id 14314 Nieznany
13 14id 14578 Nieznany
36 13 id 36113 Nieznany (2)
7 13 id 44730 Nieznany (2)
piae wyklad3 12 13 id 356381 Nieznany
13 cwiczenie13(alternatywnie) i Nieznany
Alkohole 13 id 58087 Nieznany (2)
EZNiOS Log 12 13 w9 ocieplenie Nieznany
IMG 13 id 210986 Nieznany
G2 PB 02 B Rys 3 13 id 185405 Nieznany
13 4id 14362 Nieznany (2)
13 id 189372 Nieznany (2)
Opcje lato tab 13 14 zapisy[1] Nieznany
HIGIENA, CWICZENIE 7, 13 11 201 Nieznany
więcej podobnych podstron