
ROZPORZ
ĄDZENIE KOMISJI (WE) NR 542/2008
z dnia 16 czerwca 2008 r.
zmieniaj
ące załączniki I i II do rozporządzenia Rady (EWG) nr 2377/90 ustanawiającego
wspólnotow
ą procedurę dla określania maksymalnego limitu pozostałości weterynaryjnych
produktów leczniczych w
środkach spożywczych pochodzenia zwierzęcego w odniesieniu do
cyflutryny oraz lektyny uzyskanej z fasoli czerwonej kidney (
Phaseolus vulgaris)
(Tekst maj
ący znaczenie dla EOG)
KOMISJA WSPÓLNOT EUROPEJSKICH,
uwzgl
ędniając Traktat ustanawiający Wspólnotę Europejską,
uwzgl
ędniając rozporządzenie Rady (EWG) nr 2377/90 z dnia
26 czerwca 1990 r. ustanawiaj
ące wspólnotową procedurę dla
okre
ślania maksymalnego limitu pozostałości weterynaryjnych
produktów leczniczych w
środkach spożywczych pochodzenia
zwierz
ęcego (
1
), w szczególno
ści jego art. 2 i 3,
uwzgl
ędniając opinię Europejskiej Agencji Leków wydaną przez
Komitet ds. Weterynaryjnych Produktów Leczniczych,
a tak
że mając na uwadze, co następuje:
(1)
Wszystkie substancje farmakologicznie czynne stosowane
we Wspólnocie w weterynaryjnych produktach leczni-
czych przeznaczonych do podawania zwierz
ętom, od
których lub z których pozyskuje si
ę żywność, powinny
by
ć oceniane zgodnie z rozporządzeniem (EWG)
nr 2377/90.
(2)
Cyflutryna jest obecnie uwzgl
ędniona w załączniku I do
rozporz
ądzenia (EWG) nr 2377/90 dla gatunków bydła
w odniesieniu do mi
ęśni, tłuszczu, wątroby i nerek oraz
w odniesieniu do mleka, o ile mleko spe
łnia warunki
okre
ślone w dalszych przepisach dyrektywy Rady
94/29/WE z dnia 23 czerwca 1994 r. zmieniaj
ącej
za
łączniki do dyrektyw 86/362/EWG i 86/363/EWG
w
sprawie
ustalania
najwy
ższych dopuszczalnych
poziomów
pozosta
łości pestycydów, odpowiednio
w zbo
żach i w środkach spożywczych pochodzenia
zwierz
ęcego oraz na ich powierzchni (
2
). Po otrzymaniu
wniosku o obj
ęcie wszystkich przeżuwaczy istniejącym
w za
łączniku I wpisem dla cyflutryny w odniesieniu do
byd
ła, Komitet ds. Weterynaryjnych Produktów Leczni-
czych (
„Komitet”) po analizie najwyższych dopuszczal-
nych poziomów pozosta
łości („NDP”) określonych dla
cyflutryny stwierdzi
ł, że istniejących NDP dla bydła nie
mo
żna ekstrapolować na wszystkie gatunki przeżuwaczy
z powodu braku dost
ępności danych o pozostałościach
dla owiec. Komitet stwierdzi
ł, że ekstrapolacja jest
mo
żliwa tylko w przypadku kóz. W związku
z powy
ższym uznaje się za właściwe objęcie kóz
obecnym wpisem dla cyflutryny w za
łączniku I do roz-
porz
ądzenia (EWG) nr 2377/90, z takimi samymi
warto
ściami NDP jak dla bydła, w odniesieniu do mięśni,
t
łuszczu, wątroby, nerek i mleka, o ile mleko spełnia
warunki okre
ślone w dalszych przepisach w dyrektywie
94/29/WE.
(3)
Lektyna uzyskana z fasoli czerwonej kidney (Phaseolus
vulgaris) nie jest obecnie uwzgl
ędniona w załącznikach
do rozporz
ądzenia (EWG) nr 2377/90. Po analizie
wniosku o okre
ślenie NDP dla lektyny uzyskanej
z fasoli czerwonej kidney (Phaseolus vulgaris) dla
świń
Komitet stwierdzi
ł, że nie ma potrzeby określania NDP
dla lektyny uzyskanej z fasoli czerwonej kidney (Phaseolus
vulgaris)
i
zaleci
ł
uwzgl
ędnienie
tej
substancji
w za
łączniku II dla świń, wyłącznie do stosowania doust-
nego. W zwi
ązku z powyższym uznaje się za właściwe
w
łączenie tej substancji do załącznika II do rozporządze-
nia (EWG) nr 2377/90 dla
świń, wyłącznie do stoso-
wania doustnego.
(4)
Nale
ży zatem odpowiednio zmienić rozporządzenie
(EWG) nr 2377/90.
(5)
Nale
ży przewidzieć odpowiedni okres poprzedzający
stosowanie niniejszego rozporz
ądzenia, aby umożliwić
pa
ństwom członkowskim ewentualne dostosowanie
zezwole
ń na wprowadzenie do obrotu omawianych
weterynaryjnych produktów leczniczych, udzielonych
zgodnie z dyrektyw
ą 2001/82/WE Parlamentu Europej-
skiego i Rady z dnia 6 listopada 2001 r. w sprawie
wspólnotowego kodeksu odnosz
ącego się do weteryna-
ryjnych produktów leczniczych (
3
), co mo
że okazać się
konieczne w celu uwzgl
ędnienia przepisów niniejszego
rozporz
ądzenia.
(6)
Środki przewidziane w niniejszym rozporządzeniu są
zgodne z opini
ą Stałego Komitetu ds. Weterynaryjnych
Produktów Leczniczych,
PL
17.6.2008
Dziennik Urz
ędowy Unii Europejskiej
L 157/43
(
1
) Dz.U. L 224 z 18.8.1990, s. 1. Rozporz
ądzenie ostatnio zmienione
rozporz
ądzeniem Komisji (WE) nr 203/2008 (Dz.U. L 60
z 5.3.2008, s. 18).
(
2
) Dz.U. L 189 z 23.7.1994, s. 67.
(
3
) Dz.U. L 311 z 28.11.2001, s. 1. Dyrektywa ostatnio zmieniona
dyrektyw
ą 2004/28/WE (Dz.U. L 136 z 30.4.2004, s. 58).

PRZYJMUJE NINIEJSZE ROZPORZ
ĄDZENIE:
Artyku
ł 1
W za
łącznikach I i II do rozporządzenia (EWG) nr 2377/90
wprowadza si
ę zmiany zgodnie z załącznikiem do niniejszego
rozporz
ądzenia.
Artyku
ł 2
Niniejsze rozporz
ądzenie wchodzi w życie trzeciego dnia po
jego opublikowaniu w Dzienniku Urz
ędowym Unii Europejskiej.
Niniejsze rozporz
ądzenie stosuje się od dnia 16 sierpnia 2008 r.
Niniejsze rozporz
ądzenie wiąże w całości i jest bezpośrednio stosowane we wszystkich
pa
ństwach członkowskich.
Sporz
ądzono w Brukseli, dnia 16 czerwca 2008 r.
W imieniu Komisji
Günter VERHEUGEN
Wiceprzewodnicz
ący
PL
L 157/44
Dziennik Urz
ędowy Unii Europejskiej
17.6.2008
ZA
ŁĄ
CZNIK
A.
W
pkt
2.2.3
w
za
łą
czniku
I
(Wykaz
substancji
farmakologicznie
czynnych,
dla
których
zosta
ły
ustalone
maksymalne
limity
pozosta
ło
ści)
wpis
„Cyflutryna
”
zast
ępuje
się
wpisem
w
brzmieniu:
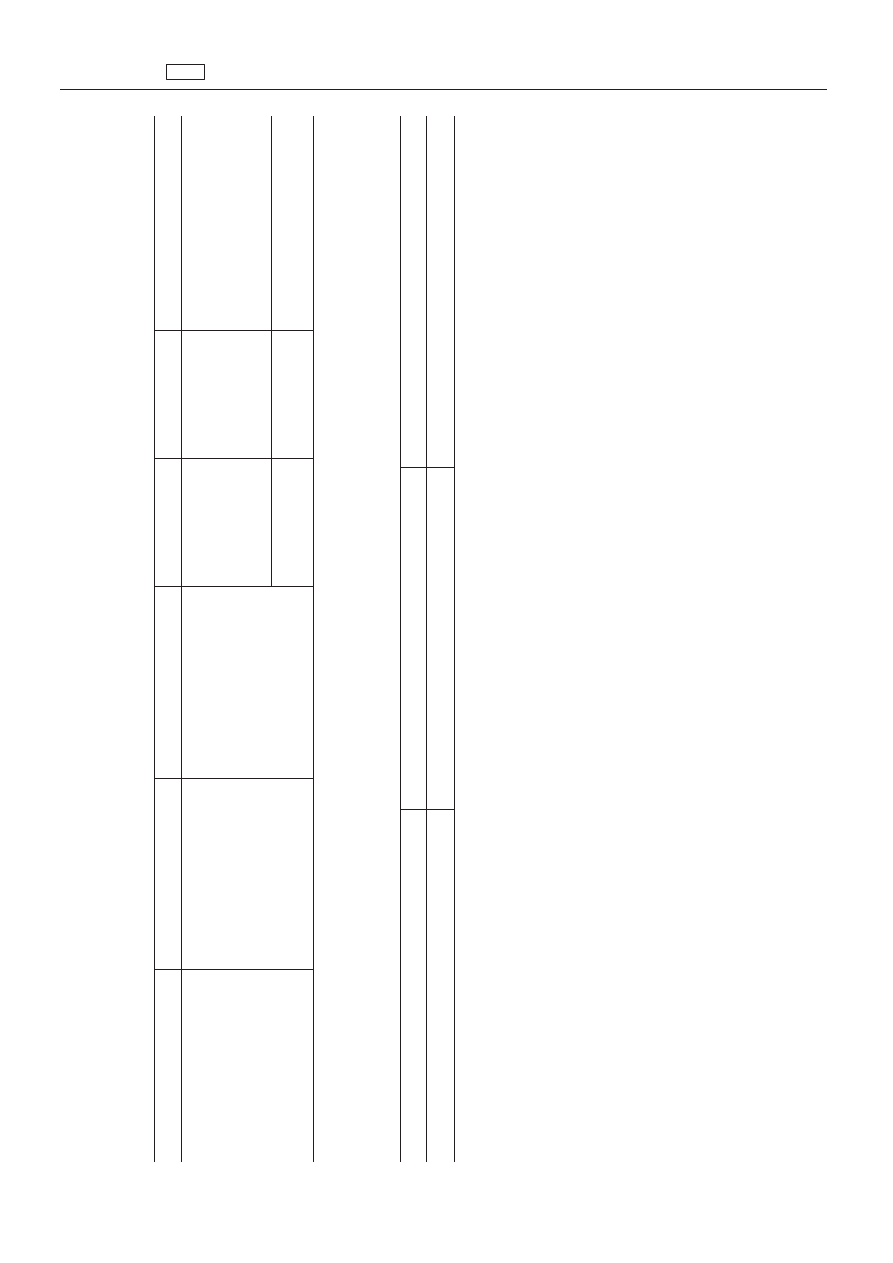
2.2.3.
Pyretroidy
Substancja
farmakologiczn
ie
czynna
Pozosta
ło
ść
znacznikowa
Gatunek
zwierz
ąt
NDP
Tkanki
docelowe
Inne
przepisy
„Cyflutryna
Cyflutryna
(suma
izomerów)
Byd
ło,
kozy
10
μg/kg
Mi
ęś
nie
50
μg/kg
Tł
uszc
z
10
μg/kg
W
ątroba
10
μg/kg
Nerki
20
μg/kg
Ml
eko
Nale
ży
przestrzega
ć
dalszych
przepisów
okre
ślonych
w
dyrektywie
94/29/WE
”
B.
W
pkt
6
w
za
łą
czniku
II
(Wykaz
substancji,
dla
których
nie
okre
ślono
maksymalnych
limitów
pozosta
ło
ści)
dodaje
się
nast
ępuj
ąc
ą
substancj
ę:
6.
Substancje
pochodzenia
ro
ślinnego
Substancja
farmakologicznie
czynna
Gatunek
zwierz
ąt
Inne
przepisy
„Lektyna
uzyskana
z
fa
soli
czerwonej
kidney
(Phaseolus
vulgaris)
Świnie
Wy
łą
cznie
do
stosowania
doustnego
”
PL
17.6.2008
Dziennik Urz
ędowy Unii Europejskiej
L 157/45
Wyszukiwarka
Podobne podstrony:
Automatyka(000507) 2008 09 17 06
Automatyka(000507) 2008 09 17 06
2008 06 Test CAPTCHA
PiKI 2008 06
2008 06 pisemny klucz
2008 06 Java Microedition – metody integracji aplikacji [Inzynieria Oprogramowania]
Filozofia 17[1].01.2008, Filozofia 17
2008 06 pisemny
mat fiz 2008 06 02
2008 06 05 WHR B DAinstrukcja
2008 06 Edytor grafiki wektorowej Inkscape [Grafika]
Elektronika Praktyczna 2008 06
2008.06.02 prawdopodobie stwo i statystyka
SIMR-AN2-EGZ-2008-06-27a-rozw
2008.06.02 matematyka finansowa
TIiK zadania 2011 06 17 IX pol
Dz U 2008 nr 17 poz 104 świadectwa charakterystyki energetycznej szkolenie
więcej podobnych podstron