
Pobrano ze strony www.sqlmedia.pl
Pobrano ze strony www.sqlmedia.pl
KOD ZDAJ
ĄCEGO
MCH-W2D1P-021
EGZAMIN MATURALNY
Z CHEMII
Arkusz II
Czas pracy 120 minut
Instrukcja dla zdaj
ącego
1. Prosz
Ċ sprawdziü, czy arkusz egzaminacyjny zawiera 12 stron.
Ewentualny brak nale
Īy zgáosiü przewodniczącemu zespoáu
nadzoruj
ącego egzamin.
2. Prosz
Ċ uwaĪnie czytaü wszystkie polecenia i informacje do
zada
Ĕ.
3. Rozwi
ązania i odpowiedzi naleĪy zapisaü czytelnie w miejscu
na to przeznaczonym przy ka
Īdym zadaniu.
4. W rozwi
ązaniach zadaĔ rachunkowych trzeba przedstawiü tok
rozumowania prowadz
ący do ostatecznego wyniku oraz
pami
Ċtaü o jednostkach.
5. W trakcie oblicze
Ĕ moĪna korzystaü z kalkulatora.
6. Prosz
Ċ pisaü tylko w kolorze niebieskim lub czarnym; nie pisaü
o
áówkiem.
7. Nie wolno u
Īywaü korektora.
8. B
áĊdne zapisy trzeba wyraĨnie przekreĞliü.
9. Brudnopis nie b
Ċdzie oceniany.
10. Obok ka
Īdego zadania podana jest maksymalna liczba
punktów, któr
ą moĪna uzyskaü za jego poprawne rozwiązanie.
11. Do ostatniej kartki arkusza do
áączona jest karta odpowiedzi,
któr
ą wypeánia egzaminator.
ĩyczymy powodzenia !
ARKUSZ II
STYCZE
ē
ROK 2003
Za rozwi
ązanie
wszystkich zada
Ĕ
mo
Īna otrzymaü
áącznie 60 punktów
(Wpisuje zdaj
ący przed rozpoczĊciem pracy)
PESEL ZDAJ
ĄCEGO
Miejsce
na naklejk
Ċ
z kodem
(Wpisuje zdaj
ący przed
rozpocz
Ċciem pracy)
Pobrano ze strony www.sqlmedia.pl
2
Egzamin maturalny z chemii
Arkusz II
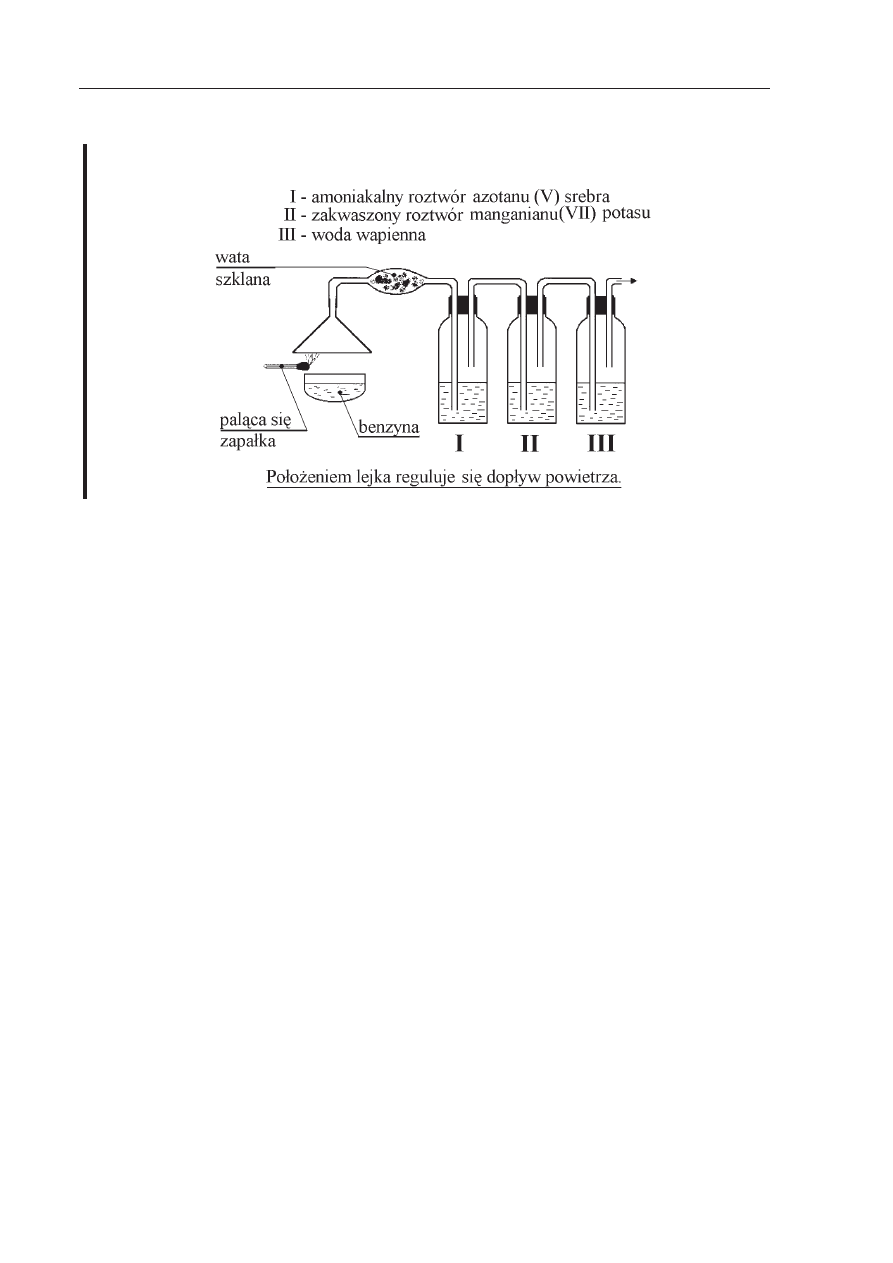
Informacje do zada
Ĕ 22., 23., 24., 25.
Przeprowadzono nast
Ċpujące doĞwiadczenie:
Zadanie 22. (3 pkt)
Napisz równania reakcji spalania jednego, dowolnego sk
áadnika benzyny przy róĪnym
dop
áywie powietrza.
.......................................................................................................................................................
.......................................................................................................................................................
.......................................................................................................................................................
Zadanie 23. (1 pkt)
Który z produktów spalania benzyny przereaguje z wod
ą wapienną? OdpowiedĨ uzasadnij
odpowiednim równaniem reakcji chemicznej.
.......................................................................................................................................................
Zadanie 24. (2 pkt)
Który z produktów spalania benzyny ma w
áaĞciwoĞci trujące i dlaczego?
.......................................................................................................................................................
.......................................................................................................................................................
.......................................................................................................................................................
Pobrano ze strony www.sqlmedia.pl

Egzamin maturalny z chemii
Arkusz II
3
Zadanie 25. (1 pkt)
Jak
ą rolĊ w opisywanym doĞwiadczeniu peánią amoniakalny roztwór azotanu(V) srebra
i roztwór manganianu(VII) potasu?
.......................................................................................................................................................
.......................................................................................................................................................
.......................................................................................................................................................
Zadanie 26. (5 pkt)
Oblicz rzeczywisty wzór w
Ċglowodoru, który w warunkach normalnych jest gazem o gĊstoĞci
2,59 g/dm
3
i zawiera 82,8% w
Ċgla.
.......................................................................................................................................................
.......................................................................................................................................................
.......................................................................................................................................................
.......................................................................................................................................................
.......................................................................................................................................................
.......................................................................................................................................................
.......................................................................................................................................................
Zadanie 27. (1 pkt)
Wyja
Ğnij, dlaczego wodą nie wolno gasiü palącej siĊ benzyny.
.......................................................................................................................................................
.......................................................................................................................................................
.......................................................................................................................................................
.......................................................................................................................................................
Pobrano ze strony www.sqlmedia.pl

4
Egzamin maturalny z chemii
Arkusz II
Zadanie 28. (2 pkt)
Zmieszano roztwory zawieraj
ące jednakowe iloĞci moli siarczanu(VI) potasu i azotanu(V)
o
áowiu(II). Uzupeánij tekst, który opisuje to doĞwiadczenie.
a) Po reakcji w uk
áadzie znajdowaáy siĊ jony:
.......................................................................................................................................................
.......................................................................................................................................................
b) Odczyn roztworu by
á:
.......................................................................................................................................................
Zadanie 29. (4 pkt)
Zaprojektuj do
Ğwiadczenie, aby wykazaü, Īe cynk jest bardziej aktywny od wodoru, a srebro
mniej aktywne od wodoru.
a) Narysuj schemat do
Ğwiadczenia lub podaj sáowny opis.
.......................................................................................................................................................
b) Zapisz obserwacje.
.......................................................................................................................................................
.......................................................................................................................................................
.......................................................................................................................................................
.......................................................................................................................................................
Pobrano ze strony www.sqlmedia.pl

Egzamin maturalny z chemii
Arkusz II
5
Zadanie 30. (4 pkt)
Zwi
ązek o wzorze sumarycznym C
3
H
6
O ma dwa izomery.
Jeden z nich
áatwo siĊ utlenia, natomiast obydwa ulegają redukcji.
a) Napisz równania redukcji tych zwi
ązków za pomocą wodoru.
I ……………………………………………………………………………………………….
II ……………………………………………………………………………………………….
b) Podaj nazwy systematyczne powsta
áych produktów reakcji redukcji:
I ……………………………………………………………………………………………….
II ……………………………………………………………………………………………….
Zadanie 31. (4 pkt)
Przeprowadzono hydroliz
Ċ tristearynianu gliceryny w Ğrodowisku zasadowym.
a) Napisz równanie hydrolizy tego t
áuszczu.
b) Zaproponuj do
Ğwiadczenie, jakie wykonasz, aby wykryü jeden, wybrany przez Ciebie
produkt hydrolizy.
…………………………………………………………………………………………………...
…………………………………………………………………………………………………...
…………………………………………………………………………………………………...
c) Jaki b
Ċdzie wynik Twojego doĞwiadczenia ?
…………………………………………………………………………………………………...
………………………………………………………………………………………………..
Pobrano ze strony www.sqlmedia.pl

6
Egzamin maturalny z chemii
Arkusz II
Zadanie 32. (3 pkt)
Podczas produkcji miedzi metod
ą hutniczą emitowane są do atmosfery gazy spalinowe,
w sk
áad których wchodzą najczĊĞciej CO
2
i SO
2
.
a) Zaproponuj odpowiedni tlenek, który zastosowany w filtrze poch
áonie CO
2
i SO
2
. Podaj
wzór tego tlenku.
…………………………………………………………………………………………………...
b) Napisz równanie reakcji zachodz
ących podczas procesu pocháaniania tlenków:
-
w
Ċgla(IV) ………………………………………………………………………………….
-
siarki(IV) ………………………………………………………………………………….
Zadanie 33. (6 pkt)
Podczas reakcji mieszaniny sproszkowanej miedzi i
Īelaza ze stĊĪonym kwasem
azotowym(V) wydzieli
áo siĊ 4,48 dm
3
gazu, a podczas reakcji tej mieszaniny z kwasem
solnym otrzymano 2,24 dm
3
gazu (obj
ĊtoĞci mierzono w warunkach normalnych).
a) Podaj, które reakcje nie zachodz
ą.
…………………………………………………………………………………………………...
…………………………………………………………………………………………………...
b) Podaj równania zachodz
ących reakcji w interpretacji jonowej.
…………………………………………………………………………………………………...
…………………………………………………………………………………………………...
c) Oblicz mas
Ċ miedzi i masĊ Īelaza w mieszaninie.
…………………………………………………………………………………………………...
…………………………………………………………………………………………………...
…………………………………………………………………………………………………...
…………………………………………………………………………………………………...
Zadanie 34. (1 pkt)
Amoniak wg teorii dysocjacji Bröensteda jest zasad
ą, bo przyjmuje proton zgodnie z reakcją:
NH
3
+ H
2
O
ĺ NH
4
+
+ OH¯
Wyja
Ğnij, dlaczego amoniak moĪe przyjąü proton?
………………………………………………………………………………………………..
Pobrano ze strony www.sqlmedia.pl

Egzamin maturalny z chemii
Arkusz II
7
Zadanie 35. (1 pkt)
Wi
ązanie wodorowe wystĊpujące miĊdzy cząsteczkami alkoholi jest odpowiedzialne za:
A. ich nisk
ą temperaturĊ topnienia,
B. ich wysok
ą temperaturĊ wrzenia,
C. ich s
áabą rozpuszczalnoĞü w wodzie,
D. ich du
Īą aktywnoĞü chemiczną.
Zadanie 36. (3 pkt)
Skomentuj zdania dotycz
ące związków 1, 2 i 3 wyrazami tak lub nie.
a) Zwi
ązki te są izomerami ……………...
b) Tylko zwi
ązek oznaczony numerem 1 odbarwia wodĊ bromową ……………..
c) Ka
Īdy z nich moĪna spaliü caákowicie, a w wyniku spalania 1 mola kaĪdego z nich
otrzymamy
tak
ą samą liczbĊ gramów wody ……………..
Zadanie 37. (3 pkt)
Pewien zwi
ązek organiczny:
-
nie daje próby Tollensa,
-
ulega hydrolizie,
-
powsta
áy w wyniku hydrolizy produkt daje pozytywny wynik próby Tollensa,
-
przed i po hydrolizie zwi
ązek ten ma sáodki smak.
a) Napisz wzór sumaryczny tego zwi
ązku.
…………………………………………………………………………………………………...
b) Napisz wzory taflowe (w projekcji Hawortha) produktów hydrolizy tego zwi
ązku.
Pobrano ze strony www.sqlmedia.pl

8
Egzamin maturalny z chemii
Arkusz II
Zadanie 38. (5 pkt)
Badany pierwiastek jest mieszanin
ą dwóch izotopów. Jądro lĪejszego izotopu skáada siĊ ze
154 cz
ąstek elementarnych, w tym z 90 neutronów, i jego zawartoĞü w mieszaninie wynosi
51,35% wszystkich atomów. Natomiast j
ądro drugiego izotopu zbudowane jest ze 156 cząstek
elementarnych.
a) Oblicz mas
Ċ atomową badanego pierwiastka.
b) Podaj liczb
Ċ atomową oraz liczby masowe obu izotopów.
…………………………………………………………………………………………………...
…………………………………………………………………………………………………...
…………………………………………………………………………………………………...
c) Jaki to pierwiastek?
…………………………………………………………………………………………………...
Zadanie 39. (1 pkt)
Wodorotlenek
Īelaza (III) moĪna otrzymaü w reakcji:
A.
Īelaza z zasadą sodową,
B. chlorku
Īelaza (II) z zasadą sodową,
C. chlorku
Īelaza (III) z zasadą sodową,
D. wodorotlenku
Īelaza (II) z zasadą sodową.
Zadanie 40. (4 pkt)
W wyniku elektrolizy wodnego roztworu substancji X na katodzie i anodzie wydzieli
áy siĊ
gazy w stosunku obj
ĊtoĞciowym 1 : 1, pH przed elektrolizą wynosiáo 7, a po elektrolizie
pH > 7.
a) Substancj
ą X moĪe byü:
…………………………………………………………………………………………………...
Pobrano ze strony www.sqlmedia.pl
Egzamin maturalny z chemii
Arkusz II
9
b) Jaki
áadunek przepáynąá przez elektrolizer, jeĪeli wydzieliáo siĊ áącznie 448 cm
3
gazów
odmierzonych w warunkach normalnych ? (F = 96500 C)
…………………………………………………………………………………………………...
…………………………………………………………………………………………………...
…………………………………………………………………………………………………...
c) Wyja
Ğnij zmianĊ pH po elektrolizie.
…………………………………………………………………………………………………...
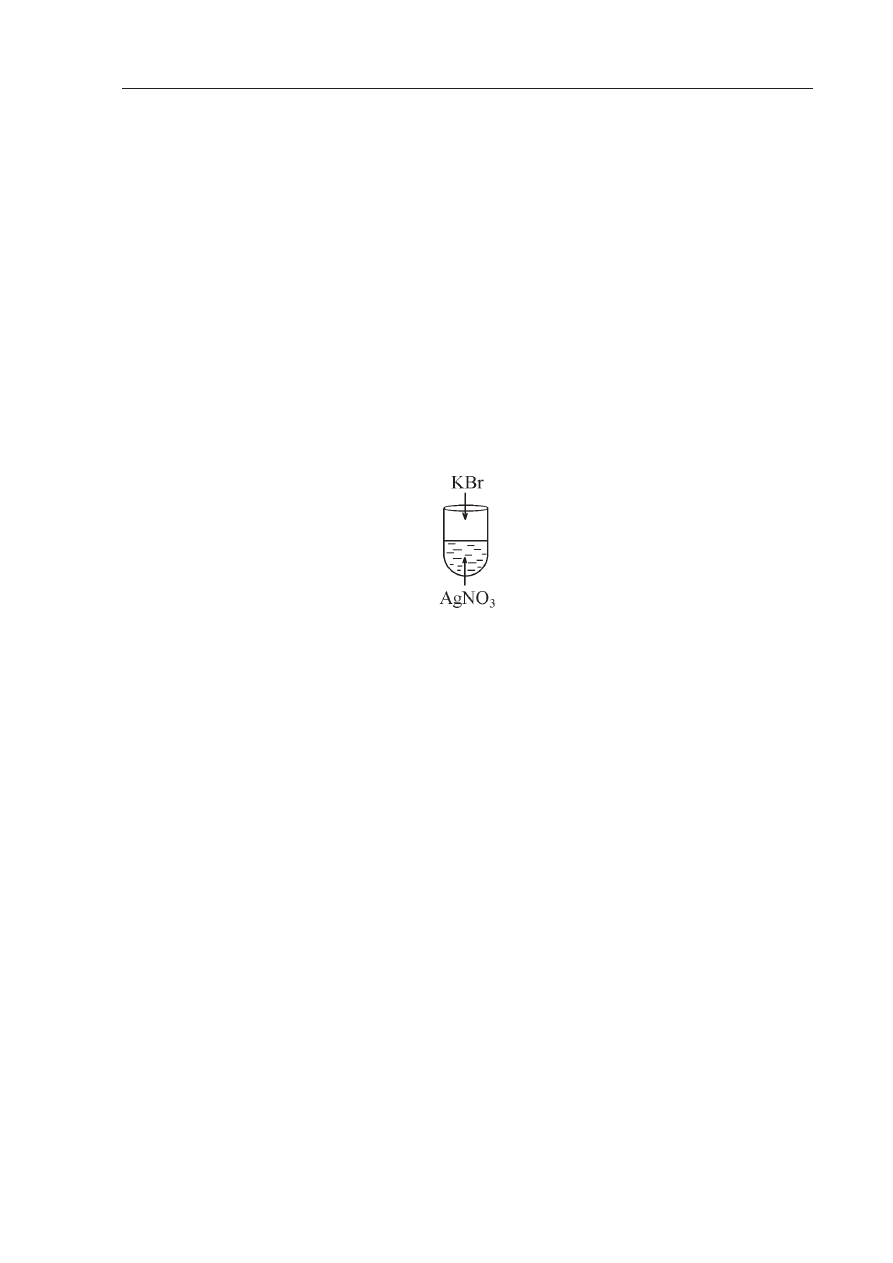
Zadanie 41. (3 pkt)
Przeprowadzono nast
Ċpujące doĞwiadczenie:
W wyniku do
Ğwiadczenia w probówce wytrąciá siĊ kremowy osad.
a) Podaj, w formie skróconej, jonowe równanie reakcji, która zasz
áa.
…………………………………………………………………………………………………...
b) Oblicz % wydajno
Ğü tej reakcji, jeĪeli roztwór zawieraá 42,5g azotanu(V)srebra
a wytr
ącony osad waĪyá 38g.
Obliczenia:
…………………………………………………………………………………………………...
…………………………………………………………………………………………………...
…………………………………………………………………………………………………...
Pobrano ze strony www.sqlmedia.pl

10
Egzamin maturalny z chemii
Arkusz II
Zadanie 42. (2 pkt)
Oblicz rozpuszczalno
Ğü substancji w temperaturze 20
0
C, je
Īeli stĊĪenie procentowe
nasyconego roztworu w tej temperaturze wynosi 20%.
.......................................................................................................................................................
.......................................................................................................................................................
.......................................................................................................................................................
.......................................................................................................................................................
.......................................................................................................................................................
Zadanie 43. (1 pkt)
Z podanych ni
Īej opisów wáaĞciwoĞci wybierz ten, który najlepiej uzasadnia róĪnice gĊstoĞci
wody i tlenu w tych samych warunkach ci
Ğnienia i temperatury.
A. Masy cz
ąsteczkowe obu substancji są róĪne.
B. W cz
ąsteczkach wody wystĊpują wiązania kowalencyjne spolaryzowane,
a w cz
ąsteczkach tlenu wiązania kowalencyjne.
C. Cz
ąsteczki tlenu nie wykazują momentu dipolowego, a miĊdzy cząsteczkami wody
mo
Īliwe jest utworzenie wiązaĔ wodorowych.
D. Za g
ĊstoĞci obu substancji odpowiedzialne są podwójne wiązania tlen–tlen
w cz
ąsteczkach tlenu i spolaryzowane wiązania wodór–tlen w cząsteczkach wody.
Pobrano ze strony www.sqlmedia.pl

Egzamin maturalny z chemii
Arkusz II
11
BRUDNOPIS
Pobrano ze strony www.sqlmedia.pl

12
Egzamin maturalny z chemii
Arkusz II
Pobrano ze strony www.sqlmedia.pl
Wyszukiwarka
Podobne podstrony:
2003, próbna matura styczeń 2003 Chemia rozszerzona arkusz2 odpowiedzi
2003 probna matura styczen 2003 Chemia podstawowa arkusz1 id 60 (2)
2003 próbna matura styczeń 2003, Chemia podstawowa arkusz1-odpowiedzi
2003, próbna matura styczeń 2003 Chemia podstawowa arkusz1 odpowiedzi
2002, matura 2002 Chemia rozszerzona arkusz2 odpowiedzi
2002, matura 2002 Chemia rozszerzona arkusz2
2002, matura 2002 Chemia rozszerzona arkusz2 odpowiedzi
Jezyk niemiecki rozszerzony arkusz id 222138
Jezyk francuski rozszerzony arkusz id 222046
chemia matura styczen 2003 arkusz 1 7NL7HMDRBPQUD5O26HUGWX
chemia matura styczen 2003 arkusz 2 DOOLNKVR7PUVYFDVTTSM5B
chemia matura styczen 2003 arkusz 1 7NL7HMDRBPQUD5O26HUGWX
fizyka matura styczen 2003 arkusz 1 YNEIP4Z27B573GY22RTYTQ
Matematyka Matura Styczen 2003 poziom rozszerzony
Fizyka Matura Styczen 2003 Arkusz 2 (2)
fizyka matura styczen 2003 arkusz 1 YNEIP4Z27B573GY22RTYTQ
Matematyka Matura Styczen 2003 poziom rozszerzony
Matematyka Matura Styczen 2003 poziom rozszerzony
więcej podobnych podstron