Witaminy E, A i C jako antyoksydanty
377
Vitamins E, A i C as antioxidatives
Rutkowski M.
1
, Matuszewski T.
2
, Kędziora J.
3
, Paradowski M.
4
,
Kłos K.
2
, Zakrzewski A.
2
1
Medical University of Lodz, Poland Physiotherapy Division, Chair
and Department of Chemistry and Clinical Biochemistry;
2
Military
Institute of Health Services in Warsaw, Poland, Central Clinical
Hospital of the Ministry of National Defense, Department
of Infectious of Diseases of Allergology;
3
Nicolaus Copernicus
University in Torun, Collegium Medicum in Bydgoszczy, Poland,
Chair and Institute of Biochemistry;
4
Medical University of Lodz,
Poland, Laboratory Diagnostics Division, Department of Laboratory
Diagnostics and Clinical Biochemistry
It has been found during last years that vitamins A, C, E and carote-
noids, besides previously recognized functions of preventing parti-
cular lipido- and avitaminosis, significantly participate in the protec-
tion of the human body against oxidation stress that is characterized
by balance disturbance between speed of free radical creation and
reactive oxygen forms with pace of their neutralization by enzymes
and antioxidants. The antioxidative system creates special protecti-
ve barrier which includes numerous chemical form with antiperoxi-
dative proprieties and vitamins are the most important part of it. The
aim of this work was the profile of occurrence and antioxidative ac-
tion of the vitamins A, C and E.
Key words: antioxidative vitamins, reactive oxygen forms
Pol. Merk. Lek., 2010, XXIX, 174, 377
Witaminy E, A i C jako antyoksydanty
MACIEJ RUTKOWSKI
1
, TOMASZ MATUSZEWSKI
2
, JÓZEF KĘDZIORA
3
, MAREK PARADOWSKI
4
,
KRZYSZTOF KŁOS
2
, ALEKSANDER ZAKRZEWSKI
2
1
Uniwersytet Medyczny w Łodzi, Katedra Biomedycznych Podstaw Fizjoterapii, Zakład Chemii i Biochemii Klinicznej,
kierownik: dr hab. med. I. Majsterek;
2
Wojskowy Instytut Medyczny w Warszawie, Centralny Szpital Kliniczny MON, Klinika Chorób Infekcyjnych
i Alergologii, kierownik: prof. dr hab. med. J. Kruszewski;
3
Uniwersytet Mikołaja Kopernika w Toruniu, Collegium Medicum w Bydgoszczy,
Katedra i Zakład Biochemii, kierownik: prof. dr hab. med. J. Kędziora;
4
Uniwersytet Medyczny w Łodzi, Katedra Diagnostyki Laboratoryjnej,
Zakład Diagnostyki Laboratoryjnej i Biochemii Klinicznej, kierownik: prof. dr hab. med. M. Paradowski
Witaminy E, A i C jako antyoksydanty
Rutkowski M.
1
, Matuszewski T.
2
, Kędziora J.
3
, Paradowski M.
4
,
Kłos K.
2
, Zakrzewski A.
2
1
Uniwersytet Medyczny w Łodzi, Katedra Biomedycznych Podstaw
Fizjoterapii, Zakład Chemii i Biochemii Klinicznej;
2
Wojskowy
Instytut Medyczny w Warszawie, Centralny Szpital Kliniczny MON,
Klinika Chorób Infekcyjnych i Alergologii;
3
Uniwersytet Mikołaja
Kopernika w Toruniu, Collegium Medicum w Bydgoszczy, Katedra
i Zakład Biochemii;
4
Uniwersytet Medyczny w Łodzi, Katedra
Diagnostyki Laboratoryjnej, Zakład Diagnostyki Laboratoryjnej
i Biochemii Klinicznej
W ostatnich latach wykazano, że witaminy A, C i E oraz karotenoidy,
oprócz poznanej wcześniej funkcji zapobiegania określonym lipido-
i awitaminozom, biorą istotny udział w mechanizmach obronnych
organizmu przeciwko stresowi oksydacyjnemu. Stres oksydacyjny
to stan organizmu, który charakteryzuje się zaburzeniem równowa-
gi, pomiędzy szybkością wytwarzania wolnych rodników i reaktyw-
nych form tlenu a szybkością ich unieszkodliwiania przez enzymy i
antyoksydanty. Układ antyoksydacyjny tworzy swoistą barierę
ochronną, a w jego skład wchodzą liczne związki o właściwościach
przeciwutleniających, z których najważniejszymi są witaminy. Ce-
lem pracy była charakterystyka występowania i działania antyoksy-
dacyjnego witamin A, C i E.
Słowa kluczowe: witaminy antyoksydacyjne, reaktywne formy tlenu
Pol. Merk. Lek., 2010, XXIX, 174, 377
We wcześniejszej pracy poglądowej [17] opisaliśmy zjawi-
ska patologiczne zachodzące w ustroju człowieka pod wpły-
wem stresu oksydacyjnego. Stres oksydacyjny (szok tleno-
wy) określa się jako zaburzenie istniejącej w ustroju równo-
wagi prooksydacyjno-oksydacyjnej w kierunku reakcji utle-
niania. Zaburzenie to wynika ze zwiększenia stężenia reak-
tywnych form tlenu (RFT) przy zbyt małej wydolności układu
antyoksydacyjnego. Szok tlenowy spełnia istotną rolę w licz-
nych procesach biologicznych zachodzących w ustroju, bę-
dąc czynnikiem sprawczym wielu różnych chorób, w tym cho-
rób nowotworowych i chorób układu krążenia.
Układ antyoksydacyjny tworzy swoistą barierę ochronną.
W skład tej bariery wchodzą liczne związki o właściwościach
przeciwutleniających określane – z racji małych rozmiarów czą-
steczek – mianem antyoksydantów drobnocząsteczkowych [1,
2]. Występują one zarówno w środowisku hydrofilowym (wod-
nym) w postaci rozpuszczonej w cytoplazmie komórek i pły-
nach pozakomórkowych, jak i w środowisku hydrofobowym
(lipofilnym) w błonach komórkowych i lipoproteinach osocza.
Do najistotniejszych antyoksydantów hydrofilowych nale-
żą: glutation (zredukowany), kwas moczowy, cysteina, kre-
PRACE POGLĄDOWE
atynina i karnozyna. Spośród antyoksydantów hydrofobowych
największe znaczenie mają: bilirubina, koenzym Q (zredu-
kowany), liczne antocyjaniny, flawonoidy i karotenoidy. Anty-
oksydantem o powinowactwie zarówno do środowiska hy-
drofilowego, jak i lipofilnego jest melatonina [1-3, 9, 11, 15,
18, 24, 28].
Wśród najważniejszych antyoksydantów drobnocząstecz-
kowych znajdują się również niektóre witaminy. W środowi-
sku hydrofobowym wiele funkcji antyoksydacyjnych spełnia
witamina E i witamina A – wraz ze swoją najistotniejszą pro-
witaminą
b-karotenem, a w środowisku hydrofilowym ener-
gicznym antyoksydantem jest witamina C [28]. Wartości pra-
widłowych stężeń witamin antyoksydacyjnych w osoczu po-
dano w tabeli 1.
WITAMINA A
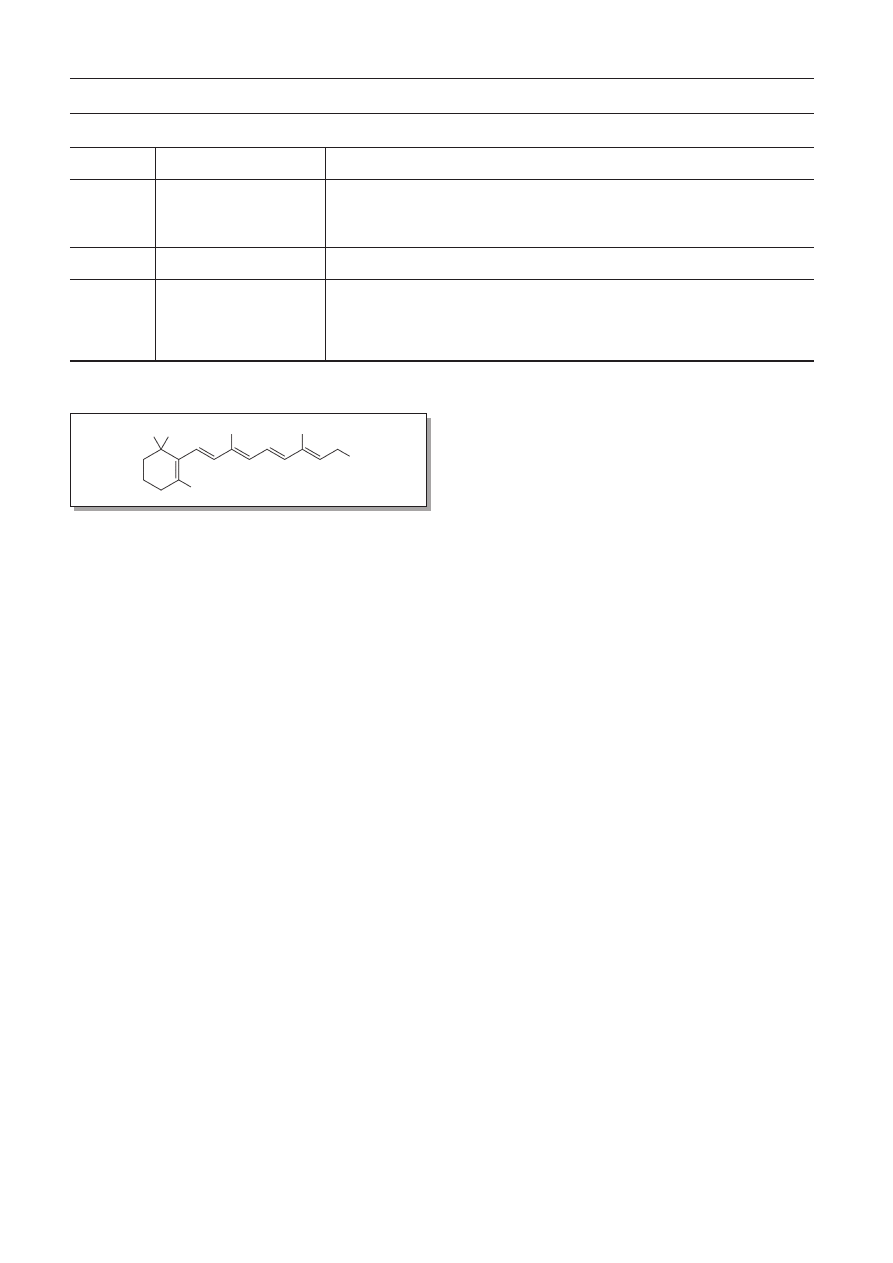
Witamina A ma dwie podstawowe formy:
– A1, czyli retinol (ryc. 1), znana też jako akseroftol,
– A2, czyli 3,4-didehydroretinol.
M. Rutkowski i wsp.
378
W organizmie człowieka może ona powstawać z niektó-
rych karotenoidów nazywanych prowitaminami A, spośród
których najważniejszy jest
b-karoten. Z jednej jego cząstecz-
ki powstają dwie cząsteczki retinolu. Retinol stanowi najpo-
spolitszą postać witaminy A, składa się z pierścienia
b-jono-
nu i połączonego z nim łańcucha polienowego. Obok wolnej
formy alkoholowej występuje on również w formie zestryfiko-
wanej. Witamina A ma też postać aldehydową (retinal) i kwa-
sową (kwas retinojowy) [1, 2, 22, 25, 28].
Retinol jest substancją krystaliczną o słabo żółtym za-
barwieniu. Rozpuszcza się w tłuszczach i rozpuszczalni-
kach organicznych. Wykazuje odporność na działanie za-
sad, natomiast kwasy – nawet rozcieńczone – powodują
odwodnienie retinolu ze znaczną utratą aktywności wita-
minowej. Zarówno retinol, jak i karotenoidy są stosunko-
wo mało wrażliwe na temperaturę rzędu 100°C, występu-
jącą podczas gotowania potraw, natomiast w wyższych
temperaturach (np. podczas smażenia), dochodzi do ich
rozpadu i znacznych strat z tego wynikających. Równie
łatwo retinol ulega rozkładowi w trakcie jełczenia tłuszczów
oraz jest wrażliwy na działanie światła (głównie nadfiole-
tu) [10, 16, 22, 25, 28].
Witamina A występuje wyłącznie w produktach pochodze-
nia zwierzęcego. Najbogatszym jej źródłem jest olej z wątro-
by ryb morskich, zwany popularnie tranem. Obecna jest też
w maśle, mleku i pełnotłustych produktach mleczarskich oraz
żółtkach jaj. W wielu krajach, w tym również w Polsce, w celu
poprawienia wartości odżywczej stosuje się witaminizowa-
nie żywności. W witaminę A wzbogaca się margaryny i odżyw-
ki dla niemowląt.
Karotenoidy (wśród nich będące prowitaminą A) wystę-
pują głównie w produktach roślinnych. Są również zawarte w
mleku krów żywionych na pastwiskach, w maśle oraz tłusz-
czu zwierząt roślinożernych. Spośród produktów roślinnych
bogatych w
b-karoten należy wymienić: marchew i dynię, zie-
lone warzywa (szpinak, boćwina, sałata, zielony groszek,
pomidory), z owoców zaś morele, wiśnie, śliwki i pomarań-
cze [8, 10, 21, 22, 28].
Witamina A i karotenoidy są wchłaniane wraz z tłuszcza-
mi pokarmowymi, jednak proces ten dla
b-karotenu przebie-
ga 6-krotnie wolniej niż dla retinolu. Prawidłowe stężenie
omawianej witaminy w osoczu przedstawiono w tabeli 1.
Właściwości antyoksydacyjne witaminy A (także karote-
noidów) wynikają z obecności w cząsteczce sprzężonego
układu wiązań C=C w łańcuchu bocznym. Dzięki niemu efek-
tywnie wygasza ona tlen singletowy oraz neutralizuje wolne
rodniki powstające podczas peroksydacji lipidów. Witamina
A ma szczególne powinowactwo do nabłonków oraz siatkówki
oka. Działa, podobnie jak witamina E, zarówno w I jak i II linii
obrony przed RFT (w procesach prewencyjnych oraz reak-
cjach wolnorodnikowych na etapie terminacji).
Witamina A w organizmie:
– zapobiega wysychaniu i rogowaceniu nabłonka,
– sprzyja zdolności regeneracyjnej komórek przez utrzymy-
wanie błon śluzowych w stanie prawidłowym fizjologicz-
nie,
– jest niezbędna w procesie widzenia, gdyż wchodzi w skład
rodopsyny – światłoczułego barwnika siatkówki oka,
– wywiera korzystny wpływ na funkcje rozrodcze organizmu
(oddziaływanie na błony śluzowe organów płciowych).
Dzienne zapotrzebowanie na witaminę A przedstawiono w
tabeli 2. Jej niedobór może objawiać się złym widzeniem, a w
szczególności ślepotą zmierzchową („kurza ślepota”), sucho-
ścią skóry i/lub wysypką skórną, kruchością i powolnym ro-
śnięciem paznokci, suchością i łamliwością włosów, brakiem
łaknienia, podatnością na infekcje, zahamowaniem wzrostu.
Długoterminowe podawanie dużych dawek witaminy A lub
jednorazowe przyjęcie nadmiernej ilości może spowodować
hiperwitaminozę A z takimi objawami, jak: drażliwość, zabu-
rzenia ze strony przewodu pokarmowego (m.in. wymioty, brak
łaknienia, nudności), zmiany zabarwienia skóry, powiększe-
nie wątroby i śledziony, wypadanie włosów, świąd i suchość
skóry [8, 10, 22, 25].
WITAMINA E
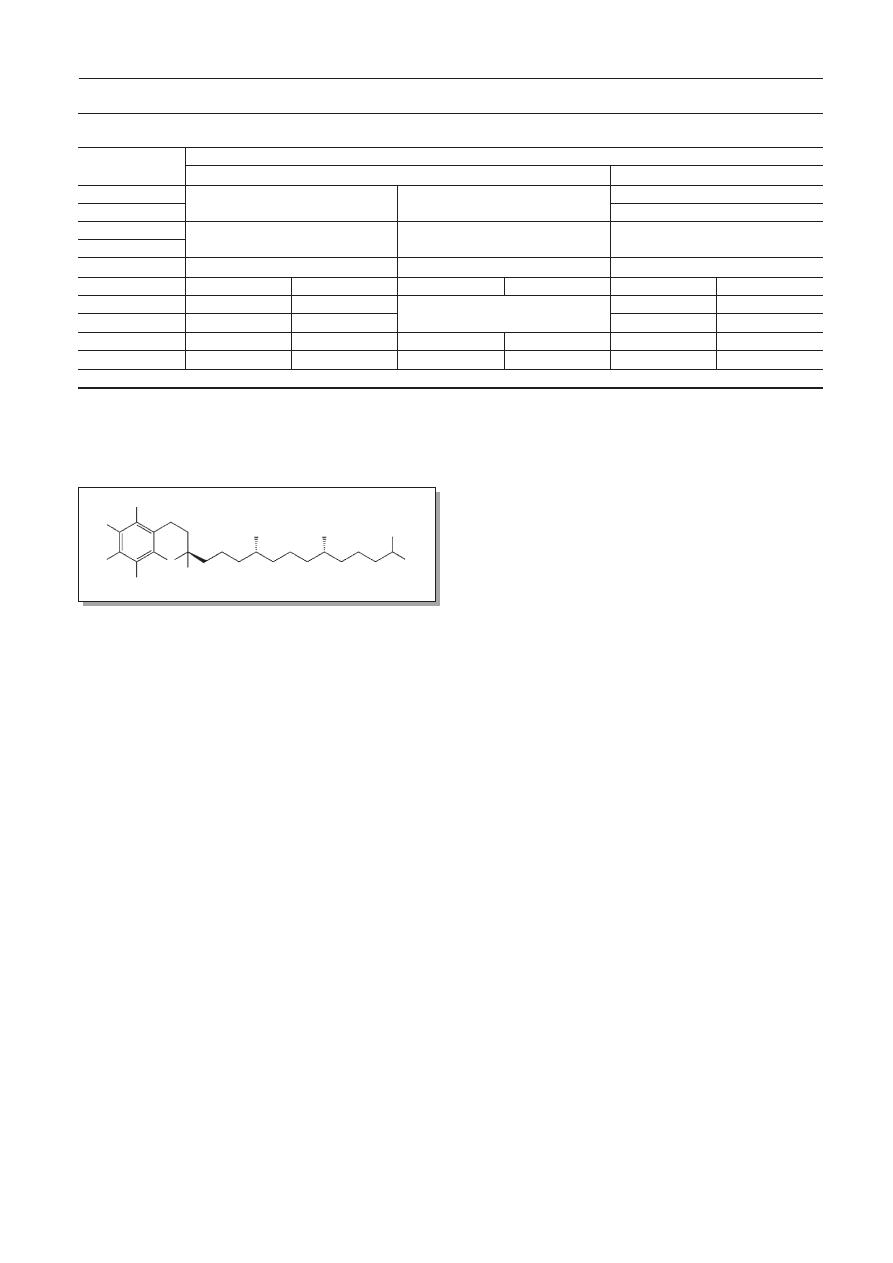
Terminem witamina E określa się 8 wielkocząsteczkowych fe-
noli, zawierających układ pierścieniowy chromanu z dołączo-
nym izoprenowym łańcuchem bocznym. Wyróżnia się wśród
nich 4 tokoferole (różnią się liczbą i położeniem grup -CH
3
) i 4
podobnie zbudowane tokotrienole, których łańcuch boczny ma
3 wiązania C=C. Istnieją także ich estry. Pełną aktywność wi-
taminy E wykazuje
a-tokoferol (ryc. 2) [1, 2, 4, 20, 28].
Witamina E ma postać lepkiego, gęstego, żółtawego ole-
ju. Dobrze rozpuszcza się w tłuszczach i większości rozpusz-
czalników organicznych. Jest dość odporna na działanie
kwasów, zasad i wysokiej temperatury. Wolne tokoferole są
wrażliwe na działanie tlenu i promieni ultrafioletowych. Estry
tokoferolu cechuje większa odporność na te czynniki, szcze-
gólnie na tlen. Ze względu na obecność 3 asymetrycznych
atomów węgla witamina E jest optycznie czynna, związek
naturalny jest prawoskrętny. Otrzymana syntetycznie (race-
mat) krystalizuje [4, 20, 22, 28].
CH
3
CH
3
CH
3
CH
3
H
3
C
OH
Ryc. 1. Wzór strukturalny retinolu
Fig. 1. The structural formula of retinol
Tabela 1. Wartości prawidłowych stężeń witamin antyoksydacyjnych w osoczu
Table 1. Regular value of antioxidative vitamins in the blood plasma
Witaminy
Prawidłowe stężenia
Źródła danych
(witaminy w
mmol/l)
Witamina A
0,53-2,10
Biochemia Harpera. PZWL, Warszawa 1995 r.
0,90-2,80
Pawelski S., Maj S.: Normy i diagnostyka chorób wewnętrznych. PZWL, Warszawa 1993 r.
1,05-2,10
Podlewski J.K., Chwalibowska-Podlewska: Leki współczesnej terapii. Wyd. Fund. Buchnera,
Warszawa 1996 r.
1,05-2,27
Kokot F., Kokot S.: Badania laboratoryjne – zakres norm i interpretacja. PZWL, Warszawa 1996 r.
Witamina E
12-371
Pawelski S., Maj S.: Normy i diagnostyka chorób wewnętrznych. PZWL, Warszawa 1993 r.
1,5-23
Fettlösliche Vitamine. Dr Falk Pharma GmbH, Freiburg 1998 r.
Witamina C
33-72
Rutkowski M., Grzegorczyk K.: Kolorymetryczne oznaczanie stężeń witaminy C przy użyciu
(zakres wyznaczony
odczynnika fosforowolfr. – modyfikacja metody Kyawa. Diagn. Lab. 1998, 34, 511-520
doświadczalnie)
36-79
Rutkowski M., Grzegorczyk K.: Witamina C w medycynie – prawidłowe stężenie w osoczu.
(na podstawie 25 zakresów
Pol. Merk. Lek. 1999, 6, 57-60
według piśmiennictwa)
Witaminy E, A i C jako antyoksydanty
379
Witamina E jest wytwarzana tylko w roślinach, zwierzęta i
ludzie jej nie syntetyzują. Najbardziej wartościowym natural-
nym źródłem tej witaminy jest olej z kiełków pszenicy, zawie-
rają ją także pełne ziarna zbóż (szczególnie pszenicy i kuku-
rydzy), orzechy oraz zielone warzywa liściaste: sałata, szpi-
nak i kapusta. Z tych względów najkorzystniejsze dla zdro-
wia jest spożywanie olejów roślinnych, mniej natomiast mar-
garyn, gdyż ich produkcja obniża zawartość tokoferoli (o około
25%). Oleje tłoczone na zimno zawierają znacznie więcej
witaminy E niż uszlachetniane, gdyż sam proces ich rafinacji
niszczy aż 75% naturalnej witaminy.
Wchłanianiu witaminy E sprzyja występowanie tłusz-
czów w pożywieniu. Płód czerpie tę witaminę z zapasów
matki, ale jej przechodzenie przez łożysko jest słabe, dla-
tego tkanki noworodków nawet urodzonych przez matki
żywiące się prawidłowo zawierają stosunkowo mało wita-
miny E. Mleko matki zawiera natomiast znaczne jej ilości
[14, 20, 22, 28]. Prawidłowe stężenie witaminy E w oso-
czu przedstawiono w tabeli 1.
Aktywność antyoksydacyjną witaminie E nadaje grupa
fenolowa -OH związana z układem pierścieniowym (estry
witaminy pozbawione są tej właściwości). Boczny łańcuch
pozwala na jej „zakotwiczanie” w lipidach.
Witamina E ze względu na silne właściwości antyoksyda-
cyjne uważana jest za jeden z głównych związków chronią-
cych nasz organizm przed stresem oksydacyjnym. Może
uczestniczyć w pierwszej linii obrony przed RFT efektywnie
wygaszając tlen singletowy. Tym samym nie dochodzi do jego
reakcji z resztami wielonienasyconych kwasów tłuszczowych
zawartych w fosfolipidach błon komórkowych oraz hamowa-
na jest reakcja peroksydacji i generowania ich rodników. W
drugiej linii obrony witamina E szybko reaguje z wolnymi rod-
nikami nadtlenkowymi lipidów i unieczynnia je, a równocze-
śnie przerywa ich wytwarzanie oraz hamuje ciąg wolnorod-
nikowych reakcji łańcuchowych uszkadzających komórki [4,
10, 14, 16, 20, 26-28].
Witamina E, niedopuszczając do utleniania wieloniena-
syconych kwasów tłuszczowych, istotnie zapobiega rozwo-
jowi miażdżycy naczyń krwionośnych. Pobudza ona jedno-
cześnie syntezę substancji przeciwzakrzepowych, zmniejsza-
jąc ryzyko powstawania mikrozakrzepów. Zapewnia właści-
wą stabilizację i przepuszczalność błon komórkowych, za-
pobiega niedokrwistości makrocytarnej u dzieci. Witamina E
ochrania też krwinki czerwone podczas transportowania przez
nie tlenu. Wspomagając proces oddychania komórkowego
wpływa na prawidłowe funkcjonowanie i utrzymanie wyso-
kiej wydolności mięśni, dlatego m.in. zalecane jest, aby spor-
towcy spożywali produkty zawierające dużo witaminy E. Jest
ona również niezbędna dla mężczyzn do prawidłowego wy-
twarzania nasienia [5, 14].
W przypadku niedoborów witaminy E może dochodzić do
następujących najistotniejszych zaburzeń:
– zwiększonego ryzyka chorób sercowo-naczyniowych,
– niedokrwistości u niemowląt i dzieci,
– upośledzonego funkcjonowania i osłabienia mięśni szkie-
letowych (dystrofia),
– rogowacenia i przedwczesnego starzenia się skóry oraz
utrudnionego gojenia się ran, osłabienia zdolności kon-
centracji i stanów rozdrażnienia, zaburzeń płodności.
Wielkość dziennego zapotrzebowania na witaminy anty-
oksydacyjne przedstawiono w tabeli 2. W terapii stosowane
są tzw. megadawki witaminy E, przekraczające jednorazowo
wartość 1000 mg. Należy jednak podkreślić, że długotermi-
nowe przyjmowanie witaminy E w dawkach większych niż
1000 mg na dobę może dawać objawy przedawkowania pod
postacią uczucia zmęczenia, bólów głowy, osłabienia mięśni
i zaburzeń widzenia [4, 5, 10, 20, 28].
WITAMINA C
Witamina C została poznana jako czynnik zapobiegający
gnilcowi. W 1928 roku wyodrębniono ją z materiału roślinne-
go. Po kilku latach ustalono jej budowę chemiczną i pod kie-
runkiem Polaka Tadeusza Reichsteina dokonano pierwszej
jej syntezy [1, 2, 12, 23].
Potocznie używana nazwa witaminy C – „kwas askorbi-
nowy” (ryc. 3) nie odpowiada w pełni nomenklaturze chemicz-
nej, bowiem chemicznie nie jest ona kwasem, tylko związ-
kiem spokrewnionym z cukrami (heksozami). Jej biosynteza
stanowi jeden ze szlaków przemian glukozy, doprowadzają-
cy do utworzenia
g-laktonu kwasu L-gulonowego. Witamina
C jest formą enolową jego odwodornionej postaci. Związek
CH
3
H
3
C
HO
CH
3
CH
3
O
CH
3
CH
3
CH
3
CH
3
Ryc. 2. Wzór strukturalny
a-tokoferolu
Fig. 2. The structural formula of
a-tocopherol
Uwaga: 1 równoważnik retinolu odpowiada 1
mg retinolu.
Attention: 1 equivalent retinol answers 1
mg retinol.
K – kobiety; M – mężczyźni 1 IU witaminy A = 0,33
mg retinolu.
K – females; M – males 1 IU. vitamin A = 0.33
mg retinol.
Wiek
Witaminy
A (IU)
E (mg)
C (mg)
0-6 miesiąc życia
1500
5
30-50
6-12 miesiąc życia
50
1-3 rok życia
2000
6
50
4-6
7-9 rok życia
2300
7
Płeć
K
M
K
M
K
M
10-12 rok życia
2700
3300
10
75
80
13-15 rok życia
80
85
19-25 rok życia
800*
1000*
8
10
60
60
26-60 rok życia
800*
1000*
8
8
60
60
*równoważniki retinolu (
mg)
Tabela 2. Zalecenia dziennego zapotrzebowania na witaminy antyoksydacyjne [według 15, 24, 29]
Table 2. The recommendation of daily requirement on the antioxidative vitamins [according to 15, 24, 29]

M. Rutkowski i wsp.
380
ten dla większości ssaków, oprócz naczelnych i niektórych
gatunków nietoperzy nie jest witaminą, ponieważ syntetyzu-
ją go samodzielnie. Wyjątek stanowią ssaki naczelne, w tym
człowiek, a także świnka morska i niektóre gatunki nietope-
rzy. W ich organizmach istnieje blok metaboliczny w kaska-
dzie przemian prowadzących do biosyntezy kwasu askorbi-
nowego, ponieważ brakuje głównego dla tej biosyntezy en-
zymu – oksydazy L-gulonowej). Wymienione organizmy mu-
szą zatem przyjmować witaminę C pochodzenia egzogen-
nego wraz z pokarmami [8, 10, 19, 23, 28].
Witamina C tworzy 4 izomery przestrzenne, z których
czynność biologiczną ma tylko forma L kwasu (+)-askorbi-
nowego [5].
Kwas askorbinowy ma postać bezbarwnych kryształków
o kwaśnym smaku, dobrze rozpuszczalnych w wodzie, a nie-
rozpuszczalnych w rozpuszczalnikach organicznych (poza
alkoholem). Wykazuje czynność optyczną, a związek pocho-
dzenia naturalnego jest prawoskrętny [13, 23]. Łagodne utle-
niacze przeprowadzają go w zachowujący aktywność wita-
minową kwas dehydroaskorbinowy, dający się w ustroju ła-
two zredukować do związku początkowego.
Kwas askorbinowy w roztworach wodnych jest wrażliwy
na ogrzewanie, szczególnie w obecności tlenu. Niektóre
metale, np. miedź i żelazo, katalizują tę reakcję. Środowisko
silnie kwaśne działa na powyższy związek destrukcyjnie,
podobnie też środowisko alkaliczne. W procesie przetwarza-
nia żywności, takiej jak: suszenie, solenie oraz konserwowa-
nie przetworów warzywnych i owocowych (np. benzoesanem
sodu) następuje znaczny rozkład kwasu askorbinowego. Przy-
spieszony rozkład powoduję niektóre leki (np. aspiryna, sul-
fonamidy, barbiturany). Podobnie działają promienie ultrafio-
letowe [10, 13, 19, 23].
Witamina C występuje przede wszystkim w roślinach.
Szczególnie dużo zawierają jej owoce cytrusów, dzikiej róży
i głogu, czarne porzeczki, winogrona, jabłka, maliny, truskaw-
ki, żurawiny, a także chrzan i pomidory. W mniejszych ilo-
ściach obecna jest w zielonych częściach warzyw: kapuście
włoskiej, sałacie, brukselce, szpinaku, szczawiu i zielonej
papryce oraz ziemniakach.
Warto pamiętać, że podczas przechowywania w okresie
zimy ziemniaki i warzywa tracą znaczną część witaminy C.
Produkty pochodzenia zwierzęcego zawierają jej bardzo
mało. Niewielkie ilości znajdują się w korze nadnerczy, przy-
sadce mózgowej, grasicy, soczewce oka oraz w mleku. Pra-
widłowe stężenia witaminy C w osoczu człowieka przedsta-
wiono w tabeli 1. Dla celów medycznych otrzymywana jest
ona syntetycznie, zarówno w stanie wolnym, jak i w postaci
różnych soli [8, 10, 13, 23].
Witamina C jest niezbędna jako kofaktor w wielu proce-
sach ustrojowej biosyntezy. Uczestniczy w procesach meta-
bolicznych jako substancja przenosząca elektrony. Współ-
działa w biosyntezie kolagenu, przyspiesza proces gojenia
się ran i zrastania kości. Uczestniczy w metabolizmie tłusz-
czów, cholesterolu i kwasów żółciowych. Bierze udział w bio-
syntezie hormonów kory nadnerczy. Ułatwia przyswajanie
niehemowego żelaza i uczestniczy w erytropoezie.
Jedną z najważniejszych właściwości witaminy C jest sil-
ne działanie antyoksydacyjne. Sprzężona para jej form: utle-
nionej i zredukowanej, tworzy układ oksydoredukcyjny o po-
tencjale E’O = + 0,100 V, zdolny do redukcji RFT toksycz-
nych dla komórek, takich jak
1
O
2
, O
2
·–
i
·
OH. Jako silny reduk-
Ryc. 3. Wzór strukturalny kwasu askorbinowego
Fig. 3. The structural formula of ascorbic acid
HO
HO
HO
OH
O
O
tor przeciwdziała też procesom oksydacyjnym powodowa-
nym przez wolne rodniki. Stwierdzono, że witamina C jest
głównym antyoksydantem środowiska wodnego organizmu.
Corocznie w coraz większej liczbie publikacji omawiane jest
działanie prewencyjne, a nawet terapeutyczne witaminy C w
różnych chorobach. Można o nim przeczytać szczególnie w pra-
cach dotyczących nowotworów oraz chorób serca i naczyń. Jest
też przedmiotem zainteresowania gastrologii, gdyż hamuje po-
wstawanie w żołądku rakotwórczych N-nitrozoamin. Poza tym
podkreśla się jej właściwości stymulujące odporność organizmu,
a nawet jej właściwości bakteriostatyczne [8, 19, 23, 28].
Niedobory witaminy C wynikające z błędów żywieniowych
lub nasilonego zużycia w przebiegu wymienionych chorób
mogą objawiać się: zaburzeniami w wytwarzaniu kolagenu i
wynikającą stąd zwiększoną łamliwością kości oraz wolniej-
szym gojeniem się ran, kruchością naczyń włosowatych i
możliwością powstawania mikrowylewów w różnych narzą-
dach, zmniejszeniem odporności na zakażenia, bólami mię-
śniowymi i zmęczeniem, apatią i brakiem łaknienia, wystę-
powaniem szkorbutu (gnilca), objawiającego się obrzękami i
krwawieniem z dziąseł oraz wypadaniem zębów.
Objawami towarzyszącymi przyjmowaniu tzw. megadawek
tej witaminy może być tworzenie się kamieni szczawiano-
wych w nerkach, czy też zaburzenia czynności przewodu
pokarmowego. Jednocześnie należy pamiętać, aby nie łą-
czyć jej z podawaniem witaminy B
12
[8, 10, 13, 19, 23, 28]. W
tabeli 2 przedstawiono wielkość dziennego zapotrzebowa-
nia na witaminę C.
POSUMOWANIE
Witaminy A, E i C są w stanie, mimo małych stężeń we krwi,
opóźniać bądź zapobiegać oksydacyjnej przemianie innych
substratów ważnych dla naturalnej homeostazy ustrojowej,
takich jak białka czy lipidy, występujące w większych stęże-
niach. Witaminy te przeciwdziałają gromadzeniu RFT uniesz-
kodliwiając je, bądź podwyższając możliwości obronne innych
endogennych antyoksydantów [1, 2, 6, 7]. Duże znaczenie
prewencyjne i terapeutyczne ma więc suplementacja witami-
nami antyoksydacyjnymi, a przede wszystkim racjonalne odży-
wianie bogate w naturalne źródła tych witamin [8, 24].
PIŚMIENNICTWO
1. Antoniades C., Tousoulis D., Tentolouris C. i wsp.: Oxidative stress, an-
tioxidant vitamins, and atherosclerosis – from basic research to clinical
practice. Herz, 2003, 28, 628-638.
2. Bartosz G.: Druga twarz tlenu. Warszawa: Wydawnictwo Naukowe PWN,
2003, 179-196.
3. Berger M.M.: Can oxidative damage be treated nutritionally? Clin. Nutr.,
2005, 24, 172-183.
4. Bramley P.M., Elmadfa I., Kafatos A. i wsp.: Vitamin E – review. J. Sci.
Food Agric., 2000, 80, 913-938.
5. Christen W.G., Gaziano J.M., Hennekens C.H.: Design of Physicians’
Health Study II – a randomized trial of beta-carotene, vitamins E and C,
and multivitamins, in prevention of cancer, cardiovascular disease, and
eye disease, and review of results of completed trials. Ann. Epidemiol.,
2000, 10, 125-134.
6. Evans P., Halliwell B.: Micronutrients – oxidant/antioxidant status. Br. J.
Nutr., 2001, 85, supl. 2, S67-S74.
7. Fairfield K.M., Fletcher R.H.: Vitamins for chronic disease prevention in
adults. Scientific review. JAMA 2002, 287, 3116-3126.
8. Gawęcki J.: Podstawowe składniki pożywienia. W: Kompendium wiedzy
o żywności, żywieniu i zdrowiu (red. Gawęcki J., Mossor-Pietraszewska
T.). Warszawa, Wydawnictwo Naukowe PWN, 2006, 238-244.
9. Guz J., Dziaman T., Szpila A.: Czy witaminy antyoksydacyjne mają wpływ
na proces karcynogenezy? Postępy Hig. Med. Dośw. (Online) 2007, 61,
185-198.
10. Jopp A.: Ryzyko braku witamin. Warszawa: Interspar., 2006, 123-125.
11. Kędziora-Kornatowska K., Szewczyk-Golec K., Czuczejko J. i wsp.: Ef-
fect of melatonin on the oxidative stress in erythrocytes of healthy young
and elderly subject. J. Pineal. Res., 2007, 42, 153-158.
12. Kołodziejczyk A.: Naturalne związki organiczne. Warszawa: Wydawnic-
two Naukowe PWN, 2004, 525-532.
13. Le Cren F.: Przeciwutleniacze – rewolucja w medycynie XXI wieku. War-
szawa: Bauer-Weltbild Media, 2006, 160-176.

Witaminy E, A i C jako antyoksydanty
381
14. Mayne S.T.: Antioxidant nutrients and chronic disease. J. Nutr., 2003,
133, 933S-940S.
15. McDermott J.H.: Antioxidant nutrients – current dietary recommendations
and research update. J. Am. Pharm. Assoc. (Wash), 2000, 40, 785-799.
16. Naturalne antyoksydanty w farmacji i medycynie. Materiały sympozjum
Wydziału Farmaceutycznego Akademii Medycznej, 2001.27-28.04 War-
szawa. Farm. Pol., 2001, 57, 699-759.
17. Pędzik A., Paradowski M., Rysz J.: Stres oksydacyjny a zjawiska patolo-
giczne w ustroju. Diagn. Lab., 2008, 44, 363-369.
18. Podsędek A., Sosnowska D., Nogala-Kałucka M.: Witamina C. Karoteno-
idy. Tokochromanole. (w) Przeciwutleniacze w żywności – aspekty zdro-
wotne, technologiczne, molekularne i analityczne (red. Grajek W.). War-
szawa, WNT, 2007, 163-187.
19. Racek J., Holecek V., Trefil L.: Antioxidative properties of ascorbic acid.
Cas. Lek. Cesk., 2000, 139, 583-587.
20. Rutkowski M., Grzegorczyk K., Chojnacki J. i wsp.: Właściwości antyok-
sydacyjne witaminy E podstawą jej nowych zastosowań w terapii. Pol.
Merk. Lek., 2006, 20, 609-614.
21. Rutkowski M., Grzegorczyk K.: Co należy dziś wiedzieć o
b-karotenie i
innych karotenoidach? Farm. Pol., 2002, 58, 97-105.
22. Rutkowski M., Grzegorczyk K.: Witaminy o działaniu antyoksydacyjnym –
ogólna charakterystyka. Część I : Witamina A. Farm. Pol., 1998, 54, 739-43.
23. Rutkowski M., Grzegorczyk K.: Witaminy o działaniu antyoksydacyjnym
– ogólna charakterystyka. Część III : Witamina C. Farm. Pol., 1999, 55,
74 -79.
24. Scott-Moncrieff Ch.: ABC witamin. Warszawa: Bertelsmann Media, 2005,
36-50.
25. Szymańska J.: Zatrucia lekami. W: Toksykologia współczesna (red. Seń-
czuk W.). Warszawa, Wydawnictwo Lekarskie PZWL, 2006, 298-301.
26. Wartanowicz M., Ziemlański Ś.: Stres oksydacyjny oraz mechanizmy
obronne. Żyw. Człow. Metabol., 1999, 26, 67-86.
27. Weise Prinzo Z., de Benoist B.: Meeting the challenges of micronutrient
deficiencies in emergency-affected populations. Proc. Nutr. Soc., 2002,
61, 251-257.
28. Zając M., Pawełczyk E., Jelińska A.: Chemia leków. Poznań: Wydawnic-
two Naukowe Akademii Medycznej w Poznaniu, 2006, 540-563.
29. Ziemlański Ś.: Normy żywienia człowieka. Fizjologiczne podstawy, Wyd.
Lek. PZWL, Warszawa, 2001, 140-211.
Otrzymano 15 czerwca 2010 r.
Adres: Tomasz Matuszewski, 03-287 Warszawa, ul. Skarbka z Gór 17b/ 10,
Wojskowy Instytut Medyczny w Warszawie, CSK MON, Klinika Chorób Infek-
cyjnych i Alergologii, ul. Szaserów 128, tel. 501 510 772, (22) 810 29 09, fax
(22) 681 75 19
Konferencja Naukowo-Szkoleniowa
„Racjonalna antybiotykoterapia”
pod patronatem
Komisji Chorób Układu Oddechowego
Komitetu Patofizjologii Klinicznej
Polskiej Akademii Nauk
Ryn, 19-21 maja 2011 r.
Tematy wiodące:
• Problemy współczesnej antybiotykoterapii
• Antybiotykoterapia w zakażeniach układu oddechowego
• Antybiotykoterapia w stanach zagrożenia życia
• Antybiotykoterapia w pediatrii i innych specjalnościach
• Antybiotykoterapia w epidemiach XXI wieku
• Kierunki badań nad antybiotykami
Zgłoszenia: Medpress, 00-112 Warszawa, ul. Bagno 7 m.69
www.medpress.com.pl, tel./fax 22 624 25 20, 22 711 40 21
e-mail: medpress@medpress.com.pl
prof. dr hab. med. Tadeusz Płusa
e-mail: tplusa@wim.mil.pl
tel. 48 22 612-24-10, faks 48 22 6-816-588
Wyszukiwarka
Podobne podstrony:
07 3id 6701 ppt
EŚT 07 Użytkowanie środków transportu
07 Windows
07 MOTYWACJAid 6731 ppt
Planowanie strategiczne i operac Konferencja AWF 18 X 07
Wyklad 2 TM 07 03 09
ankieta 07 08
11 3id 12114 ppt
Szkol Okres Pracodawcy 07 Koszty wypadków
Wyk 07 Osprz t Koparki
009 Dystrybucja 3id 2475 ppt
więcej podobnych podstron