
Chemia i technologia polimerów
Wykład 11
Kopolimeryzacja
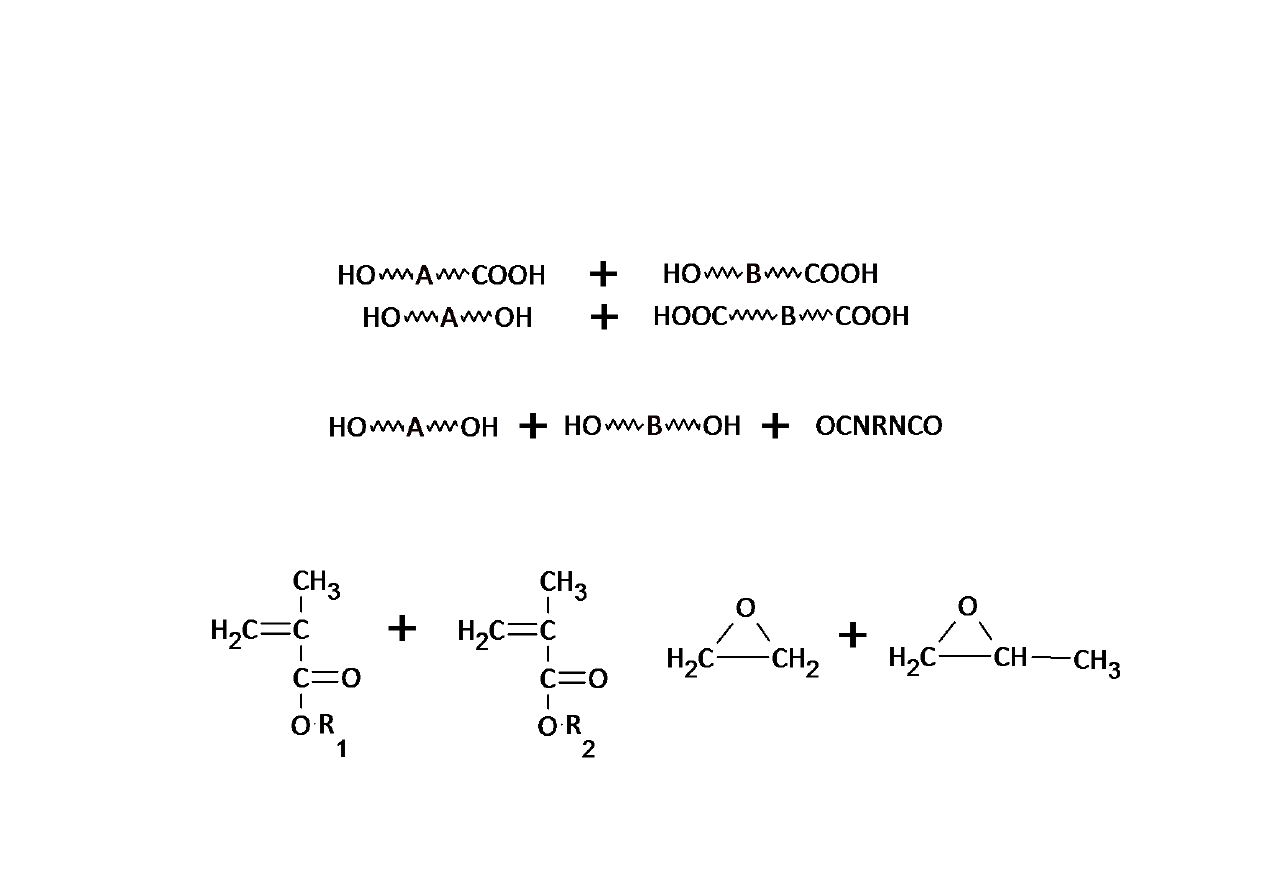
Kopolimeryzacja w różnych procesach
•
Polikondensacja:
•
Poliaddycja:
•
Polimeryzacja addycyjna (łańcuchowa):
Niektóre monomery wykorzystywane są głównie do produkcji kopolimerów

Polimeryzacja rodnikowa i
kopolimeryzacja
Definicje IUPAC:
25. Kopolimeryzacja
Polimeryzacja, w której powstaje kopolimer. Kopolimer jest polimerem
utworzonym z więcej niż jednego rodzaju monomeru.
80. Kopolimeryzacja bezładna (przypadkowa)
Kopolimeryzacja, w której powstaje bezładny kopolimer. Bezładny kopolimer
jest kopolimerem zbudowanym z makrocząsteczek, w których
prawdopodobieństwo znalezienia danej jednostki powtarzalnej (meru) nie
zależy od budowy sąsiednich jednostek (merów).
88. Kopolimeryzacja statystyczna
Kopolimeryzacja, w której powstaje kopolimer statystyczny. Kopolimer
statystyczny jest kopolimerem zbudowanym z makrocząsteczek, w których
rozkład sekwencji jednostek powtarzalnych (merów) podlega znanym
prawom statystyki.
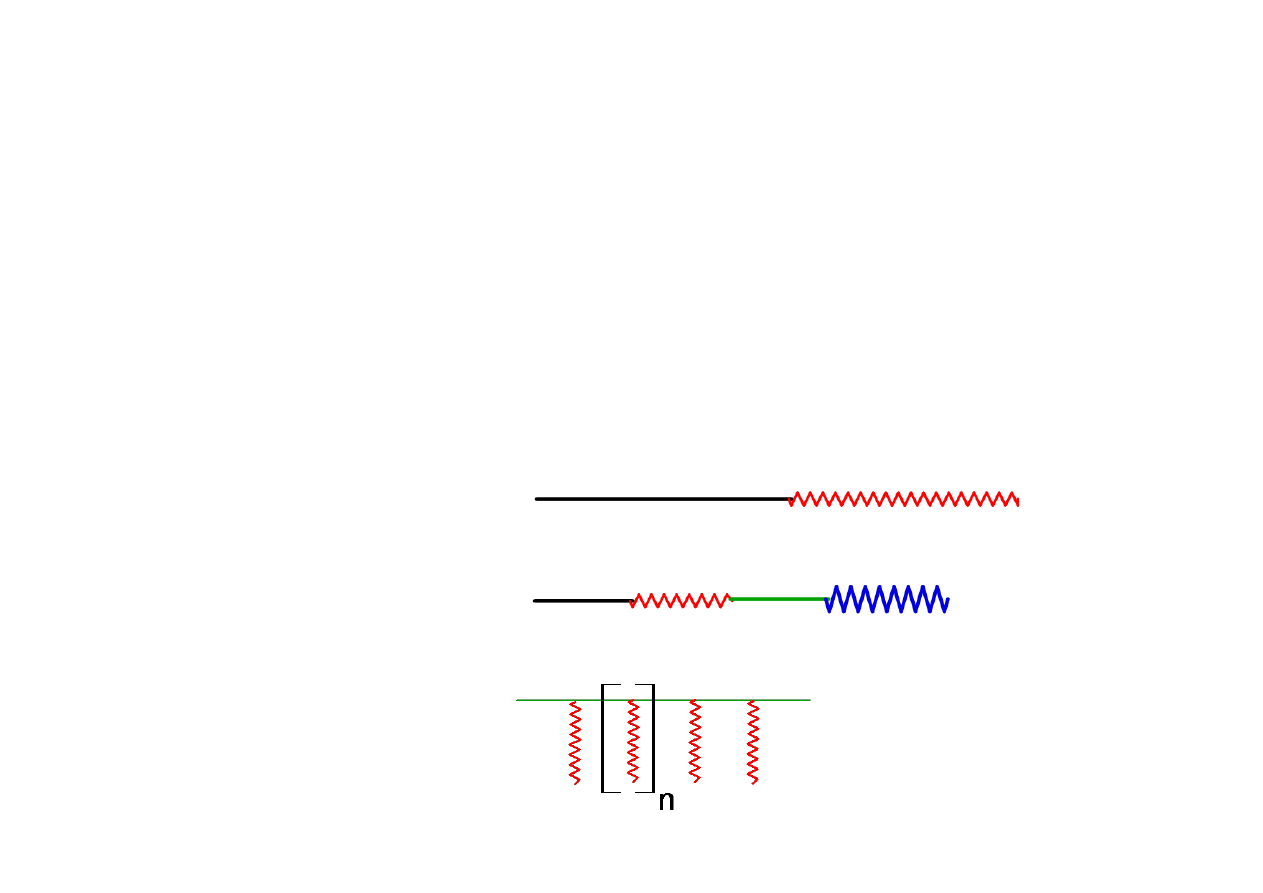
Kopolimeryzacja
Definicje cd.
Kopolimeryzacja przemienna (‐alt‐).
Kopolimeryzacja, w której powstaje kopolimer przemienny. Kopolimer
przemienny jest kopolimerem zbudowanym z makrocząsteczek,
zawierających dwie różne jednostki powtarzalne występujące
przemiennie: …‐m
1
‐
m
2
‐m
1
‐
m
2
‐…
Kopolimer
blokowy (‐b‐)
.
Kopolimer
multiblokowy (‐b‐..‐b‐) (periodyczny)
Kopolimer
szczepiony (‐g‐)
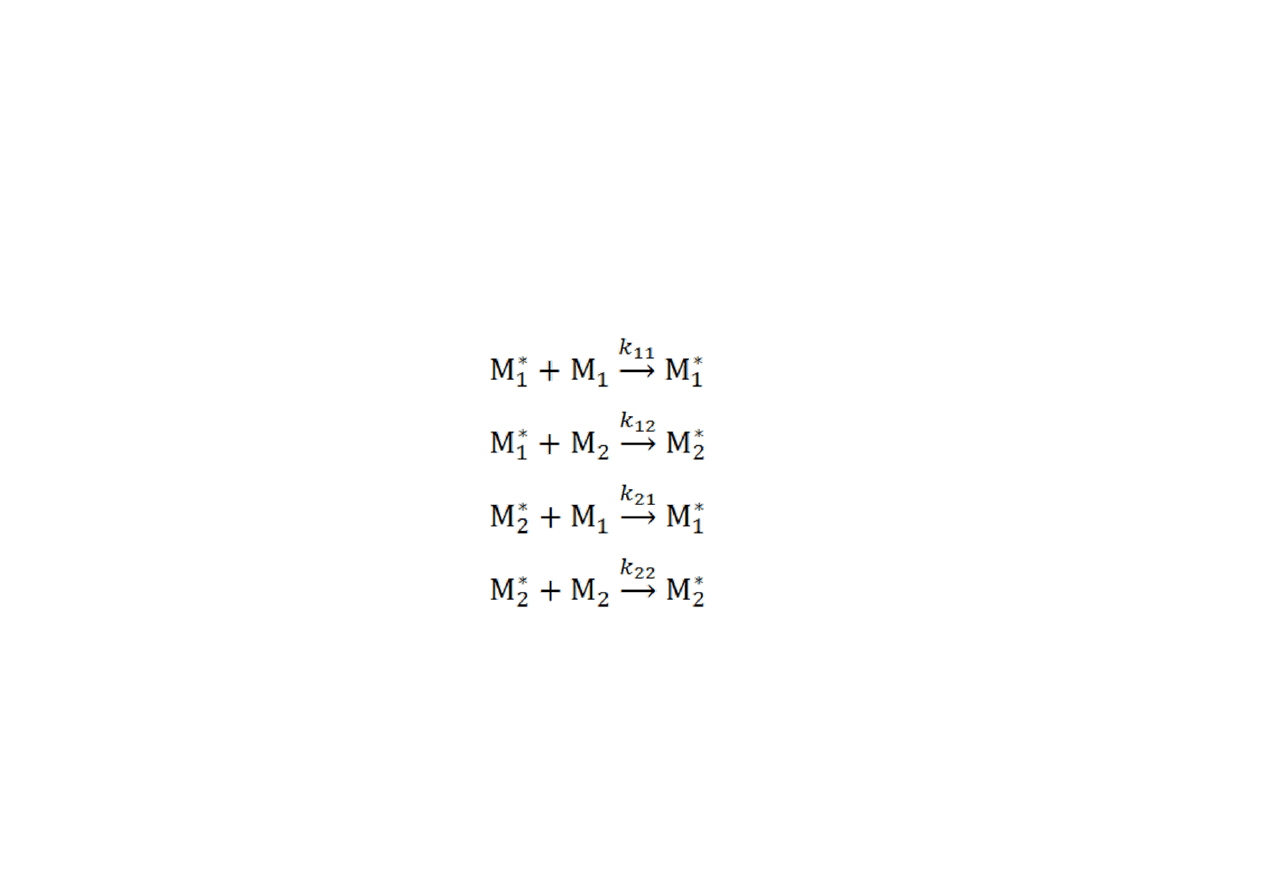
Równanie kopolimeryzacji.
Model meru końcowego
•
Niezależnie od typu polimeryzacji łańcuchowej, komplet możliwych
reakcji wzrostu można zapisać następująco:
•
Symbol z gwiazdką odpowiada merowi, na którym znajduje się
centrum aktywne polimeryzacji, a k
ij
(i,j = 1,2) jest odpowiednią
stałą propagacji.
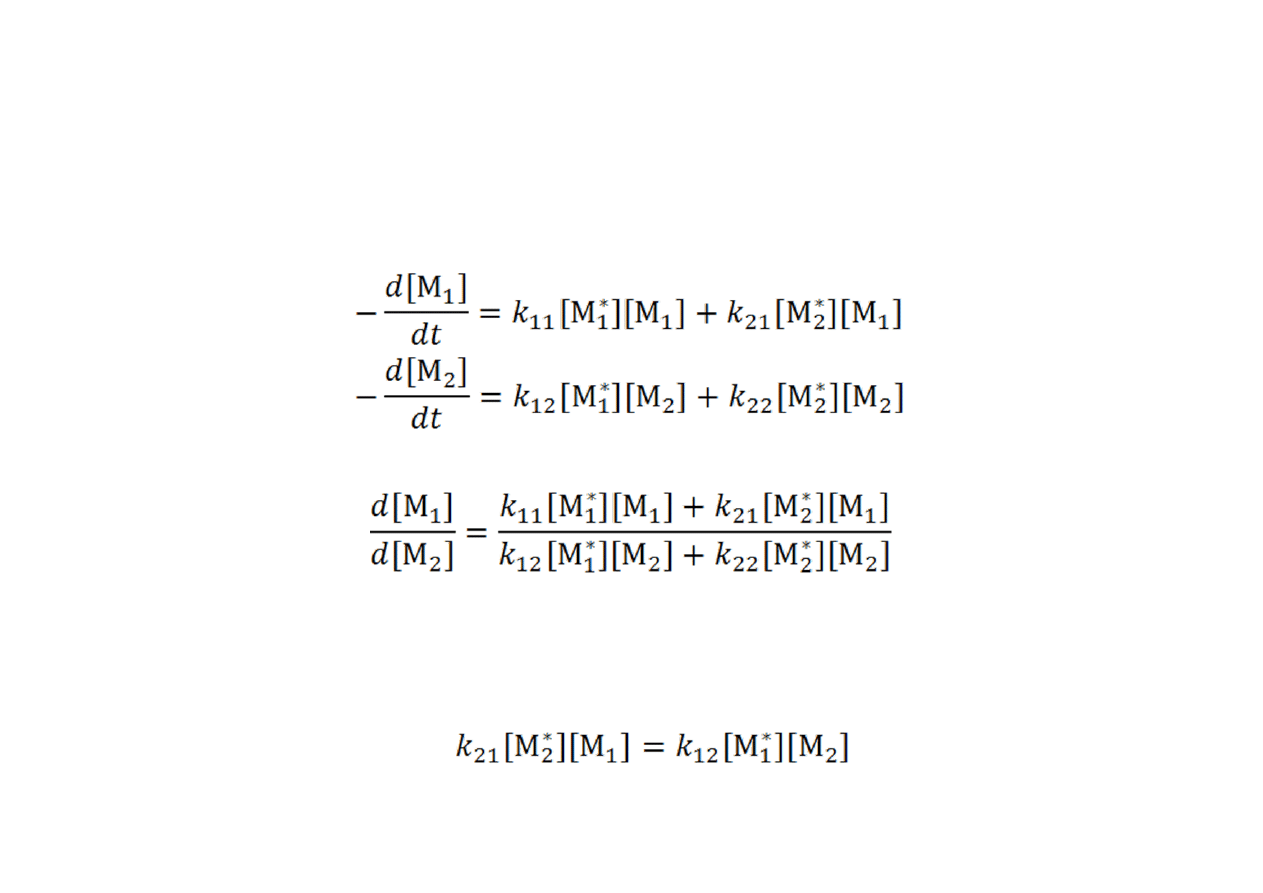
Równanie kopolimeryzacji
•
Szybkość zaniku merów (ich wbudowywania do polimeru) jest sumą
odpowiednich reakcji propagacji:
•
Podzielenie tych równań przez siebie daje
równanie kopolimeryzacji
w formie:
•
By wyeliminować stężenia centrów aktywnych zwykle przyjmujemy,
że, obok stanu stacjonarnego stężenia centrów aktywnych, mamy
do czynienia ze
stanem stacjonarnym
typów merów wieńczących
rosnące centra aktywne, tj.:
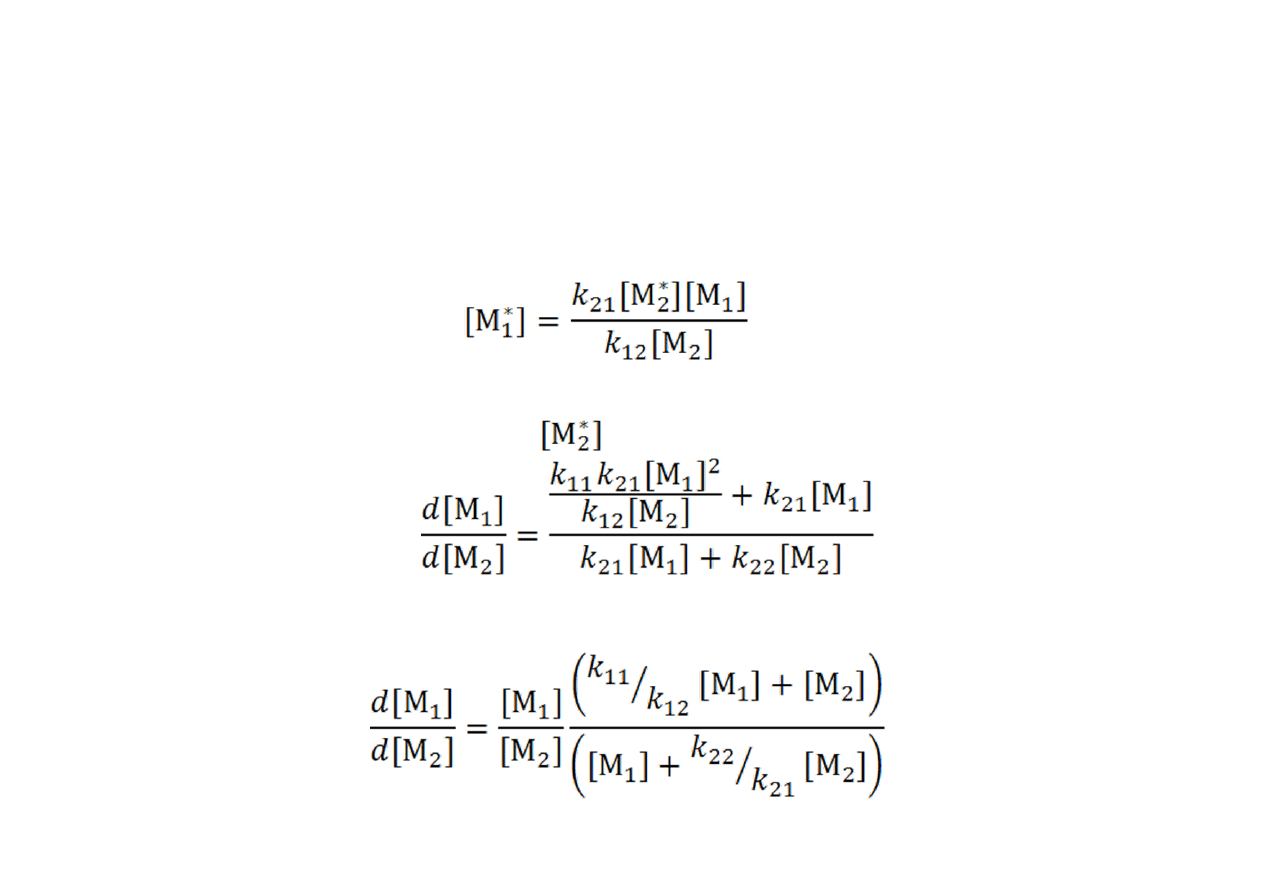
Równanie kopolimeryzacji
•
Wyrażenie stężenia jednego typu centrów przez to drugie, np.:
•
daje, po podstawieniu do równania kopolimeryzacji i skróceniu
(wyeliminowaniu członu) :
•
a po dalszym przekształceniu:

Równanie kopolimeryzacji
•
Łatwo zauważyć, że występujące w równaniu kopolimeryzacji
stosunki stałych szybkości propagacji odpowiadają względnym
szybkościom reagowania danego typu centrum aktywnego ze
swoim macierzystym monomerem i z komonomerem. Noszą one
nazwę
współczynników reaktywności komonomerów
i oznaczone
symbolami:
•
Po ich wprowadzeniu równanie kopolimeryzacji przyjmuje swoją
najbardziej znaną formę:
•
względnie
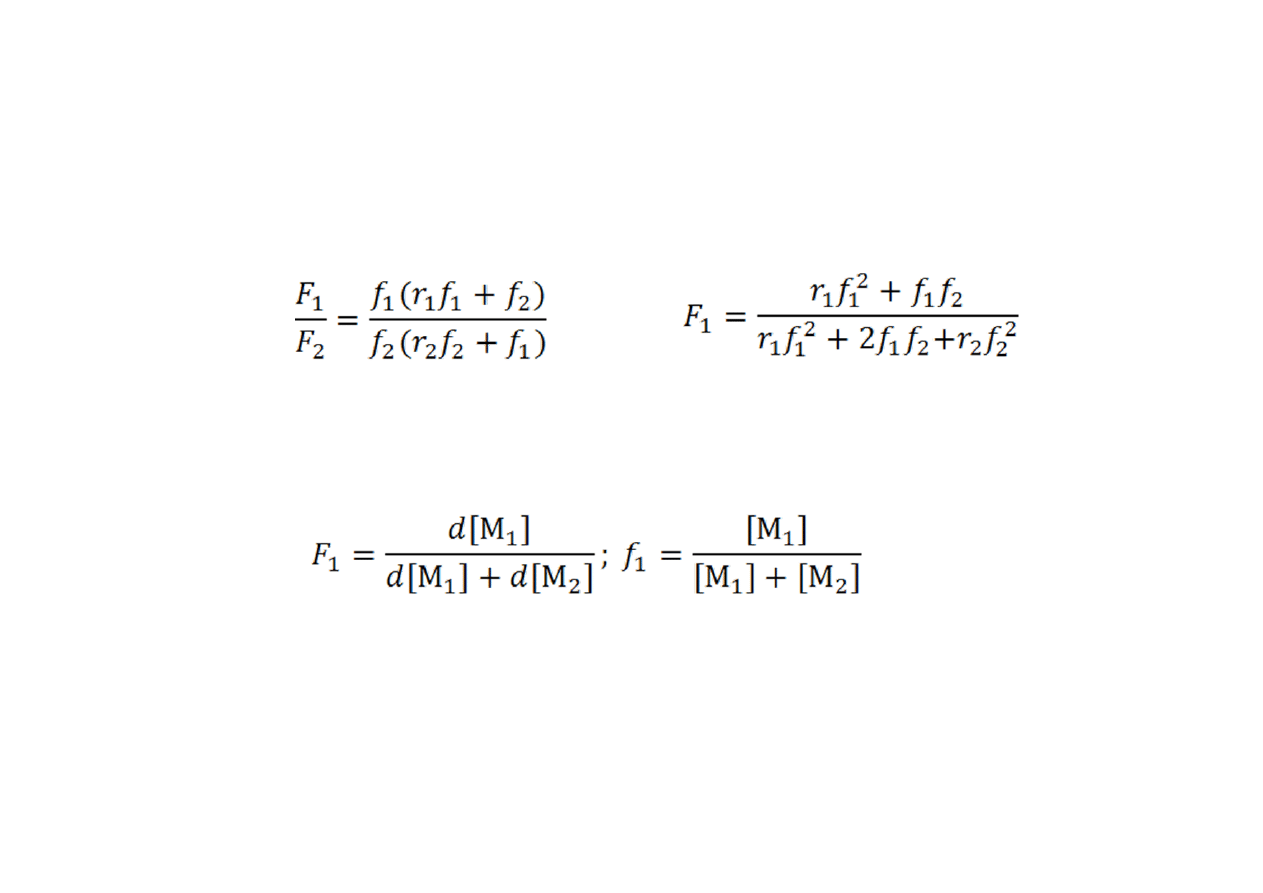
Równanie kopolimeryzacji
•
Alternatywnie, równanie kopolimeryzacji bywa przedstawiane w
postaci:
•
w której występują (chwilowe) ułamki molowe merów
wbudowanych do makrocząsteczek, F
1
= 1 – F
2
, i ułamki molowe
monomerów w mieszaninie reakcyjnej, f
1
= 1 – f
2
. Wyrażają się one
stosunkami, odpowiednio:
•
Należy pamiętać, że wyrażenia dotyczą różniczkowych zmian
stężenia monomerów, wbudowujących się do polimeru. Jeżeli
znamy wyjściowy skład monomerów, możemy przyjąć, że równanie
kopolimeryzacji jest spełnione do ok. 5% przereagowania
monomerów.
lub

Kopolimeryzacja
•
Niezależnie od typu centrum aktywnego polimeryzacji (rodniki,
kationy, aniony) współczynniki reaktywności komonomerów, a także
równanie kopolimeryzacji są niezależne od wielu parametrów
reakcji.
•
Skład kopolimeru nie zależy od szybkości inicjowania, ani terminacji,
obecności inhibitorów lub środków przenoszących łańcuch
kinetyczny.
•
W większości przypadków skład kopolimeru nie zależy od stopnia
polimeryzacji łańcuchów polimeru, jeżeli są one odpowiednio
długie.
•
Sposób inicjowania w polimeryzacji rodnikowej nie ma wpływu na
skład kopolimeru. Taki sam skład ma kopolimer otrzymany przy
użyciu inicjatorów ulegających homolizie termicznej, inicjatorów
redoks, względnie w rekacji foto‐ lub radiolizy.
•
Niekiedy rozpuszczalnik może wpływać na skład kopolimeru w
kopolimeryzacji rodnikowej.
•
W polimeryzacji jonowej wpływ rozpuszczalnika, także rodzaju
przeciwojonu może być istotny.
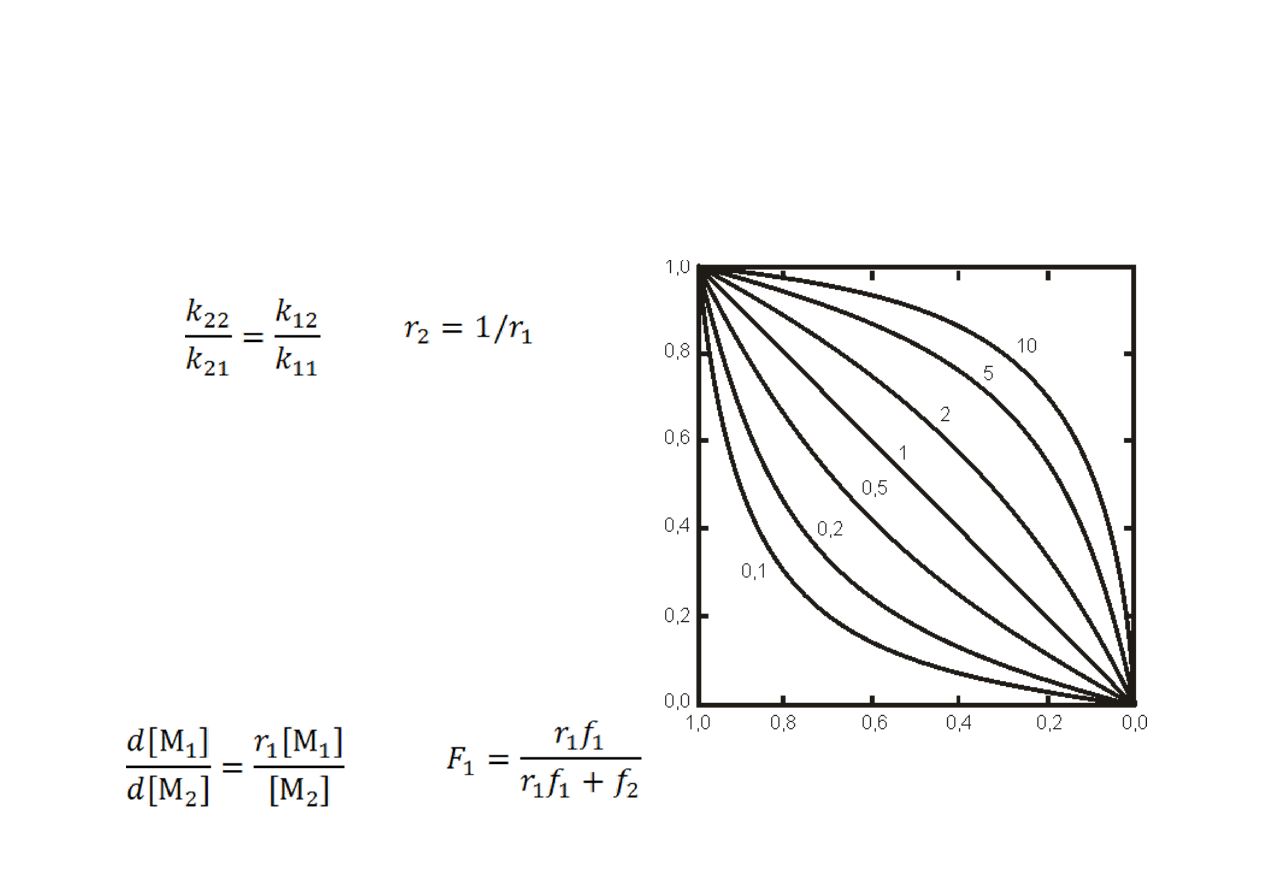
Kopolimeryzacja „idealna”
Jeżeli reagujące mery mają takie
same preferencje wobec jednego
lub drugiego monomeru, tj.:
mówimy, że mamy do czynienia z
kopolimeryzacją idealną
, w której
r
1
⋅r
2
= 1.
Na rysunku pokazane są składy
kopolimeru w zależności od udziału
molowego monomeru M
1
dla
różnych wartości r
1
w
kopolimeryzacji idealnej.
Równanie kopolimeryzacji
przyjmuje wtedy formę:
Udział molowy monomeru M
1
w mieszaninie polimeryzacyjnej, f
1
Udzia
ł molo
wy
mer
ó
w
m
1
w
polimerz
e,
F
1
r
1
=
lub
lub
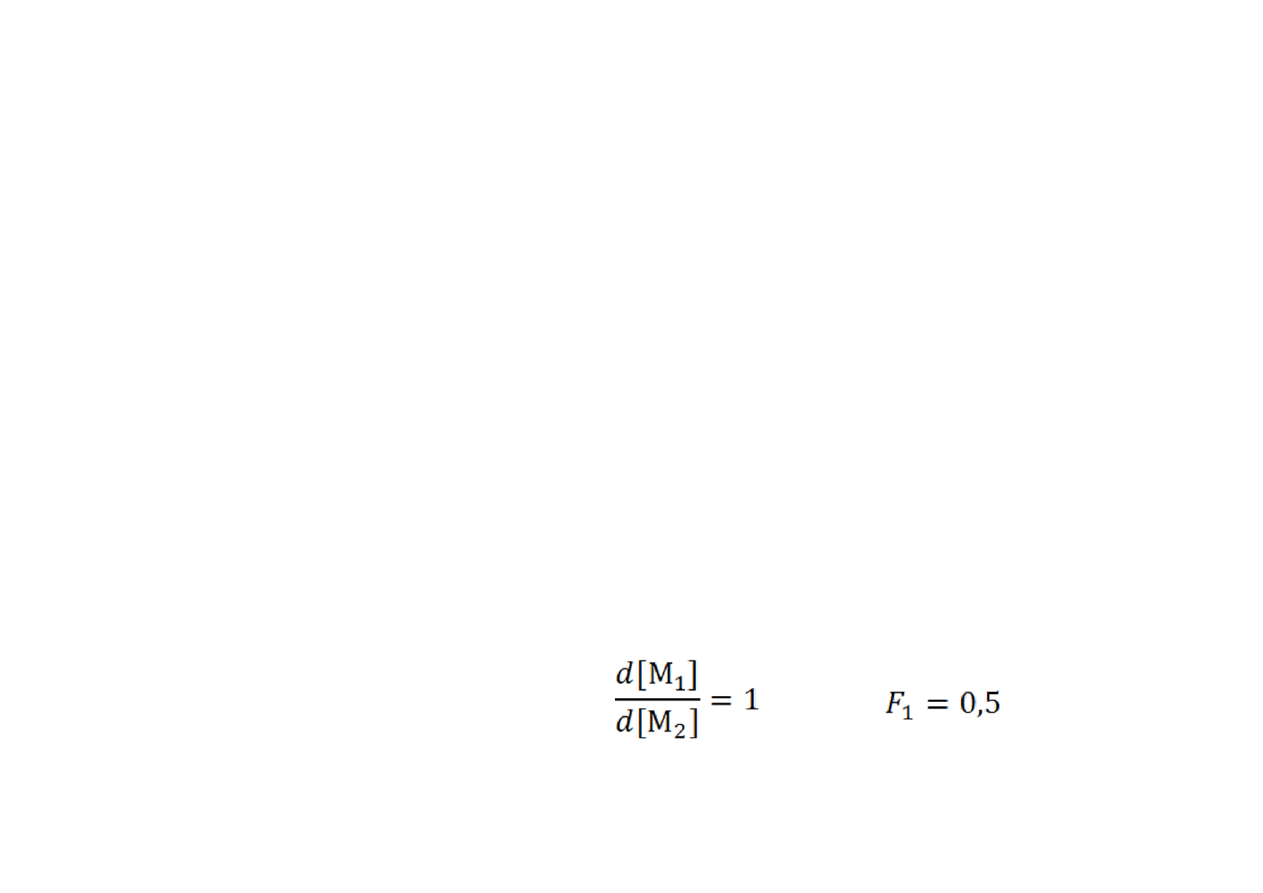
Skład kopolimeru
•
Jeżeli r
1
= r
2
= 1, to jest to kopolimeryzacja idealna, w której skład
kopolimeru jest taki sam, jak skład monomeru. Powstaje kopolimer
przypadkowy.
•
Dla r
1
< 1 i r
2
> 1 lub odwrotnie, powstający kopolimer idealny jest
wzbogacany w mery bardziej reaktywnego monomeru, tj. tego, dla
którego r jest większe od jedności.
•
Ekstremalny
kopolimer
idealny
to taki, dla którego współczynniki
reaktywności znacznie się różnią (np. 10 i 0,1).
•
Umiarkowany
kopolimer
idealny
to taki, dla którego, np. r
1
= 0,5 a r
2
= 2.
•
Kopolimer przemienny
, to kopolimer, dla którego r
1
⋅r
2
= 0, a współczynnik,
który nie jest zerowy, jest mniejszy od 1. Tutaj też wyróżnia się przypadek
ekstremalny i umiarkowany.
•
W kopolimeryzacji przemiennej aktywne centra reagują prawie wyłącznie z
merami komonomeru. W przypadku ekstremalnym równanie
kopolimeryzacji redukuje się do:
•
Większość komonomerów ma właściwości pomiędzy granicznymi
przypadkami kopolimeryzacji
idealnej
i kopolimeryzacji
przemiennej
.
lub
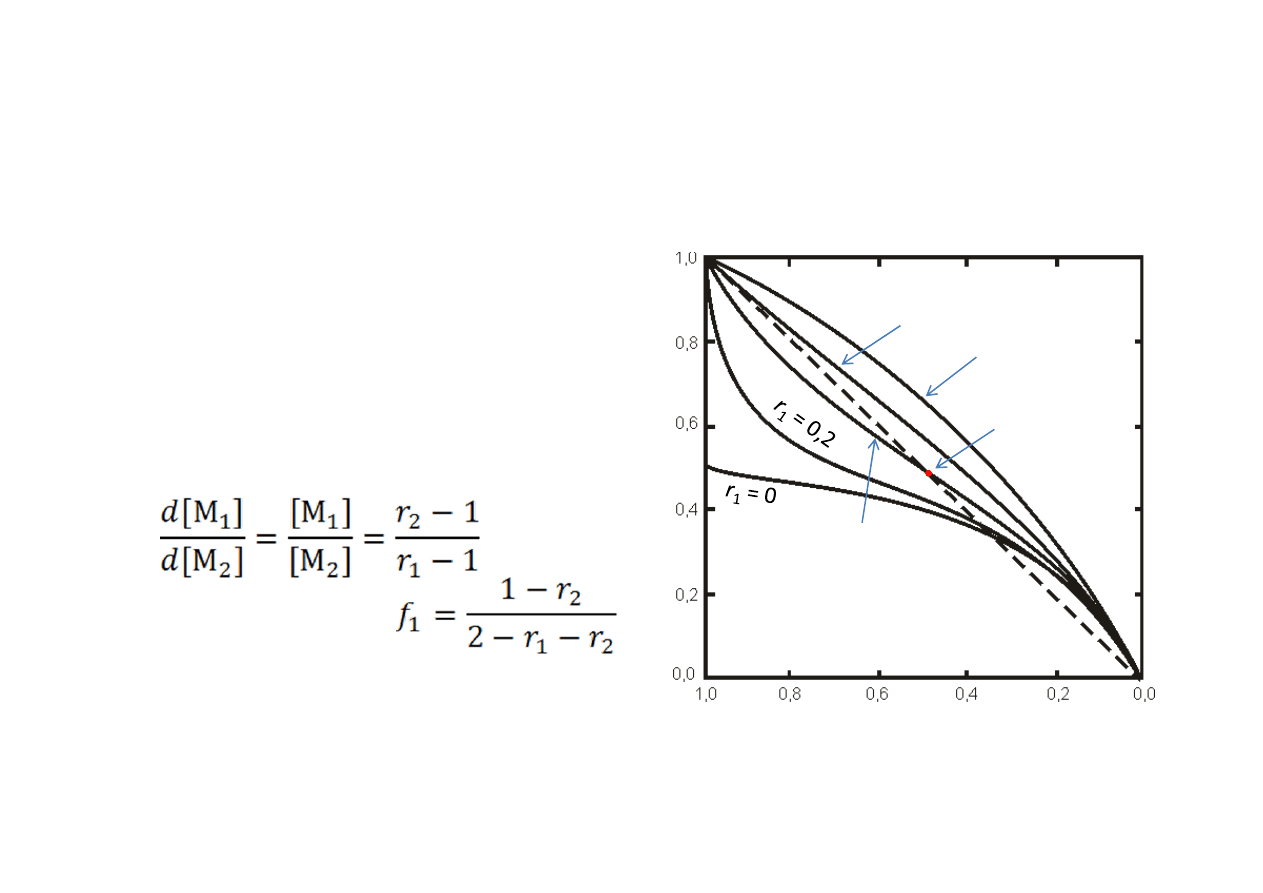
Skład kopolimeru
Ilustruje to wykres zależności
składu kopolimeru od składu
monomerów, w przypadkach, kiedy
r
2
= 0,5, a r
1
zmienia od 0 do 2.
Dla r
1
i r
2
mniejszych od 1 wykres
przecina przekątną, co znaczy, że
jest skład, dla którego F
1
= f
1
. Jest to
skład azeotropowy
. Skład
azeotropowy występuje, kiedy:
Przypadek: r
1
>1 i r
2
> 1 odpowiada
sytuacji, w której występuje
tendencja to tworzenia kopolimeru
blokowego
. W praktyce występuje
rzadko.
r
1
= 1
r
1
= 2
r
1
= 0,5
r
2
= 0,5
Udział molowy monomeru M
1
w mieszaninie polimeryzacyjnej, f
1
Udzia
ł molo
wy
mer
ó
w
m
1
w
polimerz
e,
F
1
azeotrop
lub
Skład kopolimeru
•
Poprzednie relacje, w tym równanie kopolimeryzacji, dotyczyły
chwilowego składu kopolimeru
, w zależności pod chwilowego
składu komonomerów. Obowiązują one dla różniczkowego stopnia
przereagowania monomerów (zmiana stopnia przereagowania
<5%). Dla większego zakresu zmiany stopnia przereagowania relacje
stają się nieco bardziej złożone.
•
Niech układ zawiera M moli komonomerów. Niech powstający
kopolimer będzie bogatszy w monomer M
1
, niż wynika to ze składu
mieszaniny monomerów (tj. F
1
> f
1
).
•
Po spolimeryzowaniu dM moli monomerów, polimer zawierać
będzie F
1
dM merów 1, a mieszanina monomerów (M – dM)(f
1
– df
1
)
monomeru 1.
•
Z bilansu masy wynika, że: Mf
1
– (M – dM)(f
1
– df
1
) = F
1
dM. Po
pominięciu członu dMdf
1
równanie przekształca się w formę
całkową:
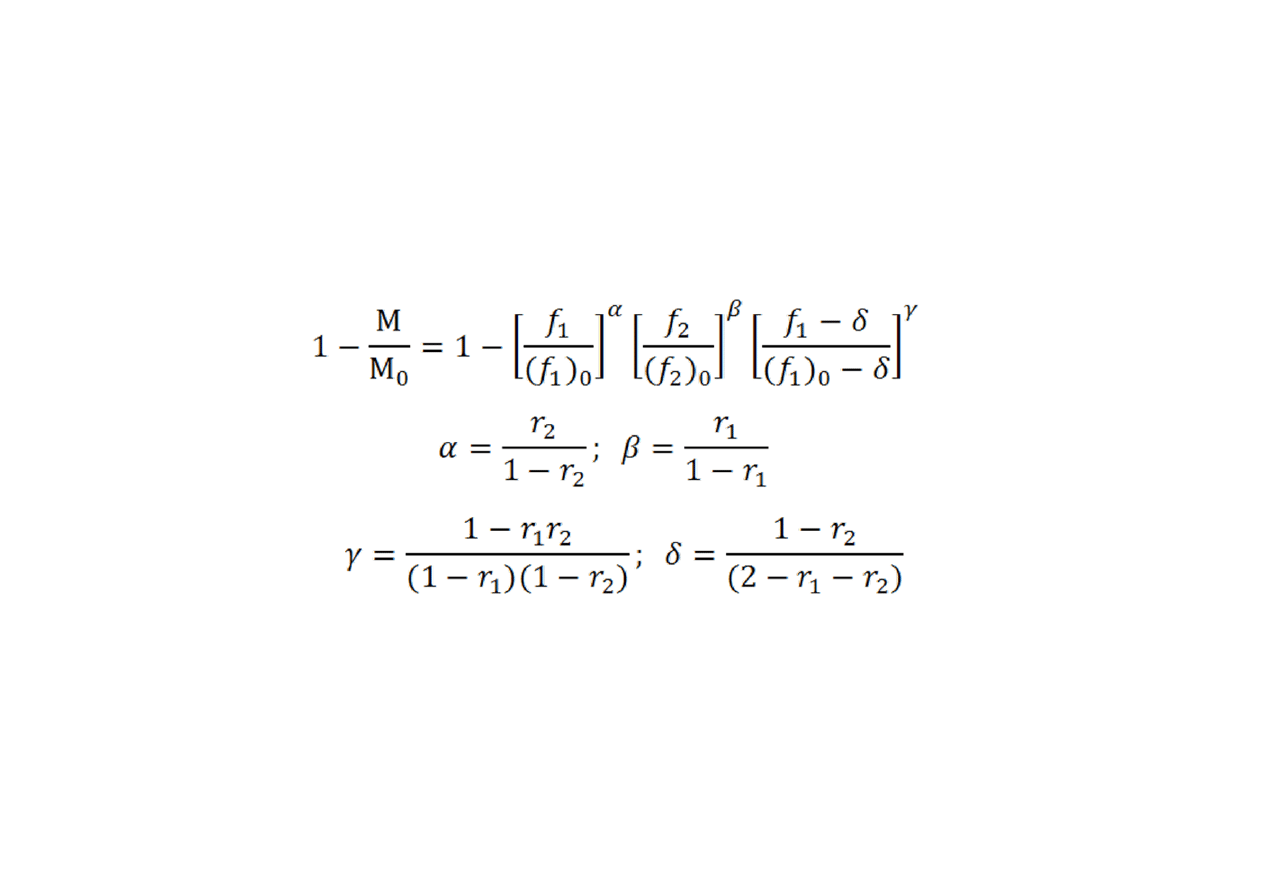
Skład kopolimeru
•
Po zcałkowaniu otrzymamy zestaw relacji analitycznych:
•
Dolny indeks ‘0’ wyróżnia wartości początkowe.
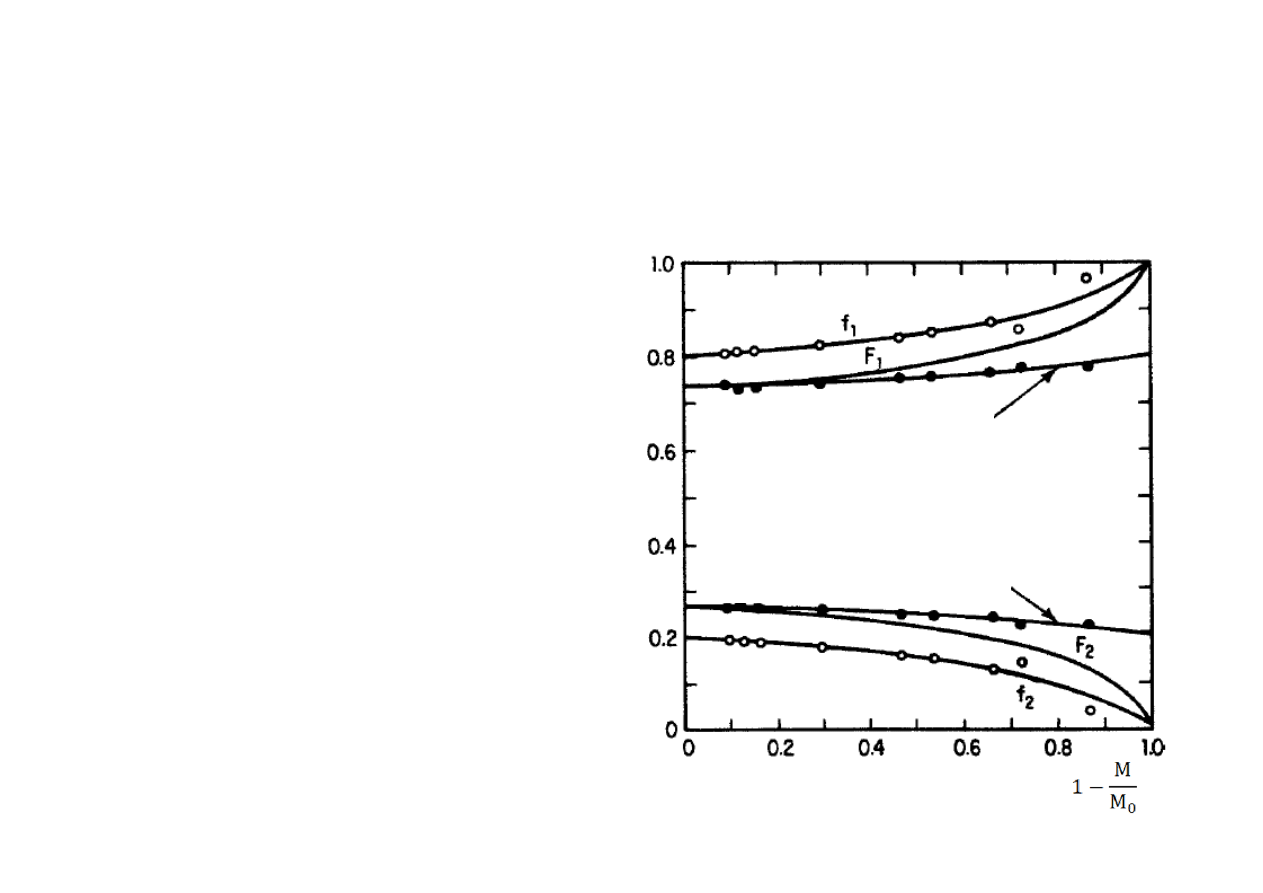
Skład kopolimeru
•
Zmiany składu monomerów
oraz merów w kopolimerze
wraz ze stopniem przereago‐
wania styrenu (M
1
) i
metakrylanu metylu (M
2
):
(f
1
)
0
= 0,80; (f
2
)
0
= 0,20; r
1
=
0,53; r
2
= 0,56.
Średnia zawartość M
1
w kopolimerze
Średnia zawartość M
2
w kopolimerze
U
łamki
molow
e
Stopień przereagowania monomerów
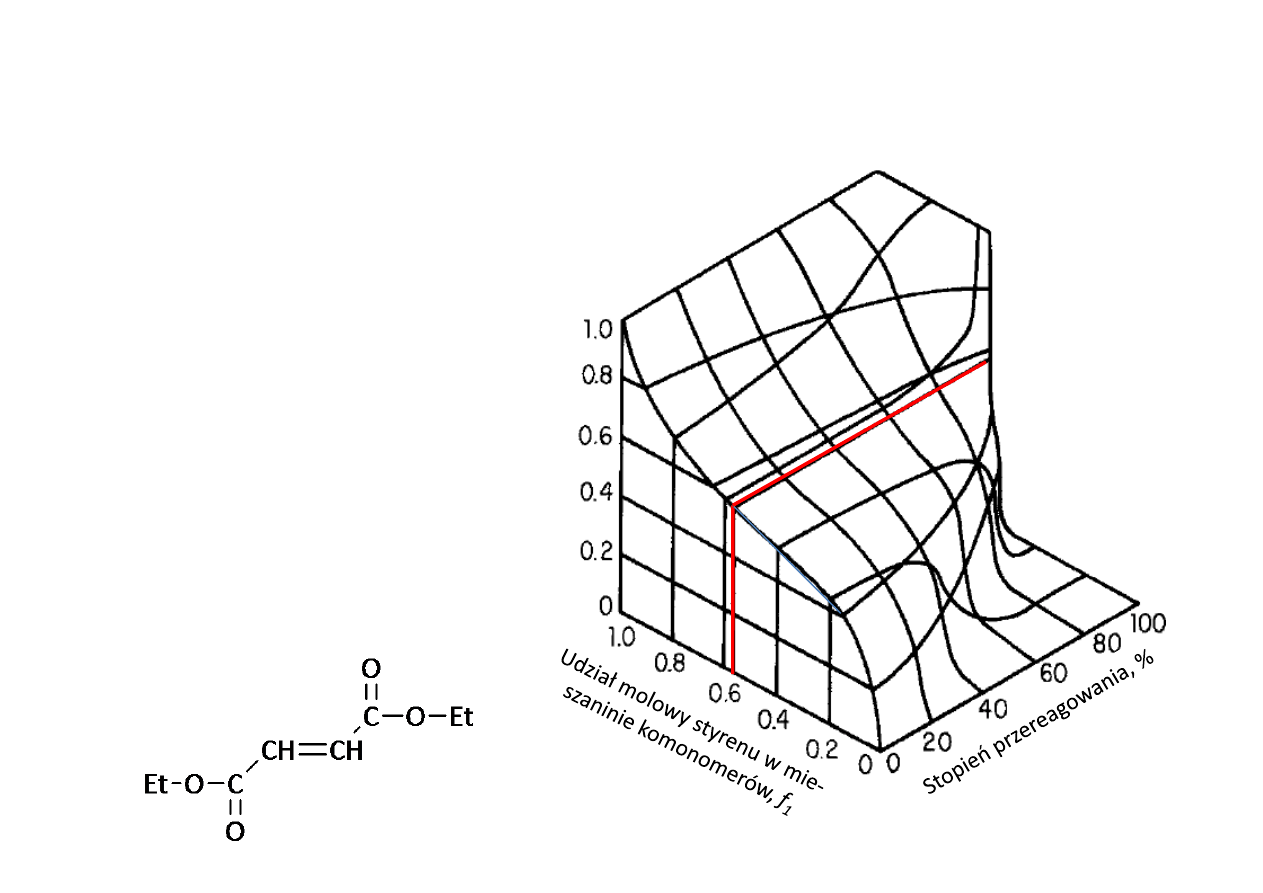
Skład kopolimeru
Zależność chwilowego
składu kopolimeru, F
1
od
początkowej kompozycji
mieszaniny monomerów f
1
i procentowego przere‐
agowania monomerów w
układzie styren (M
1
)–
fumaran dietylu (M
2
):
r
1
= 0,30; r
2
= 0,07.
Udzia
ł molow
y
mer
ó
w
st
yr
en
u
w
k
o
polimerz
e,
F
1
mieszanina
azeotropowa
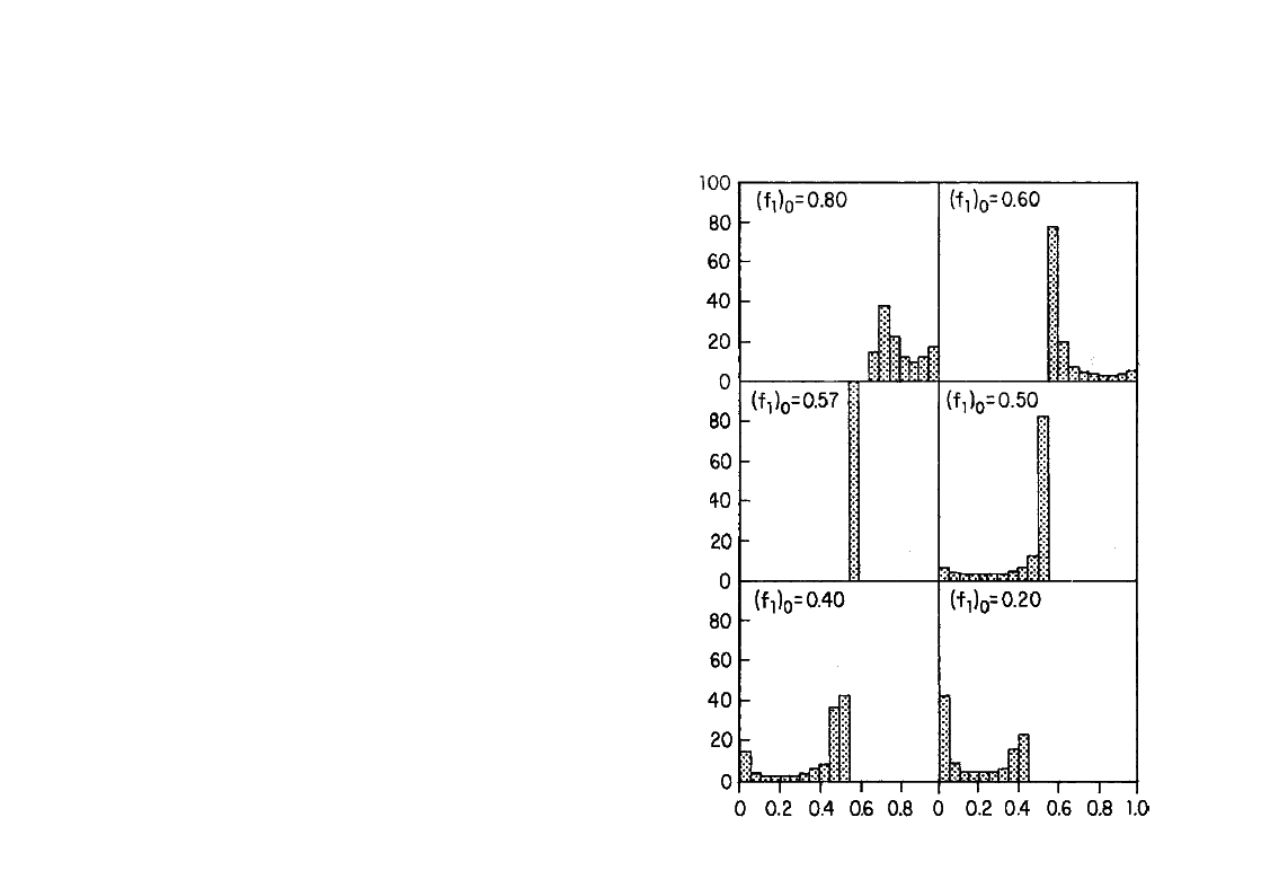
Skład kopolimeru
Rozkład kompozycji kopolimeru po
przereagowaniu całości mieszaniny
komonomerów: styrenu i
fumaranu dietylu przy podanych,
początkowych udziałach molowych
styrenu.
Udział molowy merów styrenu w kopolimerze, F
1
Zaw
arto
ść
pr
ocen
to
w
a

Skład kopolimeru
•
W reakcjach kopolimeryzacji prowadzących do polimerów
użytecznych komercyjnie wskazane jest uzyskanie kopolimerów o
możliwie niezbyt szerokim rozrzucie składów łańcuchów ponieważ
ich właściwości, a zatem także zastosowania silnie zależą od
kompozycji kopolimeru.
•
Stosuje się dwie metody minimalizacji heterogeniczności składu
cząsteczek kopolimeru.
1.
Odpowiedni dobór komonomerów. Wskazany jest taki wybór pary
komonomerów, dla których F
1
niezbyt znacznie różni się od f
1
, o
ile taki kopolimer ma pożądane właściwości.
2.
Zachowanie w przybliżeniu stałego składu komonomerów w
mieszaninie reakcyjnej przez okresowe lub ciągłe wprowadzanie
bardziej reaktywnego monomeru. Zakres ingerencji w skład
komonomerów, by zachować stałe f
1
, zależy od tego o ile skład
kopolimeru różni się od składu mieszaniny monomerów.
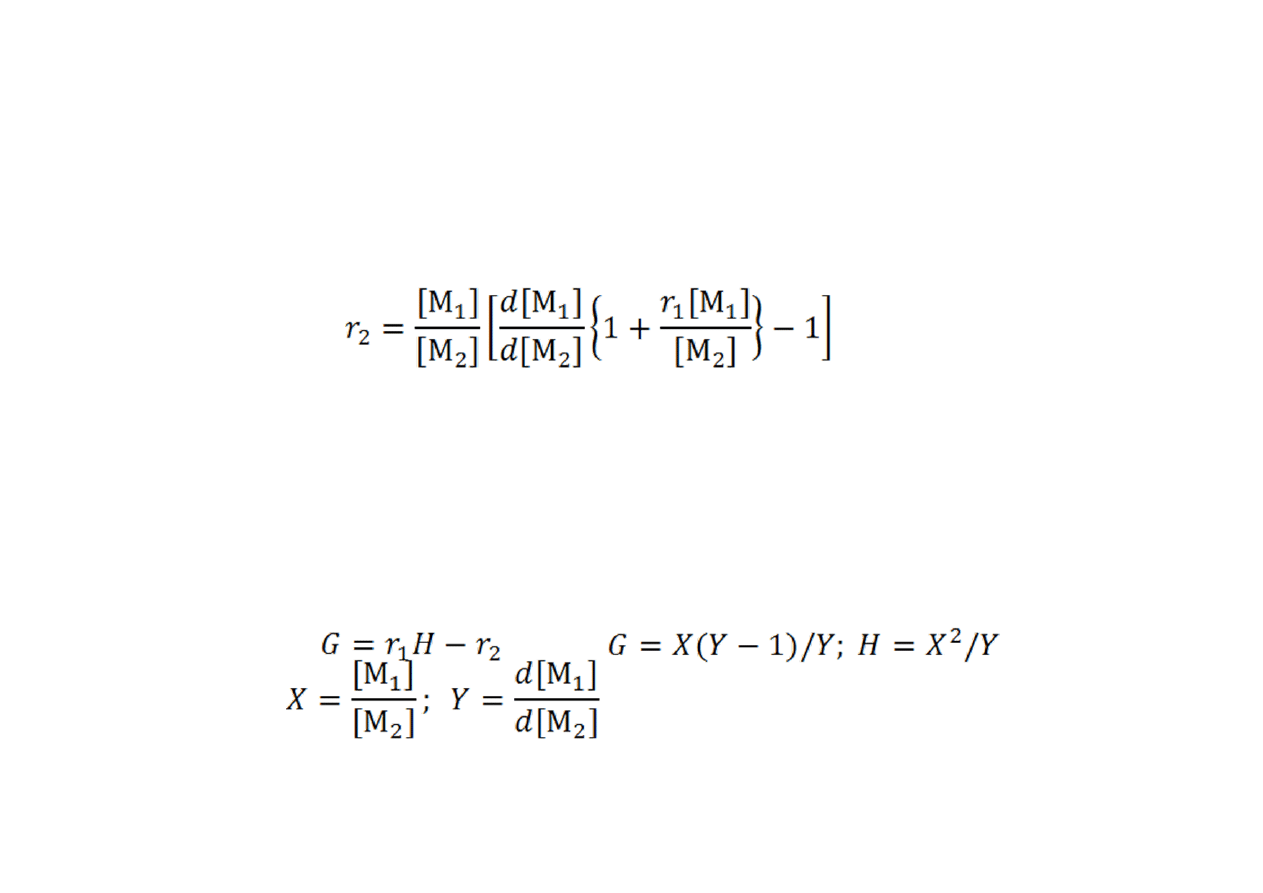
Wyznaczanie współczynników
reaktywności komonomerów
•
Metoda
Mayo‐Lewisa
. Linearyzacja zależności r
2
od r
1
.
•
Dane dla składu kopolimeru i mieszaniny monomerów dla każdego
eksperymentu z danym składem monomerów są podstawiane do
wzoru i wykreślana zależność r
2
of różnych założonych wartości r
1
.
Otrzymuje się dla każdego eksperymentu linię prostą, a przecięcie
wykreślonych linii daje najlepsze r
1
i r
2
.
•
Metoda
Finemana‐Rossa
. Wzór kopolimeryzacji przekształca się do
postaci:
gdzie
•
oraz:
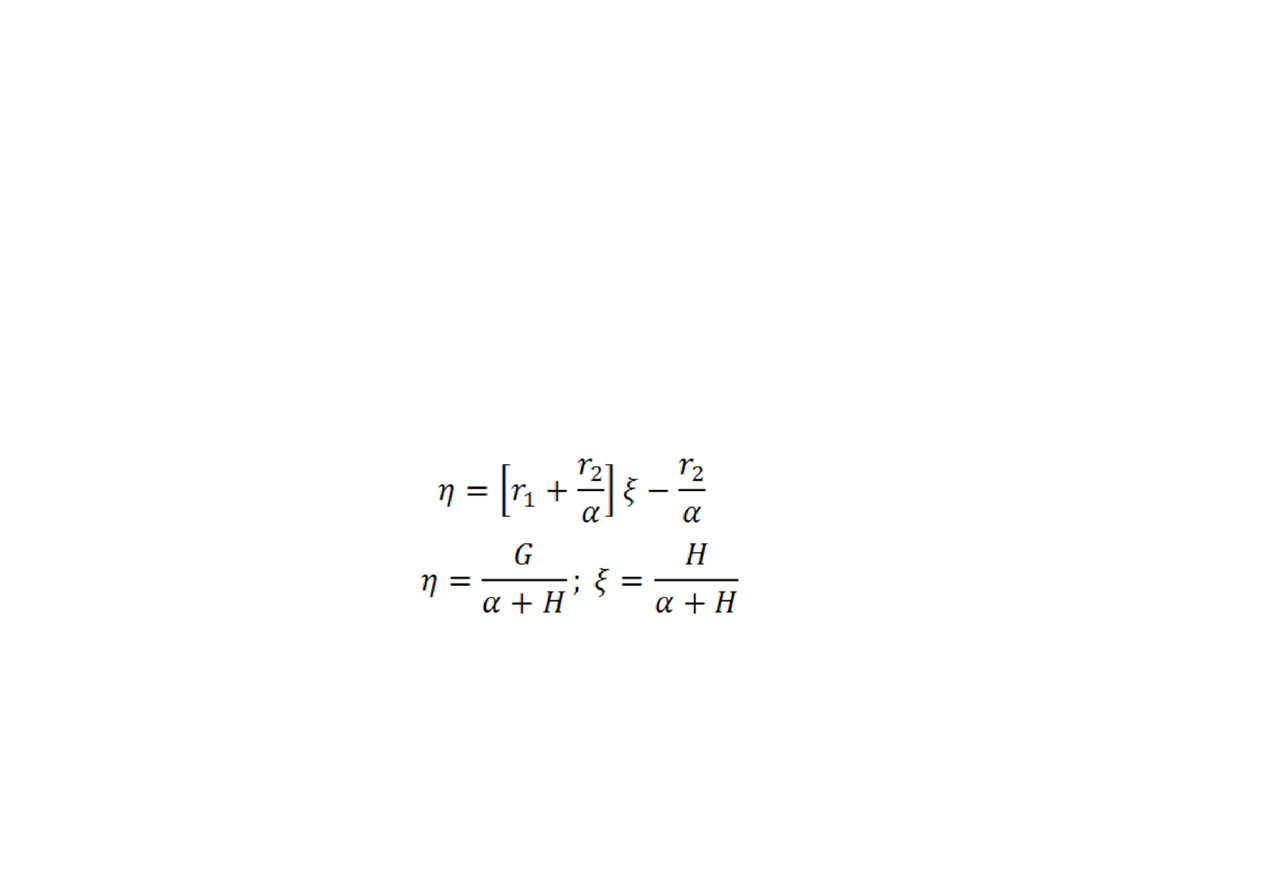
•
Wadą metod linearyzacji jest niejednakowa waga danych
eksperymentalnych dla różnych składów monomerów. Prowadzi to
do różnic w uzyskanych wartościach r
1
i r
2
, zależnie od tego, który
monomer jest wzięty jako M
1
.
•
Metoda
Kelena‐Tüdösa
wprowadza poprawki wyrównujące wagi, z
jakimi dane wpływają na wyznaczone wartości. Liniową funkcję
wiążącą wartości r przekształca się do formy:
•
w której:
•
Wykres η = f(ξ) jest linią prostą, a r
2
/α i r
1
otrzymuje się przez
ekstrapolację, odpowiednio, do ξ = 0 and ξ = 1. Wartość α wybiera
się tak, by α = (H
m
/H
M
)
1/2
gdzie H
m
i H
M
są, odpowiednio,
najmniejszą i największą wartością H. Te przekształcenia skutkują
tym, że dane doświadczalne są rozmieszczone na wykresie
równomiernie.
Wyznaczanie współczynników
reaktywności komonomerów

Wyznaczanie współczynników
reaktywności komonomerów
•
Nawet ta ostatnia metoda (Kelena‐Tüdösa), zakładająca linearyzację
danych ma ograniczenia dokładności. Zmienna niezależna w każdej
zależności liniowej nie jest w pełni niezależna, a zmienna zależna
nie ma stałej wariancji.
•
Obecnie stosowane są metody regresji nieliniowej, które dla
zestawu danych wyliczają (metodami numerycznymi) najlepsze
wartości r
1
i r
2
. Uwzględniana jest także zmiana składu mieszaniny
komonomerów i składu łańcuchów kopolimeru związana ze
zmianami stopnia przereagowania. W obliczeniach stosuje się
zcałkowaną formę
równania kopolimeryzacji, w granicach
rzeczywistych stopni przereagowania monomerów.
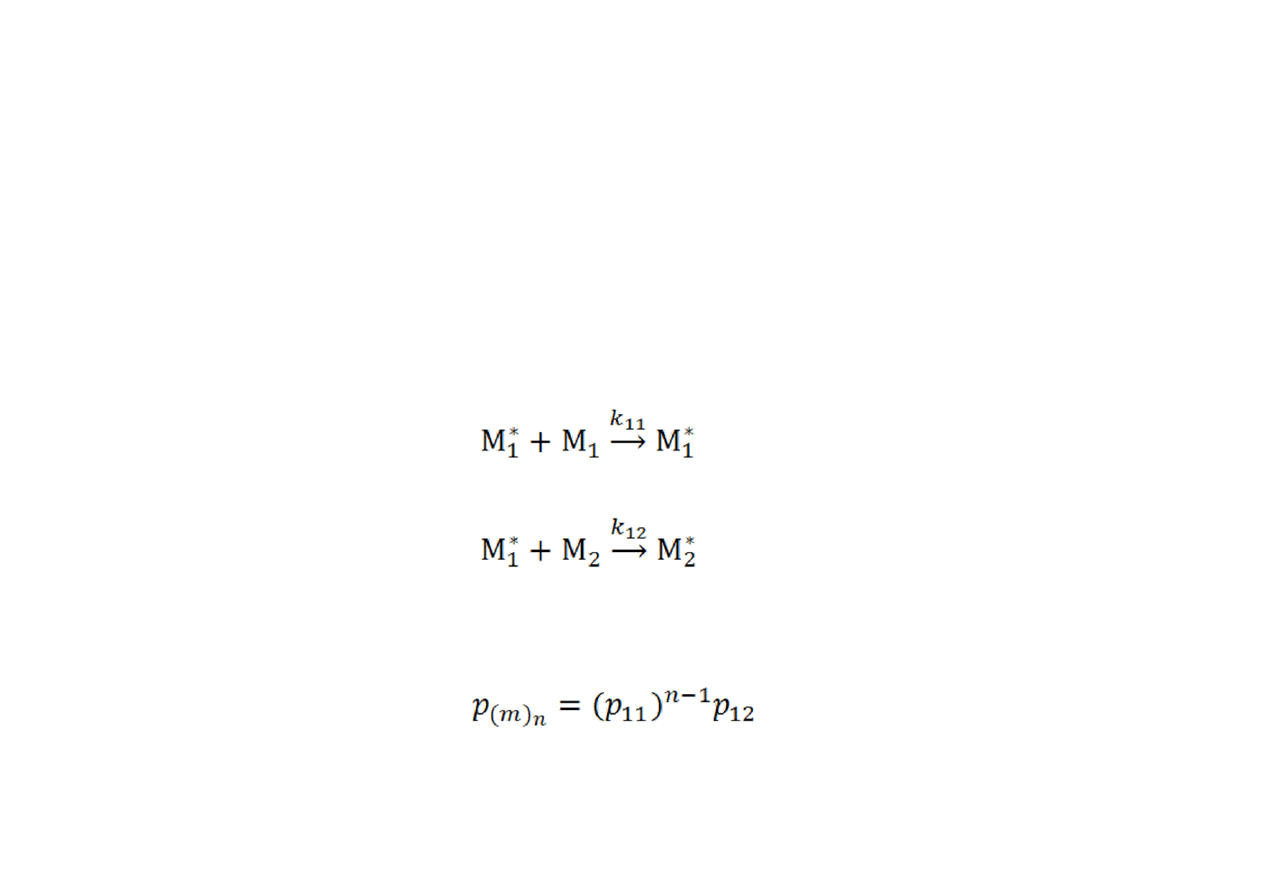
Rozkład długości sekwencji merów
•
Prawdopodobieństwo, że sekwencja merów o pewnej długości w
łańcuchach kopolimeru , np. od długości n merów: ~(m
1
)
n
~ (n = 0,
1, 2,…) ma rozkład Bernoulliego (dwumianowy).
•
Jeżeli prawdopodobieństwo, że przebiegnie reakcja:
•
wynosi p
11
, zaś prawdopodobieństwo, że przebiegnie reakcja
kończąca sekwencję :
•
wynosi p
12
, to prawdopodobieństwo (równe udziałowi molowemu)
wystąpienia sekwencji ~(m
1
)
n
~ wynosi:
1
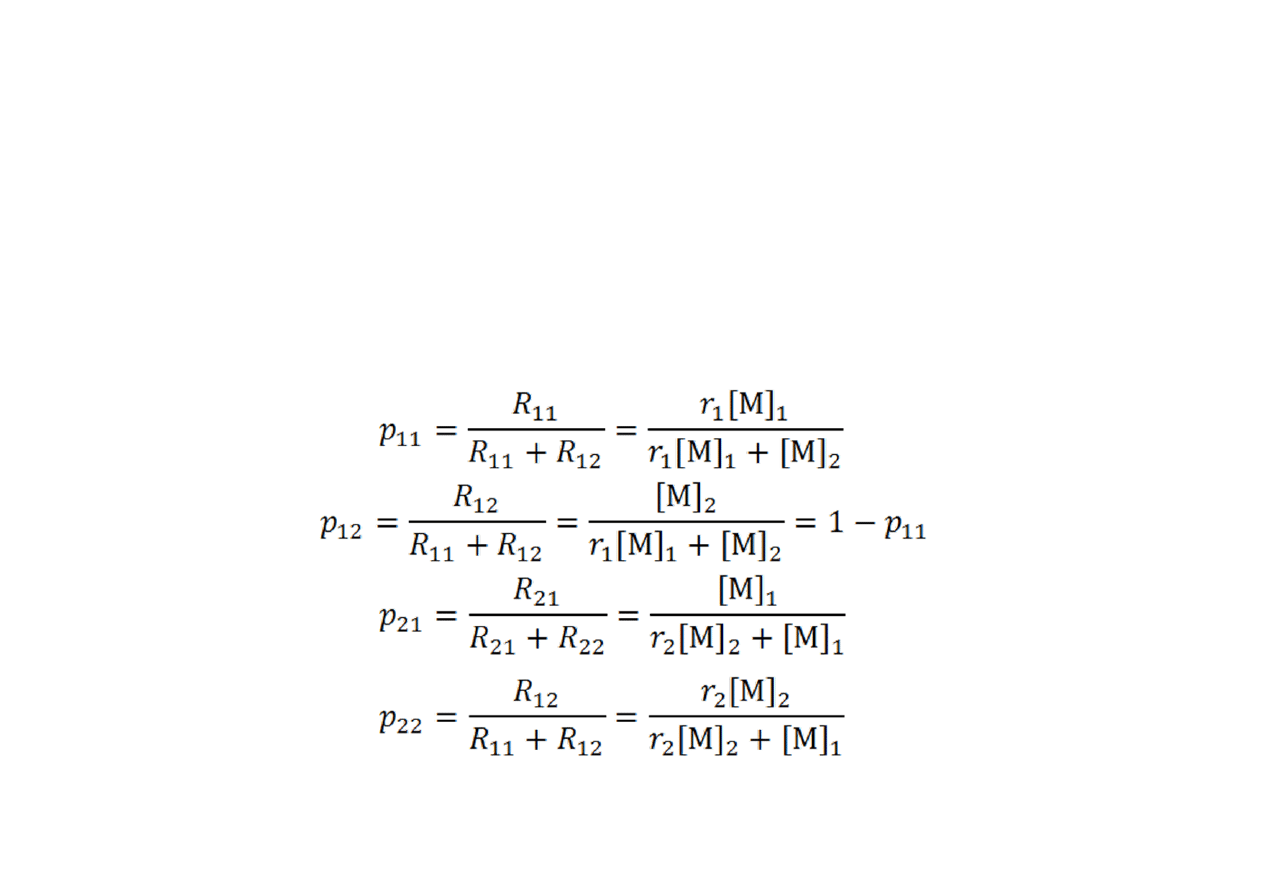
Rozkład długości sekwencji merów
•
Analogiczne relacje obowiązują dla drugiego rodzaju merów.
•
Prawdopodobieństwa są stosunkami szybkości odpowiednich
reakcji wzrostu i dają się wyrazić odpowiednimi stosunkami stężeń
monomerów i współczynników reaktywności komonomerów:
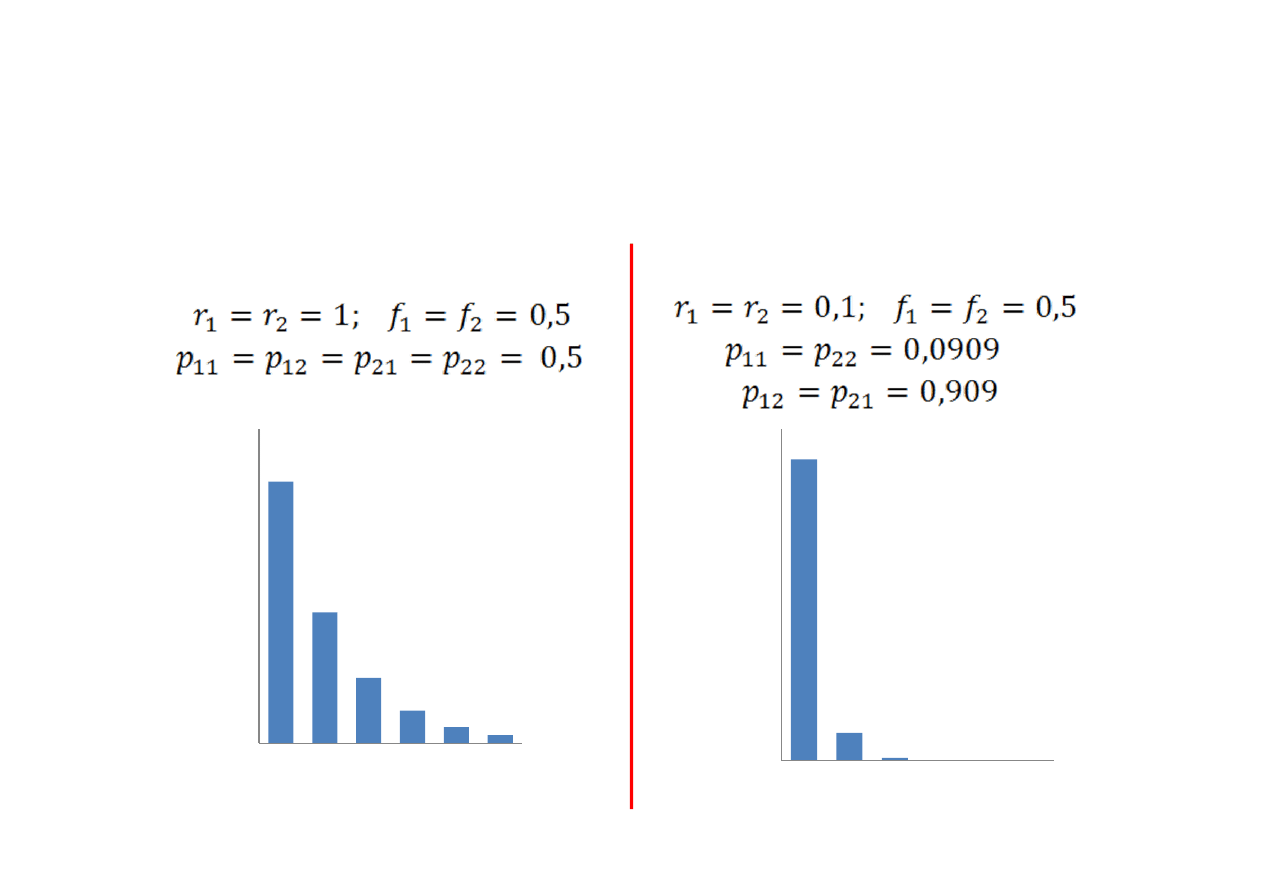
Rozkład długości sekwencji merów.
Przykłady
Kopolimeryzacja przypadkowa
Kopolimeryzacja (prawie)
przemienna
0,5
0,25
0,125
0
0,1
0,2
0,3
0,4
0,5
0,6
1
2
3
4
5
6
0,91
0,083
0,00
0,10
0,20
0,30
0,40
0,50
0,60
0,70
0,80
0,90
1,00
1
2
3
4
5
6
udzia
ł molow
y
udzia
ł molow
y
n
n
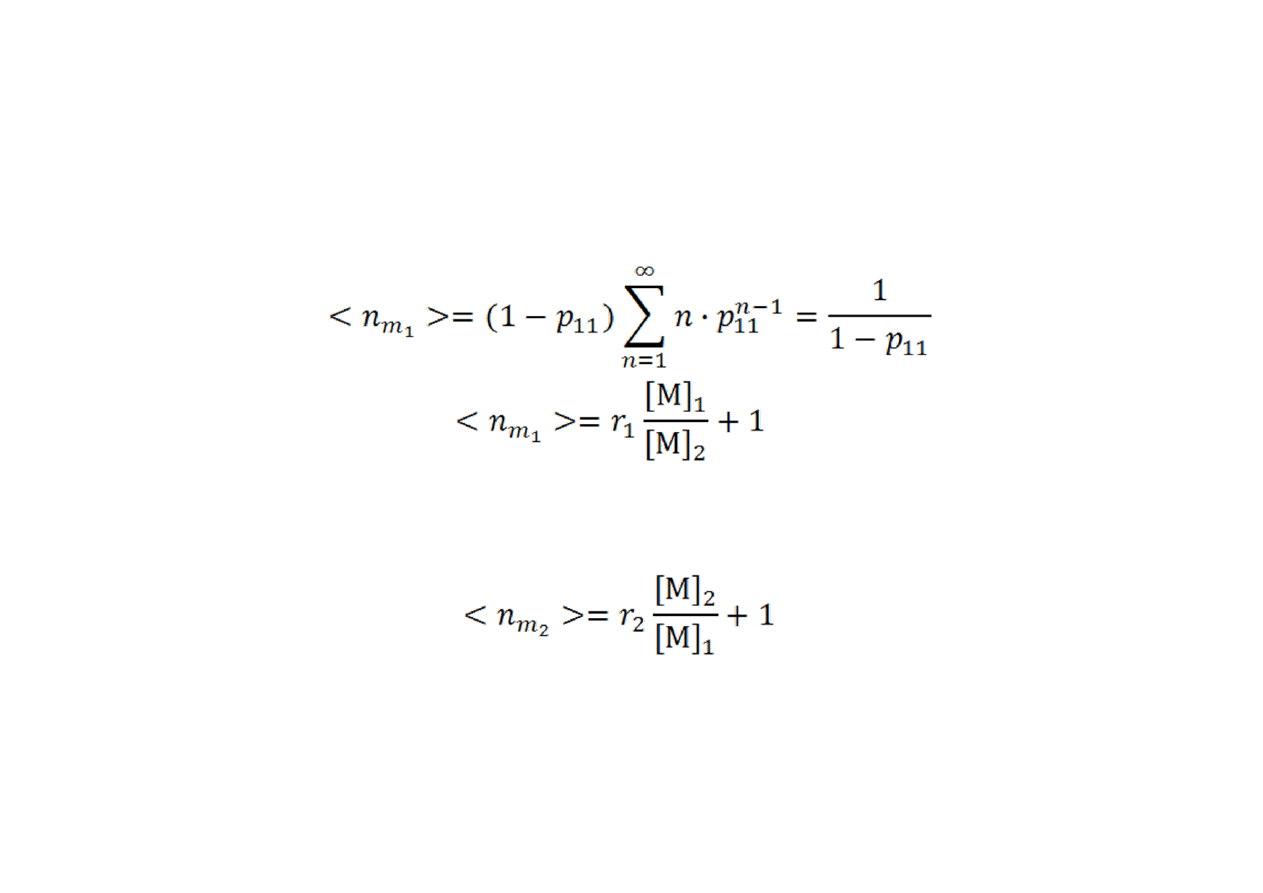
Rozkład długości sekwencji merów
Średnia długość sekwencji merów jest równa:
a zatem:
Wartości te są wartościami chwilowymi, określają skład kopolimeru,
powstającego przy niewielkiej zmianie stopnia przereagowania (t.j., <
ok. 5%). Nietrudno zauważyć, że przez analogię:
a stosunek tych dwóch wielkości „odtwarza” równanie kopolimeryzacji.
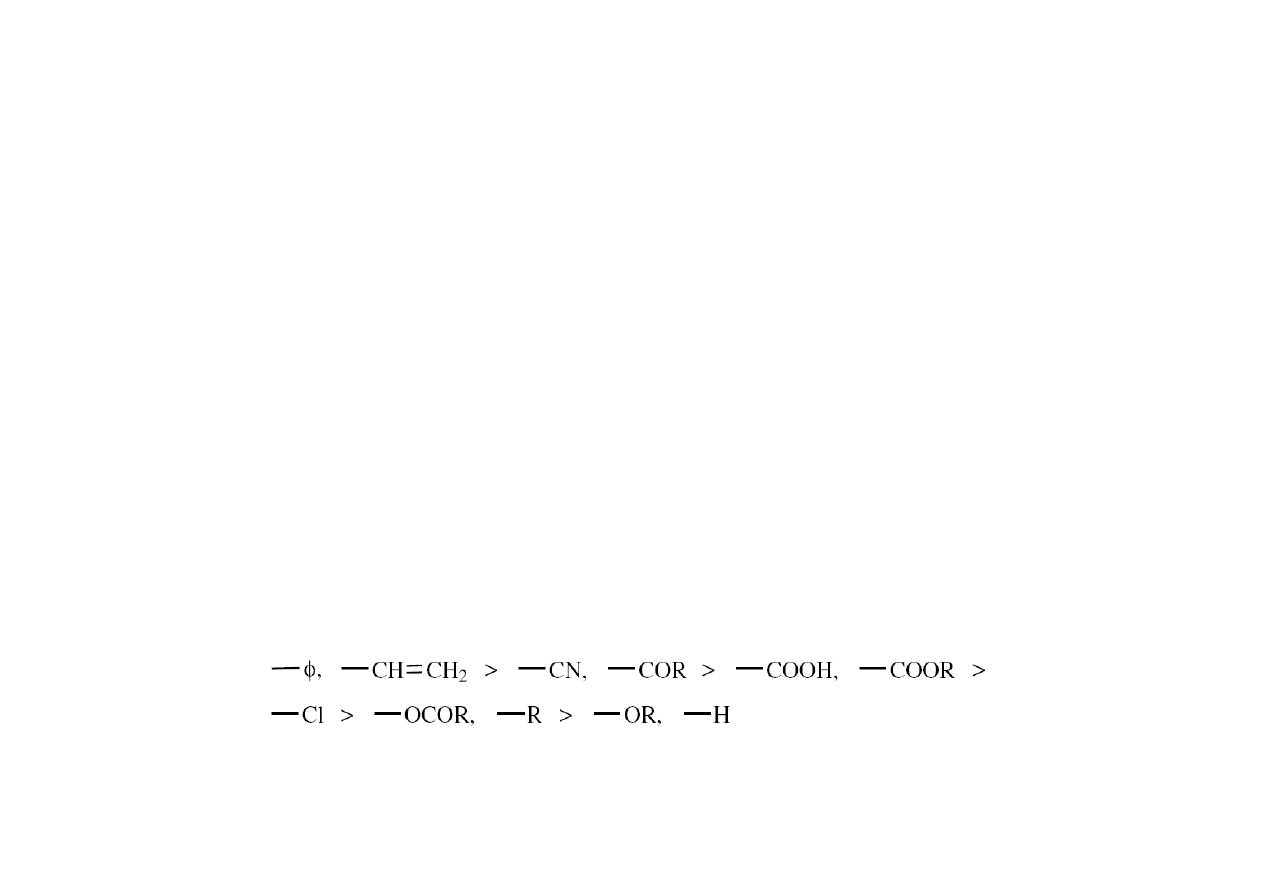
Reaktywność merów w
kopolimeryzacji rodnikowej
•
Środowisko reakcji
:
–
Ma wpływ na reaktywność, ale często jest to wpływ w granicach błędu
wyznaczenia r
1
i r
2
. W przypadku polimeryzacji heterofazowej możliwy wpływ
współczynnika podziału monomeru między fazy.
•
Temperatura
:
–
Brak lub niewielki wpływ, zwłaszcza w przypadku reakcji nieodwracalnych.
•
Ciśnienie
:
–
Wpływ zerowy lub niewielki – jak temperatura.
•
Budowa meru
:
–
Podstawniki zwiększają podatność monomeru na atak rodnika w szeregu
(rośnie ze zdolnością meru do stabilizacji rodnika):
Reaktywność merów w
kopolimeryzacji rodnikowej
•
Efekty steryczne
:
–
Zwiększenie ilości i wielkości podstawników przy wiązaniu podwójnym zmniejsza
reaktywność monomerów. W przypadku chlorku winylidenu maleje ona, odpowiednio 2
do 10 i 2 do 20 razy w przypadku chlorku winylidenu i 1,2‐dichloroetylenu w porównaniu
do chlorku winylu. 1,2‐podstawione monomery praktycznie nie polimeryzują rodnikowo
– są jednak reaktywne (choć słabo) w kopolimeryzacji, zwłaszcza przemiennej. To jest
także steryczny efekt budowy monomeru. Izomery trans‐ 1,2 podstawione są nieco
bardziej reaktywne niż cis‐.
•
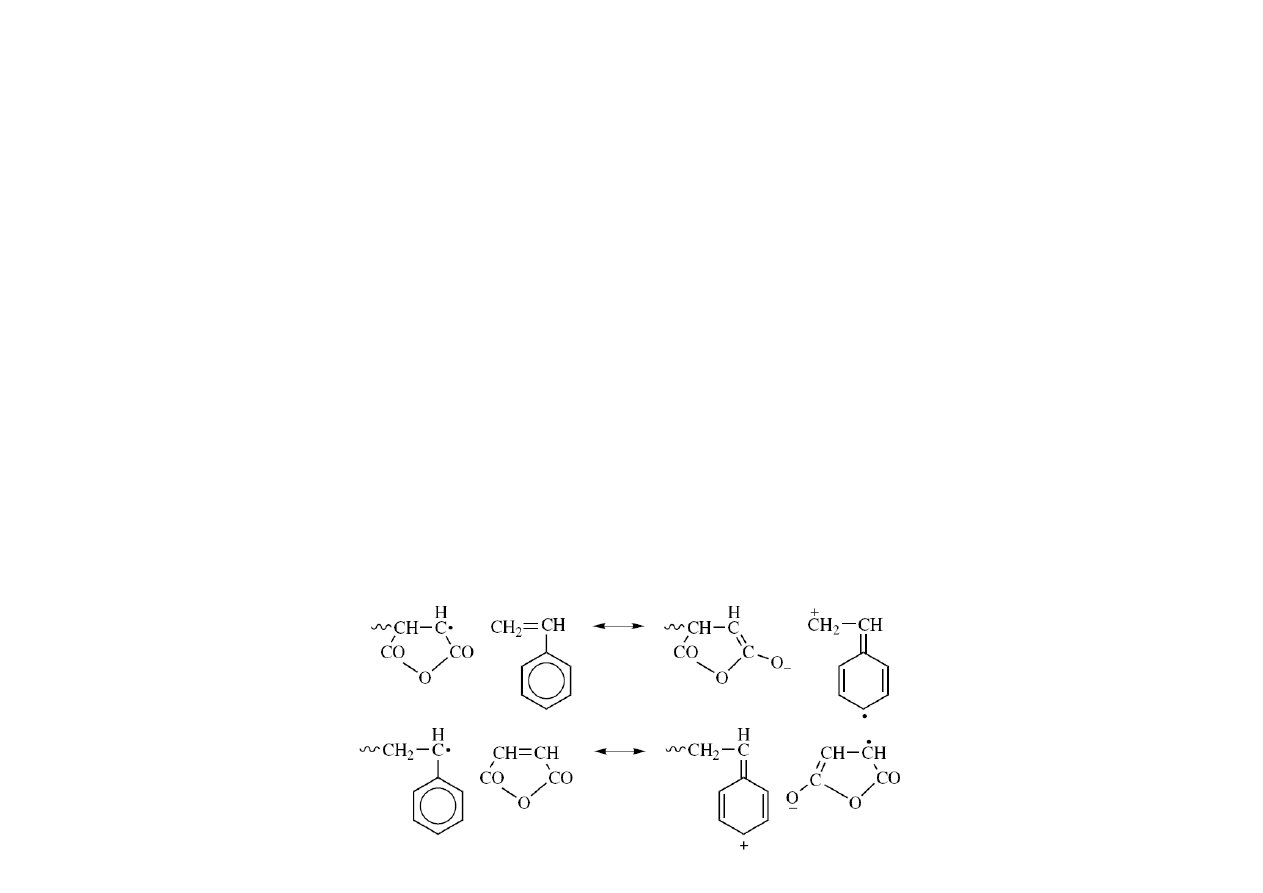
Przemienność – polarność monomeru i tworzenie kompleksów
:
–
Miarą skłonności do przemienności jest dążenie iloczynu r
1
r
2
do zera. Niekiedy da się to
wytłumaczyć powstawaniem kompleksów (np. charge‐transfer) lub stabilizacją stanu
przejściowego, jak w kopolimeryzacji styrenu i bezwodnika maleinowego:
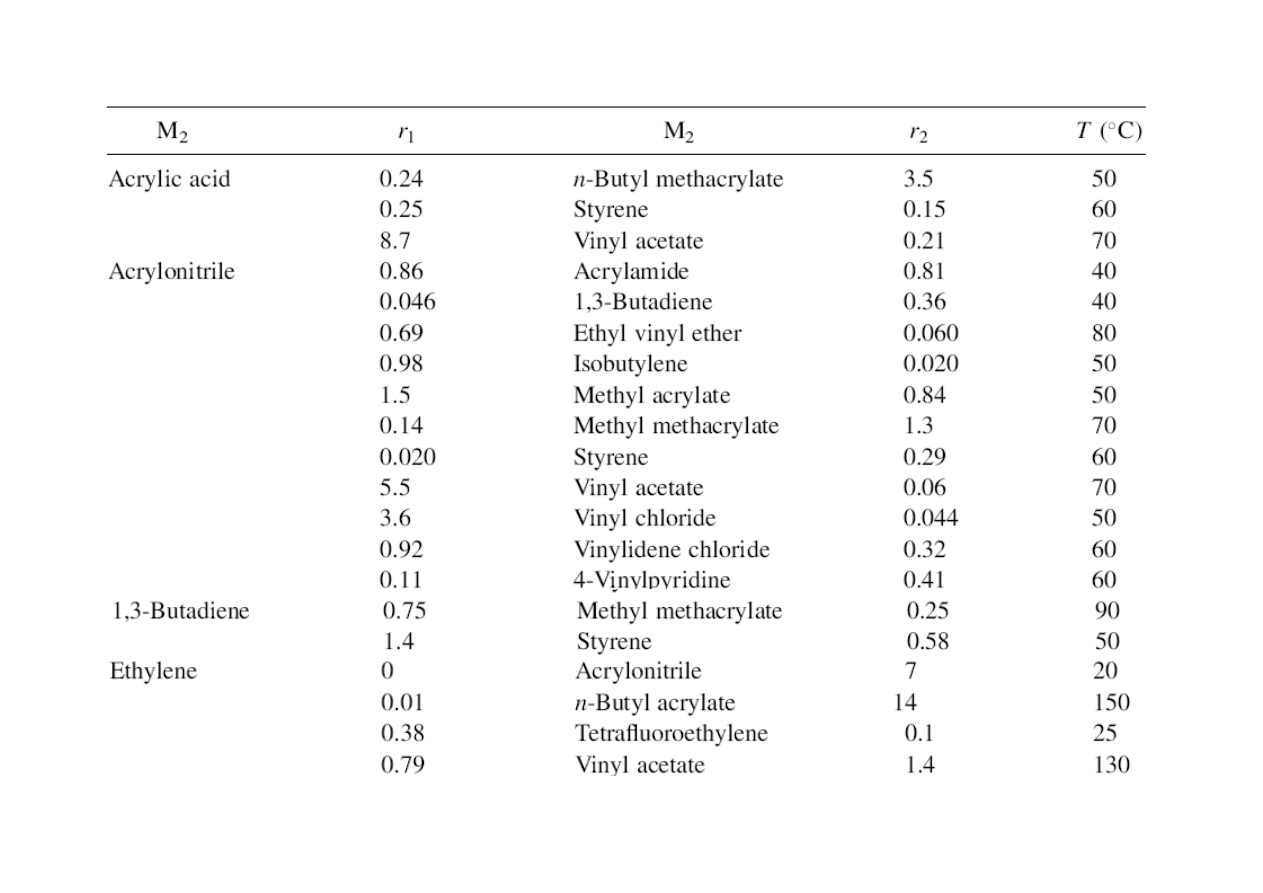
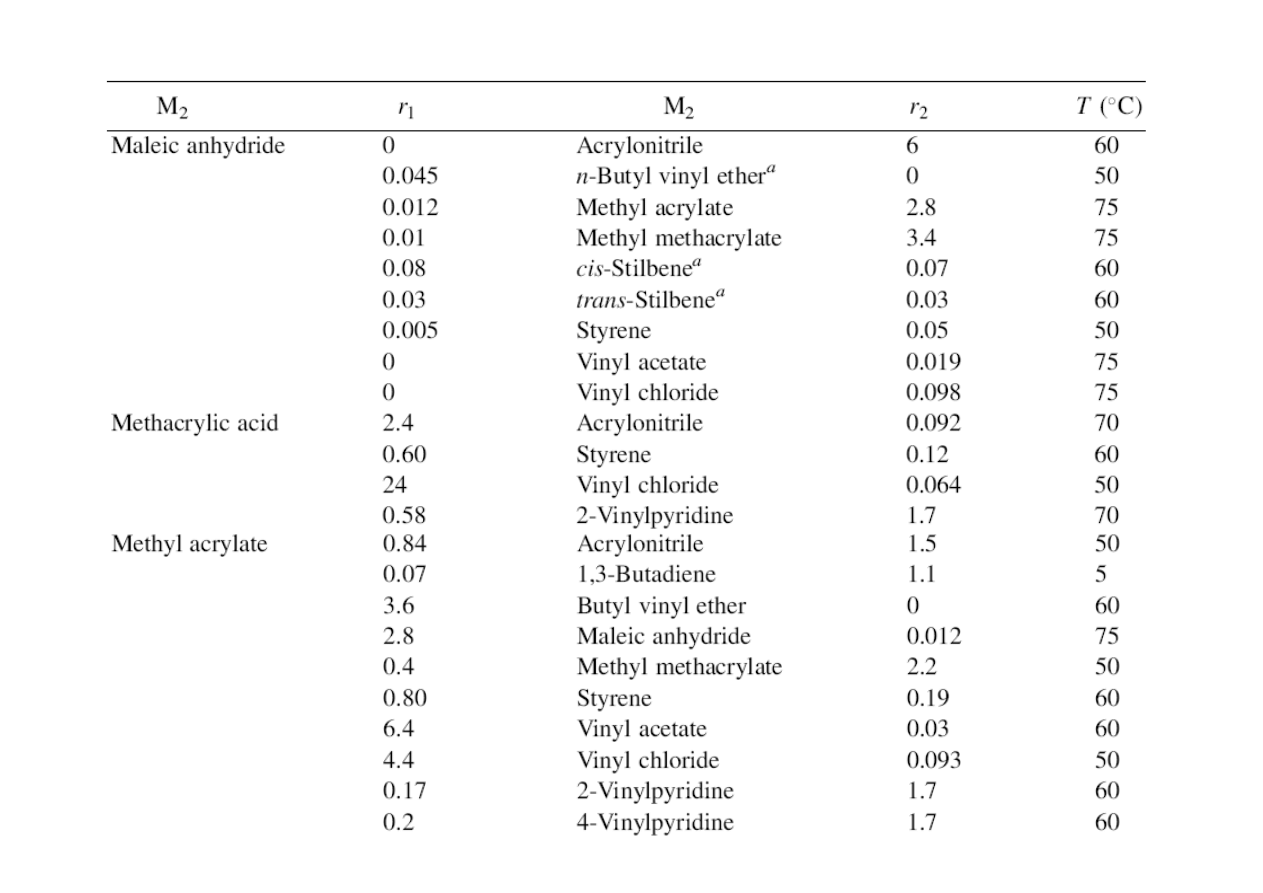
Współczynniki reaktywności komonomerów w polimeryzacji rodnikowej*
* Fragmenty tabeli z podręcznika: G.Odian „Principles of Polymerization” 2004
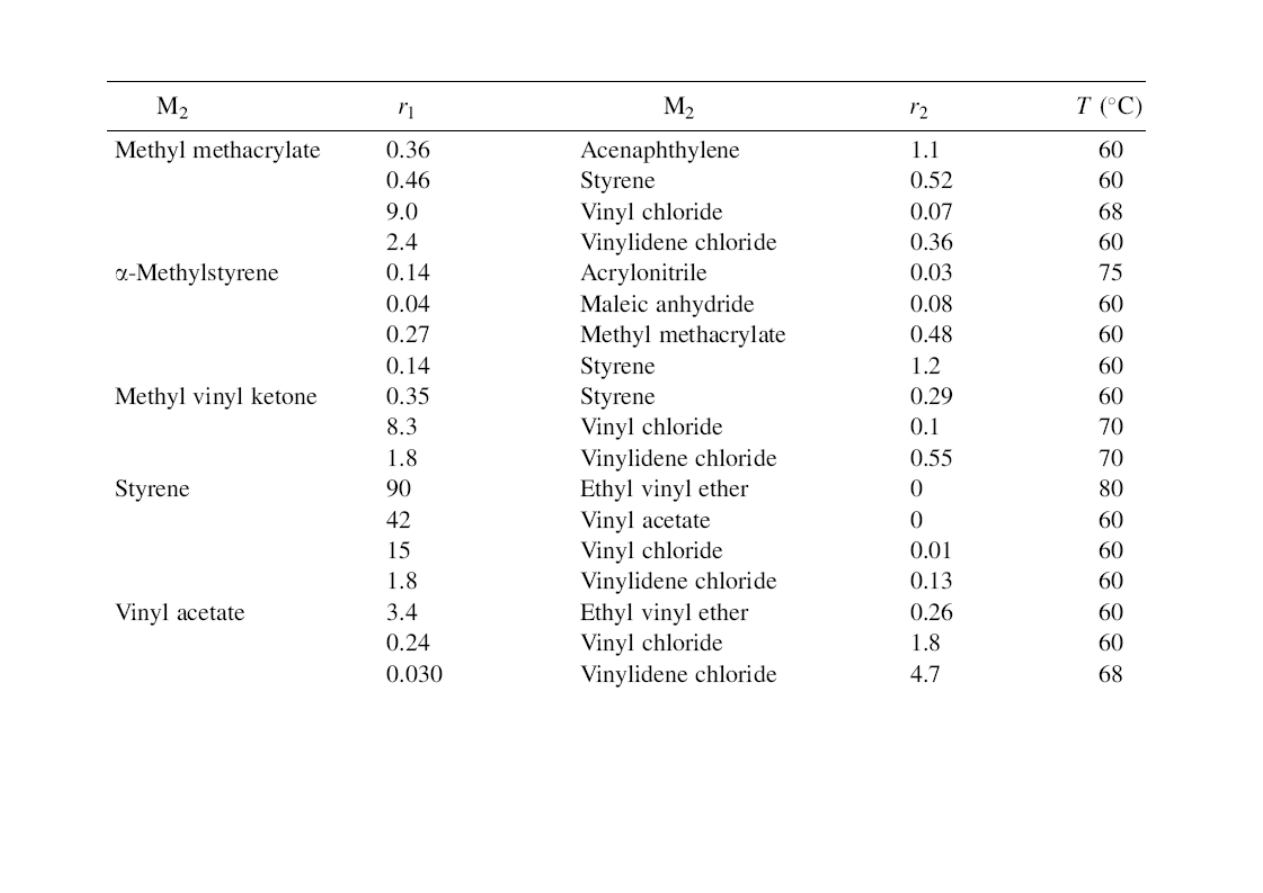
Reaktywność względną monomeru względem rodnika innego monomeru określa
odwrotność współczynnika reaktywności monomeru w kopolimeryzacji.
Wartości zebrano w tabeli powyżej (wg Odiana).
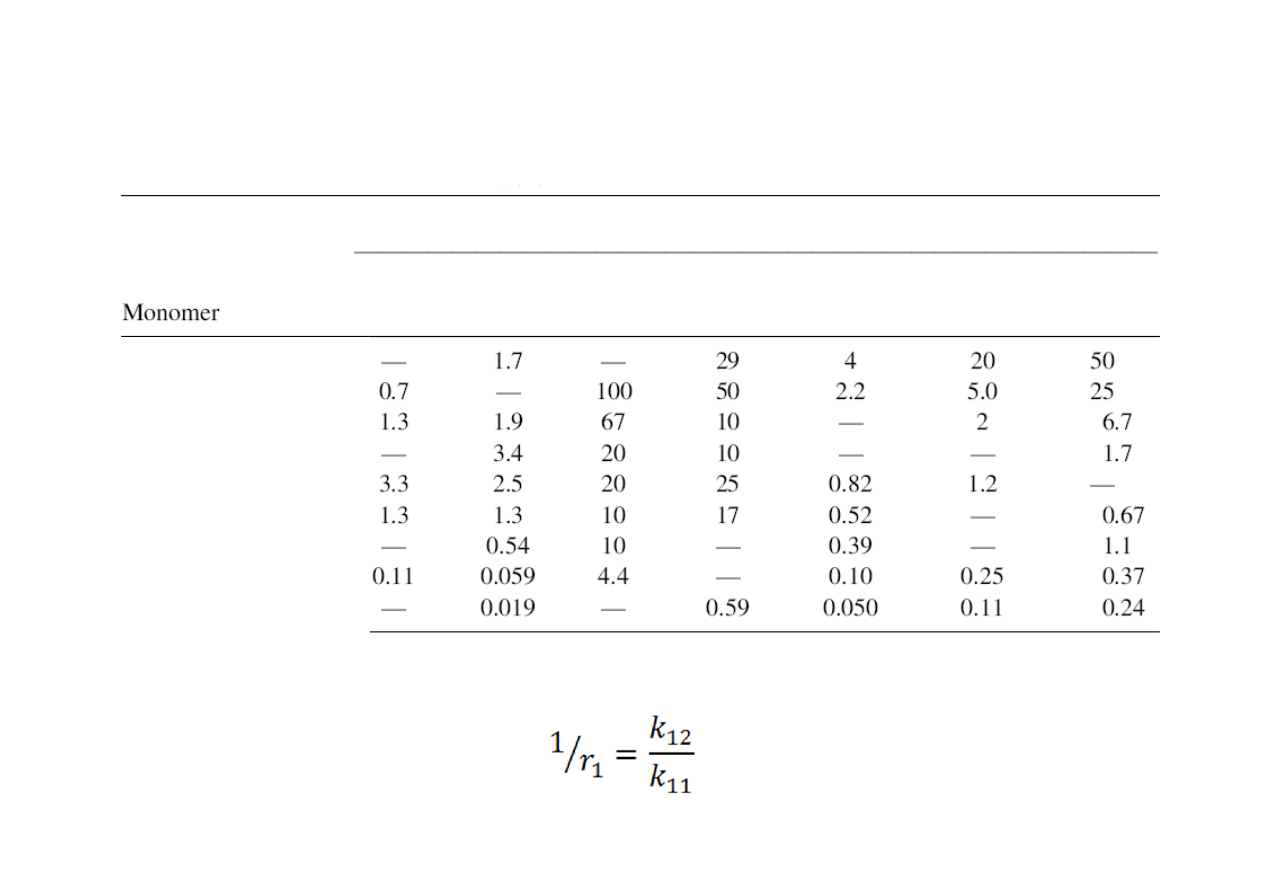
Względne reaktywności (1/r) monomerów z różnymi makrorodnikami
Makrorodnik
Butadien
Styren
Octan
winylu
Chlorek
winylu
Metakrylan
metylu
Akrylan
metylu
Akrylonitryl
Butadien‐1,3
Styren
Metakrylan metylu
Keton metylo‐winylowy
Akrylonitryl
Akrylan metylu
Chlorek winylidenu
Chlorek winylu
Octan winylu
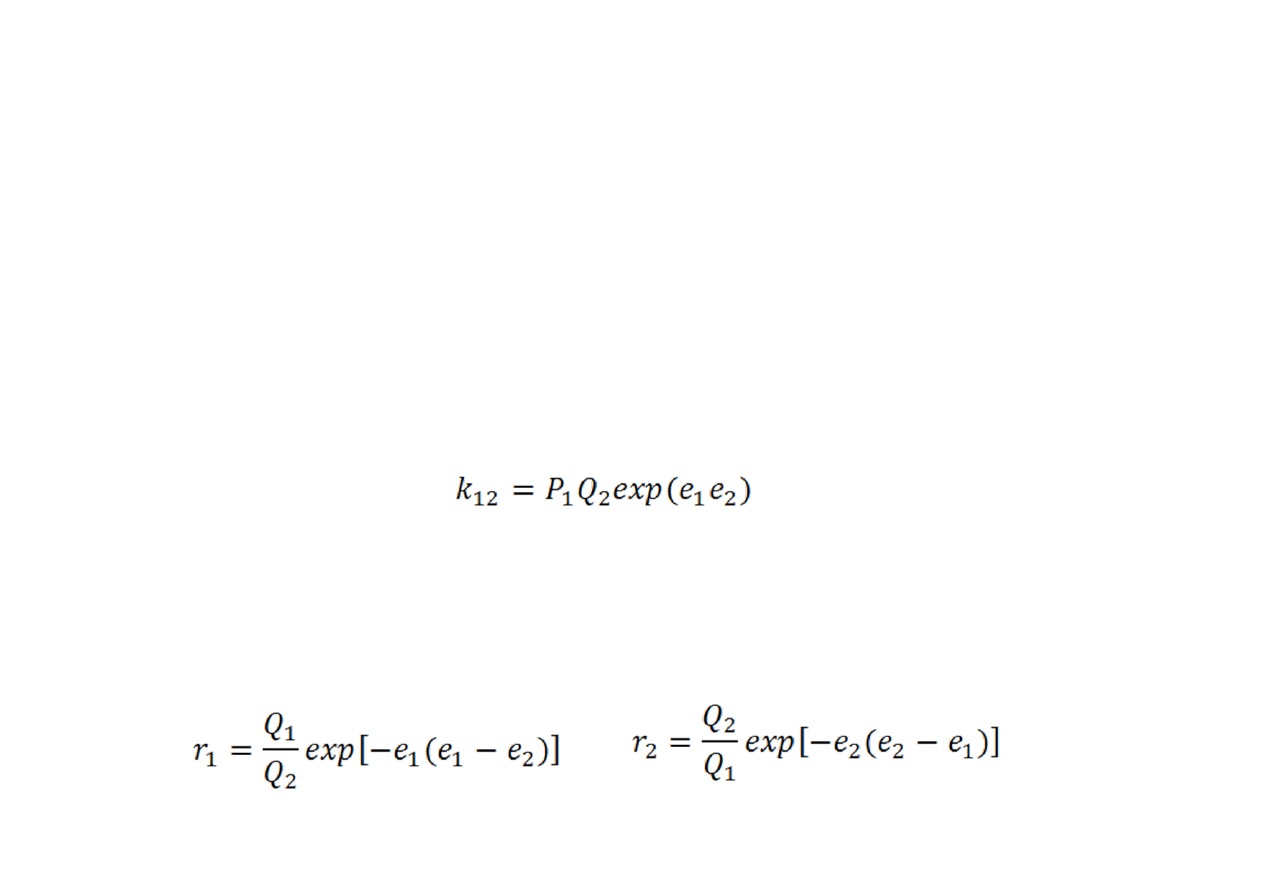
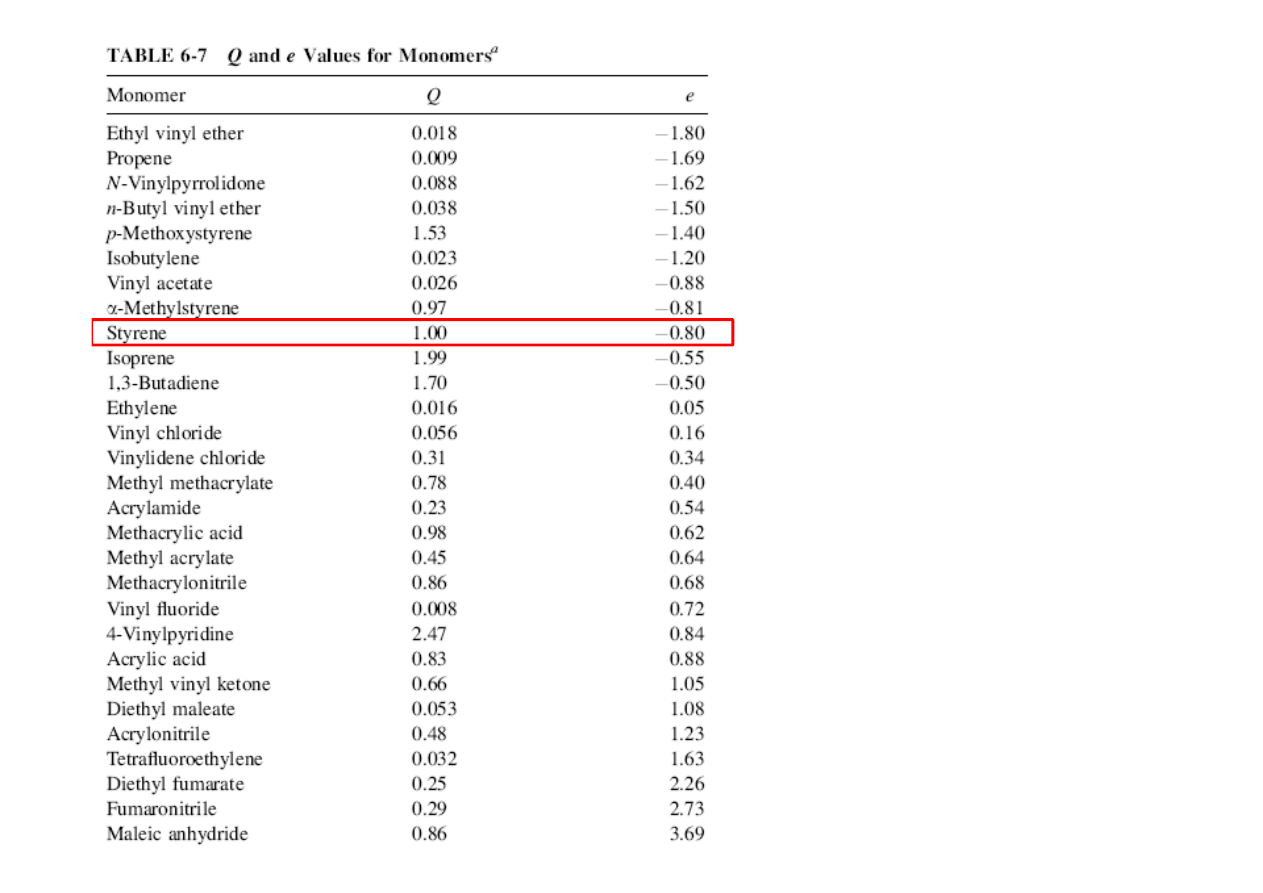
Schemat Q‐e
•
Podejmowano próby skorelowania struktury z reaktywnością
monomerów i rodników. Pozwoliłoby to na oszacowanie
współczynników reaktywności monomerów, zanim jeszcze doszłoby
do eksperymentu.
•
Pożyteczną korelację tego typu wprowadzili Alfrey i Price, znaną
jako schemat Q–e. Zaproponowali oni relację wiążącą stałą
szybkości reakcji rodnika M
1
z monomerem M
2
w postaci:
•
przy czym P
1
określa reaktywność rodnika M
1
x, Q
1
reaktywność
monomeru M
2
, a e
1
i e
2
określają polarności, odpowiednio, rodnika i
monomeru.
•
Analogiczne relacje dotyczące pozostałych stałych szybkości
propagacji prowadzą do wzorów:
Schemat Q‐e
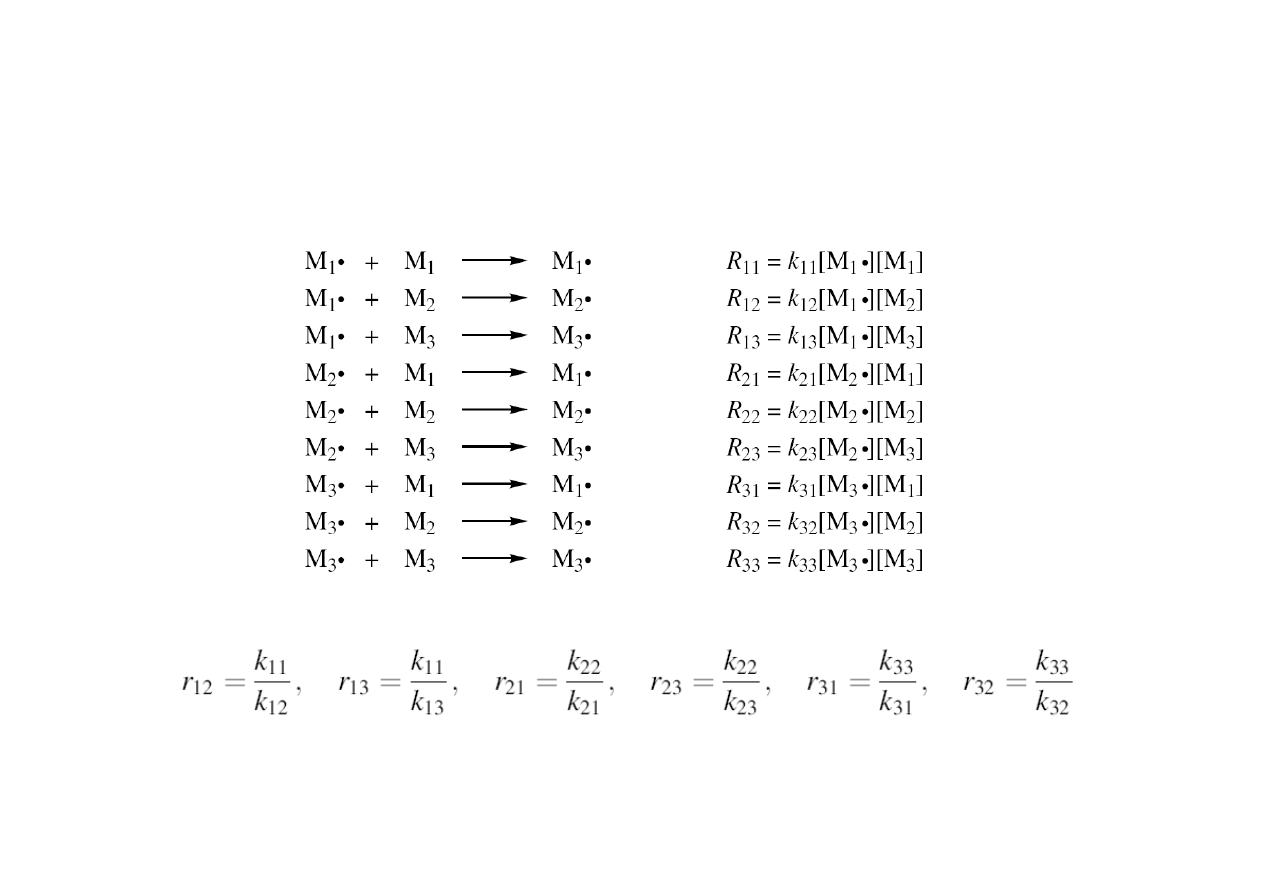
Terpolimeryzacja
Rozpatrujemy 9 równań szybkości:
i definiujemy 6 współczynników reaktywności monomerów:

Równanie terpolimeryzacji

Kopolimeryzacja wg mechanizmu
kationowego i anionowego
•
W polimeryzacji kationowej reaktywność jest częściej zależna od
warunków reakcji (rozpuszczalnik, przeciwjon, temperatura), niż od
struktury monomeru.
•
Stosuje się korelacje półempiryczne, zwłaszcza w stosunku do
pochodnych styrenu. Szereg reaktywności podstawionych styrenów
ma postać:
p‐OCH
3
> p‐CH
3
> p‐H > p‐Cl > m‐Cl > m‐NO
2
•
W kopolimeryzacji anionowej reaktywność monomerów jest
odwrotna w stosunku do kopolimeryzacji kationowej. Reaktywność
monomerów z podstawnikami elektrono‐donorowymi jest zerowa.
•
W kopolimeryzacji anionowej szereg reaktywności monomerów
winylowych ma postać:
–CN > –COOR > –φ > –CH=CH
2
> –H.

Kopolimery o znaczeniu komercyjnym
•
Kopolimery styrenu
. Większa część polimerów styrenu to jego
kopolimery:
•
Z
butadienem
(kauczuki o zaw. 25 % styrenu i 75% butadienu,
lateksy do farb z ok. 50‐70% styrenu, karboksylowane)
•
Z
diwinylobenzenem
(usieciowane nośniki do jonitów i wypełnień
chromatograficznych)
•
Z
akrylonitrylem
(SAN) (10‐40% AN – wyroby o lepszej odporności
na chemikalia i lepszej odporności termicznej)
•
Z
akrylonitrylem
, otrzymywany w emulsji, zawiesinie lub w bloku w
obecności polibutadienu, SBR lub NBR. W wyniku powstaje
kopolimer ABS.
•
Polimeryzowany w obecności
polibutadienu
; powstaje polistyren
wysokoudarowy (HIPS: high impact polystyrene)

Kopolimery o znaczeniu komercyjnym
•
Kopolimery etylenu
. Ponad 25% całej ilości etylenu
polimeryzowanego rodnikowo wchodzi w skład kopolimerów.
•
Z
octanem winylu
(kopolimery o symbolu EVA). Kopolimery
zawierające 2‐18% VA stosuje się jako materiały opakowaniowe,
folie termokurczliwe, folie do powlekania folii z aluminium i/lub PET.
Zawierające do 20% VA służą do wytłaczania lub prasowania
zabawek, rurek, węży, uszczelek lub izolacji przewodów
elektrycznych. Kopolimery zawierające 20‐30% VA służą jako
dodatki do wosków, parafiny i elastomerów, jako kleje na gorąco,
dodatki do asfaltu.
•
Z
monomerami akrylowymi
(kopolimery lub terpolimery),
wykorzystywane są jako elastomery.
•
Z
kwasem (met)akrylowym
jonomery (dodatki jonów metali)
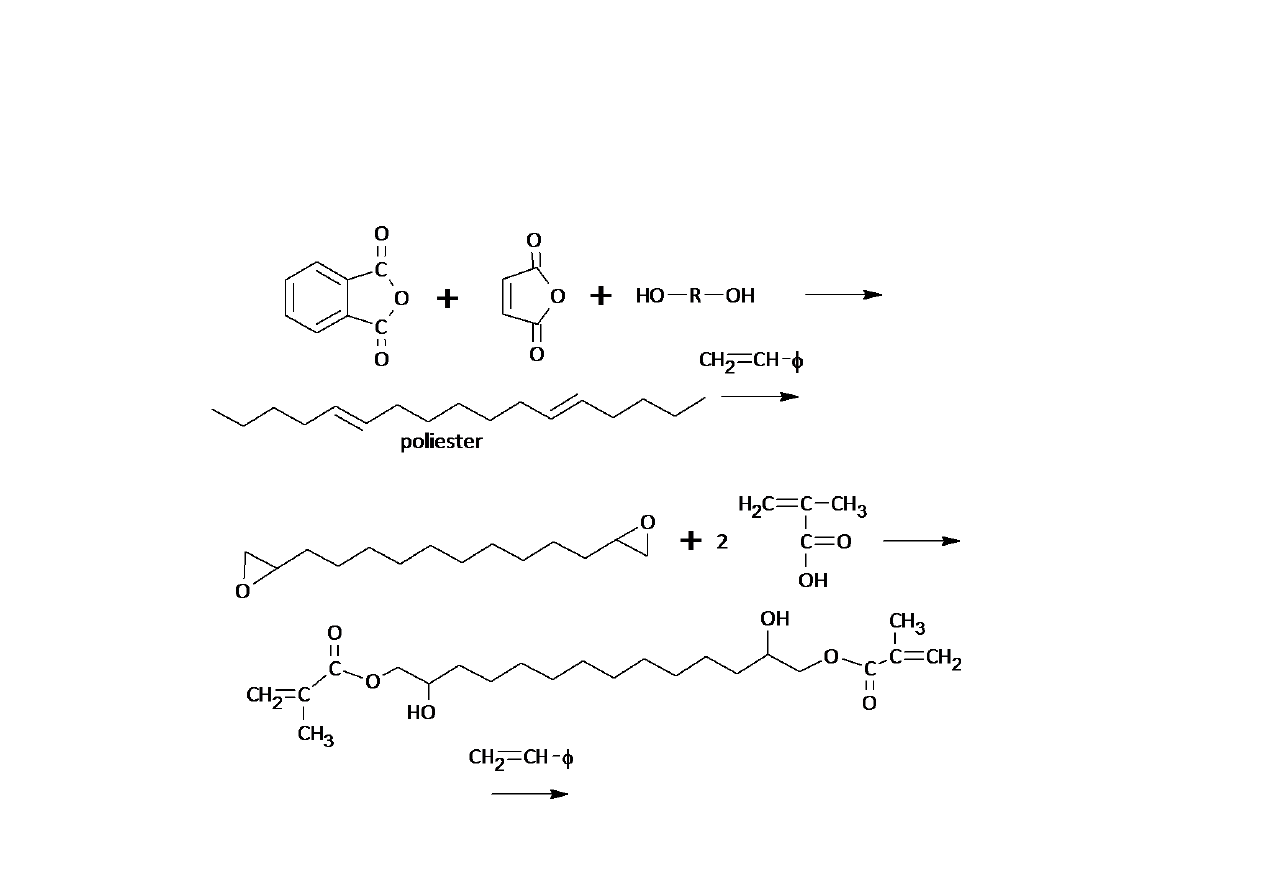
Nienasycone żywice poliestrowe.
Żywice winyloestrowe
żywica epoksydowa
żywica winyloestrowa
bezwodnik ftalowy
bezwodnik maleinowy
glikole
kwas metakrylowy
usieciowany kopolimer
usieciowany kopolimer

Polimery allilowe
•
Monomery allilowe
słabo reagują w polimeryzacji łańcuchowej, ale monomery
diallilowe i triallilowe są wykorzystywane w różnych formulacjach, łącznie z
żywicami poliestrowymi lub monomerami zawierającymi wiązania podwójne. Są
one kopolimeryzowane w podwyższonej temperaturze, dając produkty
termoutwardzalne.
•
Najważniejszymi monomerami z tej grupy są
ftalan
oraz
tereftalan diallilu
(odpowiednio, diestry o‐ and p‐dikwasów) (DAP, DAIP). Są one stosowane do
formowania i powlekania łączników elektrycznych i izolatorów w telekomunikacji,
układach komputerowych i w systemach lotniczych i kosmicznych, wyróżniających
się niezawodnością. Inne zastosowania to impregnowane tkaniny szklane (radary,
rakiety, części lotnicze) oraz tekstylia i papiery do wyrobu dekoracyjnych warstw
powierzchniowych, odpornych na zabrudzenie i podwyższoną temperaturę,
przeznaczonych na wykładziny, panele ścienne i elementy mebli.
•
Węglan diglikolowo‐diallilowy
(bis[allilowęglan] glikolu dietylenowego) (DADC)
jest wykorzystywany do wyrobu wysoce przejrzystych elementów optycznych,
takich jak soczewki do okularów, osłony bezpieczeństwa, filtry fotograficzne i inne.
•
Polimery
chlorku N, N, N, N‐diallildimetylammoniowego
(DADMAC) (i jego
kopolimery z akryloamidem) są żywicami allilowymi w sensie budowy, ale różnią
się właściwościami od innych żywic tego typu, ponieważ nie są usieciowane.
Document Outline
- Chemia i technologia polimerów
- Kopolimeryzacja w różnych procesach
- Polimeryzacja rodnikowa i kopolimeryzacja
- Kopolimeryzacja
- Równanie kopolimeryzacji. Model meru końcowego
- Równanie kopolimeryzacji
- Równanie kopolimeryzacji
- Równanie kopolimeryzacji
- Równanie kopolimeryzacji
- Kopolimeryzacja
- Kopolimeryzacja „idealna”
- Skład kopolimeru
- Skład kopolimeru
- Skład kopolimeru
- Skład kopolimeru
- Skład kopolimeru
- Skład kopolimeru
- Skład kopolimeru
- Skład kopolimeru
- Wyznaczanie współczynników reaktywności komonomerów
- Wyznaczanie współczynników reaktywności komonomerów
- Wyznaczanie współczynników reaktywności komonomerów
- Rozkład długości sekwencji merów
- Rozkład długości sekwencji merów
- Rozkład długości sekwencji merów. Przykłady
- Rozkład długości sekwencji merów
- Reaktywność merów w kopolimeryzacji rodnikowej
- Reaktywność merów w kopolimeryzacji rodnikowej
- Slajd numer 29
- Slajd numer 30
- Slajd numer 31
- Slajd numer 32
- Schemat Q-e
- Schemat Q-e
- Terpolimeryzacja
- Równanie terpolimeryzacji
- Kopolimeryzacja wg mechanizmu kationowego i anionowego
- Kopolimery o znaczeniu komercyjnym
- Kopolimery o znaczeniu komercyjnym
- Nienasycone żywice poliestrowe. Żywice winyloestrowe
- Polimery allilowe
Wyszukiwarka
Podobne podstrony:
chemia i technologia polimerow zagadnienia egzaminacyjne, chemia i technologia polimerów
synteza wielkocząsteczkowej żywicy epoksydowej - sprawozdanie, chemia i technologia polimerów
polimeryzacja emulsujna octanu winylu - sprawozdanie, chemia i technologia polimerów
radiacja spr3-polimeryzacja radiacyjna, studia, nano, 3rok, 5sem, chemia i technologia radiacyjna po
Dozymetr alaninowy, studia, nano, 3rok, 5sem, chemia i technologia radiacyjna polimerów, lab
Chemia i technologia radiacyjna polimerow Cw2 - Dozymetria CalorymetriaAlanina, studia, nano, 3rok,
radiacja spr1-dozymetr Frickego, studia, nano, 3rok, 5sem, chemia i technologia radiacyjna polimerów
Chemia i technologia radiacyjna polimerow Cw3 - Polimeryzacja radiacyjna - instrukcja, studia, nano,
CHEMIA FIZYCZNA POLIMER ôW
Tarcie na poziomie atomowym, UŁ Chemia, Technologia chemiczna
Wykład PŁ, bio, Chemia, Biofizyka, Toksykologia, Chemia i Technologia Wody
WYKLAD13.DOC, Chemia i technologia nitrowych pochodnych chlorobenzenu. 2,4-chlorodinitrobenzen, trin
Materialy wytrzym materialow, Chemia, technologia chemiczna, metaloznawstwo
LABORATORIUM TECHNOLOGII POLIMERÓW I
egzamin - chemia, Technologia żywnosci i Żywienie człowieka, 3 semestr, Chemia żywności, testchemiaz
więcej podobnych podstron