
43
PRACE POGLĄDOWE / Review articles
Polski Przegląd Kardiologiczny 2009, 11, 1, 43-47
ISSN 1507-5540
Copyright © 2009 Cornetis; www.cornetis.com.pl
Kliniczne zastosowania rezonansu magnetycznego serca
Clinical applications of cardiovascular magnetic resonance
Jolanta Miśko
1
, Łukasz A. Małek
2
, Mateusz Śpiewak
2
1
Pracownia Rezonansu Magnetycznego, Zakład Radiologii, Instytut Kardiologii w Warszawie
2
I Klinika Choroby Wieńcowej, Instytut Kardiologii w Warszawie
Adres do korespondencji:
Dr n. med. Jolanta Miśko
Pracownia Rezonansu Magnetycznego,
Instytut Kardiologii, ul. Alpejska 42; 04-628 Warszawa
tel. (022) 343 46 55; e-mail: jmisko@wp.pl
Streszczenie
Możliwości rezonansu magnetycznego serca (cardiovascular magnetic resonance – CMR) plasują tę metodę w pozycji standardu obrazowania w wielu
klinicznych i naukowych zastosowaniach w diagnostyce kardiologicznej, stratyfikacji ryzyka oraz ocenie efektów leczenia. Swoją pozycję CMR zawdzię-
cza wysokiej dokładności oraz powtarzalności oceny poszczególnych parametrów. Obecnie najbardziej uznane zastosowania kliniczne obrazowania
CMR to ocena: 1. parametrów funkcjonalnych lewej i prawej komory serca z zastosowaniem sekwencji kinematograficznych (aktualnie najczęściej
steady state free precession – SSFP) – objętości późnorozkurczowej (EDV), objętości późnoskurczowej (ESV), objętości wyrzutowej (SV), frakcji wyrzuto-
wej (EF), regionalnej kurczliwości mięśnia serca, 2. obecności, lokalizacji i śródściennej rozległości martwicy lub włóknienia w obrębie mięśnia serca na
podstawie późnego wzmocnienia pokontrastowego, 3. ilościowego przepływu krwi w dużych naczyniach i istotności hemodynamicznej wad zastaw-
kowych serca przy użyciu sekwencji phase contrast, 4. negatywnych skutków wad wrodzonych serca przy zastosowaniu sekwencji SSFP, angiografii MR,
sekwencji o typie „czarna krew” i sekwencji z oceną przepływu. CMR jest nieinwazyjną metodą diagnostyczną serca z aktualnymi i perspektywicznymi
możliwościami w ocenie anatomii, funkcji i żywotności serca.
Słowa kluczowe: rezonans magnetyczny serca, żywotność mięśnia serca, funkcja mięśnia serca.
Abstract
The comprehensive potential of cardiovascular magnetic resonance (CMR) placed this method as an imaging standard in clinical and research cardio-
logy in terms of diagnosis, risk stratification and monitoring of treatment. It is based mainly on the high accuracy and reproducibility of the assessment.
Currently the main clinical applications of CMR are: 1. to measure the RV and LV functional parameters – end diastolic volume (EDV), end systolic volu-
me (ESV), stroke volume (SV), ejection fraction (EF), regional contractile function using cine sequence (nowadays the most commonly used is steady
state free precession – SSFP), 2. to determine presence, location and extent of myocardial infarction or fibrosis with means of delayed enhancement, 3.
to quantify blood flow in large vessels and the severity of regurgitant and stenotic valve using velocity mapping CMR sequence, 4. to image and eva-
luate negative consequences of congenital abnormalities of the heart and great vessels using MR angiography, black-blood, SSFP and velocity mapping
sequences. CMR is a noninvasive modality with current capability and future promise in evaluation of the heart anatomy, function and viability.
Key words: cardiovascular magnetic resonance, myocardial viability, myocardial function
Wprowadzenie
Pierwsze obrazy rezonansu magnetycznego (magnetic
resonance – MR) serca powstały ok. 25 lat temu – rejestra-
cja pojedynczego obrazu morfologicznego serca trwała
6-10 minut, a marzeniem i celem naukowców było osią-
gnięcie szybkiego i dobrego jakościowo odwzorowania
serca w MR. Po latach szybkiego postępu technologiczne-
go w zakresie budowy skanerów MR i tworzenia sekwencji
dedykowanych dla tzw. cardiovascular magnetic resonance
(CMR), osiągnięty został oczekiwany efekt: kilku-, kilku-
nastosekundowe rejestracje bramkowane lub sterowane
sygnałem EKG, oceniające morfologię, funkcję serca oraz
charakterystykę budowy tkankowej mięśnia serca i struktur
okołosercowych z wysoką rozdzielczością przestrzenną i cza-
sową, w precyzyjnie planowanych przekrojach (
ryc. 1
). Gdy
jakość badania CMR osiągnęła wysoki poziom, nastąpił naj-
ważniejszy w rozwoju każdej metody obrazowania moment,
w którym klinicyści zadali pytanie: Jakie korzyści z badania
CMR może odnieść pacjent kardiologiczny?
Ocena funkcji serca w rezonansie magnetycznym
Ocena funkcji serca, to niewątpliwie najbardziej spekta-
kularna część badania CMR – nic nie robi tak dużego wraże-
nia na klinicystach, jak możliwość wizualizacji serca w ruchu
w każdej płaszczyźnie przekroju, bez znanych z echokar-
diografii ograniczeń w postaci złych okien akustycznych.
Istotna rola CMR zyskała uznanie ekspertów tworzących
najnowsze europejskie wytyczne niewydolności serca. CMR
opisano jako złoty standard dokładności i powtarzalności
oceny parametrów objętościowych, masy oraz ruchomości
ścian lewej komory serca (1-3). Analiza funkcji serca w CMR
jest używana przez firmy farmaceutyczne w projektach kli-
nicznych oraz przez naukowców w projektach badawczych.
Nie ma innej metody obrazowania, która w sposób tak
obiektywny, powtarzalny, całkowicie nieinwazyjny, z wyso-
ką rozdzielczością przestrzenną (ok. 1,5x1,5 mm) i czasową
(30-40 ms) potrafiłaby udokumentować funkcję mięśnia
serca przed i po zastosowanej terapii. Czy poza pięknym,
ruchomym obrazem serca wynikają z tej metody bezpośred-
nie korzyści dla pacjenta? Czy badanie funkcji serca metodą
rezonansu magnetycznego znajduje zastosowanie głównie
u pacjentów kardiologicznych, u których nie można wyko-
nać dobrego jakościowo badania echokardiograficznego
(ECHO)? Prawdopodobnie takie jest miejsce CMR w diagno-
styce pacjentów z chorobą wieńcową, którzy stanowią domi-
nującą grupę pacjentów kardiologicznych (4). Ocena funkcji
serca CMR u tych chorych dotyczy głównie lewej komory
i obejmuje te same parametry i płaszczyzny obrazowania,
które są wykorzystywane w badaniu ECHO. Podobnie jak
w badaniu ECHO przy zastosowaniu CMR, można wykonać
44
Pol. Przegl. Kardiol., 2009, 11, 1, 43-47
Miśko J., Małek Ł.A., Śpiewak M.
CMR in practise
ocenę żywotności mięśnia serca lub diagnostykę istotności
zwężenia tętnicy wieńcowej stosując ocenę funkcji serca
podczas testu obciążeniowego z dobutaminą.
Istnieją jednak obszary, gdzie CMR wydaje się być bar-
dziej konkurencyjny w stosunku do ECHO, także w codzien-
nej praktyce klinicznej. Obejmują one ocenę morfologii
i funkcji prawej komory, ocenę pnia płucnego i tętnic płuc-
nych, łuku aorty, czyli te obszary, które są na granicy lub
poza granicą wizualizacji ECHO (2).
Badanie prawej komory serca i jej drogi odpływu metodą
CMR może przynieść wymierne korzyści u pacjentów z wro-
dzonymi wadami serca: po wszczepieniu konduitów, w kon-
troli po operacji wrodzonych wad serca z morfologiczną
prawą komorą zaopatrującą krążenie systemowe. Rutynowa
ocena parametrów prawej komory we wrodzonych wadach
serca, obejmuje: określenie objętości późnorozkurczowej,
objętości wyrzutowej, frakcji wyrzutowej, masy mięśnia,
ocenę niedomykalności trójdzielnej, stenozy czy niedomy-
kalności płucnej, średnicy homograftu płucnego, obecności
i istotności zwężeń tętnic płucnych, przepływu przez pień
płucny i tętnice płucne. Po operacji wrodzonej wady serca
w ośrodkach dysponujących rezonansem zalecana jest okre-
sowa kontrola CMR ze względu na wynikające ze zrostów
pooperacyjnych utrudnienia w obrazowaniu ECHO (2).
Poza wadami wrodzonymi serca bardzo prawdopodobne
jest, że diagnostyka CMR prawej komory stanie się przydat-
na przy określaniu skutków hemodynamicznych przewlekłej
zatorowości płucnej oraz w każdej innej postaci nadciśnienia
płucnego (2).
Przyjęcie właściwego algorytmu badania funkcji serca,
przełożenie wypracowanych już w ECHO parametrów
oceny, wdrożenie nowych parametrów możliwych do oceny
w CMR, może być drogą integracji, a nie rywalizacji obu
metod. Należy także pamiętać, że CMR nie jest badaniem
pierwszego rzutu, a czas akwizycji i opracowania wyników
sprawia, że warto traktować tę metodę, jako uzupełniającą/
weryfikującą badanie ECHO.
Sposób oceny funkcji lewej i prawej komory w rezo-
nansie magnetycznym opiera się na zastosowaniu sekwen-
cji SSFP (steady state free precession), która jest pozbawiona
artefaktów wynikających z szybkiego przepływu krwi zabu-
rzających obraz w poprzednio stosowanej sekwencji GRE
(gradient echo). Obrazowanie funkcji serca w CMR, określane
jako cineMR, przypomina klatki filmu, który został puszczo-
ny w formie pętli i naśladuje nieustający ruch serca. Trzeba
jednak pamiętać, że w najlepszych jakościowo obrazach
cineMR mamy do czynienia nie z obrazem rzeczywistym
cyklu serca, a z uśrednionym, gdzie informacja tworząca
obraz jest zbierana w ciągu kilku lub kilkunastu odcinków
RR. Każdy cykl RR jest podzielony na ok. 20-30 faz (rozdziel-
czość czasowa 40-50 ms), a informacja dla każdej fazy czyn-
ności skurczowo-rozkurczowej jest sumowana z kilku/kilku-
nastu odstępów R-R w czasie jednego bezdechu pacjenta
(ok. 5-10 sek). Jakość obrazów będzie z pewnością zaburzo-
na przy niemiarowej czynności serca lub nasilonej niewy-
dolności oddechowej pacjenta. W takiej sytuacji pozostaje
jedynie możliwość gorszego jakościowo obrazowania funkcji
serca w czasie rzeczywistym z oceną wizualną kurczliwości
(bez ilościowej oceny parametrów funkcjonalnych).
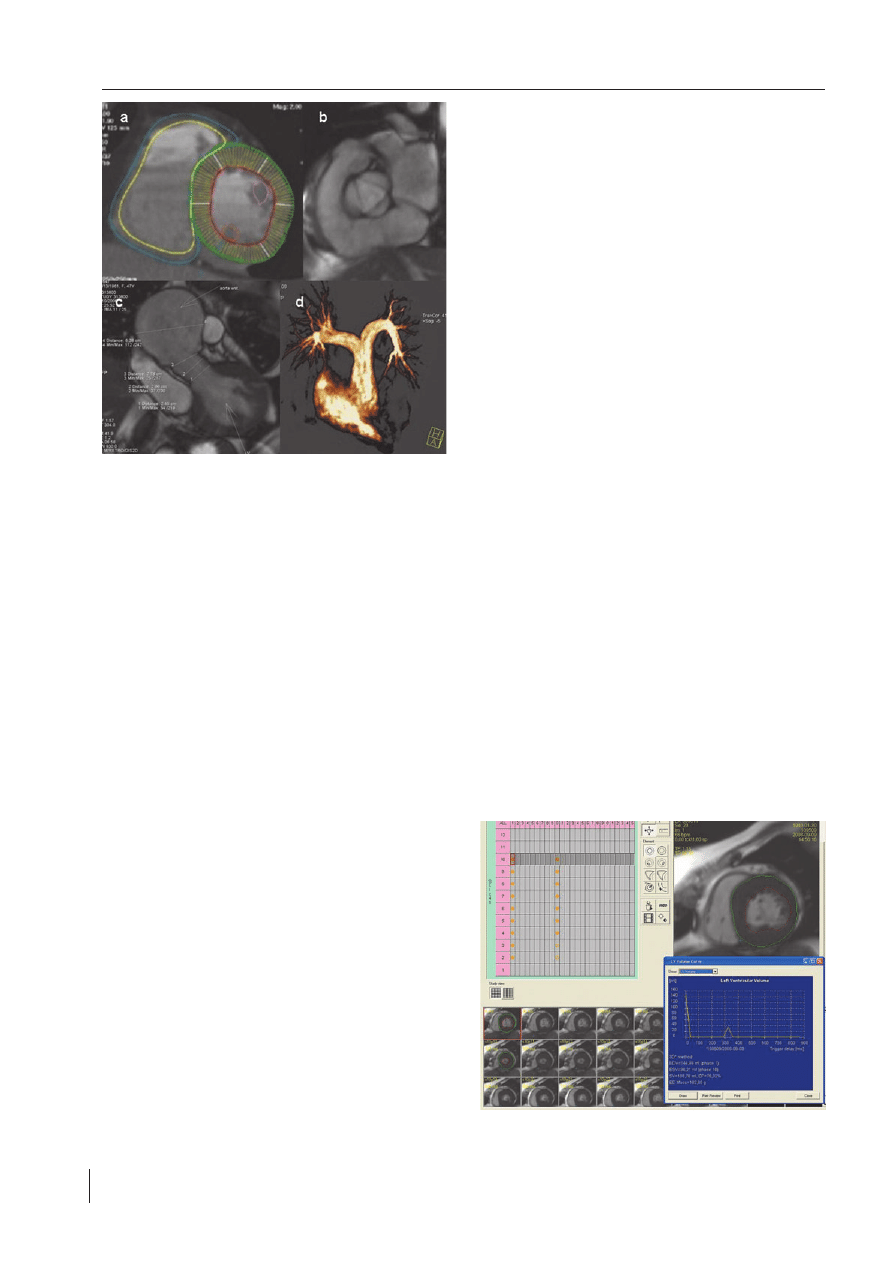
Po akwizycji oceniane są wszystkie obrazy w osi krótkiej
serca (przekroje od podstawy serca do koniuszka), zareje-
strowane we wszystkich fazach czynności serca. Spośród
zarejestrowanych faz czynności serca, wybierany jest obraz
końcoworozkurczowy oraz końcowoskurczowy. Na obra-
zach tych we wszystkich przekrojach zaznaczany jest zarys
wsierdzia i nasierdzia oraz punkty referencyjne wyznaczają-
ce połączenie lewej i prawej komory oraz poziom segmen-
tów podstawnych w rozkurczu i skurczu (
ryc. 2
). Podobne
opracowanie dotyczy prawej komory serca. Po wyznaczeniu
konturów otrzymujemy automatycznie wyliczone ilościowe
parametry takie jak: objętość końcoworozkurczowa EDV (ml),
objętość końcowoskurczowa ESV (ml), objętość wyrzutowa
SV (ml), frakcja wyrzutowa EF (%), masa mięśnia (g), indek-
sy wszystkich powyższych parametrów w przeliczeniu na
RYCINA 1.
Przykłady obrazowania serca w rezonansie magnetycznym: a – obrysy
konturów wsierdzia i nasierdzia do oceny funkcji serca w CMR; b – obraz
zastawki aortalnej; c – ocena drogi odpływu lewej komory (LVOT)
metodą „cineMR”; d – Obraz drogi odpływu prawej komory (RVOT)
w angio CMR. Obrazy pochodzą z Pracowni Rezonansu Magnetycznego
Instytutu Kardiologii w Warszawie
FIGURE 1.
Examples of heart visualization with magnetic resonance: a – endo- and
epicardia contours used for functional assessment in CMR; b – aortic
valve view; c – left ventricular outflow tract (LVOT) assessment with
means of cineMR; d – right ventricular outflow tract (RVOT) view in
angio CMR. All pictures come from the CMR Unit of the Institute of
Cardiology in Warsaw.
RYCINA 2.
Program MASS Medis (Leiden, Holandia) do ilościowej analizy param-
etrów funkcji serca jest rutynowo używany w Pracowni Rezonansu
Magnetycznego Instytutu Kardiologii w Warszawie
FIGURE 2.
MASS Medis (Leiden, The Nedherlands) software routinely used for the
quantitative assessment of the heart function in the CMR Unit of the
Institute of Cardiology in Warsaw

45
Pol. Przegl. Kardiol., 2009, 11, 1, 43-47
Miśko J., Małek Ł.A., Śpiewak M.
Rezonans serca w praktyce
powierzchnię masy ciała, a także grubość mięśnia w każ-
dym segmencie (mm), skurczowy przyrost grubości mięśnia
w segmencie (%) oraz ruchomość mięśnia w segmencie
(mm)
Ocena martwicy i żywotności mięśnia serca – „what is alive
and what is dead”
Odpowiedz na pytanie o przydatność CMR jest prosta
w odniesieniu do oceny żywotności mięśnia serca. CMR
pozwala na określenie obecności, lokalizacji i rozległości
martwicy mięśnia serca z najwyższą rozdzielczością prze-
strzenną spośród dostępnych in vivo metod – CMR pozwa-
la na identyfikację martwicy o masie 0,16 g oraz progno-
zuje poprawę funkcji mięśnia serca po rewaskularyzacji
(2). Wytyczne amerykańskie z 2006 roku bardzo wysoko
oceniły przydatność badania CMR z kontrastem w ocenie
żywotności mięśnia przed rewaskularyzacją (9 pkt. w skali
9-punktowej) oraz lokalizacji i rozległości martwicy (7 pkt.
w skali 9-punktowej) (4).
Mechanizm obrazowania martwicy w CMR
Późne wzmocnienie po kontraście, czyli delayed enhan-
cement, jest techniką pozwalającą ocenić integralność
błony komórkowej miocytów. Kontrast stosowany w CMR
gadolin, połączony z nośnikiem chemicznym jest znacz-
nikiem wewnątrznaczyniowym dyfundującym do prze-
strzeni zewnątrzkomórkowej. Nie wnika on do przestrzeni
wewnątrzkomórkowej, o ile błona komórkowa nie uległa
uszkodzeniu, nie podlega także mechanizmom aktywnego
transportu. Przestrzeń dostępności pozakomórkowej kontra-
stu w zdrowym mięśniu serca wynosi ok. 15-20% objętości
mięśnia. Do komórki mięśnia serca kontrast wnika jedynie
w sytuacji uszkodzenia integralności błony komórkowej. Gdy
uszkodzeniu ulegają błony komórkowe i bariera dostępu do
przestrzeni wewnątrzkomórkowej przestaje istnieć, wtedy
dochodzi do zwiększenia przestrzeni dostępności kontrastu
do 75-80% objętości mięśnia (5). To zjawisko leży u pod-
staw obrazowania ostrej martwicy mięśnia serca w CMR.
Przy martwicy przewlekłej zwiększa się objętość przestrze-
ni pozakomórkowej w porównaniu z objętością włókien
kolagenowych, co również powoduje zaleganie kontrastu
w miejscu blizny. Gromadzenie gadolinu w obszarze ostrej
lub przewlekłej martwicy i opóźnienie jego wypłukiwania,
w porównaniu do zdrowego mięśnia, pozwala zróżnicować
prawidłowy i uszkodzony mięsień serca (
ryc. 3
).
Jak oceniamy żywotność w CMR
Im większą śródścienną rozległość martwicy/zalegania
kontrastu posiada dany obszar tym, mniejsza jest podna-
sierdziowa warstwa żywotnego mięśnia i tym mniejsze jest
prawdopodobieństwo poprawy funkcji tego obszaru po
rewaskularyzacji. CMR jest metodą, w której wielkość obsza-
ru martwicy, wyrażona jako odsetek grubości ściany lewej
komory, determinuje prawdopodobieństwo poprawy kurcz-
liwości po rewaskularyzacji w obszarze dysfunkcyjnym: brak
martwicy lub śródścienna rozległość martwicy poniżej 25%
grubości ściany – to wysokie prawdopodobieństwo poprawy
funkcji (>60%), rozległość martwicy 25-50% – to prawdo-
podobieństwo ok. 40-50%, natomiast śródścienna rozległość
martwicy, powyżej 50% grubości ściany, zmniejsza szanse na
pozytywny wynik zabiegu (prawdopodobieństwo poprawy
funkcji <20%) (6). W ocenie CMR, w odróżnieniu do SPECT
czy PET, mniejsze znaczenie ma ilość mięśnia żywotnego,
czyli „how much is alive” ważna jest natomiast proporcja
mięśnia martwego i żywego w danym segmencie – nawet
cienka 3-4 mm warstwa mięśnia żywego jest w stanie wyge-
nerować poprawę funkcji po rewaskularyzacji, jeśli grubość
warstwy martwicy jest mniejsza niż warstwy żywego mię-
śnia. Istnieje natomiast mała szansa na poprawę funkcji, jeśli
warstwie żywotnego mięśnia o grubości 5-6 mm towarzyszy
martwica >6 mm grubości (7).
Dla potrzeb klinicznych żywotność CMR ocenia się
w 17 segmentach mięśnia lewej komory zgodnie z podzia-
łem AHA (8). W każdym segmencie ocenia się rozległość
martwicy w skali 0-4:
0 – brak martwicy,
1 – martwica o rozległości 1-25%,
2 – martwica o rozległości 26-50%,
3 – martwica o rozległości 51-75%,
4 – martwica o rozległości 76-100%.
W przypadku obecności segmentów dysfunkcyjnych
z rozległością martwicy 0-50%, prawdopodobieństwo popra-
wy funkcji po rewaskularyzacji jest wysokie i nie ma koniecz-
ności wykonywania dodatkowych badań przed zabiegiem.
U pacjentów z rozległością martwicy w przedziale 50-75%,
prawdopodobieństwo poprawy funkcji spada poniżej 20%.
Aby wyłonić z tej grupy pacjentów, u których może wystą-
pić poprawa funkcji mięśnia po rewaskularyzacji, można
wykonać badanie CMR z niską dawką dobutaminy. Na razie
bez odpowiedzi jest pytanie, czy pacjenci z żywotnym mię-
śniem w obszarze dysfunkcji, nie odnoszą innych, niż popra-
wa funkcji, korzyści po rewaskularyzacji, czyli np. prewencji
remodelingu lewej komory, prewencji epizodów niedokrwie-
nia czy arytmii.
W chwili obecnej dostępność metody CMR i koszt bada-
nia mogą ograniczać jego zastosowanie w diagnostyce
żywotności mięśnia serca przed rewaskularyzacją. W Polsce
pracuje około 20 skanerów MR, na których można wykonać
to badanie. Niektóre skanery mają możliwość wykonania
badania serca, jednak najczęściej brak jest zainstalowa-
nych dedykowanych programów, przeszkolonego persone-
lu i możliwości czasowych. Do wykonywania badań CMR
serca nie zachęca również obecny poziom finansowania
przez NFZ.
Bez jednoznacznej odpowiedzi pozostają nadal nastę-
pujące pytanie pytania, a dotyczące obrazowania w CMR
martwicy i zwłóknienia mięśnia serca w, kardiomiopatiach,
chorobach spichrzeniowych oraz w zapaleniu mięśnia ser-
cowego: Czy ocena ilościowa masy lub objętości martwi-
cy lub zwłóknienia w mięśniu serca pozwoli na określenie
grup wysokiego ryzyka? Czy wynik CMR może wskazywać
na konieczność wszczepienia kardiowertera-defibrylatora
(ICD)? Odpowiedź na te i inne pytania może zostać udzie-
lona dopiero po wieloośrodkowych, prospektywnych bada-
niach, które prawdopodobnie zaczną się w przyszłym roku,
gdyż przed ich rozpoczęciem konieczna jest standaryzacja
RYCINA 3.
Obraz późnego wzmocnienia pokontrastowego (delayed enhance-
ment): a – projekcja w osi krótkiej; b – projekcja dwujamowa. Strzałki
pokazują lokalizację późnego wzmocnienia
FIGURE 3.
Delayed enhancement after contrast injection: a – short axis view; b
– 2-chamber view. Arrows demonstrate sites of delayed enhancement
46
Pol. Przegl. Kardiol., 2009, 11, 1, 43-47
Miśko J., Małek Ł.A., Śpiewak M.
CMR in practise
protokołów badania CMR oraz stworzenie elektronicznych
baz danych. Aktualnie dostępne są dane wskazujące na
większą częstość występowania zaburzeń rytmu u pacjen-
tów z obecnością ognisk późnego wzmocnienia kontra-
stowego. Brak jest jednak badań wskazujących korzyści
z interwencji podjętej w oparciu o wynik CMR. Jest bardzo
prawdopodobne, że obecność i nasilenie późnego kon-
trastowania w mięśniu serca determinuje poziom ryzyka
powikłań danej choroby i być może w przyszłości w wielu
chorobach będziemy mieli do czynienia z LGE-guided the-
rapy (późne wzmocnienie po kontraście – late gadolinium
enhancement – LGE).
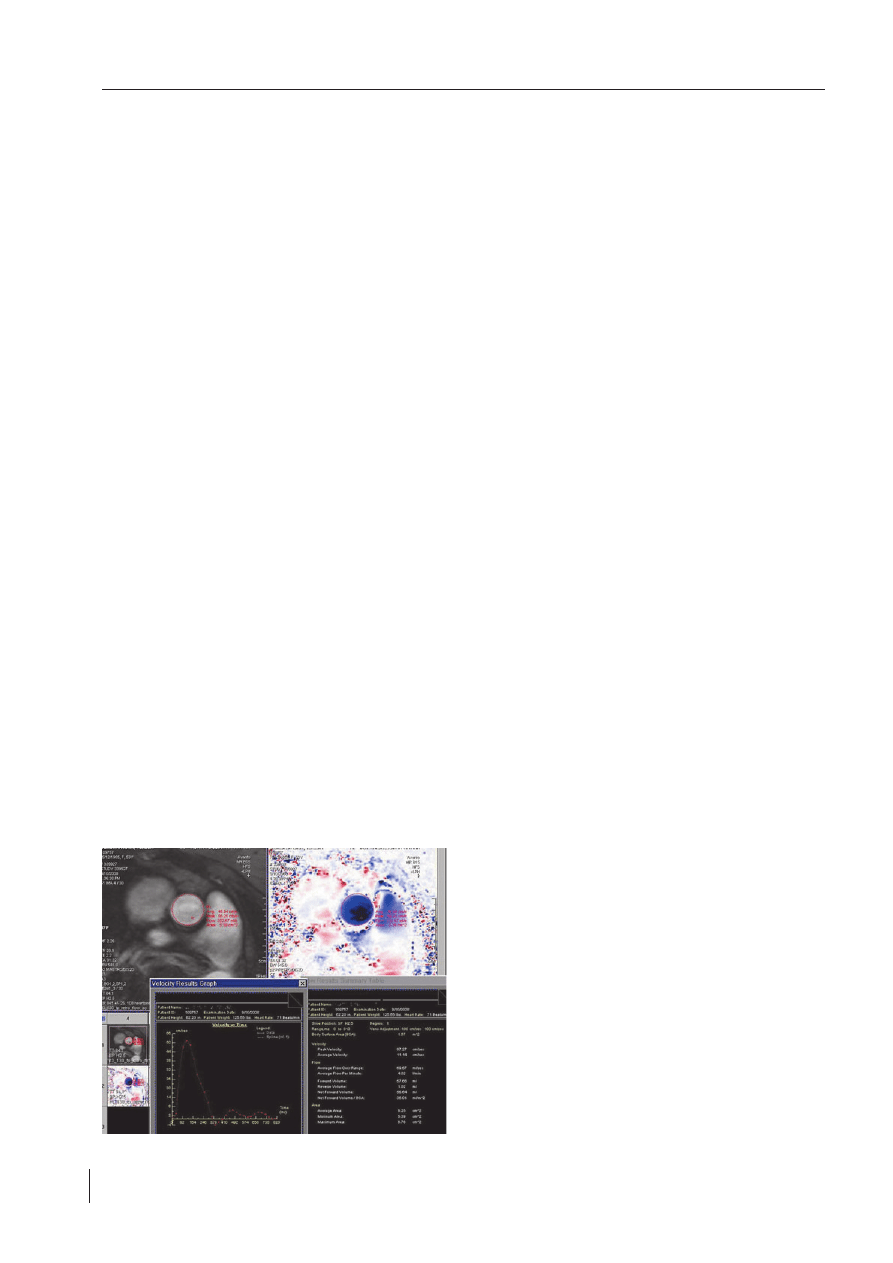
Ocena wad zastawkowych
Ocena wad zastawkowych jest wykonywana w CMR
przy zastosowaniu phase contrast MR i umożliwia analizę
przepływów i gradientów. W sekwencji tej powstają 2 obra-
zy. Pierwszy obraz jest morfologiczny, zbliżony do cineMR
– mniej dokładny pod względem rozdzielczości przestrzen-
nej, ale bardziej czuły na przepływ krwi sekwencji gradient
echo (określany jako magnitude) i służy do dwuwymiaro-
wej orientacji ustawienia płaszczyzny rejestracji. Drugi – to
obraz jednowymiarowy, fazowy, w którym intensywność
sygnału MR odpowiada prędkości krwi w płaszczyźnie prze-
kroju (nieruchome struktury mają sygnał zbliżony do zera)
(
ryc. 4
).
Przy zastosowaniu programu komputerowego obryso-
wujemy pole powierzchni naczynia, w którym oceniamy
przepływ. Program komputerowy wylicza przepływ systemo-
wy – Q
s
(pole pomiaru powinniśmy wstawić w aortę nieco
powyżej opuszki) oraz przepływ płucny – Q
p
(pole pomiaru
powinno być umiejscowione w pniu płucnym między pozio-
mem zastawki płucnej a podziałem na tętnice płucne) oraz
ich stosunek. Metodą phase contrast możemy oznaczać wiel-
kość i prędkość przepływu krwi w jamach serca na różnych
poziomach, w zależności od ustawienia płaszczyzny pomia-
ru. Należy jednak pamiętać, że przy turbulentnym przepły-
wie krwi metoda ta obarczona jest dużym błędem. Przy jej
właściwym zastosowaniu (tzn. pomiarze w prawidłowym
miejscu), można oceniać prędkość maksymalną i gradient
przez miejsce zwężenia, a także nieprawidłowe napełnianie
lewej i prawej komory (falę E/A).
W celu pełnej oceny wady zastawkowej, konieczne są
także dane z badania cineMR, które pozwalają na pomiar
ERO (effective regurgitant orfice) i vena contracta przy ana-
lizie stopnia nasilenia wady serca, jeżeli wykonamy reje-
strację w płaszczyźnie zastawki oraz na ocenę ruchu pier-
ścienia zastawki trójdzielnej i mitralnej, przy ocenie funkcji
rozkurczowej jeśli rejestracja jest wykonana w płaszczyźnie
4-jamowej.
Warto zaznaczyć, że do pełnej i wiarygodnej oceny
zarówno funkcji jak i wad zastawkowych, należy porównać
dane z badania cineMR oraz phase contrast MR. Obie meto-
dy uzupełniają się przy ocenie funkcji serca i istotności wad
zastawkowych a uzyskane przy ich zastosowaniu ilościowe
parametry powinny być spójne, tzn. gdy nie ma wady prze-
ciekowej i gdy nie ma wady zastawki mitralnej, objętość
wyrzutowa lewej komory powinna być równa przepływowi
w aorcie wstępującej (pomniejszonemu o przepływ wieńco-
wy), natomiast gdy nie ma wady zastawki trójdzielnej, rzut
prawej komory powinien być równy wielkości przepływu
w pniu płucnym. W chwili obecnej metoda phase contrast
MR jest stosowana głównie do ilościowej oceny niedo-
mykalności zastawek serca, natomiast w ilościowej ocenie
zwężenia – metodą z wyboru pozostaje echokardiografia
(2, 3)
Podsumowanie
Na obecnym etapie rozwoju, poza wyjątkami w posta-
ci oceny żywotności mięśnia i martwicy, oceny przed-
i pooperacyjnej dorosłych pacjentów z wrodzonymi wadami
serca, weryfikacji niektórych postaci kardiomiopatii (AKPK,
kardiomiopatii przerostowej koniuszka) oraz guzów serca,
w przypadku większości wytycznych CMR, określane jest
jako metoda dodatkowa, stosowana w celu potwierdzenia
lub uzupełnienia innych badań obrazowych (2). Wynika to
m.in. z faktu, że obrazowanie CMR rozwija się tak szyb-
ko, że trudno jest zastosować metody walidacyjne, które
wymagają dużych nakładów finansowych i długiego czasu
obserwacji (9).
Metodami, które potwierdziły wysoką precyzję standar-
dowej oceny funkcji serca w CMR, są metody autopsyjne
oceny masy lewej i prawej komory oraz bardzo precyzyjne,
trójwymiarowe rejestracje funkcji serca przy zastosowaniu
trójwymiarowych protokołów akwizycyjnych u zdrowych
ochotników (10, 11). Dodatkowe znaczenie ma uzyskana
zgodność przepływu w aorcie i w pniu płucnym w ocenie
phase contrast MR z wynikami objętości wyrzutowej lewej
i prawej komory uzyskanymi w cineMR u zdrowych ochot-
ników, którzy nie mieli niedomykalności mitralnej czy trój-
dzielnej (12).
Piśmiennictwo
1. The Task Force for the Diagnosis and Treatment of Acute and Chronic Heart Failure
2008 of the European Society of Cardiology. Developed in collaboration with the
Heart Failure Association of the ESC (HFA) and endorsed by the European Society of
Intensive Care Medicine (ESICM). ESC Guidelines for the diagnosis and treatment of
acute and chronic heart failure 2008. Eur J Heart Fail. 2008;10:933 -989.
2. Pennell DJ, Sechtem UP, Higgins CB, i wsp. Clinical indications for cardiovascular mag-
netic resonance (CMR): Consensus Panel report. Eur Heart J. 2004;25:1940 -1965.
3. Schwitter J ed. CMR Update. Switzerland: Kueng Druck AG; 2008.
4. A report of the American College of Cardiology Foundation Quality Strategic
Directions Committee Appropriateness Criteria Working Group. ACCF/ACR/SCCT/
SCMR/ASNC/NASCI/SCAI/SIR 2006 Appropriateness Criteria for Cardiac Computed
Tomography and Cardiac Magnetic Resonance Imaging. J Am Coll Cardiol.
2006;48:1475 -1497.
5. Rehwald WG, Fieno DS, Chen EL, i wsp. Myocardial magnetic resonance imaging con-
trast agent concentrations after reversible and irreversible ischemic injury. Circulation.
2002;105:224 -229.
RYCINA 4.
Ocena ilościowa ocena przepływu w aorcie wstępującej metodą phase
contrast
FIGURE 4.
Quantitative flow assessment in the ascending aorta using phase con-
trast approach

47
Pol. Przegl. Kardiol., 2009, 11, 1, 43-47
Miśko J., Małek Ł.A., Śpiewak M.
Rezonans serca w praktyce
6. Kim RJ, Wu E, Rafael A, i wsp. The use of contrast -enhanced magnetic resonance imag-
ing to identify reversible myocardial dysfunction. N Engl J Med. 2000;343:1445 -53.
7. Kim RJ, Shah DJ. Fundamental concepts in myocardial viability assessment revisited:
when knowing how much is “alive” is not enough. Heart. 2004;90:137 -140.
8. Cerqueira MD, Weissman NJ, Dilsizian V, i wsp. Standardized myocardial segmentation
and nomenclature for tomographic imaging of the heart: a statement for healthcare
professionals from the Cardiac Imaging Committee of the Council on Clinical Cardiology
of the American Heart Association. Circulation. 2002;105:539 -542.
9. Fuster V, Kim RJ. Frontiers in cardiovascular magnetic resonance. Circulation.
2005;112:135 -144.
10. Katz J, Millikem MC, Stray -Gunderson J, i wsp. Estimation of human myocardial mass
with MR imaging. Radiology. 1988;169:495 -498.
11. Helbing WA, Rebergen SA, Maliepaard C, i wsp. Quantification of right ventricular
function with magnetic resonance imaging in children with normal hearts and with
congenital heart disease. Am Heart J. 1995;130:828 -837.
12. Kondo C, Caputo GR, Semelka R, i wsp. Right and left ventricular stroke volume mea-
surements with velocity encoded cine MR imaging: In vitro and in vivo validation. Am J
Roentgenol 1991;157:9-16.
Praca wpłynęła do Redakcji: 2008-11-07. Zaakceptowano do druku: 2008-11-19.
Konflikt interesów: nie zgłoszono
Wyszukiwarka
Podobne podstrony:
43 5 id 38667 Nieznany
PINOP 43 id 358324 Nieznany
2008 2009 wojewodzki id 245053 Nieznany (2)
II 43 id 209770 Nieznany
2008 2009 szkolny id 245052 Nieznany (2)
bik 02 2009 04 id 85660 Nieznany
Annales 64(3) 2009 rozylo id 65 Nieznany
34 43 id 35890 Nieznany (2)
41 42 43 id 38542 Nieznany (2)
poradnik 2009 tk id 375931 Nieznany
klasa5 2009 pretest id 235710 Nieznany
EGZ niest I 2009 poprawka id 15 Nieznany
43 id 38658 Nieznany
43 3 id 38664 Nieznany (2)
2008 2009 rejon id 245051 Nieznany (2)
więcej podobnych podstron