Pobrano ze strony www.sqlmedia.pl
Pobrano ze strony www.sqlmedia.pl
Wpisuje zdaj!cy przed rozpocz"ciem pracy
P E S E L Z D A J ! C E G O
Miejsce na nalepk"
z kodem szko#y
PRÓBNY EGZAMIN MATURALNY
Z CHEMII
Arkusz I
Czas pracy 120 minut
Instrukcja dla zdaj"cego
1. Prosz" sprawdzi$, czy arkusz egzaminacyjny zawiera 12 stron. Ewentualny brak nale%y zg#osi$
przewodnicz!cemu zespo#u nadzoruj!cego egzamin.
2. Do arkusza do#!czone s! tablice chemiczne (3 strony).
3. Prosz" uwa%nie czyta$ wszystkie polecenia i informacje do zada&.
4. Rozwi!zania i odpowiedzi nale%y zapisa$ czytelnie w miejscu na to przeznaczonym przy ka%dym
zadaniu.
5. W rozwi!zaniach zada& rachunkowych trzeba przedstawi$ tok rozumowania prowadz!cy do
ostatecznego wyniku oraz pami"ta$ o jednostkach.
6. W trakcie oblicze& mo%na korzysta$ z kalkulatora.
7. Prosz" pisa$ tylko w kolorze niebieskim lub czarnym; nie pisa$ o#ówkiem.
8. Nie wolno u%ywa$ korektora.
9. B#"dne zapisy trzeba wyra'nie przekre(li$.
10. Brudnopis nie b"dzie oceniany.
11. Obok ka%dego zadania podana jest maksymalna liczba punktów, któr! mo%na uzyska$ za jego
poprawne rozwi!zanie.
!yczymy powodzenia!
Wpisuje egzaminator / nauczyciel sprawdzaj!cy prac"
Nr. zadania
1.
2.
3.
4.
5.
6.
7.
8.
9.
10.
11.
12.
13.
14.
15. 16. 17. 18.
19.
20.
Maksymalna
liczba punktów
1
2
3
3
1
2
1
3
1
1
3
2
3
1
1
1
3
2
2
2
Uzyskana
liczba punktów
Nr. zadania
21. 22. 23. 24. 25. 26. 27.
28.
29.
30.
SUMA
Maksymalna
liczba punktów
2
3
1
3
3
3
2
3
1
1
60
Uzyskana
liczba punktów
Pobrano ze strony www.sqlmedia.pl
Strona 2 z 12
Zadanie 1. (1 pkt)
Który zapis przedstawia poprawnie konfiguracj# elektronow" jonu glinu Al
3+
?
A. K
2
L
8
B. K
2
L
8
M
3
C. K
2
L
8
M
6
D. K
2
L
8
M
8
Zadanie 2. (2 pkt)
Uzupe$nij zapis, podaj"c liczb# masow" i atomow" produktu przemiany oraz jego symbol
chemiczny.
228
90
Th ) ................. + *
Zadanie 3. (3 pkt)
Tlenek pewnego jednowarto(ciowego metalu po wprowadzeniu do wody tworzy wodorotlenek
o masie cz!steczkowej 56 u.
Ustal, jaki to metal (podaj jego symbol chemiczny i nazw#). Jaki stan skupienia ma ten
tlenek?
Obliczenia: .............................................................................................................................................
................................................................................................................................................................
................................................................................................................................................................
................................................................................................................................................................
................................................................................................................................................................
Stan skupienia tlenku: ...........................................................................................................................
Zadanie 4. (3 pkt)
Po$"cz w pary substancje z kolumny I z charakterystycznymi dla nich wi"zaniami
chemicznymi z kolumny II.
I.
II.
Odpowiedzi
1. tlenek sodu a) wi!zanie atomowe spolaryzowane
1.
2. chlorowodór b) wi!zanie atomowe niespolaryzowane
2.
3. azot
c) wi!zanie jonowe
3.
4. amoniak
4.
Pobrano ze strony www.sqlmedia.pl
Strona 3 z 12
Informacja do zada% 5. i 6.
Poni%sza tabela przedstawia temperatury topnienia i wrzenia wybranych kwasów karboksylowych.
Nazwa kwasu
Wzór sumaryczny
Temperatura
topnienia [ºC]
Temperatura
wrzenia [ºC]
Kwas octowy
CH
3
COOH
16,6
117,9
Kwas stearynowy
C
17
H
35
COOH
69,3
360 rozk!ada si"
Kwas oleinowy (cis) C
17
H
33
COOH
16,2
360,0
Na podstawie: Witold Mizerski, Tablice chemiczne, Warszawa 1997
Zadanie 5. (1 pkt)
Na podstawie tabeli okre&l stan skupienia ka'dego z tych kwasów w temperaturze 25ºC.
................................................................................................................................................................
................................................................................................................................................................
................................................................................................................................................................
................................................................................................................................................................
Zadanie 6. (2 pkt)
Porównuj"c budow# cz"steczek, wyja&nij krótko przyczyn# ró'nic stanów skupienia
1. kwasu octowego i stearynowego,
2. kwasu stearynowego i oleinowego.
................................................................................................................................................................
................................................................................................................................................................
................................................................................................................................................................
................................................................................................................................................................
................................................................................................................................................................
Zadanie 7. (1 pkt)
Wska' b$#dn" interpretacj# równania C
(s)
+ CO
2(g)
( 2CO
(g)
.
A. 1 mol w"gla + 1 mol tlenku w"gla(IV) ) 2 mole tlenku w"gla(II)
B. 1 atom w"gla + 1 cz!steczka tlenku w"gla(IV) ) 2 cz!steczki tlenku w"gla(II)
C. 22,4 dm
3
w"gla + 22,4 dm
3
tlenku w"gla(IV) ) 44,8 dm
3
tlenku w"gla(II)
D. 12 g w"gla + 44 g tlenku w"gla(IV) ) 56 g tlenku w"gla(II)
Pobrano ze strony www.sqlmedia.pl
Strona 4 z 12
Zadanie 8. (3 pkt)
Ile atomów azotu znajduje si# w 6,72 dm
3
tlenku azotu(III) w warunkach normalnych?
Rozwi!zanie: .........................................................................................................................................
................................................................................................................................................................
................................................................................................................................................................
................................................................................................................................................................
Odpowied': ...........................................................................................................................................
Zadanie 9. (1 pkt)
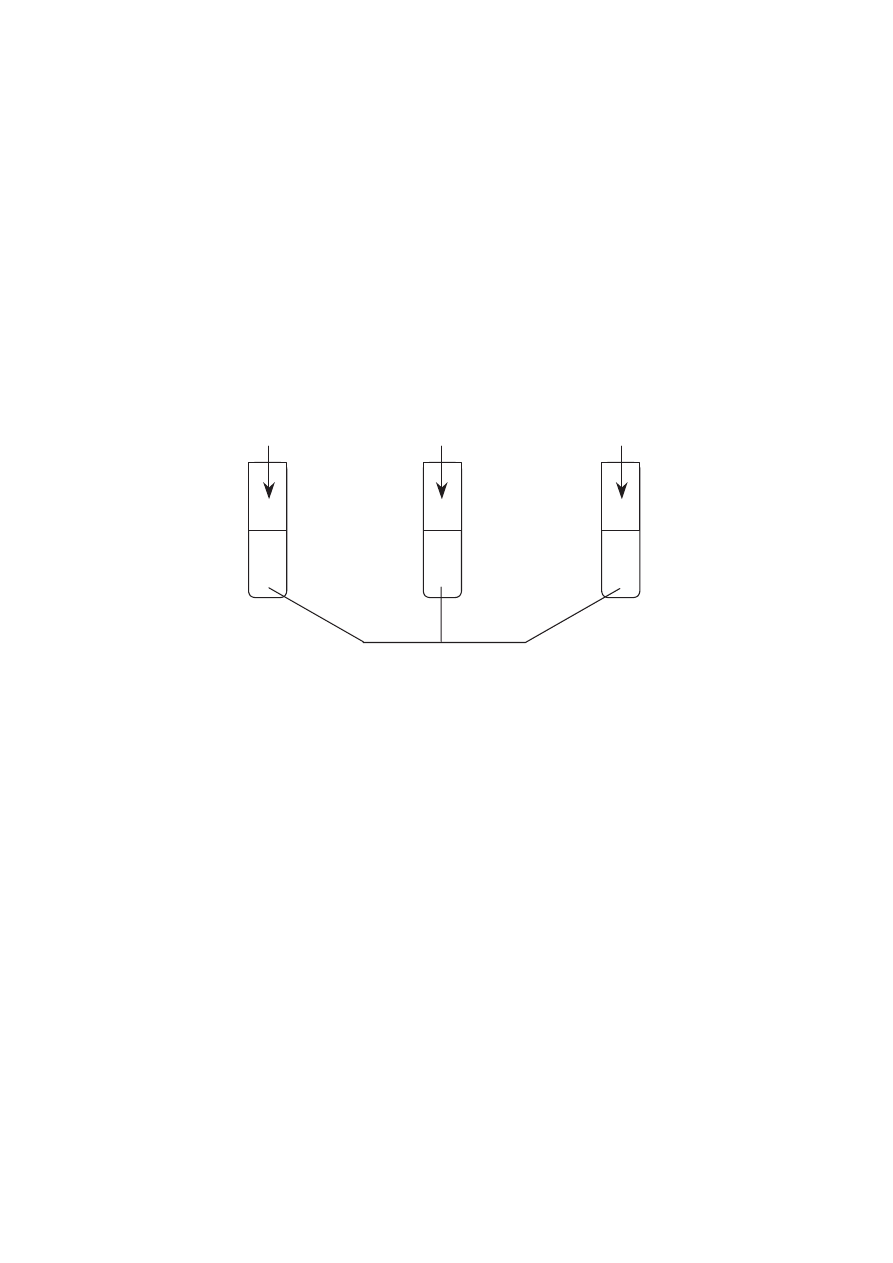
Wykonano nast"puj!ce do(wiadczenie:
!
0,5 g opi!ków Mg
0,5 g wst#$ki Mg
0,5 g opi!ków Mg
100 cm
3
0,5-molowego kwasu solnego
I.
II.
III.
W której probówce reakcja przebieg$a najszybciej?
A. We wszystkich naczyniach reakcja przebieg#a z jednakow! szybko(ci!.
B. Reakcja przebieg#a najszybciej w naczyniu I.
C. Reakcja przebieg#a najszybciej w naczyniu II.
D. Reakcja przebieg#a najszybciej w naczyniu III.
Zadanie 10. (1 pkt)
W którym z podanych zwi"zków azot ma najni'szy stopie% utleniania?
A. NO
B. HNO
3
C. NH
3
D. N
2
O
3
Pobrano ze strony www.sqlmedia.pl

Strona 5 z 12
Informacja do zada% 11. i 12.
Mied' reaguje mi"dzy innymi z rozcie&czonym roztworem kwasu azotowego(V). Powstaje wtedy
azotan(V) miedzi(II) oraz woda. Równania po#ówkowe tej reakcji przedstawia poni%szy schemat
(symbole x i y oznaczaj! w nim liczb" oddanych lub przy#!czonych elektronów):
Cu – xe ) Cu
2+
NO
3
–
+ ye + 4H
+
) NO + 2H
2
O
Zadanie 11. (3 pkt)
Oblicz warto&ci x i y, a nast#pnie napisz – w formie cz"steczkowej - ca$kowite równanie
reakcji miedzi z rozcie%czonym roztworem kwasu azotowego(V).
Obliczenia: ............................................................................................................................................
................................................................................................................................................................
................................................................................................................................................................
................................................................................................................................................................
Równanie reakcji:
................................................................................................................................................................
Zadanie 12. (2 pkt)
Wska' utleniacz i reduktor w tej reakcji.
Utleniacz: ..............................................................................................................................................
Reduktor: ...............................................................................................................................................
Zadanie 13. (3 pkt)
Z 200 cm
3
0,3-molowego roztworu soli odparowano 80 cm
3
wody.
Oblicz st#'enie molowe otrzymanego roztworu.
Rozwi!zanie: .........................................................................................................................................
................................................................................................................................................................
................................................................................................................................................................
................................................................................................................................................................
................................................................................................................................................................
................................................................................................................................................................
Odpowied': ...........................................................................................................................................
Pobrano ze strony www.sqlmedia.pl
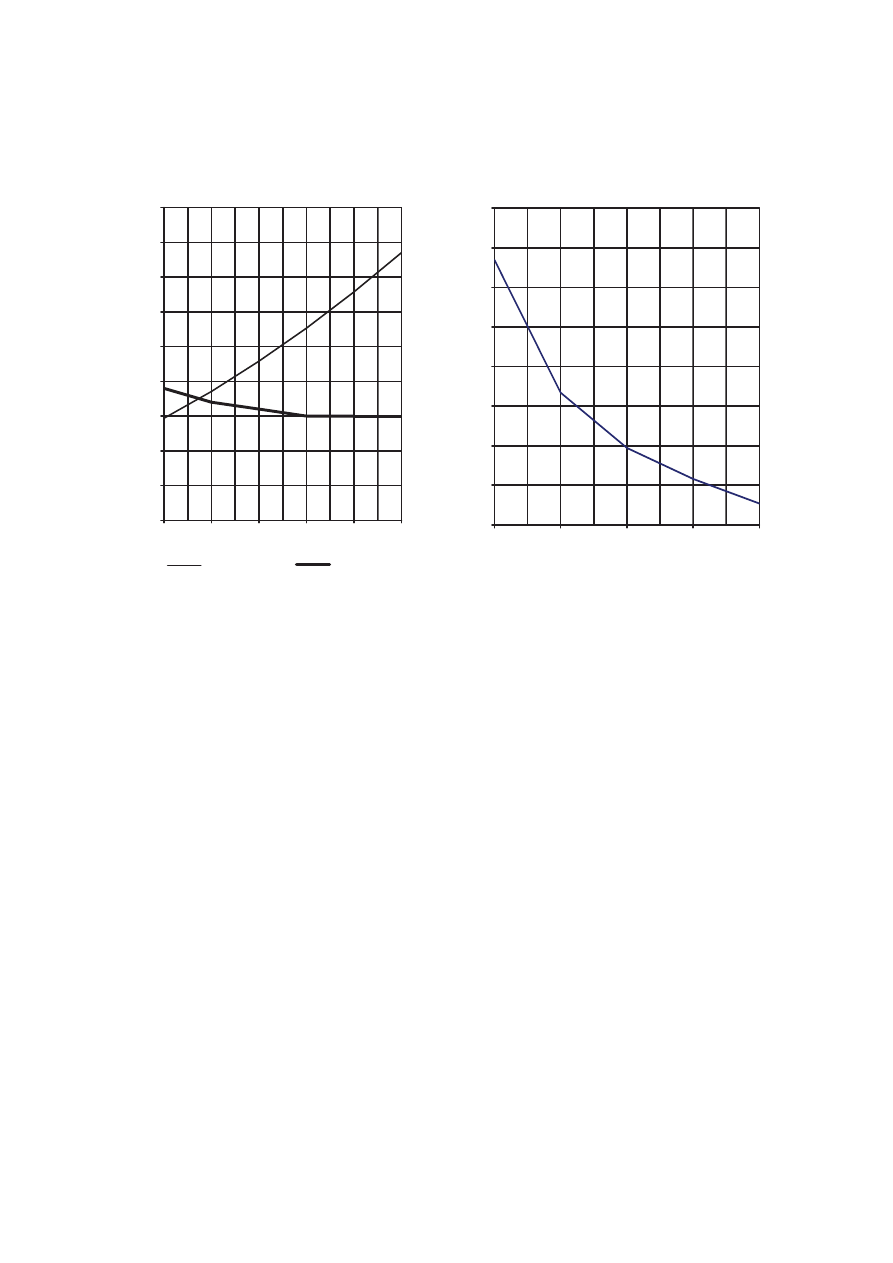
Strona 6 z 12
Informacja do zda% 14., 15. i 16.
Poni%ej przedstawiono dwa wykresy rozpuszczalno(ci: chlorku amonu i octanu wapnia (wykres I)
oraz dwutlenku w"gla (wykres II).
Wykres I
Rozpuszczalno%& NH
4
Cl i (CH
3
COO)
2
Ca
Wykres II
Rozpuszczalno%& CO
2
Zadanie 14. (1 pkt)
Na podstawie powy'szych wykresów mo'na stwierdzi), 'e w zakresie temperatur 20ºC - 50ºC
rozpuszczalno&) substancji zmienia si# w nast#puj"cy sposób:
Rozpuszczalno($
octanu wapnia
dwutlenku w"gla
chlorku amonu
A. ro(nie
ro(nie
maleje
B. nie zmienia si"
ro(nie
maleje
C. maleje
maleje
ro(nie
D. ro(nie
maleje
ro(nie
Zadanie 15. (1 pkt)
Oszacuj temperatur#, w której rozpuszczalno&ci chlorku amonu i octanu wapnia s"
jednakowe.
................................................................................................................................................................
................................................................................................................................................................
0 ,0
1 0 ,0
2 0 ,0
3 0 ,0
4 0 ,0
5 0 ,0
6 0 ,0
7 0 ,0
8 0 ,0
9 0 ,0
0
2 0
4 0
6 0
8 0
1 0 0
te m p e ra tu ra w s to p n ia c h C e ls ju s z a
ro
z
p
u
s
z
c
z
a
ln
o
%
&
w
g
/1
0
0
g
w
o
d
y
c h lo re k a m o n u
o c ta n w a p n ia
0,000
0,050
0,100
0,150
0,200
0,250
0,300
0,350
0,400
0
20
40
60
80
temperatura w stopniach Celsjusza
ro
z
p
u
s
z
c
z
a
ln
o
%
&
w
g
/1
0
0
g
w
o
d
y
Pobrano ze strony www.sqlmedia.pl
Strona 7 z 12
Zadanie 16. (1 pkt)
Spo&ród poni'szych zda% wybierz to, które nie jest prawdziwe.
A. Rozpuszczalno($ dwutlenku w"gla w temperaturach od 0ºC do 80ºC jest mniejsza
od rozpuszczalno(ci chlorku amonu i octanu wapnia.
B. W temperaturze 60ºC rozpuszczalno($ chlorku amonu jest wi"ksza od rozpuszczalno(ci octanu
wapnia i dwutlenku w"gla.
C. W temperaturze 80ºC rozpuszczalno($ octanu wapnia jest mniejsza od rozpuszczalno(ci chlorku
amonu.
D. Rozpuszczalno($ chlorku amonu w temperaturach od 0ºC do 80ºC jest równa rozpuszczalno(ci
octanu wapnia albo od niej wi"ksza.
Zadanie 17. (3 pkt)
Masz do dyspozycji potas, wod", tlenek krzemu(IV) i kwas solny.
Opisz kolejne etapy do&wiadczenia, w wyniku którego otrzymasz kwas krzemowy H
2
SiO
3
.
Pami#taj, 'e tlenek krzemu(IV) i kwas krzemowy nie rozpuszczaj" si# w wodzie.
................................................................................................................................................................
................................................................................................................................................................
................................................................................................................................................................
................................................................................................................................................................
................................................................................................................................................................
................................................................................................................................................................
................................................................................................................................................................
Zadanie 18. (2 pkt)
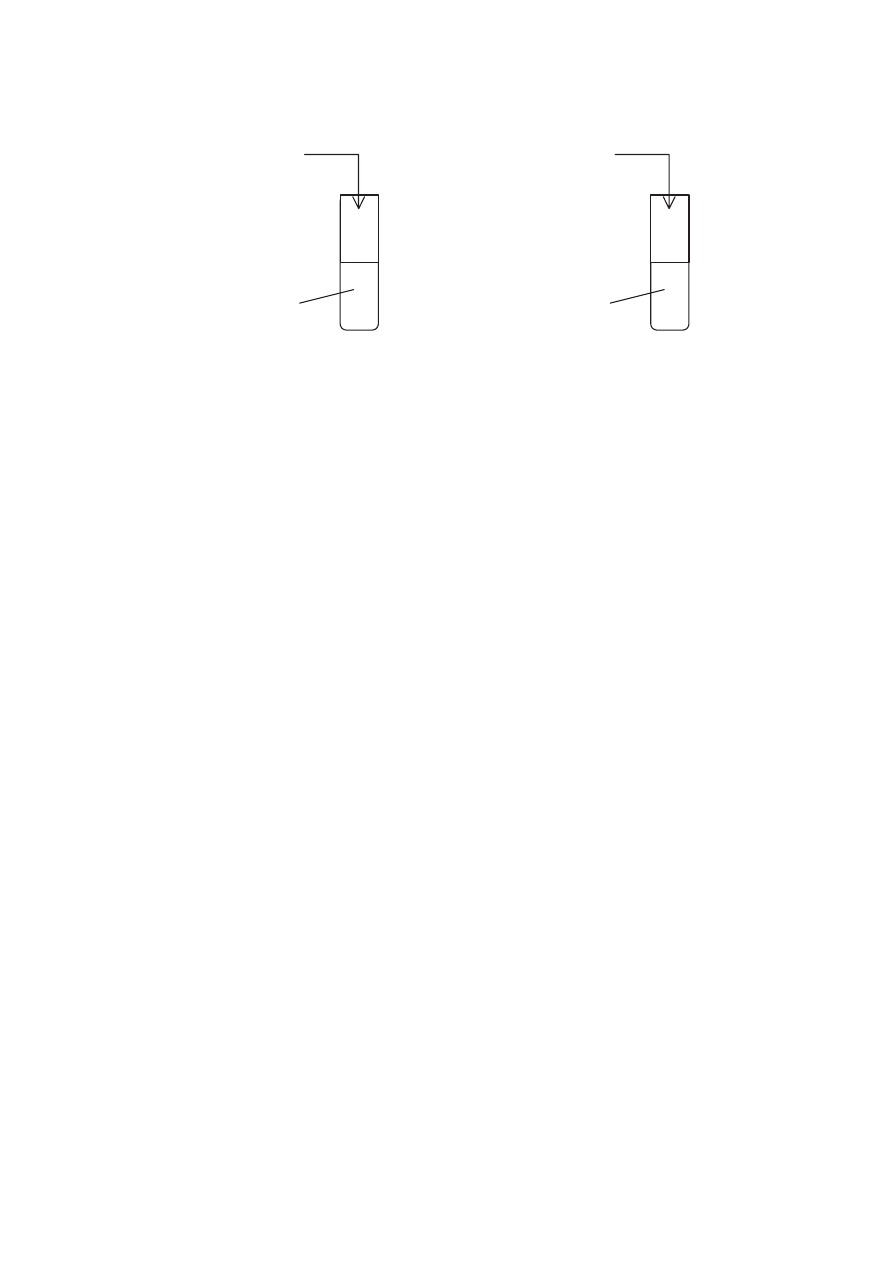
Do czterech probówek z wod! wprowadzono próbki nast"puj!cych tlenków:
Probówka I
Probówka II
Probówka III
Probówka IV
Al
2
O
3
CaO
P
4
O
10
SiO
2
Zawarto($ ka%dej probówki energicznie wstrz!(ni"to i podzielono na dwie porcje. Do pierwszej
porcji z ka%dej probówki dodano kropl" oran%u metylowego, a do drugiej – kropl" fenoloftaleiny.
W której próbce (próbkach) oran' metylowy zmieni$ zabarwienie z 'ó$tego na czerwone,
a w której (których) fenoloftaleina zabarwi$a si# na malinowo?
................................................................................................................................................................
................................................................................................................................................................
Pobrano ze strony www.sqlmedia.pl
Strona 8 z 12
Informacja do zada% 19. i 20.
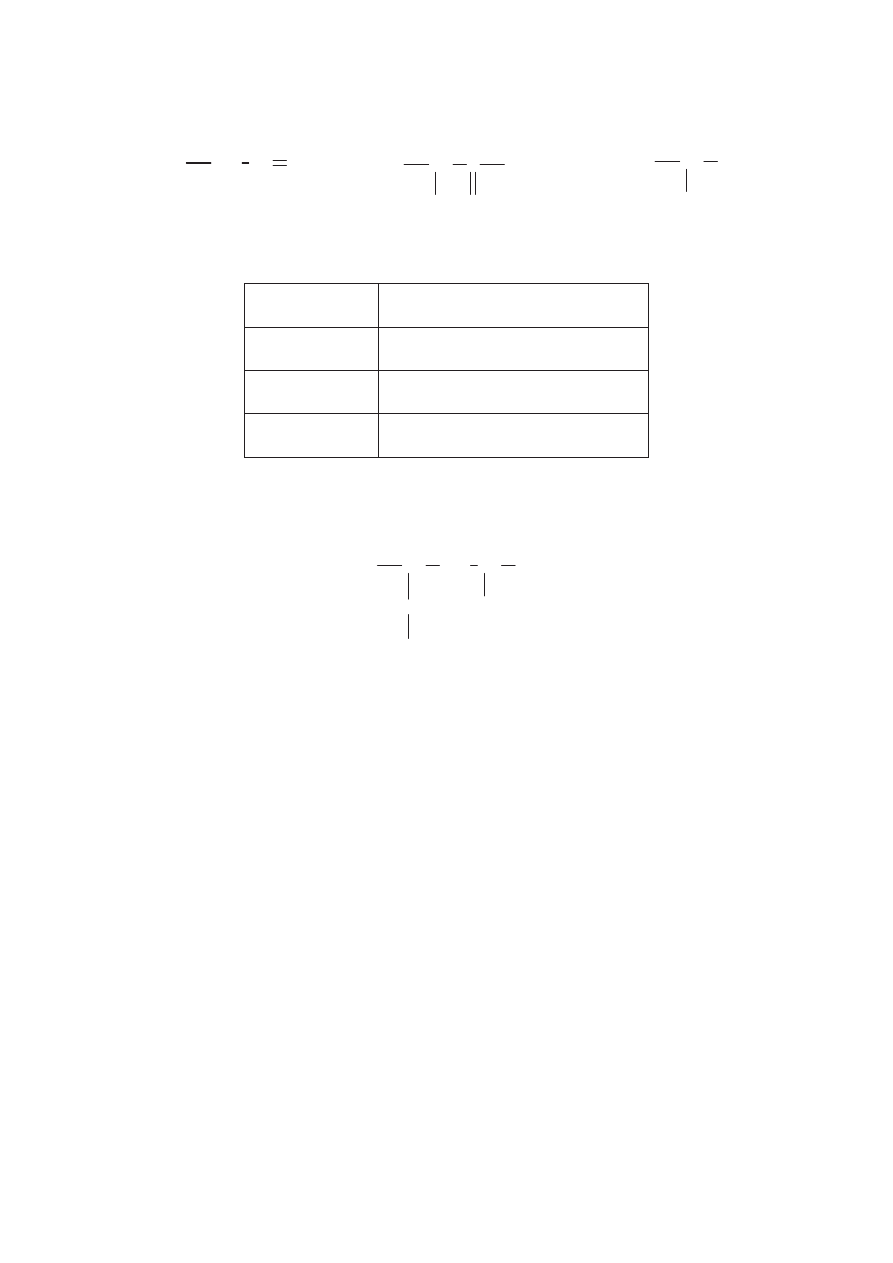
Przeprowadzono nast"puj!ce do(wiadczenie:
roztwór HCl
roztwór Na
2
CO
3
I.
roztwór K
3
PO
4
roztwór AgNO
3
II.
Zadanie 19. (2 pkt)
Zanotuj obserwacje, jakie poczyniono w czasie wykonywania do&wiadcze%.
Probówka I: ...........................................................................................................................................
................................................................................................................................................................
Probówka II: ..........................................................................................................................................
................................................................................................................................................................
Zadanie 20. (2 pkt)
Zapisz w pe$nej jonowej formie równania reakcji przebiegaj"cych w opisanym powy'ej
do&wiadczeniu.
Równanie reakcji I:
................................................................................................................................................................
Równanie reakcji II:
................................................................................................................................................................
Zadanie 21. (2 pkt)
Musisz przela$ roztwór kwasu solnego z du%ej butli do kilku mniejszych. Dysponujesz dwoma
lejkami – miedzianym i %elaznym.
Którego z nich u'yjesz, aby przela) kwas? Swój wybór krótko uzasadnij.
................................................................................................................................................................
................................................................................................................................................................
................................................................................................................................................................
Pobrano ze strony www.sqlmedia.pl
Strona 9 z 12
Zadanie 22. (3 pkt)
Poni%ej przedstawiono wzory trzech zwi!zków organicznych.
C
H
3
CH
2
CH
CH
2
1.
C
H
3
CH
C
CH
3
CH
3
O
2.
C
H
3
CH
CH
3
COOH
3.
Uzupe$nij poni'sz" tabel#, wpisuj"c do niej nazwy szeregów homologicznych, do których
nale'" zwi"zki 1. – 3.
Numer zwi#zku Nazwa szeregu homologicznego
1.
2.
3.
Zadanie 23. (1 pkt)
Wska' poprawn" nazw# w#glowodoru o wzorze:
C
H
3
CH
CH
2
CH
CH
3
CH
2
CH
3
CH
3
A. 2-etylo-4-metylopentan
B. 2-metylo-4-etylopentan
C. 2,4-dimetyloheksan
D. 3,5-dimetyloheksan
Zadanie 24. (3 pkt)
Do dwóch probówek, z których jedna zawiera#a próbk" heksanu a druga próbk" benzenu, dodano
kilka kryszta#ów bezwodnego FeBr
3
. Nast"pnie dodano do obu probówek po dwie krople bromu.
Tylko w drugiej probówce nast!pi# zanik brunatnoczerwonego zabarwienia bromu.
Okre&l, w których probówkach znajdowa$y si# poszczególne w#glowodory. Napisz równanie
reakcji, która zasz$a w drugiej probówce i okre&l, jak" rol# w tej reakcji pe$ni FeBr
3
.
Odpowied': ...........................................................................................................................................
................................................................................................................................................................
Równanie reakcji: .................................................................................................................................
Rola FeBr
3
: ............................................................................................................................................
Pobrano ze strony www.sqlmedia.pl

Strona 10 z 12
Informacja do zada% 25. i 26.
Dany jest ci!g reakcji opisany schematem:
CaC
2
A
B
C
H
2
O
H
2
HCl
1.
2.
3.
Zadanie 25. (3 pkt)
Napisz wzory sumaryczne i nazwy systematyczne substancji A, B i C.
Substancja A:
................................................................................................................................................................
Substancja B:
................................................................................................................................................................
Substancja C:
................................................................................................................................................................
Zadanie 26. (3 pkt)
Napisz równania reakcji 1., 2. i 3. z powy'szego schematu.
Równanie reakcji 1.:
................................................................................................................................................................
Równanie reakcji 2.:
................................................................................................................................................................
Równanie reakcji 3.:
................................................................................................................................................................
Zadanie 27. (2 pkt)
Wodorotlenek miedzi(II) jest odczynnikiem cz"sto stosowanym w chemii organicznej
do identyfikacji zwi!zków chemicznych. Wykonano dwie próby z u%yciem tego odczynnika:
Próba I: po dodaniu do badanej substancji wodorotlenku miedzi(II) w temperaturze pokojowej
niebieski osad tego wodorotlenku uleg# roztworzeniu (rozpu(ci# si") i powsta#a klarowna ciecz
o ciemnoniebieskiej (szafirowej) barwie.
Próba II: po dodaniu do badanej substancji wodorotlenku miedzi(II) i ogrzaniu zawarto(ci naczynia
wytr!ci# si" ceglasty osad.
Któr" z wymienionych ni'ej substancji wykryto prób" I, a któr" za pomoc" próby II:
etanol, octan propylu, propanal, gliceryna, propanon?
Prób! I wykryto .....................................................................................................................................
Prób! II wykryto ...................................................................................................................................
Pobrano ze strony www.sqlmedia.pl

Strona 11 z 12
Zadanie 28. (3 pkt)
U'ywaj"c wzorów pó$strukturalnych napisz równanie reakcji kondensacji dwóch cz"steczek
glicyny (kwasu aminoetanowego). We wzorze produktu reakcji zaznacz wi"zanie peptydowe.
................................................................................................................................................................
................................................................................................................................................................
................................................................................................................................................................
................................................................................................................................................................
................................................................................................................................................................
................................................................................................................................................................
................................................................................................................................................................
................................................................................................................................................................
Zadanie 29. (1 pkt)
Freony to ogólna nazwa chlorofluoropochodnych metanu lub etanu.
Wska', które z nast#puj"cych substancji zaliczamy do freonów:
CHCl
3
, CCl
2
F
2
, CCl
3
F, CH
2
F
2
................................................................................................................................................................
................................................................................................................................................................
Zadanie 30. (1 pkt)
Napisz równanie reakcji powstawania CH
3
Cl z metanu i chloru.
................................................................................................................................................................
................................................................................................................................................................
................................................................................................................................................................
Pobrano ze strony www.sqlmedia.pl

Strona 12 z 12
BRUDNOPIS (nie podlega ocenie)
Pobrano ze strony www.sqlmedia.pl
Wyszukiwarka
Podobne podstrony:
2004 MCH A2 pro2004 id 603782 Nieznany (2)
2004 MCH A1 model pro2004
2004, MCH A1 model pro2004
pp A1 2012 id 381123 Nieznany
pr A1 2012 id 381781 Nieznany
a1 geogr id 49589 Nieznany (2)
pp A1 2012 id 381123 Nieznany
antropomotoryka 26 2004 id 6611 Nieznany (2)
Lista A1 id 269942 Nieznany
2004 2005 szkolny id 245044 Nieznany (2)
2004 2005 wojewodzki id 245045 Nieznany (2)
przekladnia rysunek A1 id 40466 Nieznany
asm state of the art 2004 id 70 Nieznany (2)
Lista5 AF 2013 a1 id 270434 Nieznany
a1 inform rozw id 289218 Nieznany (2)
więcej podobnych podstron