
Kamil Guzy
Notatki z wykładów
z chemii nieorganicznej.

1
Spis treści
Chemia ogólna i nieorganiczna ...............................................................................................................2
1. Równowagi w roztworach ...............................................................................................................2
2. Kompleksy, związki koordynacyjne, nomenklatura, liczba koordynacyjna, izomery ......................7
3. Reakcje chemiczne ..........................................................................................................................9
4. Roztwory ...................................................................................................................................... 13
5. Amfotery i bufory ......................................................................................................................... 19
6. Budowa materii ............................................................................................................................ 22
7. Hybrydyzacja, struktura jądra, przemiany promieniotwórcze ..................................................... 24
8. Struktura blokowa układu okresowego ....................................................................................... 28
9. Wiązania chemiczne ..................................................................................................................... 31
10. Utlenianie i redukcja .................................................................................................................... 33
Systematyka pierwiastków .................................................................................................................. 37
11. Wodór ........................................................................................................................................... 37
12. Litowce ......................................................................................................................................... 39
13. Berylowce ..................................................................................................................................... 42
14. Pierwiastki bloku p ....................................................................................................................... 45
15. Borowce........................................................................................................................................ 47
16. Węglowce ..................................................................................................................................... 52
17. Azotowce ...................................................................................................................................... 57
18. Tlenowce ...................................................................................................................................... 63
19. Fluorowce ..................................................................................................................................... 68
20. Metale d-elektronowe ................................................................................................................. 71
2
Wykład 1.
Analiza I, II grupy.
Wykład 2.
Równowagi w roztworach.
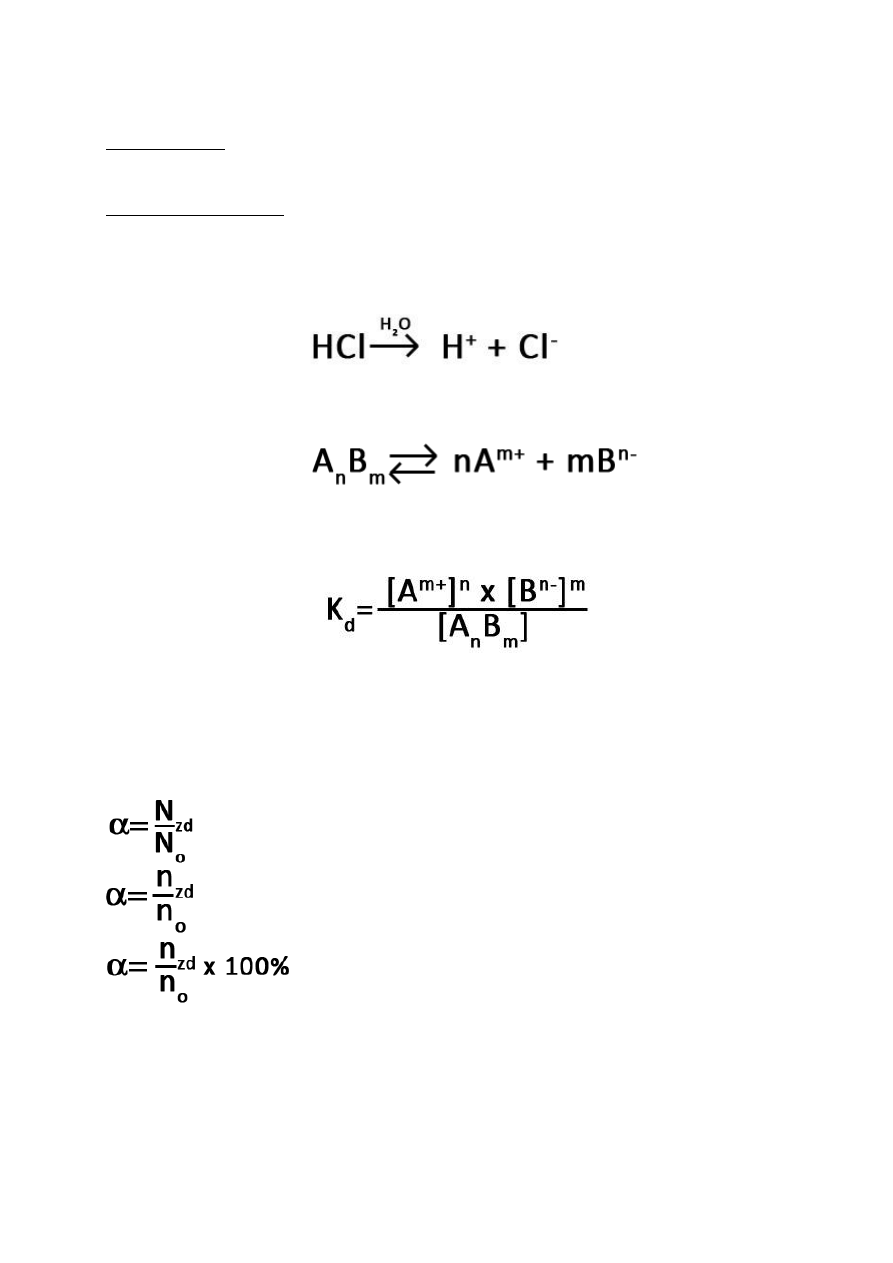
Dysocjacja elektrolityczna – rozkład cząsteczek na jony pod wpływem rozpuszczalnika
(rozpuszczalnik pozostaje bez zmian).
Bardziej elektroujemny pierwiastek ściąga bardziej do siebie elektrony.
Stała dysocjacji – iloczyn stężeń produktów (jonów) przez iloczyn stężeń substratów.
Im wyższa K
d
tym większa ilość substratu(-ów) rozłożyła się na jony.
Stopień dysocjacji – stosunek liczby moli cząsteczek danego związku chemicznego, które uległy
rozpadowi na jony do łącznej liczby moli cząsteczek tego związku
dla: CH
3
OH, C
2
H
5
OH, N
2
, O
2
, CH
4
, CO, C
4
H
12
O
6
dla: HCl, HNO
3
, CH
3
COOH, Ca(OH)
2
, NaCl, Na
2
SO
4

3
Czynniki wpływające na stopień dysocjacji:
rodzaj elektrolitu
o mocne i słabe elektrolity
rodzaj rozpuszczalnika
o polarne i niepolarne
temperatura
o ze wzrostem temperatury
jest wyższy
stężenie
Elektrolity:
mocne
o a >30%
o prawie wszystkie sole, niektóre kwasy nieorganiczne, organiczne (chlorokwasy),
wodorotlenki I i II grupy (oprócz Be(OH)
2
i Mg(OH)
2
)
średniej mocy
o 5%<a<30%
słabe
o a<5%
o część kwasów nieorganicznych (H
3
BO
3
, H
2
CO
3
, H
2
SO
3
, HF), część zasad
nieorganicznych (NH
4
OH)
Prawo rozcieńczeń Ostwalda – przybliżona zależność stopnia dysocjacji słabego elektrolitu
od jego stężenia
Gdy
5% lub gdy C/K >400:
Jeśli C
o
spada
rośnie!!!

4
Dla roztworów rzeczywistych
a – aktywność jonu
f – współczynnik aktywności jonu
= constans
Dysocjacja wielostopniowa:
stałe dysocjacji kolejnych etapów – następcze stałe dysocjacji, są niższe od poprzednich (np.
w H
3
PO
4
; protony są bardziej trzymane i ciężej je oderwać)
stała kumulatywna:
Autodysocjacja:
Pomiar pH umożliwiają wskaźniki:
Błękit bromotymolowy – kwasowe pH czerwony – zasadowe pH fioletowy
Oranż metylowy – kwasowe pH czerwony – zasadowe pH żółty
W zależności od [H
+
] indykator może występować w postaci uprotonowanej lub zdeprotonowanej.
Iloczyn rozpuszczalności - iloczyn stężeń jonów w roztworze nasyconym charakterystyczny
dla substancji w danej temperaturze
Ujemny logarytm ze stężenia

5
niższe współczynniki – lepsza rozpuszczalność
roztwory przesycone – układy nierównowagowe i termodynamicznie nietrwałe i z biegiem czasu
wytrąci się z nich osad
Iloczyn rozpuszczalności a rozpuszczalność.
S – rozpuszczalność molowa, ilość moli substancji rozpuszczonej w roztworze nasyconym
Czynniki wpływające na rozpuszczalność:
rozdrobnienie substancji
temperatura
mieszanie
efekt wspólnego jonu
roztwór nasycony
roztwór nienasycony
wytrącenie osadu

6
iloczyn aktywności jonów
wprowadzamy obce jony, spada aktywność
jonów, rośnie rozpuszczalność
zwiększają rozpuszczalność
- sole są trudno rozpuszczalne
- kompleksy są łatwo rozpuszczalne
efekt solny
hydroliza – reakcja jonów z cząsteczkami wody w wyniku której następuje rozkład cząsteczek
wody z uwolnieniem jonu wodorowego lub hydroksylowego
jony H
+
kompleksowanie
hydroliza będzie poprawiać rozpuszczalność

7
Wykład 3.
Kompleksy, związki koordynacyjne, nomenklatura, liczba koordynacyjna, izomery.
kompleks – centralnie położony jon metalu otoczony podstawnikami
o elektrycznie obojętny związek
o jon [Fe(CN)
6
]
4-
związek koordynacyjny – jeden jon jest kompleksem
o elektrycznie obojętny
W nawiasie kwadratowym [xy] metal i ligandy.
Jony centralne – jony „d” lub „f” elektronowe; np.: Ti
3+
, V
3+
, Cr
2+
, Cr
3+
, Mn
2+
, Mn
3+
, Fe
3+
, Co
3+
Podstawniki – cząsteczki polarne NH
3
, H
2
O; jony Cl
-
, CN
-
, F
-
Nie mają niesparowanych elektronów zawsze układy zamkniętopowłokowe.
Nomenklatura:
I miejsce – atom centralny – metal
o w kompleksach anionowych – końcówka „-an”
o w kompleksach obojętnych i kationowych nie zmienia się nazwy
w kwasach odpowiadających kompleksom anionowym końcówka „-owy”
w nawiasie stopień utlenienia
[atom centralny (ligand 1)
n
(ligand 2)
m
]
ligandy ujemne końcówka “-o”
ligandy podaje się w kolejności alfabetycznej
Nazwy ligandów:
H
2
O – akwa
NH
3
– amina
CO – karbonyl
NH
2
CH
2
CH
2
NH
2
– etylodiamina (en)
NO
2
-
- azotynowy (nitrito-N)
O
2
-
- tlenowy (okso)
SCN – tiocyjanianowy
o tiocyjanino-N – azot
o tiocyjanino-S – siarka
N
3
- nitrydo
Br
-
- bromo
CO
3
2-
- węglano
SO
4
2-
- siarczano
OH
-
- hydrokso
Liczba koordynacyjna: mówi o ilości ligandów związanych z atomem centralnym
LK2 – Struktura liniowa; najczęstsze Cu, Au, Ag Hg
LK3 – Struktura trójkąta; równoboczny jeśli te same ligandy
LK4 – Struktura tetraedryczna; płaska kwadratowa – metale o konfiguracji d
8
; najczęściej
rod(I), iryd (I), platyna(II)
LK5 – Struktura bipiramidy trygonalnej; piramida trygonalna
LK6 – Odkształcenia tetragonalne, odkształcenie rombowe

8
Izomery:
ta sama liczba atomów różniąca się ich przestrzennym uporządkowaniem
typy izomerii
o geometryczna – różne konfiguracje wiązań pomiędzy tymi samymi atomami; cis-trans
o optyczna – cząsteczki optycznie czynne, nie pokrywają się w odbiciach lustrzanych,
skręcają płaszczyznę
o koordynacyjna – wymiana jednego lub więcej ligandów kationu lub anionu
[Cr(NH
3
)
6
]
3+
[Fe(CN)
6
]
3-
[Fe(NH
3
)
6
]
3+
[Cr(CN)
6
]
3-
o wiązaniowa – ligandy ambichelatowe – łączą się z metalem na więcej sposobów
[Cr(H
2
O)
5
(SCN)]
2+
[Cr(H
2
O)
5
(NCS)]
2+
o jonowa – następuje wymiana ligandu z cząsteczkom lub anionem spoza sfery
koordynacyjnej
[CoBr(NH
3
)
5
]SO
4
[CoSO
4
(NH
3
)
5
]Br
o hydratacyjna – nienaładowany, skoordynowany ligand przemieszcza się poza
kompleks w to miejsce wchodzi np. woda
[Cr(H
2
O)
6
]Cl
3
- fioletowy
[Cr(H
2
O)
6
]Cl
2
.
H
2
O – niebiesko-zielony
[Cr(H
2
O)
6
]Cl
2
.
H
2
O – zielony
Ligandy:
monodentante
dwudentante
polidentante (EDTA – jedna cząsteczka wiąże kilka metali; czynnik helatujący)
Białka jako ligandy:
atom N grupy aminowej
atom O grupy karbonylowej
amidowy atom N z wiązania peptydowego
atom O grupy karboksylowej
atomy donorowe łańcuchów bocznych reszt aminokwasów
Kwasy nukleinowe jako ligandy:
endocykliczne atomy N zasad nukleotydowych
ujemnie naładowane atomy O grup fosfodiestrowych
Rozszczepienie orbitalu „d”: (umieć schemat rozszczepienia)
teoria pola krystalicznego – tłumaczy powstawanie kompleksów oddziaływaniem
elektrostatycznym pomiędzy elektronami znajdującymi się
na podpowłokach d atomu centralnego a elektronami ligandu.
teoria pola ligandów
W oktaedrze większe (mocniejsze) rozszczepienie niż w tetraedrze.
Szereg spektrochemiczny ligandów:
I
-
< Br
-
< SCN
-
< Cl
-
< OH
-
~
ONO
-
< C
2
O
4
2-
< H
2
O < NCS
-
< EDTA
+
< NH3 < bipy < phen <
CN- ~ CO
9
Wpływ na wielkość rozszczepienia ma:
ładunek jonu metalu (wzrost ładunku => silniejsze przyciąganie ładunku)
symetria pola
rodzaj ligandów
struktura elektronowa metalu
Wykład 4.
Reakcje chemiczne.
reakcja chemiczna – proces w którym z cząsteczek, atomów powstają cząsteczki, atomy lub jony.
Substraty i produkty mają inne właściwości.
Reakcje chemiczne:
przegrupowanie atomów
tworzenie wiązań w produktach
niszczenie wiązań w substracie
częste zmiany w zewnętrznych powłokach elektronowych.
Reakcja chemiczna
Proces fizyczny
Prawa w reakcji chemicznej:
zachowania masy – masa substratów = masa produktów
stosunków stałych – pierwiastki reagują ze sobą w stałych stosunkach ilościowych
stosunków wielokrotnych – liczności i masy jednego z pierwiastków
stosunków objętościowych – objętości gazowe substratów i produktów w jednakowych
warunkach mają się do siebie jak niewielki liczby całkowite (H
2
+ Cl
2
-> 2HCl)
Avogadra – w jednakowej objętości gazów (doskonałych) znajduje się taka sama liczba
cząsteczek; w tych samych warunkach.
Równanie reakcji:
znamy skład substratów i produktów
znamy towarzyszące produkty energetyczne
znamy wymagane warunki (ciśnienie, temperatura, katalizator)
znamy mechanizm reakcji chemicznej
nie znamy stopnia przereagowania
Typy reakcji:
syntezy: A + B → C
o polimeryzacja
wymiany: AB + C → AC + B
analizy: AB → A + B
o piroliza: CaCO
3
→T→ CaO + CO
2
o fotoliza: 2AgCl →hv→ 2Ag + Cl
2
o radioliza: O
2
→
→ O + O
+
+ e
***
10
endotermiczna – wymagane dostarczenie energii (ciepła) z otoczenia
egzotermiczna – powstające produkty o energii wewnętrznej mniejszej niż suma energii
wewnętrznej substratów; uwolnienie energii
***
homogeniczne – wszystkie substraty i produkty znajdują się w tej samej fazie
w roztworze całkowicie się mieszających
pomiędzy gazami → zachodzące w całej objętości
heterogeniczne – na granicy 2 faz ( C
(c)
+O
2(g)
→ CO
2(g)
)
***
z przeniesieniem elektronów
bez przeniesienia elektronów
***
jonowe – w roztworach wodnych lub innych rozpuszczalnikach
cząsteczkowe – w fazie gazowej, rzadziej w roztworach rozpuszczalników niepolarnych
otrzymywanie cząsteczek, atomów z wolnymi niesparowanymi e
o tworzenie rodników (Cl
2
+ hv → 2Cl
)
o reakcja rodnikowa (Cl
2
+ H
→ HCl + Cl
)
o rekombinacja rodników (H
+ Cl
→ HCl)
***
odwracalne – do osiągnięcia stałej równowagi
nieodwracalne – do wyczerpania substratów
Kinetyka reakcji:
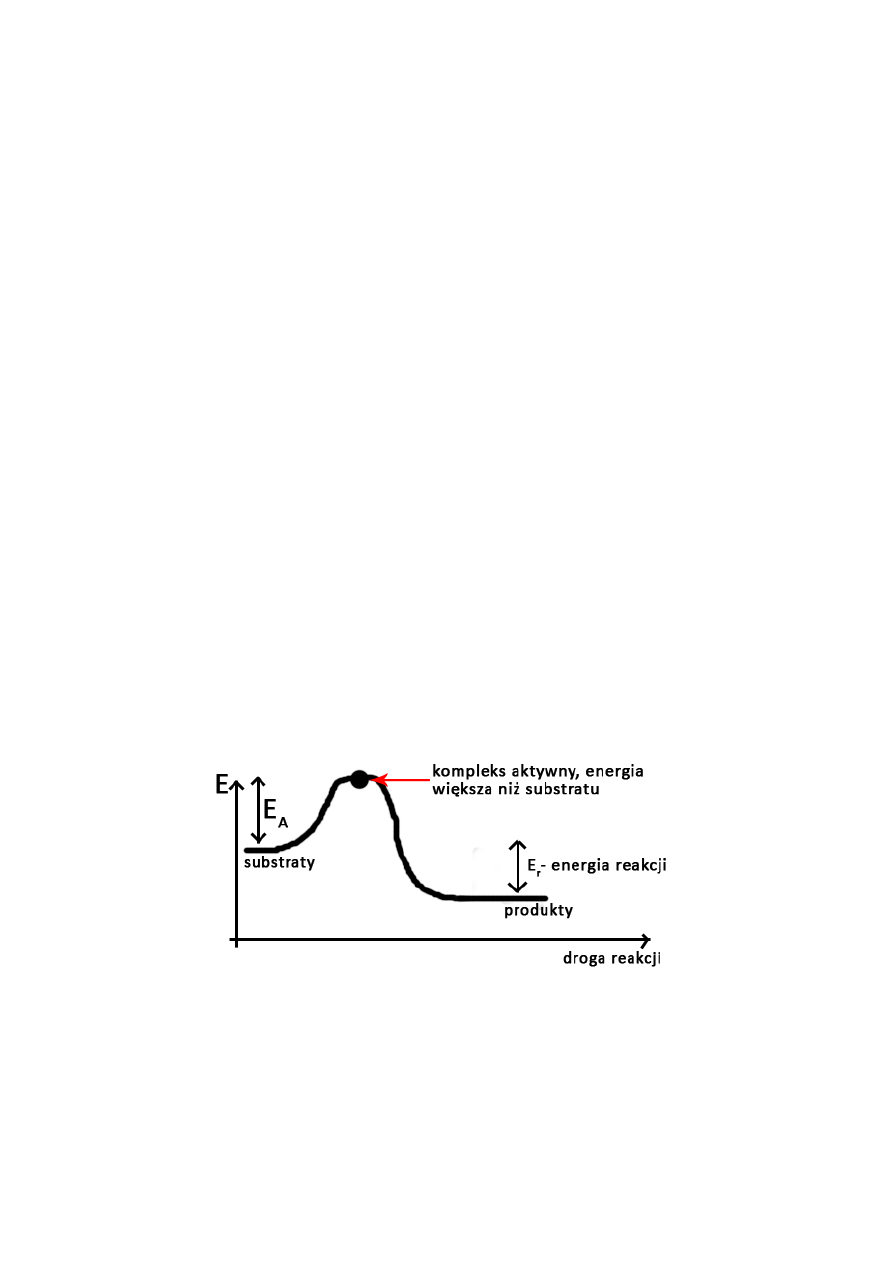
teoria zderzeń – reakcja zachodzi gdy dojdzie do zderzenia reagujących cząsteczek, reakcja
stanu gazowego
o zderzenie efektywne – cząsteczki posiadają energię aktywacji
o liczba zderzeń zależy od: stężenia i temperatury
o skuteczność zderzeń zależy od temperatury
teoria stanu przejściowego – wg tej teorii w wyniku zderzenia powstaje kompleks przejściowy
i w nim dochodzi do przegrupowania wiązań
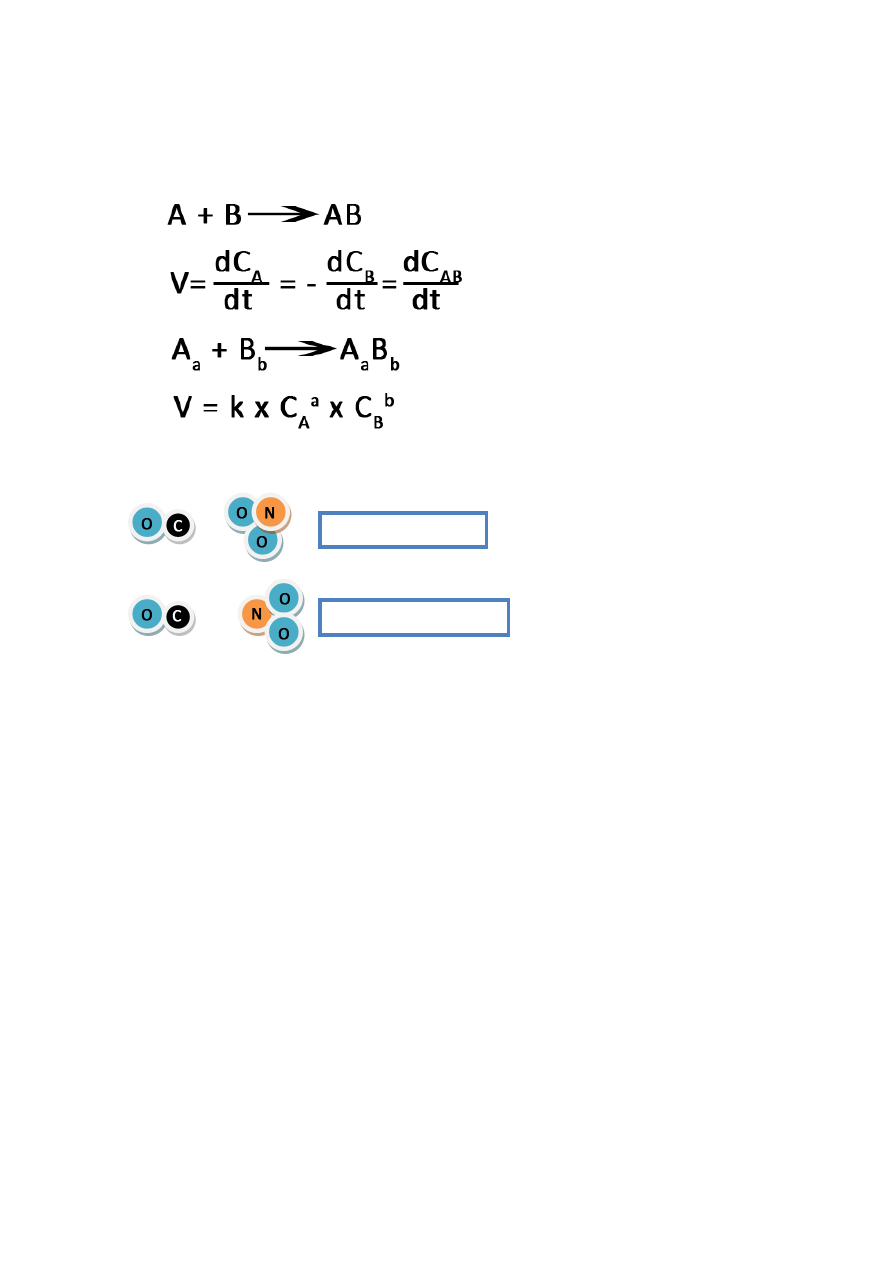
11
zderzenie nieefektywne
zderzenie efektywne
Szybkość reakcji:
jest proporcjonalna do iloczynu stężeń substancji reagujących; im większe stężenie
tym większa szybkość
Wpływ orientacji cząsteczek w zderzeniach:
Kataliza:
katalizator – substancja wprowadzona do układu reagującego zwiększająca szybkość tej reakcji
a sama nieulegająca przemianom chemicznym w ostatecznym wyniku reakcji.
typu redoks – pośredniczy w wymianie e
typu kwasowo zasadowego
kataliza homogeniczna – katalizator stanowi jeden ze składników jednorodnej fazy
(g)
(c)
kataliza heterogeniczna – katalizator jest odrębną fazą w porąbaniu do substratów
Proces absorpcji:
dyfuzja substratów
absorpcja substratów
reakcja chemiczna
desorpcja produktów
dyfuzja produktów
Czynniki wpływające na szybkość reakcji:
stężenie
katalizator
promieniowanie elektromagnetyczne
ciśnienie
rozwinięcie powierzchni
rodzaj środowiska
mechanizm reakcji
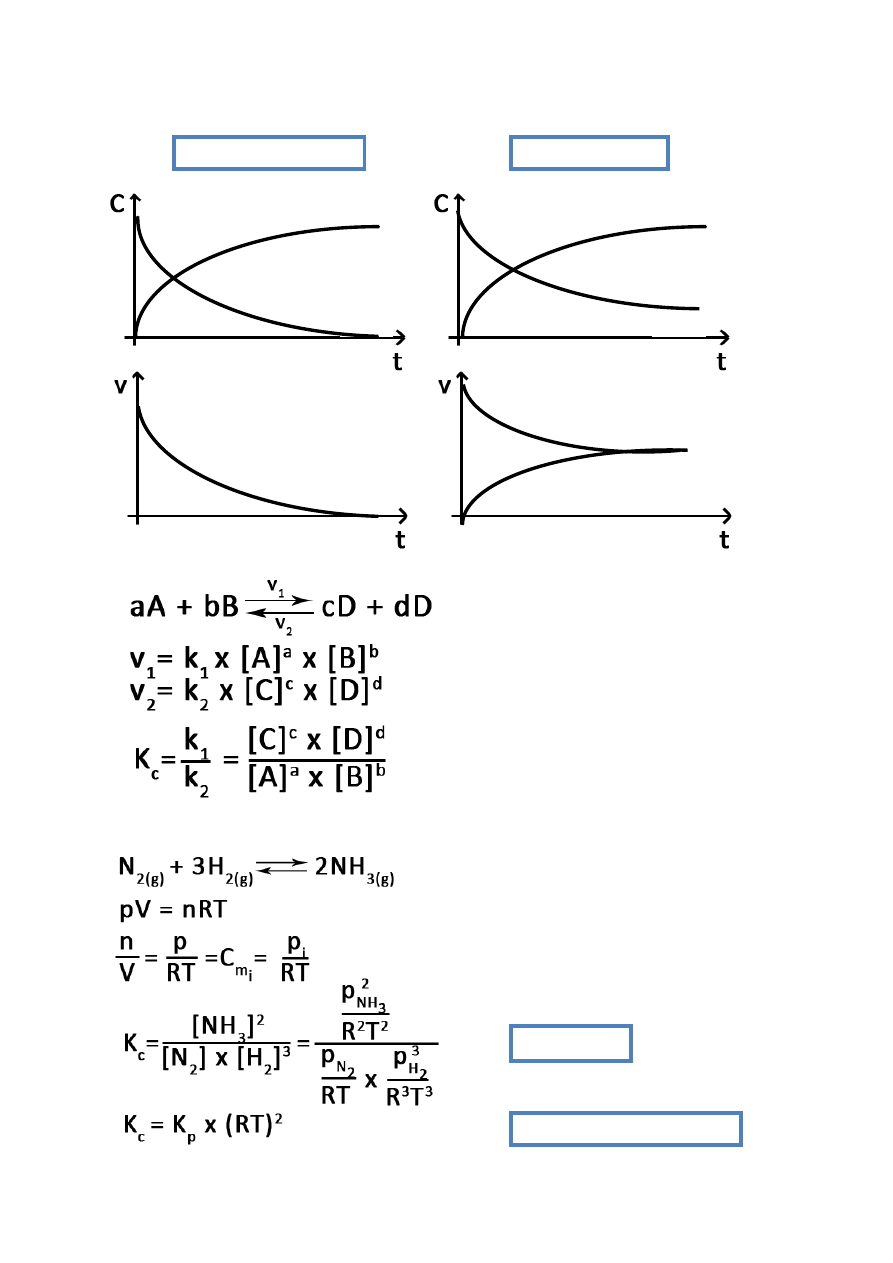
12
reakcja nieodwracalna
reakcja odwracalna
stan równowagi
stan równowagi
v
1
= v
2
C
p
C
p
C
s
C
s
Równowaga chemiczna:
Reakcja odwracalna:
Reakcja w fazie gazowej:
K
p
– ciśnieniowa stała reakcji
skracanie RT
13
Reguła przekory La Chateliera i Browna:
Zmiana stężenia reagentów, ciśnienia, temperatury powoduje przesunięcie stanu równowagi, by
skompensować zmiany.
stężenie
o dodanie substratu – przesunięcie w prawo
o dodanie produktu – przesunięcie w lewo
ciśnienie
o wzrost ciśnienia powoduje przesunięcie w stronę mniejszych objętości
temperatura
o w egzoenergetycznych ogrzewanie powoduje przesunięcie w lewo
Wykład 5.
Analiza III grupy.
Wykład 6.
Roztwory.
roztwór jednorodny – jednofazowy, układ dwu lub więcej składnikowy, których zawartość może się
zmieniać.
Typy roztworów:
gazowe (gaz + gaz)
ciekłe (gaz, ciecz, ciało stałe + ciecz)
stałe (gaz, ciecz, ciało stałe + ciało stałe)
***
rzeczywiste, właściwe - molekularne rozproszenie składników <10
-10
m
koloidalny – drobno dyspergowany, układ wielofazowy
***
rozpuszczalnik – składnik będący w przewadze
substancja rozproszona – pozostałe składniki
Stężenia:
procentowe
procentowe objętościowe
molowe
molarne:
Ułamek molowy:
% molowy = x
i
× 100%
max = 1

14
roztwór nasycony – roztwór substancji rozpuszczonej pozostający w stanie równowagi dynamicznej
z osadem substancji rozpuszczonej w danej temperaturze.
roztwór mianowany – roztwór odczynnika chemicznego o znanym stężeniu (dokładnie ustalone
stężenie roztworu za pomocą substancji podstawowych lub innych roztworów
mianowanych)
Tworzenie roztworu:
1. chemiczna reakcja substancji z rozpuszczalnikiem, w wyniku której powstaje nowa
rozpuszczona substancji:
a. Zn + 2H
+
→ Zn
2+
+ H
2
b. CO
2
+ H
2
O → H
2
CO
3
c. P
2
O
5
+ 3 H
2
O → 2H
3
PO
4
2. oddziaływanie substancji z rozpuszczalnikiem – powstanie formy sol watowanej cząsteczkami
rozpuszczalnika:
a.
hydratowany jon sodowy hydratowany jon chlorkowy
3. dyspersja substancji w rozpuszczalniku
a. samorzutne tworzenie roztworu w wyniku oddziaływania sił międzycząsteczkowych
mieszanie dwóch gazów
mieszanie cieczy niepolarnych
Charakter oddziaływań:
cząsteczka (jon) [koniecznie dipol) – rozpuszczalnik
o zależy od budowy chemicznej cząsteczki i rozpuszczalnika
elektrostatyczne
o rozpuszczona cząsteczka polarna lub kryształ jonowy - rozpuszczalniki polarne
poprzez siły dyspersyjne
o van der Waalsa
Siła dielektryczna – im wyższa tym bardziej polarna cząsteczka.
Teorie kwasów i zasad:
1. Arrheniusa
HA → H
+
+ A
-
MOH → M
+
+ OH
-
2. Brönsteda – Lowry’ego
zasada – akceptor protonu (Z)
kwas – wytwarza proton (K)
(K) H
3
O
+
↔ H
+
+ (Z) H
2
O
(K) H
2
O ↔ H
+
+ (Z) OH
-
Na
+
-
Cl
+
-

15
anion amidkowy
Ca, Fe (III), Mg – węglany
Cu, Hg, Cd - siarczki
3. Rozpuszczalnikowa
solwo(kwas) – po rozpuszczeniu wytwarza kation charakterystyczny dla
rozpuszczalnika
solwo(zasada) – substancja wytwarza charakterystyczny dla danego rozpuszczalnika
anion
4. Lewisa
kwas – akceptor pary elektronowej
zasada – donor pary elektronowej
5. Usanowicza
Teoria twardych i miękkich kwasów i zasad (1963 Pearson):
twarde
o mała polaryzowalność
o małe rozmiary atomów
o kwasy redukują się trudno
o zasady trudno się utleniają
o duża różnica elektroujemności
miękkie
o znaczna polaryzowalność
o duże atomy
o kwasy łatwo się redukują
o zasady łatwo się utleniają
o niewielka różnica elektroujemności
Powstawanie adduktów:
addukt twardy – wiązanie z dużym udziałem charakteru jonowego
addukt miękki – wiązanie o charakterze kowalencyjnym
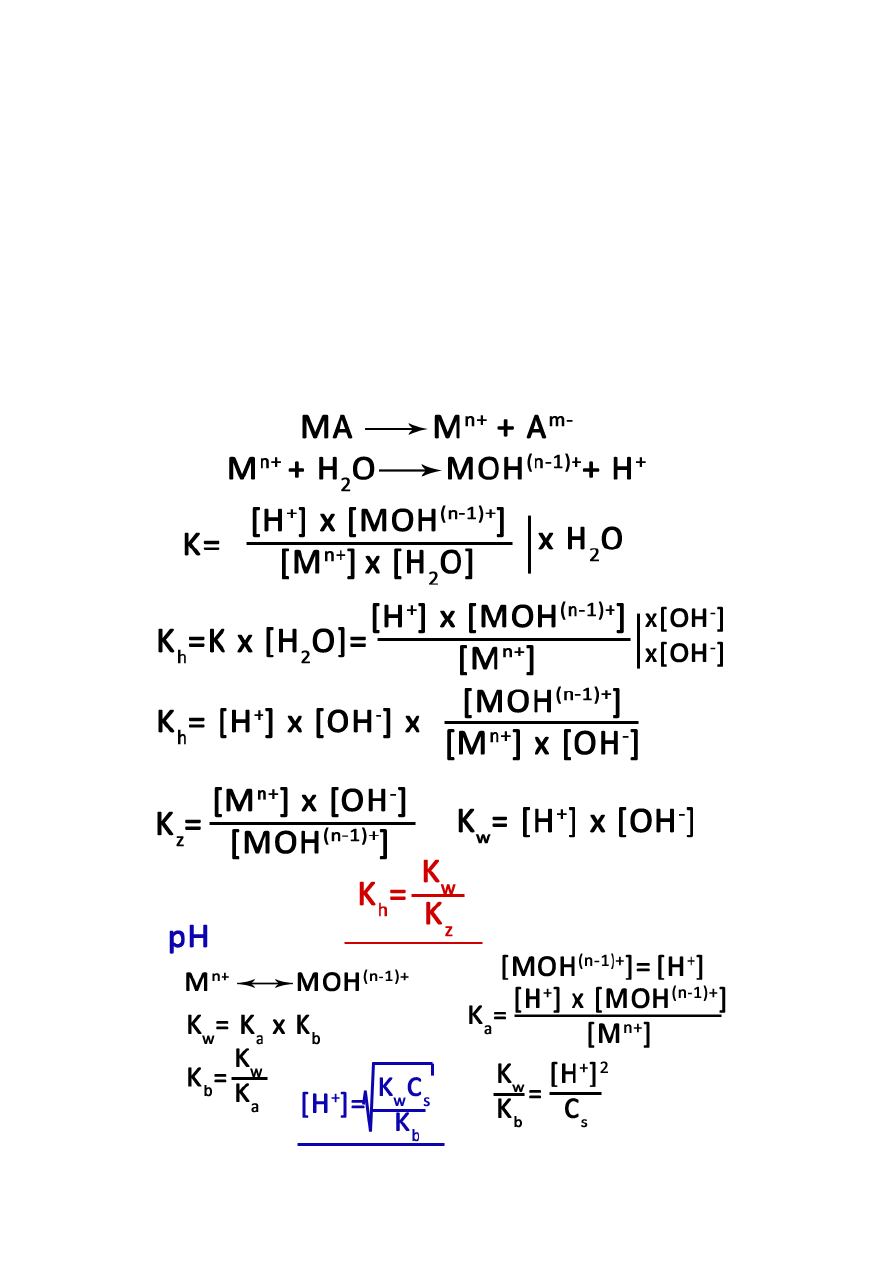
16
Hydroliza:
reakcja jonów z wodą
reakcja protolityczna
anion słabego kwasu – anionowa zasada
kation słabej zasady – kationowy kwas
hydroliza soli wieloprotonowej lub wielohydroksylowych wodorotlenków prowadzi do
powstania amfolitów (mogą przyłączać i odszczepiać protony)
reakcje hydrolizy można traktować jako odwrotne do reakcji zobojętniania
ulegają jej sole
o mocnego kwasu i słabej zasady
o mocnej zasady i słabego kwasu
o słabego kwasu i słabej zasady
1. Sól mocnego kwasu i słabej zasady:
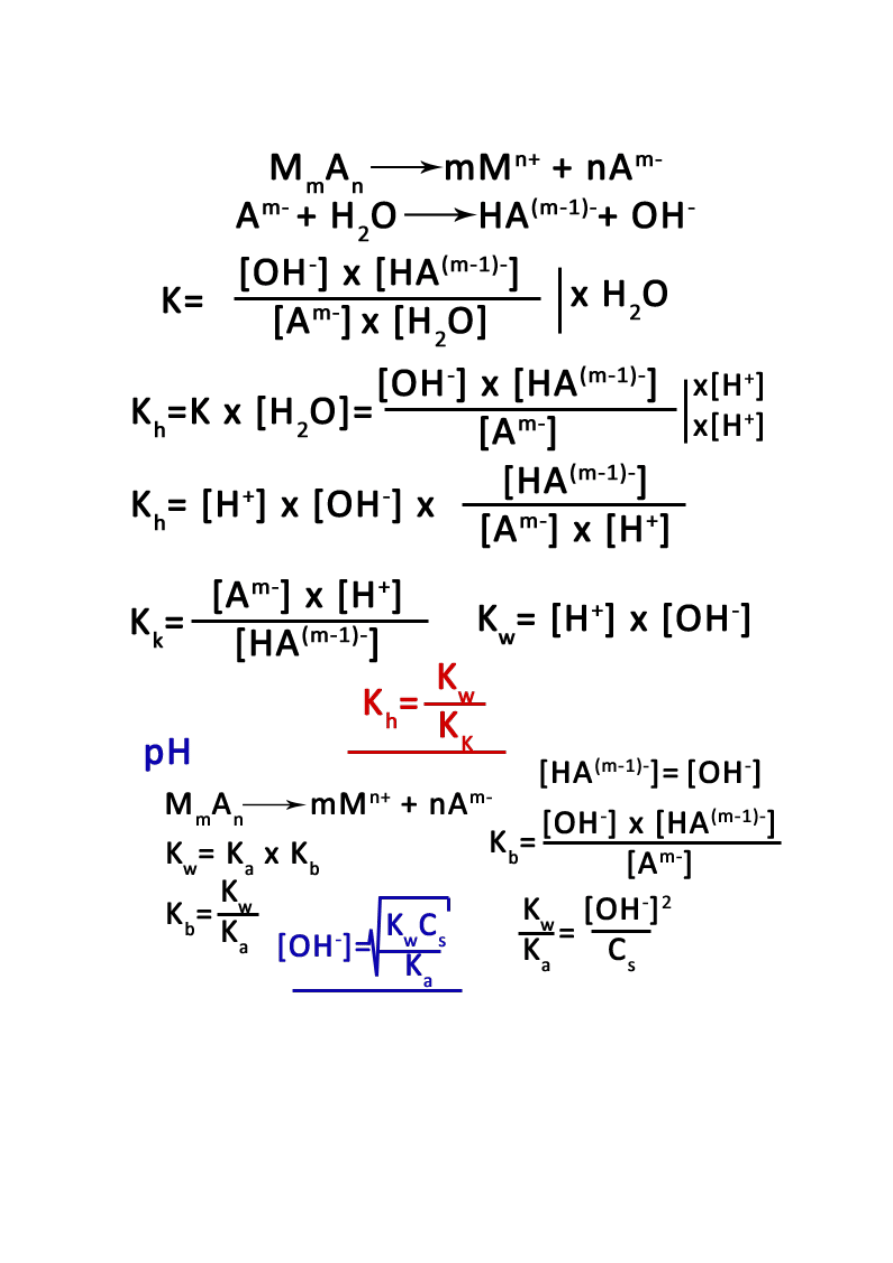
17
2. Sól słabego kwasu i mocnej zasady:

18
3. Sól słabego kwasu i słabej zasady:
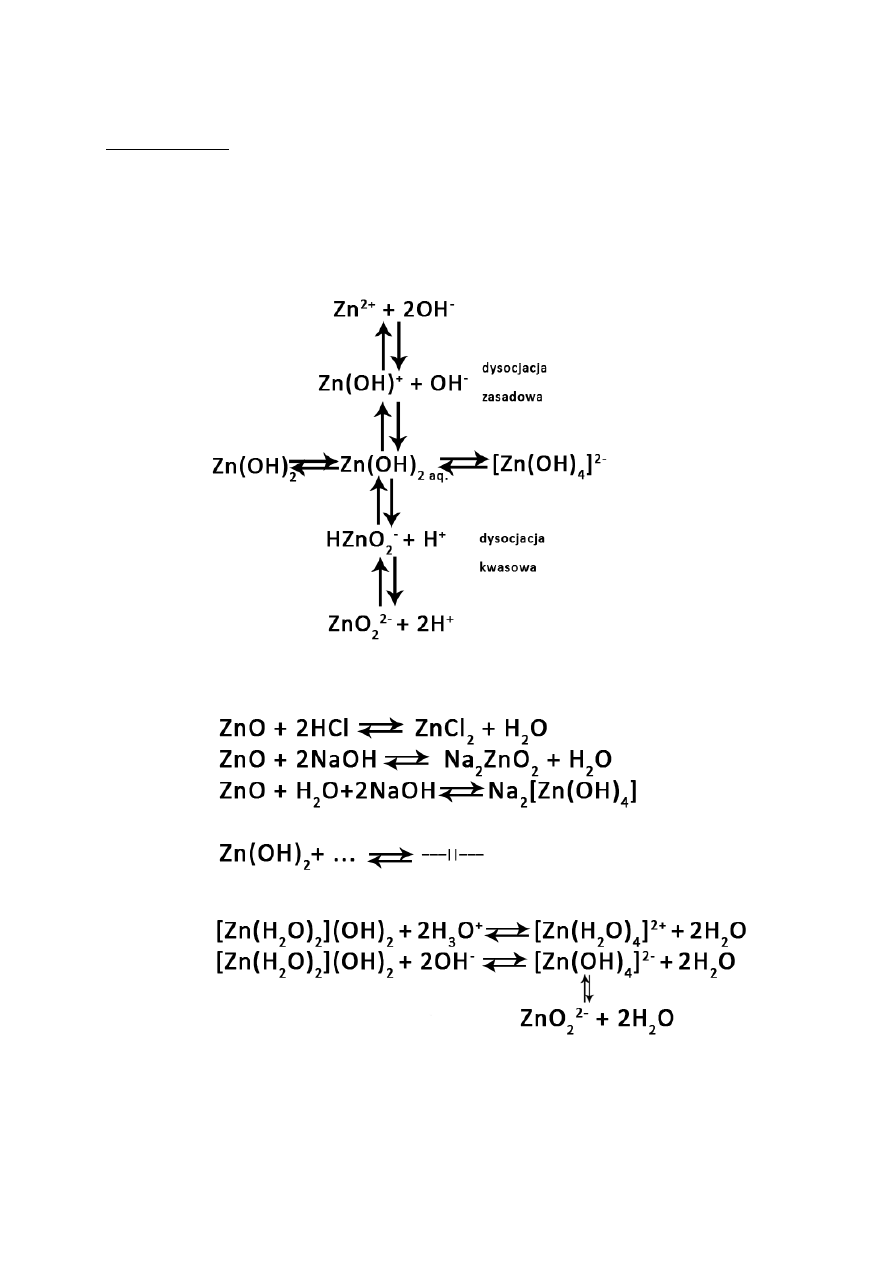
19
Wykład 7.
Amfotery i bufory.
amfotery – substancje, które w zależności od środowiska mogą mieć właściwości kwaso- lub
zasadotwórcze:
X
+
+ OH
-
↔ X–OH ↔ XO
-
+ H
+
Wiązanie –O–H nie jest tak silne jak w zasadach.
Teorie właściwości amfoterów:
klasyczna
o
protonowa
o

20
Bufory:
słabego kwasu i soli tego kwasu z mocną zasadą
o CH
3
COOH - kwas; CH
3
COO
-
- zasada
słabej zasady i soli tej zasady z mocnym kwasem
o NH
3
– zasada; NH
4
+
- kwas
dwóch soli wieloprotonowego kwasu (dostateczna wartość stałej dysocjacji)
o H
2
PO
4
-
- kwas; HPO
4
2-
- zasada
Bufory utrzymują stałe pH.
1. Bufor octanowy
2. Bufor amonowy
Zakres działania buforu:
pH buforu – nie zależy od bezpośrednich wartości stężeń składników buforu
bufor można rozcieńczać bez zmiany jego pH
Zależności wynikające z równania Hendersona-Haselbacha:
dodanie do roztworu buforowego niewielkich ilości mocnego kwasu lub mocnej zasady
zmienia bezwzględnie stężenia składników buforu, ale stosunek stężeń zmienia się
nieznacznie = nieznaczna zmiana pH.
dodatek kwasu – reakcja z zasadą
dodatek zasady – reakcja z kwasem
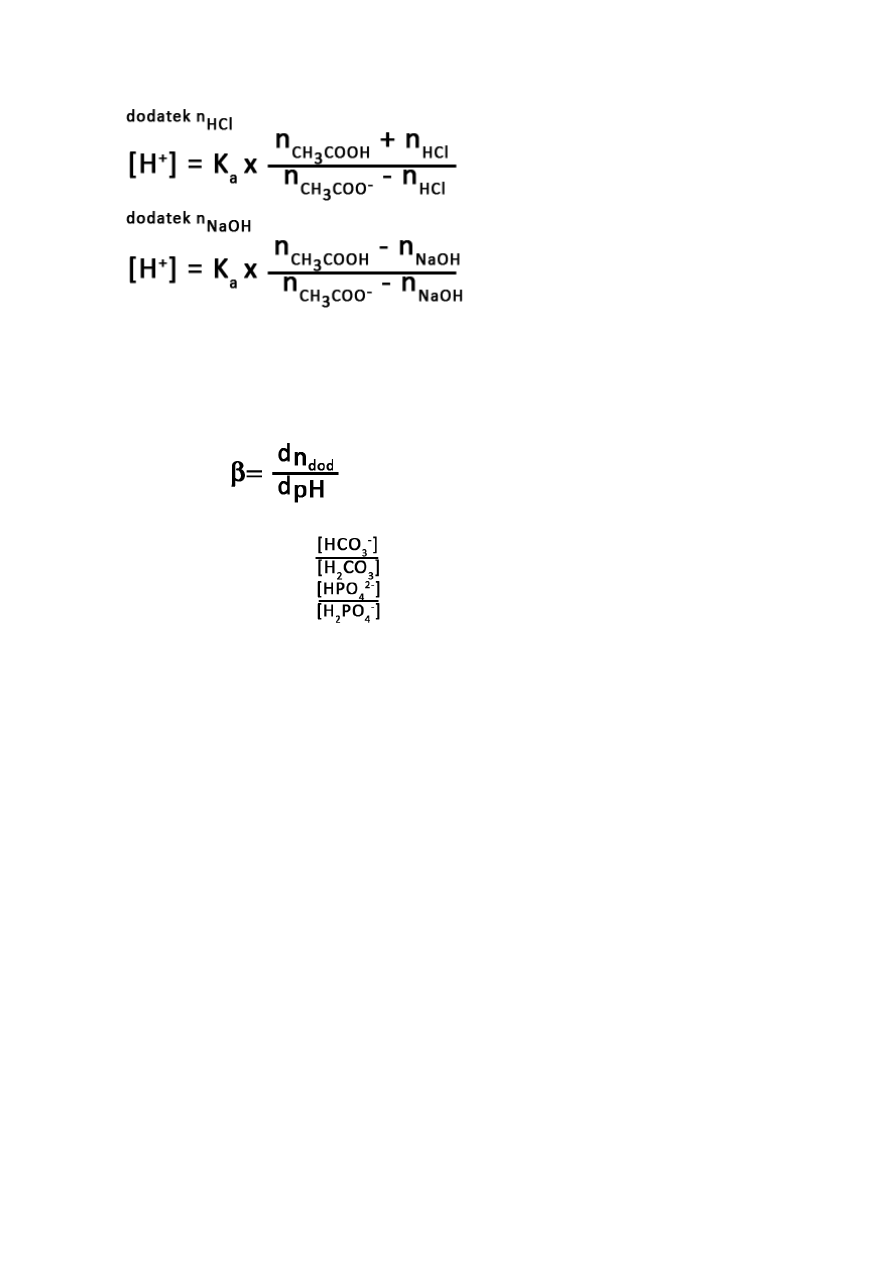
21
Pojemność buforowa:
bufor utrzyma w miarę stałe pH dopóki nie wyczerpie się jeden z jego składników kwas lub
zasada. Ilościową miarą „odporności” buforu na dodatek mocnego kwasu lub zasady jest
pojemność buforowa.
Bufory krwi i tkanek:
wodorowęglanowy
fosforanowy
białczanowy
hemoglobinowy
22
Wykład 8.
Budowa materii.
atom – najmniejsza cząstka pierwiastka zachowująca swoją indywidualność we wszystkich
przemianach chemicznych
związek chemiczny – powstaje w wyniku łączenia się atomów różnych pierwiastków w stałych
stosunkach liczbowych, masy atomowe nie ulegają zmianie podczas reakcji
chemicznych
pierwiastek – zbiór atomów o jednakowej liczbie protonów w jądrze atomowym
nuklid – zbiór atomów o takim samym składzie jądra atomowego (p
+
i n
0
)
Budowa atomu - Dalton, Rutherford, Thompson.
Liczby kwantowe:
n – główna liczba kwantowa
o energia elektornu w atomie wodoru jest kwantowana- może przyjąć tylko wartość 1
o charakteryzuje energię elektronu na powłoce
o n = 1, 2, 3, 4, 5, … ∞
o powłoka – zbiór wszystkich stanów kwantowych o określonej wartości „n”
o maksymalna liczba e na powłoce = 2n
2
n
1
2
3
4
5
6
7
Symbol
powłoki
K
L
M
N
O
P
Q
Energia
l – poboczna liczba kwantowa
o kwantuje moment pędu elektronu
o rozróżnia stany energetyczne e znajdującego się na tej samej powłoce
o l = 0, 1, 2, 3, …, (n-1)
o podpowłoka – zbiór stanów kwantowych o tych samych wartościach „n”
n
1
2
3
4
symbol
K
L
M
N
l
0
0
1
0
1
2
0
1
2
3
symbol
s
s
p
s
p
d
s
p
d
f
m – magnetyczna liczba kwantowa
o kwantuje wartości rzutu momentu pędu w na kierunek pola magnetycznego
o m = -l, …, 0, …, +l
n
1
2
3
4
symbol
K
L
M
N
l
0
0
1
0
1
2
0
1
2
3
symbol
s
s
p
s
p
d
s
p
d
f
m
0
0
-1
0
-1
-2
0
-1
-2
-3
0
0
-1
0
-1
-2
1
1
0
1
0
-1
1
1
0
2
2
1
2
3
m
s
– (magnetyczno)-spinowa liczba kwantowa
o kwantuje rzut momentu spinowego na wyróżniony kierunek w przestrzeni
o m
s
= -½ lub ½
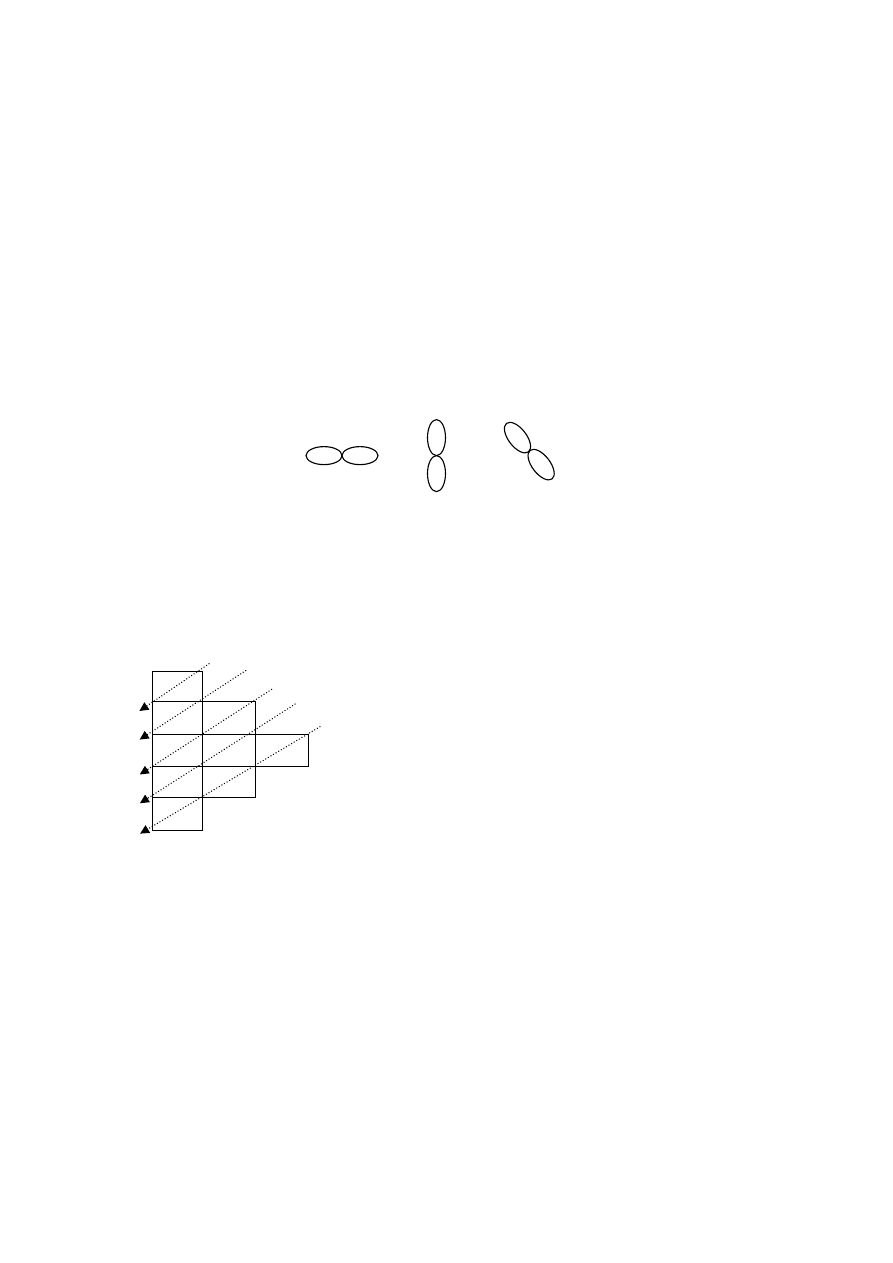
23
Podpowłoki - obszary gdzie zachodzi największe prawdopodobieństwo znalezienia elektronu:
podpowłoka „s”
o n= 1, …; l= 0; m= 0
o kształt sfery
o w każdej podpowłoce istnieje tylko jeden orbital „s”
o poszczególne obszary różnią się między sobą jedynie wielkością konturu, im wyższa
„n” tym większy kontur obszaru
podpowłoka „p”
o n= 2, …; l= 1; m= -1, 0, 1
o istnieją trzy orbitale typu „p”
p
x
,
p
y
,
p
z
o na osi na której leży zachodzi największe prawdopodobieństwo obecności e
o obszary orbitalne mają symetrię obrotową
o jedna powierzchnia węzłowa przechodzi przez jądro, dzieli funkcję „p” na gałąź
dodatnią i ujemną
podpowłoka „d”
o n=3, …; l= 2; m= -2, -1, 0, 1, 2
Atomy wieloelektronowe:
obsadzenie orbitali o najniższej energii
zakaz Pauliego – nie może być w atomach dwóch e w jednakowym stanie kwantowo-
mechanicznym
reguła Hunda – kolejne e pojedynczo uzupełniają orbitale a następnie umieszczane są e o
przeciwnych liczbach spinowych
1s
2s
2p
3s
3p
3d
4s
4p
5s
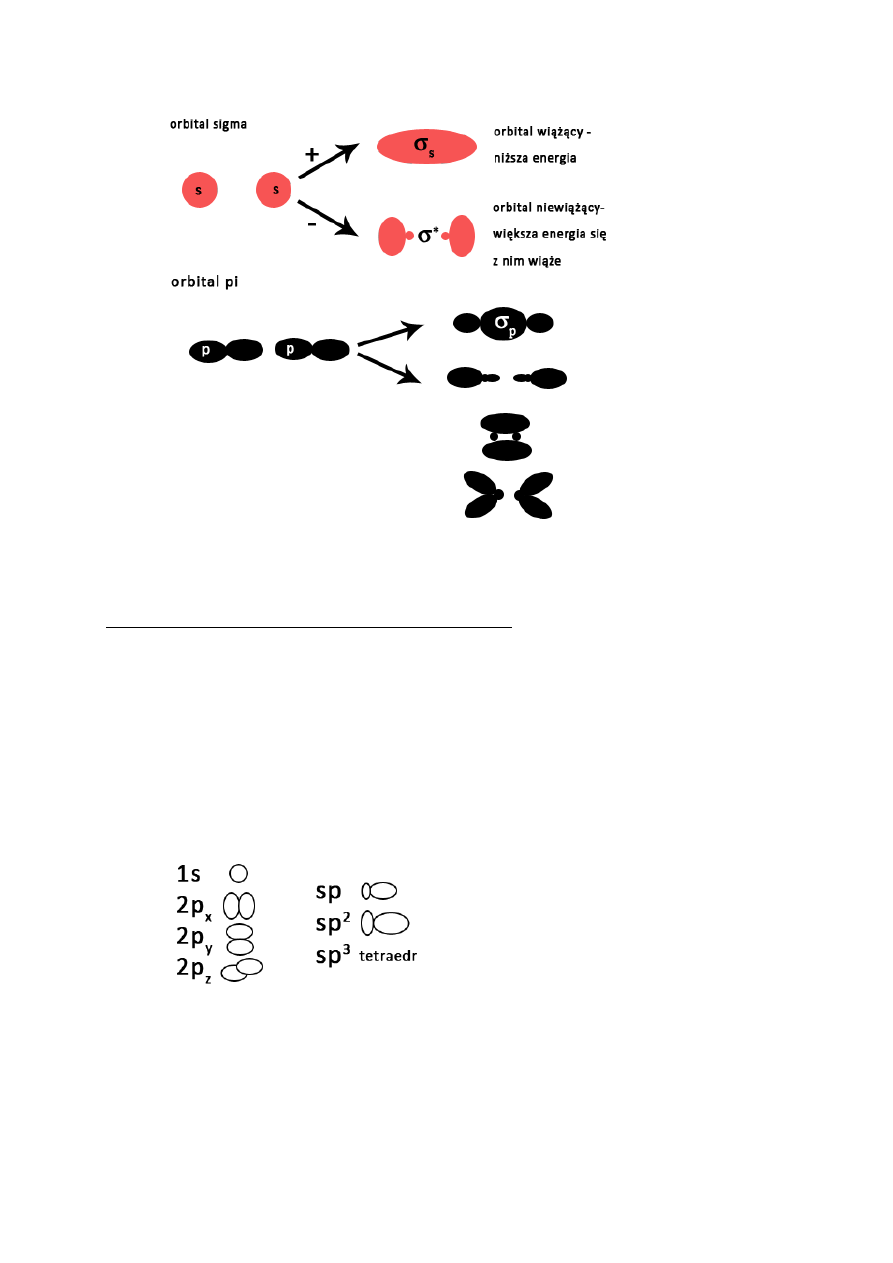
Teoria orbitali molekularnych:
e znajdujące się w cząsteczce opisują orbitale molekularne
orbital molekularny jest układem wielocentowym
określane są liczbami kwantowymi
stosuje się w nich zakaz Pauliego
obu orbitalom atomowym wchodzącym w kombinację liniową odpowiadają porównywalne
energie
nakładają się na siebie
wykazują tę samą symetrię w stosunku do osi łączącej oba jądra
24
Wykład 9.
Hybrydyzacja, struktura jądra, przemiany promieniotwórcze.
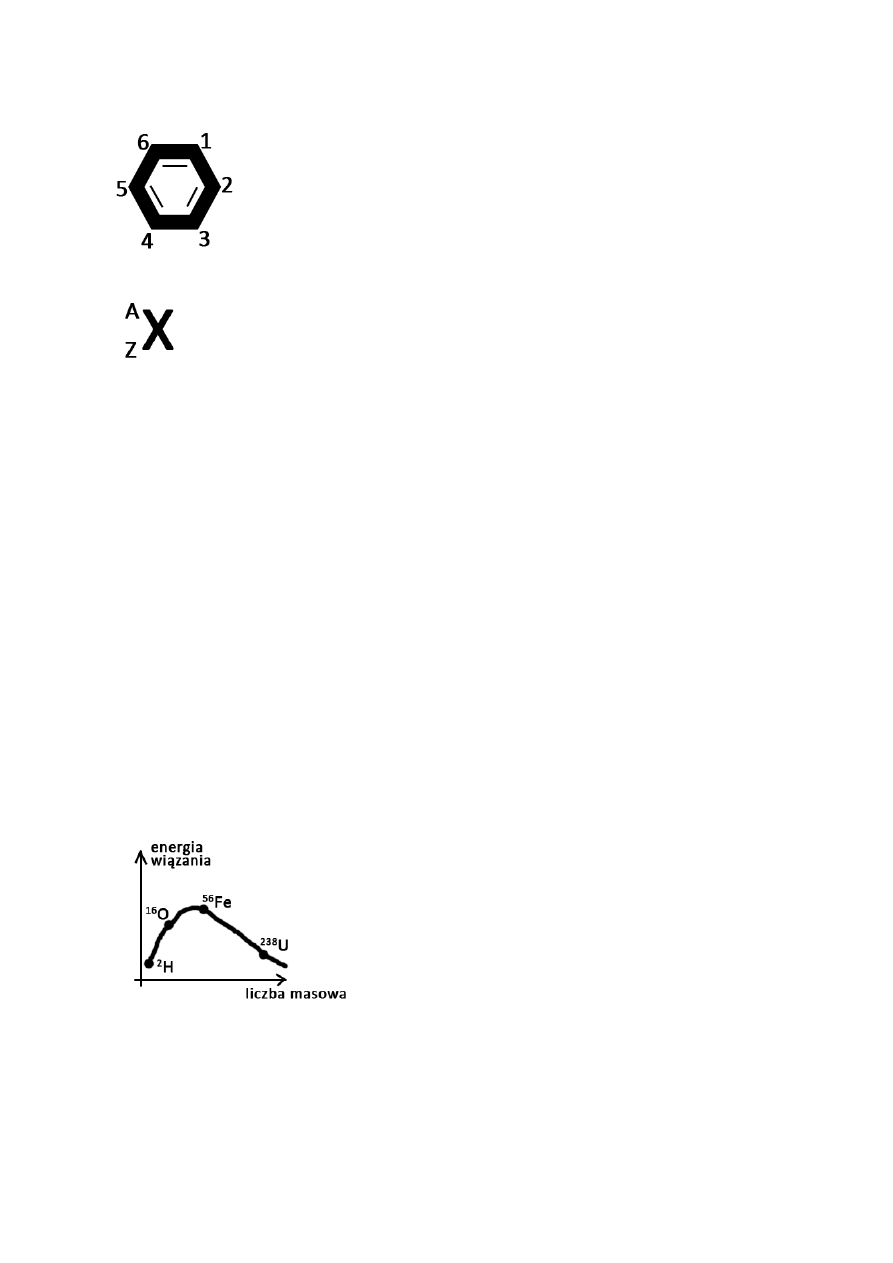
Hybrydyzacja:
tworzenie nowych funkcji falowych dla centralnego atomu cząsteczki wieloatomowej
proces mieszania orbitali w danym atomie
Cechy atomowych orbitali zhybrydyzowanych (I):
równocenne
inaczej zorientowane w przestrzeni, inny kształt w porównaniu do orbitali wyjściowych
złożone z dwóch niejednakowych części
silne właściwości kierunkowe
optymalne ułożenie w przestrzeni
różne typy hybrydyzacji
wpływ wielkości udziału orbitalu „s” na kąty pomiędzy orbitalami zhybrydyzowanymi
nie wszystkie orbitale hybrydyzowane biorą udział w tworzeniu orbitalu chemicznego
hybrydyzacji nie podlegają orbitale tworzące wiązanie typu π
25
Orbitale zdelokalizowane:
Struktura jądra:
A – liczba masowa (suma p
+
i n
0
)
Z – liczba atomowa (liczba p
+
, liczba e, liczba porządkowa w układzie okresowym)
oddziaływanie silne – siły przyciągania pomiędzy p
+
i n
0
Cząstki elementarne:
poruszające się z prędkością światła
o fotony – kwanty energii promieniowania elektromagnetycznego
o grawitony – przenoszą oddziaływanie grawitacyjne
leptony – cząstki o bardzo małej masie
o elektrony
o neutrino
mezony – o masie 1 u, mogą mieć ładunek „+”, „-”, lub „0”, są odpowiedzialne za spójność
bariony
o protony
o neutrony
Izotopy – atomy pierwiastka o tej samej liczbie atomowej i różnej liczbie masowej (p
+
1
= p
+
2
, n
0
1
n
0
2
)
wodór – prot, deuter, tryt.
Energia wiązania – energia jaką należałoby dostarczyć do jądra atomu, aby rozdzielić je na
poszczególne nukleony.
Energia odpowiedzialna za zniknięcie 1 u:
E = 1,49 × 10
-10
J
E = 931 × 10
6
eV
lżejsze jądra atomowe są trwałe (p
+
=n
0
, tlen
16
O)
cięższe jądra atomowe są mniej trwałe (p
+
>n
0
, ołów
208
Pb)
ze wzrostem liczby atomowej wzrasta odpychanie elektrostatyczne pomiędzy p
+
wszystkie pierwiastki powyżej bizmutu (
83
Bi) są promieniotwórcze
powłokowy model jądra (nukleony tworzą powłoki
magiczne liczby p
+
lub n
0
(2, 8, 20, 28, 50, 82, 126)
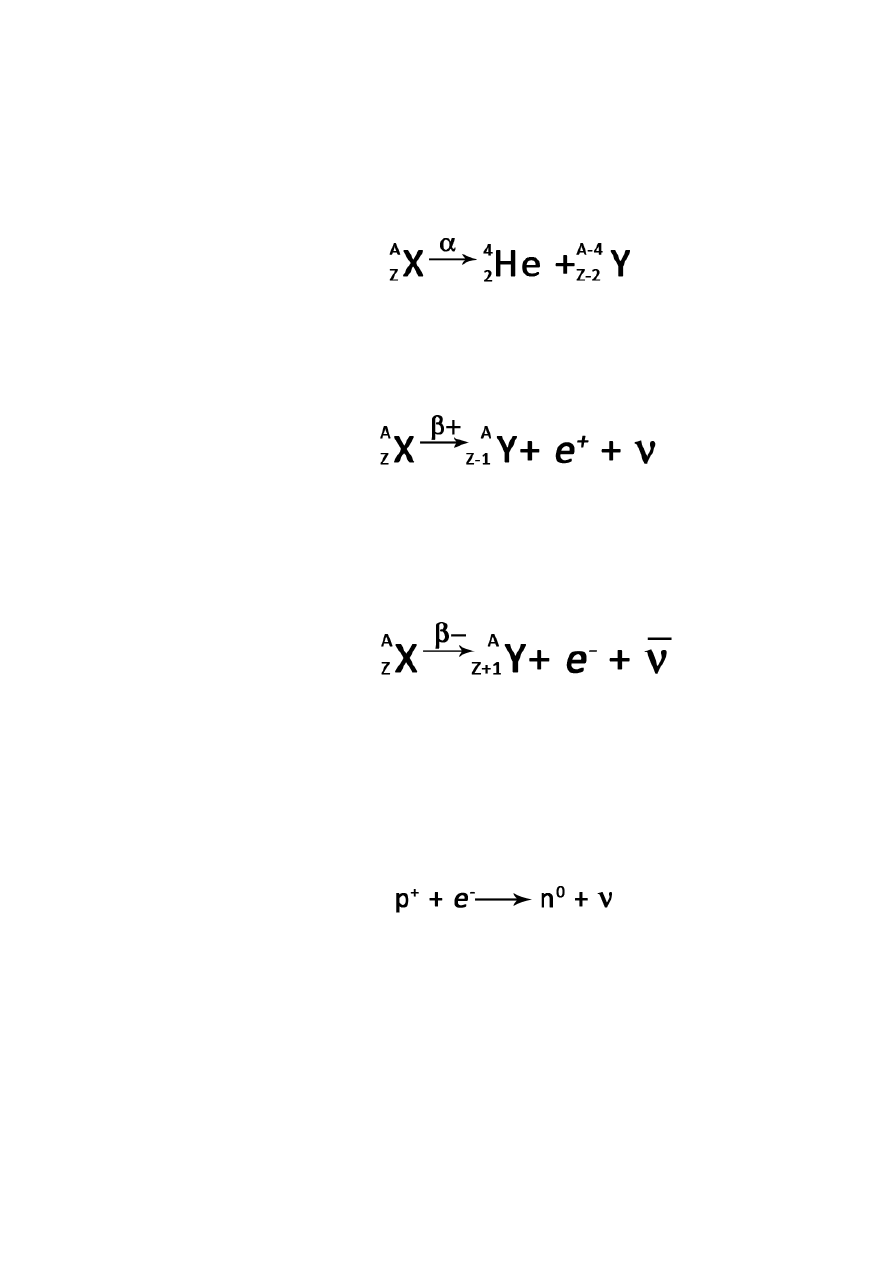
26
Promieniotwórczość – zdolność do ulegania mniej lub bardziej szybkiemu samorzutnemu rozpadowi
połączonemu z emisją różnego rodzaju promieniowania. Samorzutne reakcje
jądrowe to:
emisja α
o przemiana jąder o zbyt dużej liczbie masowej,
o zmniejszenie liczby atomowej i masowej
emisja β
+
o zmniejszenie liczby atomowej
o emisja pozytonu i neutrino (e
+
= β
+
)
o ν – neutrino – cząstka o znikomej masie spoczynkowej, bez
ładunku
o tylko dla sztucznych izotopów
emisja β
-
o zwiększenie liczby atomowej
o emisja negatonu i antyneutrino (e
-
= β
-
)
o przemiana neutronu w proton poprzez emisję bozonu
pośredniczącego przez jeden z kwarków neutronu W
-
→e
-
+ ν
-
o emisja γ
o ulegają jej naturalne izotopy
wychwyt K
o zmniejszenie liczby protonów
o zwiększenie liczby neutronów
o liczba masowa nie zmienia się
o wychwytowi elektronu z powłoki „K” ulegają przeważnie
jądra ciężkie na miejsce brakującego przeskakuje e z wyższej
orbity (musi się pozbyć nadmiaru energii)
o na zewnątrz emitowane jest promieniowanie rentgenowskie
o emisja promieniowania γ przez jądro atomowe
emisja γ
Rozszczepienie jądra atomowego:
rozpad jądra na dwa rzadziej więcej fragmenty o zbliżonych masach
emisja n
0
promieniowanie γ – obydwa fragmenty powstałe w rozczepieniu są jądrami
neutrononadmiarowymi
emisja n
0
opóźnionych
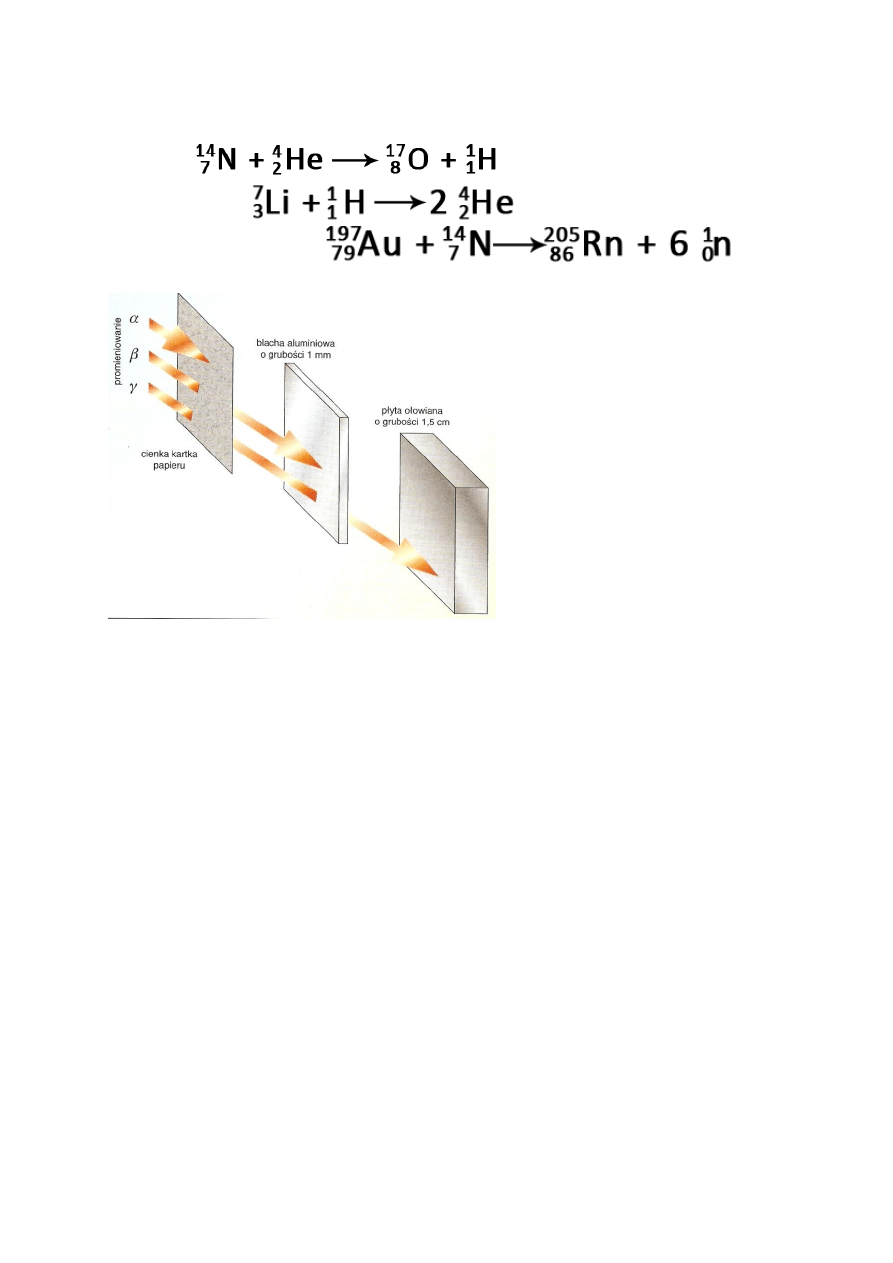
27
Wymuszone reakcje jądrowe:
α
protony
inne jądra atomowe
Zasięg promieniowania:
Zastosowania izotopów:
badania dyfuzji w układach stałych
określenie rozpuszczalności substancji trudno rozpuszczalnych
badanie mechanizmów reakcji chemicznych
o R-COOH + HCOH
3
→ RCOOCH
3
+ H
2
O
określanie wieku przedmiotów (izotop węgla
14
C – τ
½
= 5730 lat)
radiofarmaceutyki np. (technet – 99m, jod – 131, tal – 201, gal – 67, miedź – 64)
o radioizotopowa diagnostyka (topograficzna, czynnościowa)
o terapia izotopowa
o obrazowanie molekularne
Radioizotopy:
57
Co – niedokrwistość złośliwa
75
Se – badanie trzustki
18
Fe – diagnostyka onkologiczna
131
I – leczenie guzów tarczycy
89
Sr – leczenie przerzutów nowotworów kości
Postać radiofarmaceutyku:
proste jony (
131
I
-
,
99m
TcO
4
-
,
111
In
3+
)
roztwory koloidalne – badania wątroby
cząsteczki znakowane (florodeoksyglukoza)
kompleksy (Cardiolit)

28
Cechy radionuklidu:
rodzaj emitowanego promieniowania
okres półtrwania
długość wydalania z organizmu
czystość biologiczna i radiochemiczna
mechanizm lokalizacji
1. transport aktywny (
123
I – tarczyca,
99m
TcO
4
-
- tarczyca, selenometionina – trzustka,
201
Ti – obrazowanie serca
2. dyfuzja pasywna – związki litofilne
przemiany stereoizometryczne – łączenie z pewnymi grupami
zmiana właściwości
zahamowanie dyfuzji zwrotnej
3. fagocytoza
4. adsorpcja, chemisorpcja
5. wiązanie z receptorem
6. wiązanie z antygenem
7. wychwyt metaboliczny (fluorodeoksyglukoza)
Wykład 10.
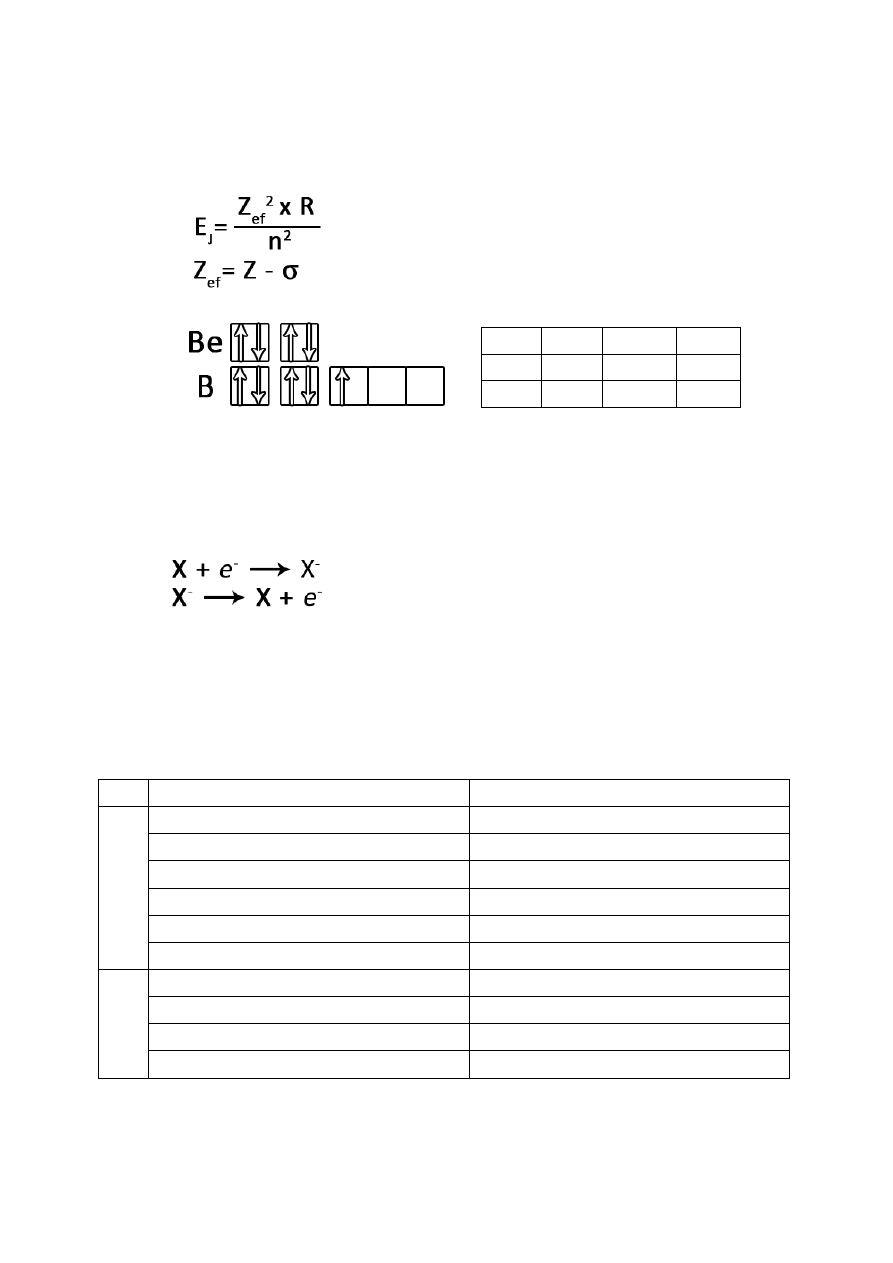
Struktura blokowa układu okresowego.
Układ okresowy opracowany przez Mendelejewa. Podzielony na 18 grup i 7 okresów.
Co można określić na podstawie położenie w układzie okresowym?
liczbę atomową i masową
liczbę cząstek elementarnych
konfigurację elektronową
konfigurację walencyjną
liczbę powłok elektronowych
wartościowość w związku chemicznym
właściwości fizyczne i chemiczne
o 1-2 grupa – blok s
o 3-12 grupa – blok d
o 13-18 grupa – blok p
o lantanowce, aktynowce – blok f
Blok „s”
litowce i berylowce
metale
aktywne chemiczne (łatwo ulegają jonizacji)
silne reduktory
stopień utlenienia odpowiednio +1 i +2
występują głównie w związkach (ze względu na reaktywność)
niskie gęstości, duże objętości molowe, duże promienie atomowe
dobre przewodnictwo elektryczne i cieplne
krystalizują
29
Blok „p”
borowce, węglowce, azotowce, tlenowce, fluorowce i helowce (gazy szlachetne)
metale
o stopień utlenienia: +2, +4
o na niższych stopniach utlenienia – właściwości redukujące
o na wyższych stopniach utlenienia – właściwości utleniające
o ze wzrostem liczby atomowej rośnie gęstość, temperatura wrzenia i topnienia,
właściwości metaliczne pierwiastków
niemetale
o w postaci wolnej lub w związkach
o na kliku stopniach utlenienia - dodatnim lub ujemnym
o łatwość przyłączania e
o ze wzrostem liczby atomowej w danej grupie maleje zdolność niemetali do
przechodzenia w stan zjonizowany
o często w postaciach alotropowych
o występują we wszystkich stanach skupienia
gazy szlachetne
o bezbarwne
o stan gazowy
o jednoatomowe gazy
o bierne chemicznie
o powłoka walencyjna ns
2
np
6
Blok „d”
skandowce, tytanowce, wanadowce, chromowce, manganowce, żelazowce, kobaltowce,
niklowce, miedziowce, cynkowce
metale
kilka stopni utlenienia
ciała stałe (za wyjątkiem rtęci – Hg)
dobra przewodność cieplna i elektryczna
duża gęstość
tworzą związki kompleksowe (cynk – bezbarwne)
Okresowość wymiarów atomowych
promienie maleją w grupie od dołu do góry
promienie maleją w okresie od lewej do prawej
Promienie jonowe:
odległość najbardziej oddalonego e od jądra atomowego w przypadku utworzonych z
jednego atomu jonu
zmiana natury atomu po przejściu w postać jonu
Na – 186 pm
Na
+
- 99 pm
Mg – 160 pm
Mg
2+
- 72 pm
Cl – 99 pm
Cl
-
- 181 pm
rosną w dół w grupach
aniony większe niż kationy
orbitalny promień atomowy
30
energia jonizacji – EJ – energia potrzebna do oderwania elektronu najsłabiej związanego z atomem
atom + EJ → kation + e
-
odzwierciedla energię orbitalu, z którego usuwany jest elektron
zależy od głównej liczby kwantowej „n” i efektywnego ładunku jądra Z
ef
najwyższa u gazów szlachetnych najniższa u litowców
zależy od:
o promienia atomu
o budowy powłoki z jakiej jest usuwany e
o skuteczności ekranowania
o ładunku jądra
Powinowactwo elektronowe – PE
1
PE < EJ
Elektroujemność – miara zdolności atomu pierwiastka do przyciągania e podczas tworzenia wiązania
chemicznego (najwyższa F – 4,0)
w okresie rośnie w prawo
w grupie rośnie w górę
Charakter metaliczny, niemetaliczny:
NIEMETALE
NIEMETALE
W
ła
śc
iw
o
śc
i f
iz
yc
zn
e
Dobre przewodnictwo elektryczne
Słabe przewodnictwo elektryczne
Ciągliwe
Nieciągliwe
Kowalne
Niekowalne
Z reguły stały stan skupienia (wyj. Hg)
Stan skupienia stały, ciekły i gazowy
Wysoka temperatura topnienia i wrzenia
Niska temperatura topnienia i wrzenia
Dobre przewodnictwo cieplne
Słabe przewodnictwo cieplne
W
ła
śc
iw
o
śc
i
ch
emi
cz
n
e
Reagują z kwasami
Nie reagują z kwasami
Tworzą zasadowe tlenki
Tworzą kwasowe tlenki
Tworzą kationy
Tworzą aniony
Tworzą jonowe halogenki
Tworzą kowalencyjne halogenki
I
1
I
2
I
3
Be
9,3
18,2
154
B
8,3
25,1
37,9

31
Podsumowanie zmian wzdłuż układu okresowego:
w dół
o rośnie
promień atomowy
aktywność chemiczna metali
o maleje
powinowactwo elektronowe
energia jonizacji
aktywność chemiczna niemetali
elektroujemność
w prawo
o rośnie
energia jonizacji
powinowactwo elektronowe
charakter niemetaliczny
o maleje
promień atomowy
charakter metaliczny
Wykład 11.
Wiązania chemiczne.
Typy wiązań chemicznych:
kowalencyjne
o między atomami tego samego pierwiastka
o między atomami pierwiastków sąsiadujących ze sobą
o mała różnica elektroujemność (x<0,4)
o uwspólnianie pary elektronowej
o gęstość elektronowa jednakowa na obu atomach
kowalencyjne spolaryzowane
o przesunięcie pary (gęstości) elektronowej
o różnica elektroujemność na poziomie 0,4<x<1,7
o biegunowy charakter („+” i „-”)
o posiadają moment dipolowy (dipole)
o gęstość elektronowa większa w pobliżu atomu bardziej elektroujemnego
jonowe
o między atomami skrajnie położonymi
o duża różnica elektroujemności
o występuje
we wszystkich solach jonowych
solach amonowych
o przyciąganie elektrostatyczne, całkowite przejęcie
metaliczne
o elektrony swobodne
o elektrony walencyjne należą do wszystkich atomów - delokalizacja
o wiązania niekierunkowe

32
* oddziaływania van der Waalsa (NIE WIĄZANIA)
o siły oddziaływania pomiędzy atomami należącymi do sąsiednich cząsteczek
o odpowiedzialne za:
stan skupienia substancji
przemiany fazowe
absorbcję fizyczną
rozpuszczalność
o elektron w ciągłym ruchu – szybkozmienny dipol
wiązania orientacyjne:
dipol trwały–dipol trwały
wiązania indukowane:
dipol trwały–dipol indukowany
wiązania indukowane:
dipol indukowany–dipol indukowany
koordynacyjne – donorowo-akceptorowe
o uwspólnienie pary elektronowej jednego atomu
o H
3
O
+
, H
2
SO
4
, H
3
PO
4
, HClO
2
wodorowe
o wysoki stopień ukierunkowania
o maksymalna trwałość (gdy atom akceptorowy do tworzenia wiązania wodorowego
znajduje się na linii wiązania O–H, N–H)
o kooperatywność
Cechy kryształów związków z określonymi typami wiązań:
kryształ kowalencyjny
o wiązania atomowe – najsilniejsze
o wysoka temperatura topnienia
o duża wytrzymałość mechaniczna
o duża trwałość
o nie przewodzą prądu – czyste
o nierozpuszczalne w rozpuszczalnikach polarnych i niepolarnych
o np. diament, krzem
kryształ molekularny, cząsteczkowy
o oddziaływania van der Waalsa
o niskie temperatury topnienia
o niska wytrzymałość
o niewielka twardość
o nie przewodzą prądu elektrycznego
o rozpuszczalne w rozpuszczalnikach niepolarnych
o np. stałe O
2
, N
2
, CO
2
, CH
4
, gazy szlachetne; większość zw. organicznych
kryształ jonowy
o oddziaływania elektrostatyczne, wiązania jonowe
o wysoka temperatura topnienia
o wysoka wytrzymałość mechaniczna
o duża trwałość
o po stopieniu i rozpuszczeniu przewodzą prąd
o na ogół rozpuszczalne w rozpuszczalnikach polarnych
o mała lotność
o np. tlenki, chlorki litowców i berylowców
Energia wiązań:
- podstawowe – 100-600kJ/mol
- van der Waalsa – 0,2-20kJ/mol

33
kryształ metaliczny
o gaz elektronowy – chmura elektronów swobodnych
o przewodzą prąd elektryczny
o dobrze przewodzą ciepło
o połysk metaliczny
o kowalność
o zróżnicowane temperatury topnienia i wrzenia oraz wytrzymałość
o metale bloku s, p, d
Wykład 12.
Utlenianie i redukcja.
Im większa elektroujemność tym większe przyciąganie e
-
.
reakcje red-ox – reakcje w których dochodzi do zmiany stopnia utlenienia pierwiastków np.
Fe + S → FeS
stopień utlenienia – liczba e, które dany atom przekazał lub przyjął od innego atomu w ramach
tworzenia z nim wiązania chemicznego (nie utożsamiać z wartościowością)
Suma stopni utlenienia w cząsteczce obojętnej jest równa 0.
Suma stopni utlenienia w cząsteczce lub atomie jonowym jest równa ładunkowi jonu.
Pierwiastki w stanie wolnym mają stopień utlenienia równy 0 we wszystkich odmianach
alotropowych.
Charakterystyczne stopnie utlenienia:
fluor (-I)
tlen (-II); wyjątki:
nadtlenki - BaO
2
(-I)
ponadtlenki - KO
2
(-½ )
jon oksygenylowy - O
2
+
(+½ )
fluorek tlenu - OF
2
(+II)
wodór (I); wyjątki:
wodorki litowców i berylowców (-I)
Utleniacze:
metale: Fe (III), Cu (II), Sn(IV), MnO
4
-
niemetale: O
2
, O
3
, S, fluorowce, NO
3
-
, ClO
4
-
, SO
4
2-
, H
2
O
2
Reduktory:
metale: w stanie wolnym (I i II grupa), Sn (II), Fe (II)
niemetale: H
2
, C, fluorowce, SO
3
2-
, NO
2
-
Wzrost stopnia utleniania powoduje:
wzrost:
o właściwości utleniających
o mocy kwasów tlenowych
o tendencji do tworzenia anionów
spadek
o właściwości redukujących
o mocy wodorotlenków
o tendencji do tworzenia kationów

34
Reakcja dysproporcjonowania (dysmutacji) – ta sama substancja jest dla siebie utleniaczem i
reduktorem.
Reakcja syn proporcjonowania – dwie substancje o dwóch różnych stopniach utlenienia przechodzą w
jednakowy stopień utlenienia.
Reakcja utleniania i redukcji może być rezultatem:
zderzeń atomów, cząsteczek, jonów (obie reakcje cząsteczkowe zachodzą w tym samym
czasie i miejscu
przestrzennego oddzielenia reakcji utleniania od reakcji redukcji, zastosowanie
przewodników:
o elektronowego – elektrody do transportu e
-
o jonowego – elektrolitu do transportu naładowanych cząsteczek – jonów
Reakcje utleniania i redukcji zachodzą z udziałem e
-
wymienionych z przewodnikiem elektronowym –
elektrodą nazywamy reakcjami elektrochemicznymi:
o reakcja utleniania substancji – reakcja anodowa – na anodzie
o reakcja redukcji substancji – reakcja katodowa – na katodzie
Równanie Nernsta – zależność elektrochemiczna wyrażająca potencjał elektrody względem jej
potencjału standardowego
Elektrody:
metaliczne
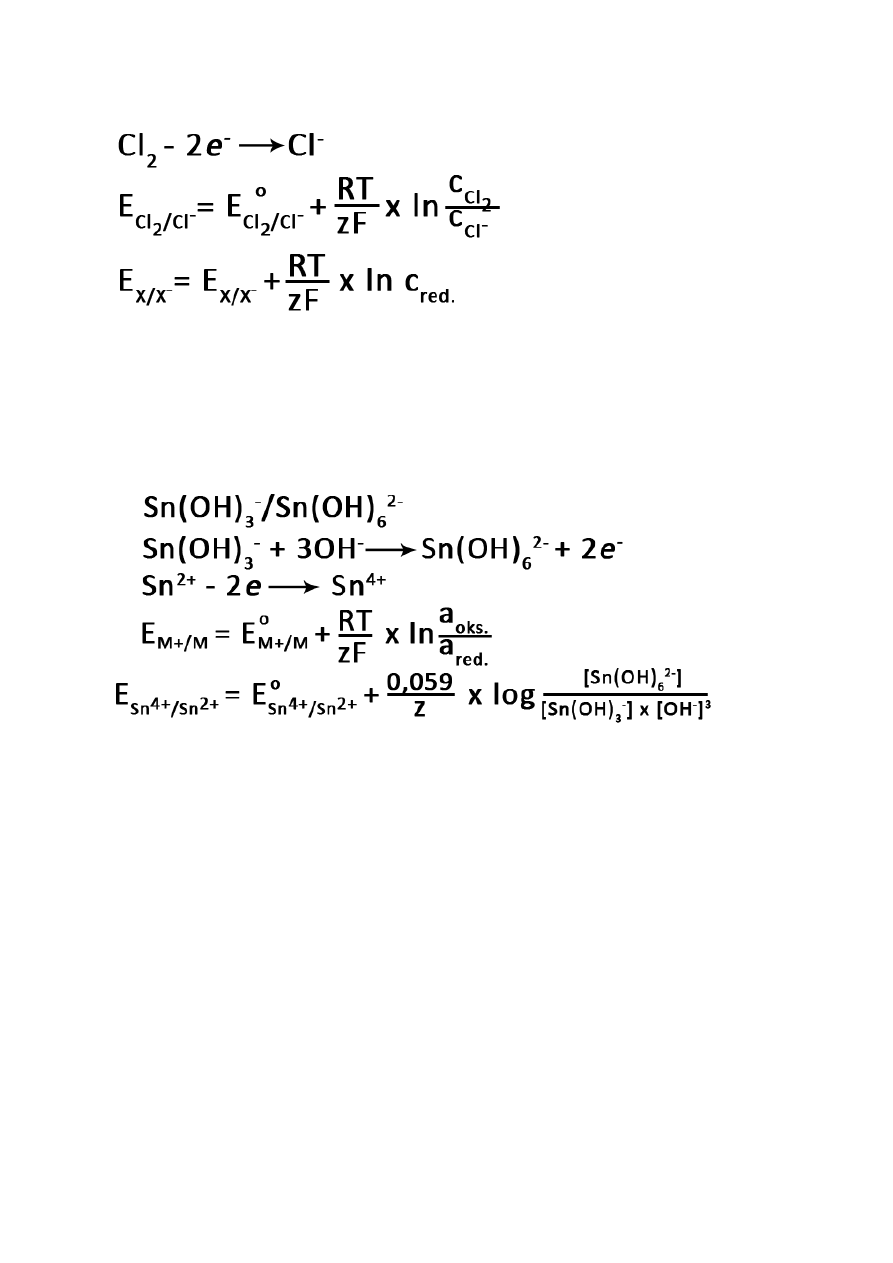
35
gazowe
Potencjał półogniwa red-ox zależy od:
właściwości danego układu
stosunku stężeń składników układu
stężenia H
+
obecności związków tworzących trudno rozpuszczalne lub kompleksowe połączenia
Wpływ pH na potencjał:
Pomiar potencjału, elektrody wzorcowe. Potencjał pojedynczej elektrody możemy zmierzyć przy
pomocy ogniwa w którym jedna elektroda jest wzorcowa, czyli ma znany niezmienny potencjał
(odniesienia).
Szereg elektrochemiczny zawiera informację:
który pierwiastek jest bardziej reaktywny
kierunek reakcji samorzutnych, a dokładnie które:
o mogą wypierać wodór z rozcieńczonych roztworów kwasów
o są odporne na działanie rozcieńczonych kwasów
o mogą wypierać metale z roztworów
Im bardziej dodatni potencjał tym silniejsze zdolności utleniające roztworu.
Korozja:
niszczenie materiału pod wpływem
o działania środowiska otaczającego
atmosfera, opady, woda
o czynników technologicznych uwalnianych do atmosfery przez człowieka
tlenki siarki, azotu, węgla, kurz chemikalia
metoda ochrony – pokrywanie metalem anodowym np. cynkiem

36
Pasywacja:
metal znajduje się w stanie pasywnym gdy ma znacznie większą odporność na korozję niż
wskazana w szeregu napięciowym.
pasywność jest wynikiem powstawania na powierzchni metalu cienkiej nierozpuszczalnej
warstwy tlenków tych metali, np. glin

37
1. Otrzymywanie:
NaH + H
2
O → NaOH + H
2
(Na
+
+ H
-
+ H
+
+ OH
-
→ Na
+
+ OH
-
+ H
2
)
wodorki magnezu i berylu nie reagują
reforming:
konwersja:
elektroliza wody, wodnych roztworów soli, wodorotlenków litowców, kwasów
wypieranie wodoru z kwasów (Zn + HCl → ZnCl
2
+ H
2
; 2Na + H
2
O→2NaOH + H
2
)
2. Charakterystyka:
najlżejszy, bezbarwny, bez zapachu i smaku
duża szybkość dyfuzji
najlepsze przewodnictwo ciepła wśród gazów
dwie odmiany:
o parawodór - 25% w temperaturze pokojowej – przeciwny spin
o ortowodór - 75% w temperaturze pokojowej – zgodny spin
znaczna rozpuszczalność w metalach
w temperaturze pokojowej brak aktywności chemicznej
o reaguje tylko z F
2
o reakcja z Cl
2
przy naświetlaniu promieniowaniem elektromagnetycznym
izotopy:
o prot -
1
H
o deuter -
2
H
ok. 0,02% w H
2
O
wielokrotna elektroliza wody (na katodzie łatwiej ulega redukcji
H
+
niż D
+
(ciężka woda)
z 1m
3
– 30 cm
3
wody ciężkiej
nieco wyższa temperatura wrzenia i topnienia
gorsza przewodność
o tryt -
3
H
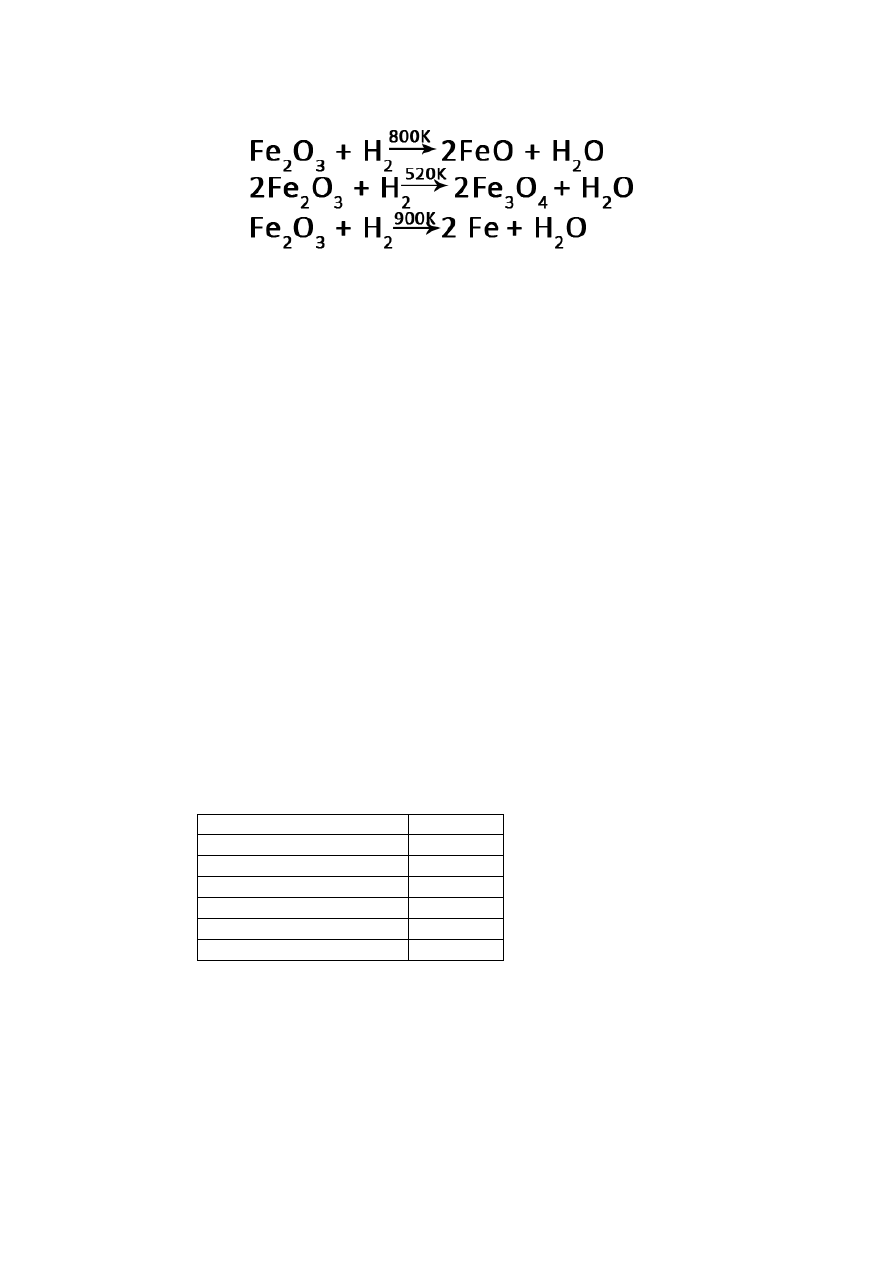
38
silny reduktor
tworzy mieszaninę piorunującą z tlenem (spalając się tworzy wodę)
słaba rozpuszczalność w H
2
O i innych cieczach
3. Związki:
wodorki
o typu soli
jonowe
oddziaływania elektrostatyczne
z metalami I i II grupy
2K
(s)
+H
2(g)
→2KH
(s)
biała barwa, wysoka topliwość
struktura krystaliczna, odpowiednik halogenku
silne reduktory
o metaliczne
połączenia wodoru z metalami zewnętrzno- i wewnętrzno
przejściowymi
połysk i właściwości metaliczne
nielotne
przewodzą prąd
o kowalencyjne
bor, grupy 14-17
na ogół lotne (HCl, HF, H
2
S)
otrzymywanie:
FeS + 2HCl → H
2
S + FeCl
2
4. Właściwości:
5. Zastosowanie:
otrzymywanie m.in.:
o amoniaku metodą Habera
o metanolu
hydrametalurgiczne wydzielanie Cu (Cu
2+
+ H
2
→ Cu + 2H
+
)
uwodornienie (…C=C… + H
2
→ …CH-CH…)
Substrat
Produkt
Metal grupy I
MH
Metal grupy II
MH
2
Niektóre metale bloku d
MH
x
Tlen
H
2
O
Azot
NH
3
Fluorowiec
HX

39
Wykład 13.
Analiza wszystkich grup anionów.
Dodatek z analizami na koniec.
Wykład 14.
Systematyka cd.
Nazwa
Lit
sód
potas
rubid
cez
frans
Symbol
Li
Na
K
Rb
Cs
Fr
Powłoka
walencyjna
2s
1
3s
1
4s
1
5s
1
6s
1
7s
1
Liczba
atomowa
3
11
19
37
55
87
Wśród najczęściej występujących w skorupie ziemskiej należą: sód i potas.
Postać w jakiej występują pierwiastki w przyrodzie:
lit
o spodumen: LiAl[Si
2
O
6
]
o ambligonit: [LiAl(PO
4
F)]
sód
o albit: NaAl[Si
3
O
8
]
o NaCl
o NaNO
3
potas
o sylwin: KCl
o karnalit: KMg
o glinokrzemiany
rubid, cez
o towarzyszą pozostałym litowcom
frans
o znaleziony przy rozpadzie jądra uranu
Ogólna charakterystyka litowców:
metale
białe lub srebrzyste
miękkie
najmniejsza gęstość spośród pierwiastków (Li, Na i K mają mniejszą gęstość od H
2
O)
reaktywne
niska energia jonizacji –E
o
(ok. -3V)
najbardziej elektrododatnie pierwiastki, tzw. metale alkaliczne
w wysokich temperaturach tworzą pary jednoatomowe barwiące płomień
o lit – karminowo-czerwony
o sód – żółty
o potas, rubid, cez – fioletowy

40
Właściwości chemiczne i fizykochemiczne litowców i ich związków:
1. Utlenianie metali powietrzem
a. wolne powietrze
6Li + N
2
→ 2Li
3
N
4M + O
2
→ 2M
2
O (M= Na, K, Rb, Cs, Fr)
b. spalanie w powietrzu
4Li + O
2
→ 2Li
2
O
2Na + O
2
→ Na
2
O
2
Na
2
O
2
+ 2Na → 2Na
2
O
M + O
2
→ MO
2
(M = K, Rb, Cs, Fr)
2. Reakcje metali i ich związków z wodą:
2M + 2H
2
O → 2MOH + H
2
^ (M= Li, Na, K, Rb, Cs, Fr)
Li
3
N + 3H
2
O → 3LiOH + NH
3
^
M
2
O + H
2
O → 2MOH (M= Li, Na, K, Rb, Cs, Fr)
M
2
O
2
+ H
2
O → 2MOH + H
2
O
2
(M= Na, K, Rb, Cs, Fr)
2MO
2
+ 4H
2
O → 2MOH + 2H
2
O
2
+ O
2
(M= K, Rb, Cs, Fr)
M
2
O – wybitnie zasadowy charakter
M
2
O
2
, MO
2
– silne utleniacze
3. Reakcje z siarką:
a. tworzenie siarczków
2M + S → M
2
S (M= Li, Na, K, Rb, Cs, Fr)
b. tworzenie M
2
S
n
(n = 2, 3, 4, 5 lub 6)
2M + 4S → M
2
S
4
(M= Li, Na, K, Rb, Cs, Fr)
4M + S
8
→ 2M
2
S
4
4. Reakcje z wodorem:
2M + H
2
→ 2MH (M= Li, Na, K, Rb, Cs, Fr)
MH + H
2
O → MOH + H
2
(M= Li, Na, K, Rb, Cs, Fr)
silne reduktory
Li[AlH
4
], Na[BH
4
]
4LiH + AlCl
3
→ Li[AlH
4
] + 3LiCl
działanie redukujące
4BClI
3
+ 3Li[AlH
4
] → 2B
2
H
6
+ 3LiCl + 3AlCl
3
PCl
3
→ PH
3
SiCl
4
→ SiH
4
5. Hydratacja:
a. podatność jonów litowców na hydratację
Li
+
> Na
+
> K
+
> Rb
+
> Cs
+
> Fr
+
b. podatność do tworzenia soli uwodnionych
sole litu – wszystkie
sole sodu – liczne
sole potasu – niewiele
sole rubidu, cezu, fransu – wszystkie bezwodne
6. Rozpuszczalność związków w H
2
O:
większość soli litowców dobrze rozpuszczalna
energia sieciowa > energia hydratacji
trudno rozpuszczalne sole litowców
Li
2
CO
3
, Li
3
PO
4
, LiF, LiOH
KClO
4

41
7. Sole litowców:
a. głównie bezbarwne
b. większość dobrze rozpuszczalna w wodzie
c. silne elektrolity
8. Trwałość tlenowych soli litowców
a. sole tlenowe mają budowę jonową, dużą trwałość – siarczany i fosforany
b. węglany przed rozłożeniem w wysokiej temperaturze ok. 1000
o
C ulegają stopieniu
(LiCO
3
– ma najmniejszą trwałość)
c. wodorowęglany są trwałe (LiHCO
3
– nie istnieje stały)
d. węglany i wodorowęglany litowców (poza solami litu) mają dobrą rozpuszczalność w
wodzie
e. azotany (V) litowców są trwałe
silne ogrzewanie prowadzi do przechodzenia w azotyny (III)
2MNO
3
→ 2MNO
2
+ O
2
(M= Na, K, Rb, Cs, Fr)
4LiNO
3
→ 2Li
2
O + 4NO
2
+ O
2
9. Związki z węglem:
2Li + 2C + (T) → Li
2
C
2
(węglit)
2M + C
2
H
2
→ M
2
C
2
+ H
2
(M= Na, K, Rb, Cs, Fr)
M
2
C
2
+ 2H
2
O → 2MOH + C
2
H
2
K, Rb,Cs
tworzą niestechiometryczne barwne węgliki międzywęzłowe z
grafitem (C
60
M, C
36
M, C
8
M), atomy węgla tworzą uporządkowaną
sieć, pomiędzy przylegające atomy węgla wpasowują się atomy
metalu
10. Reakcje ze związkami organicznymi:
CH
3
COOH + MOH → CH
3
COOM + H
2
O (M= Li, Na, K, Rb, Cs, Fr)
RCOOH + MOH → RCOOM + H
2
O (mydła; M= Na, K; C=10-22)
11. Związki alkilowe i arylowe:
a. związki Li – kowalencyjne (m.in.: rozpuszczalne w eterze)
RCl + 2Li → LiR + LiCl
b. związki Na, K, Rb, Cs – budowa jonowa (M+R-)
2M + HgR
2
→ Hg + 2MR (M= Na, K, Rb, Cs, Fr)
12. Kompleksy metali alkalicznych
a. mogą tworzyć kompleksy chylatowe ze związkami organicznymi (np. aldehyd
salicylowy, acetyloaceton)
b. liczba koordynacyjna 4 lub 6
Otrzymywanie:
nie można ich otrzymać przez redukcję tlenków
elektroliza wodnych roztworów ich soli
o katoda rtęciowa – tworzenie amalgamatu – sól otrzymywana metodą Castnera-
Kellnera
o 2Na
+
Cl
-
→ 2NaHg
(amalgamat)
+ Cl
2
elektroliza stopniowych związków (w obecności CaCl
2
)
o Na
metoda Downsa – stopienie NaCl
metoda Castnera – stopienie NaOH
o K
elektroliza stopionego KCl
przepuszczanie par sodu nad stopionym KCl (Na +KCl → NaCl + K)

42
Lit:
o względnie duże temperatury topnienia i wrzenia
o tlenek
o podwyższona twardość
o wyższe tlenki nietrwałe
o najmniejsza elektrododatniość
Li
2
CO
3
, LiNO
3
, LiOH – mniej trwałe
LiHCO
3
– nie istnieje stały
o jony i związki litu dużo lepiej hydratowane niż jony innych litowców i ich związków
o Li
3
N
o Li
2
C
2
(po bezpośredniej reakcji z węglem)
o większa tendencja tworzenia kompleksów
akwakompleksy
jodek aminalitu [Li(NH
3
)
4
] – stan stały
o LiF, Li
2
CO
3
, Li
3
PO
4
nierozpuszczalne w wodzie
o LiOH – trudno rozpuszczalny w H
2
O
o kowalencyjne halogenki, związki alkilowe litu – rozpuszczalne w rozpuszczalnikach
organicznych.
Nazwa
beryl
magnez
wapń
stront
bar
rad
Symbol
Be
Mg
Ca
Sr
Ba
Ra
Powłoka
walencyjna
2s
2
3s
2
4s
2
5s
2
6s
2
7s
2
Liczba
atomowa
4
12
20
38
56
88
powłoka walencyjna: ns
2
wśród najczęstszych we wszechświecie: Mg
wśród najczęstszych w skorupie ziemskiej: Mg, Ca
Właściwości chemiczne berylowców:
1. utlenianie powietrzem
a. spalanie w azocie
3M + N
2
→ M
3
N
2
(M= Be, Mg, Ca, Sr, Ba)
b. tlenki
spalanie w tlenie (Be, Mg, Ca, Sr, Ba, Ra)
termiczny rozkład MCO
3
, M(OH)
2
, M(NO
3
)
2
, MSO
4
– (M= Be, Mg, Ca, Sr, Ba,
Ra)
M(OH)
2
→ MO + H
2
O
c. nadtlenki
M + O
2
→ MO
2
(Sr, Ba)
M(OH)
2
+ H
2
O
2
→ MO
2
+ 2H
2
O (Mg, Ca)
d. ponadtlenki – brak

43
2. reakcje z wodą
a. pierwiastki
M + 2H
2
O → M(OH)
2
+ H
2
(Mg, Ca, Sr, Ba)
Be + H
2
O → BeO + H
2
(Be)
b. azotki
M
3
N
2
+ 6H
2
O → 3M(OH)
2
+ 2NH
3
(Be, Mg, Ca, Sr, Ba)
c. tlenki
MO + H
2
O → M(OH)
2
(Mg, Ca, Sr, Ba)
d. nadtlenki
MO
2
+ 2H
2
O → M(OH)
2
+ H
2
O
2
(Mg, Ca, Sr, Ba)
reakcja z kwasem
MO
2
+ 2HCl → MCl
2
+ H
2
O
2
(Mg, Ca, Sr, Ba)
3. Tworzenie siarczków
a. M + S +(T)
M + S → MS (M= Be, Mg)
b. M(OH)
2
+ H
2
S
M(OH)
2
+ H
2
S → MS +2H
2
O (Ca, Sr, Ba)
c. niektóre tworzą wielosiarczki
MS
4
.
xH
2
O
4. Reakcje metali z wodorem
a. Me + H
2
→ MeH
2
(Mg, Ca, Sr, Ba)
2BeCl
2
+ Li[AlH
4
] → 2BeH
2
+ LiCl + AlCl
3
CaH
2
, SrH
2
, BaH
2
– jonowe
BeH
2
, MgH
2
– kowalencyjne, preferują polimeryzację
silne reduktory:
MH
2
+ 2H
2
O→ M(OH)
2
+ 2H
2
^ (Be, Mg, Ca, Sr, Ba)
tylko Be [XH
4
]
2
(X= pierwiastki III grupy głównej)
5. Reakcje z fluorowcami
a. MX
2
(T)
M + X
2
→ MeX
2
(M= Be, Mg, Ca, Sr, Ba)
b. halogenki berylu – budowa kowalencyjna, polimeryczne
c. powstałe jonowe
d. (BeF
2
)
n
– nierozpuszczalny w wodzie
e. MF
2
(M= Mg, Ca, Sr, Ba) – słabo rozpuszczalne w wodzie
f. MX
2
(M= Mg, Ca, Sr, Ba; X=pozostałe) – dobrze rozpuszczalne w wodzie
Właściwości fizykochemiczne berylowców:
podatność na hydratację
o Be
2+
> Mg
2+
> Ca
2+
> Sr
2+
> Ba
2+
> Ra
2+
o Be
.
4H
2
O
o Mg
.
12H
2
O
o Ca, Sr, Ba – do 8H
2
O
rozpuszczalność w H
2
O
o azotany, halogenki (bez F), octany – dobrze rozpuszczalne
o rozpuszczalność wodorotlenków i fluorków berylowców rośnie ze wzrostem liczby
atomowej
o większość M
3
(PO
4
)
2
, MCO
3
nierozpuszczalna w wodzie
trwałość soli tlenowych
o sole tlenowe są mniej trwałe od odpowiednich soli litowców
MCO
3
→ MO + CO
2
(M= Be, Mg, Ca, Sr, Ba)
MHCO
3
– nie istnieje w stanie stałym tylko w roztworze
berylowce: -2500
-1300
litowce: -500

44
związki berylowców z węglem
o jonowe węgliki berylowców (acetylenki)
M + 2C → MC
2
(M= Mg, Ca, Sr, Ba)
Be + C
2
H
2
→ BeC
2
+ H
2
^
o reakcje węglików z H
2
O
MC
2
+ H
2
O → M(OH)
2
+ H
2
C
2
(M= Mg, Ca, Sr, Ba)
BeC
2
+ H
2
O → 2BeO + CH
4
(niedobrane współczynniki)
związki organiczne
o sole z kwasami karboksylowymi
2CH
3
COOH + M(OH)
2
→ (CH
3
COO)
2
M + 2H
2
O (Ca, Sr, Ba)
o mydła nierozpuszczalne w wodzie
2RCOOH + M(OH)
2
→ (RCOO)
2
M + 2H
2
O (M= Ca, Sr, Ba; R: C= 10
22)
o magnez – związki metaloorganiczne (odczynniki Gringarda) z halogenkami alkilowymi
Mg + RX → RMgX
kompleksy
o typowe kompleksy nieorganiczne Be
2+
(BeF
4
)
2-
, [Be(C
2
O
4
)
2
]
2-
, [Be(H
2
O)
4
]
2+
, [Be(NH
3
)
4
]
2+
o kompleksy z kleszczowymi ligandami organicznymi
EDTA, chlorofil
Otrzymywanie:
Be, Ca – elektroliza stopionych chlorków
o MCl
2
→ M + Cl
2
Mg, Sr, Ba – metoda aluminotermiczna, redukcja tlenków glinem metalicznym
o 3MO + 2Al → M + Al
2
O
3
Beryl:
odmienność berylu
o atomy małe, tendencja do tworzenia wiązań kowalencyjnych
o w wodzie hydroliza (podobny do Al)
o tworzy dużo kompleksów
o ulega pasywacji
o jedyny pierwiastek amfoteryczny w II grupie
BeX
2
+ 2OH
-
→ Be(OH)
2
+ 2X
-
Be(OH)
2
+ 2OH
-
→ Be(OH)
4
2-
(+ H
2
O)
Be +NaOH +H
2
O → Na
2
[Be(OH)
4
] + H
2
^
o BeC
2
– w czasie hydrolizy uwalnia CH
4
o halogenki berylu są polimeryczne – deficyt elektronowy
o BeCl
2
– budowa prosta lub tworzy dimer
o tworzy polimeryczne wodorki i związki alkilowe
Wapń:
rola biologiczna
o pierwiastek budulcowy i regulacyjny w organizmie
o przekaźnik wtórny – kinazy białkowe
o przewodzenie impulsów bioelektrycznych
o udział w krzepnięciu krwi
o skurcz mięśni gładkich, szkieletowych i serca
o udział w reakcjach zapalnych, regeneracji i proliferacji
45
Magnez:
rola biologiczna
o uczestniczy w odbudowie fosforanowych źródeł energii skurcza mięśniowego: ATP i
fosfokreatyny
o uczestniczy w syntezie i replikacji DNA i RNA
o zapewnia dobre funkcjonowanie mitochondriów
o poprawia wchłanianie potasu
o bierze udział w przesyłaniu impulsów nerwowych (prawidłowy rytm pracy serca)
Wykład 15.
Systematyka cd.
powłoka
walencyjna
stopnie
utlenienia
wodorki tlenki
pierwiastki
związki
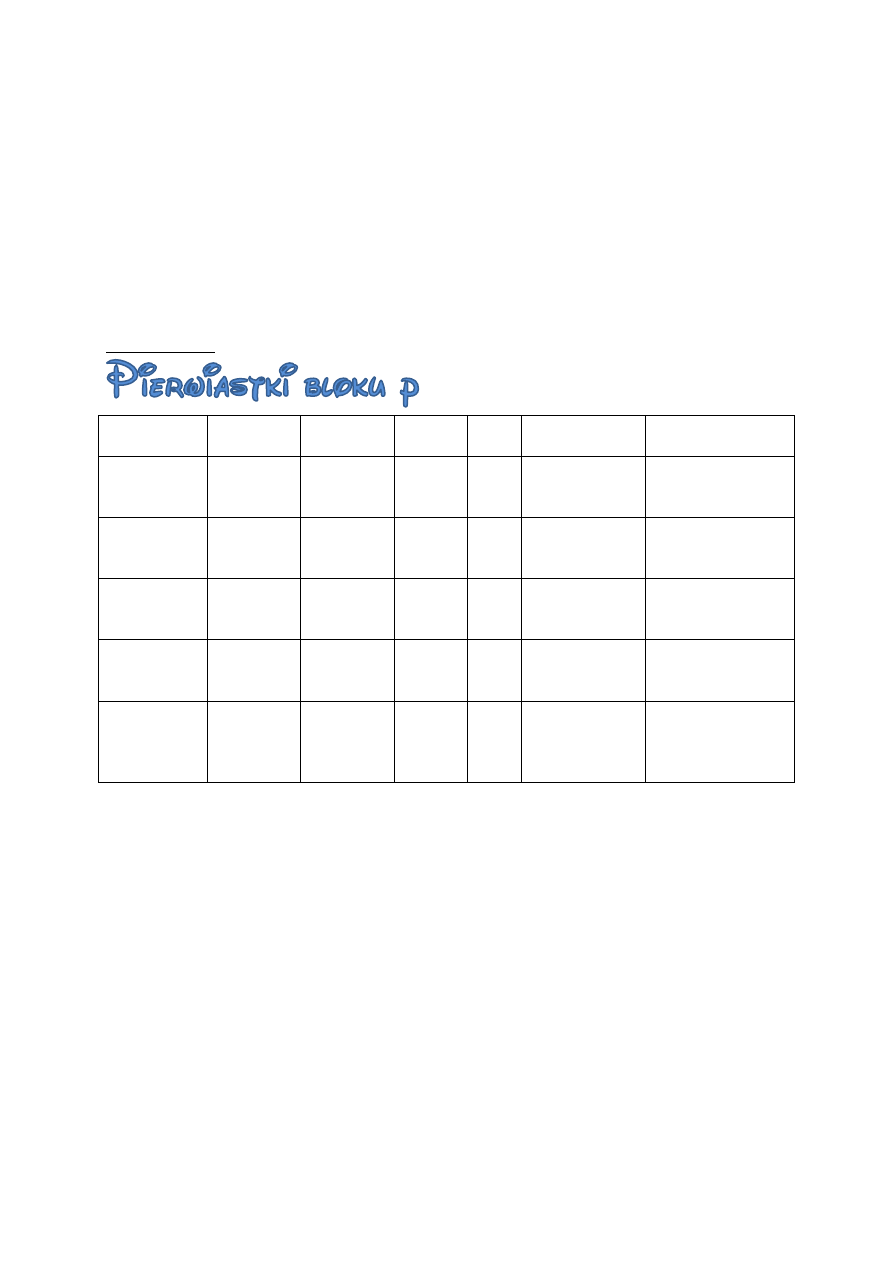
BOROWCE
s
2
p
1
+1, +3
XH
3
X
2
O
3
B - kwasowe
Al - amfoterycz.
reszta - zasad.
H
3
XO
3
X(OH)
3
HXO
2
WĘGLOWCE
s
2
p
2
+2, +4
XH
4
XO
2
XO
C, Si – kwas.
Ge, Sn, Pb –
amfoteryczne
H
2
XO
3
X(OH)
4
H
2
XO
3
X(OH)
2
H
2
XO
2
AZOTOWCE
s
2
p
3
+3, +5
XH
3
X
2
O
5
X
2
O
3
N, P – kwas.
As, Sb – amfot.
Bi – zasad.
HXO
3
, H
3
PO
4
X(OH)
3
HXO
2
X(OH)
3
TLENOWCE
s
2
p
4
+2, +4, +6
XH
2
X
2
O
3
XO
2
XO
O, S – kwas
Se, Te, Po –
amfoteryczne
H
2
XO
4
H
2
XO
3
X(OH)
4
H
2
XO
2
FLUOROWCE
s
2
p
5
+2, +3, +5,
+7
HX
X
2
O
7
X
2
O
5
X
2
O
3
X
2
O
Cl, Br, I -
kwasowe
HXO
4
HXO
3
HXO
2
HXO
Stopień utlenienia
(-3) amoniak NH
3
(-2) hydrazyna N
2
H
4
(-1) hydroksylamina NH
2
OH
(+1) podtlenek azotu N
2
O
(+2) tlenek azotu (II) NO
(+3) kwas azotowy (III) HNO
2
(+4) tlenek azotu (IV) NO
2
(+5) kwas azotowy (V) HNO
3
Zmiana właściwości:
wzrost liczby atomowej:
o wzrost
gęstości
temperatury wrzenia i topnienia
właściwości metalicznych
46
Metale bloku p:
znacznie mniej aktywne niż bloku s
stopień utlenienia +2 i +4
niższy stopień utlenienia – właściwości redukujące
wyższy stopień utlenienia – właściwości utleniające
metale o właściwościach amfoterycznych – Al
Niemetale bloku p:
O
2
, S, N
2
, P, fluorowce – niskie temperatury wrzenia i topnienia
C, Si, B – kryształy kowalencyjne
fluorowce i tlenowce – tworzenie kwasów beztlenowych
występowanie w postaci związków w stanie wolnym, w postaci cząsteczek
kilka stopni utlenienia od ujemnych po dodatnie
różne stany skupienia
odmiany alotropowe
Alotropia:
różne ułożenie pierwiastków w przestrzeni
wiązania między atomami tego samego pierwiastka
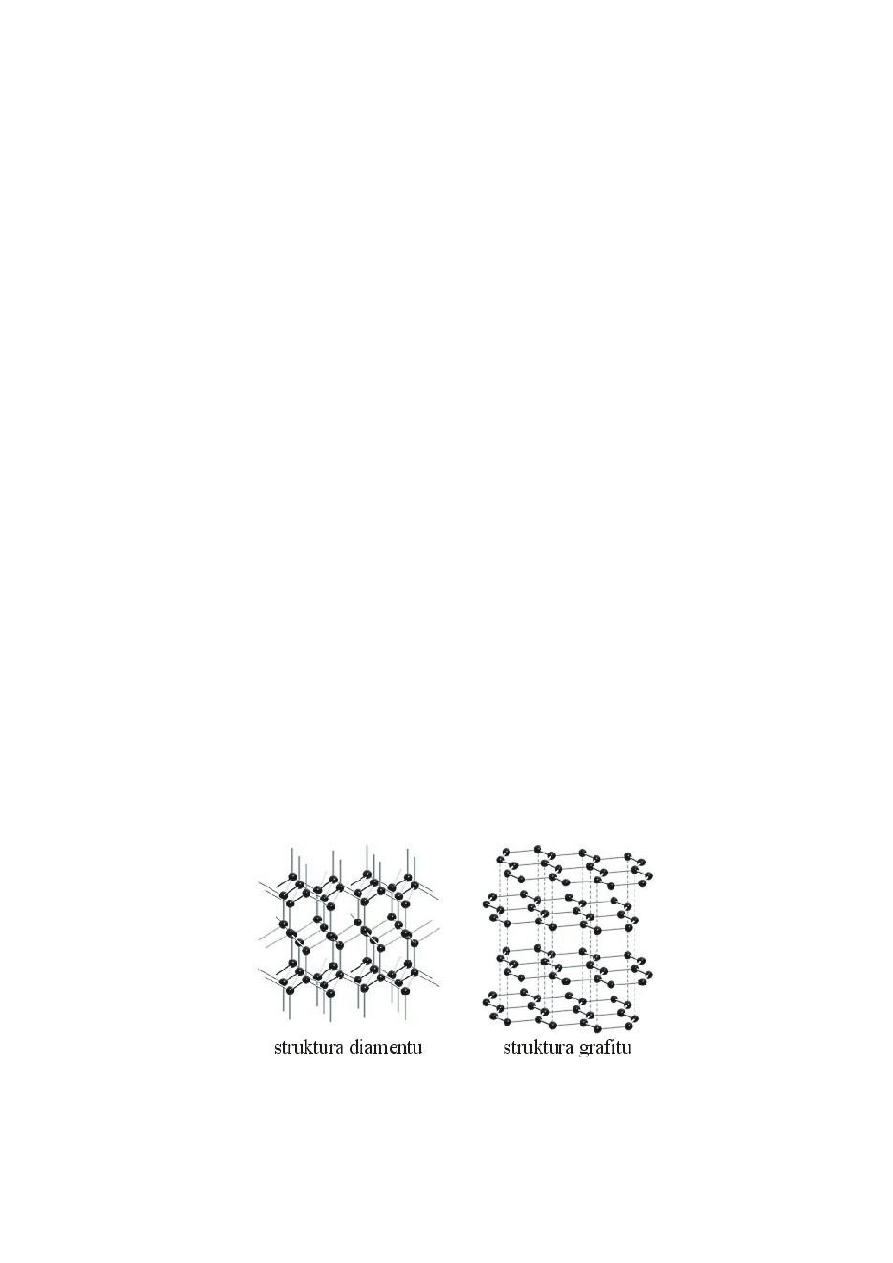
o węgiel
diament
każdy atom C – hybrydyzacja sp
3
każdy z podstawników na rogach tetraedru
jedna z najtwardszych substancji
bardzo wysoka temp. topnienia
bardzo mało reaktywna forma
nie przewodzi ciepła i prądu
grafit
każdy atom C – hybrydyzacja sp
2
znacznie miększy
niższa temperatura topnienia od diamentu
mała reaktywność (większa od diamentu)
oddziałuje z interkalatorami
słabe przewodnictwo elektryczne
właściwości kryształu kowalencyjnego
oddziaływania van der Waalsa między warstwami
fulereny
każdy atom C – hybrydyzacja sp
2
struktura sferyczna (C60, C560)
reakcje z interkalatorami (wprowadzane do środka sfery)
47
o tlen
tlen cząsteczkowy O
2
cząsteczka paramagnetyczna
bezbarwny
bez zapachu
1,42g/dm
3
w warunkach normalnych
stan tripletowy i singletowy (szkodliwy)
ozon O
3
niebieski gaz
cięższy od powietrza
niepalny, podtrzymuje palenie
dobrze rozpuszczalny w wodzie
nietrwały
w stanie wolnym występuje w atmosferze
zapach powietrza po burzy
bor, glin, gal, ind, tal
o bor – niemetal
o glin, gal, ind, tal – metale
+1 i +3 stopień utlenienia
o ze wzrostem liczby atomowej preferowany +1 stopień utlenienia
o bor +3 tylko
duża energia jonizacji
mały rozmiar jonów
duży ładunek elektryczny
wiązania kowalencyjne
o związki boru zawsze kowalencyjne
o inne związki AlCl
3
, GaCl
3
– w bezwodnym stanie, dysocjują na jony w roztworze
bor preferuje w związkach z wodorem struktury dimeryczne (diboran)
Deficyt elektronowy:
powłoka walencyjna
2s
2p
x
2p
y
2p
z
orbital cząsteczkowy
zdelokalizowany trójcentrowy

48
Właściwości chemiczne:
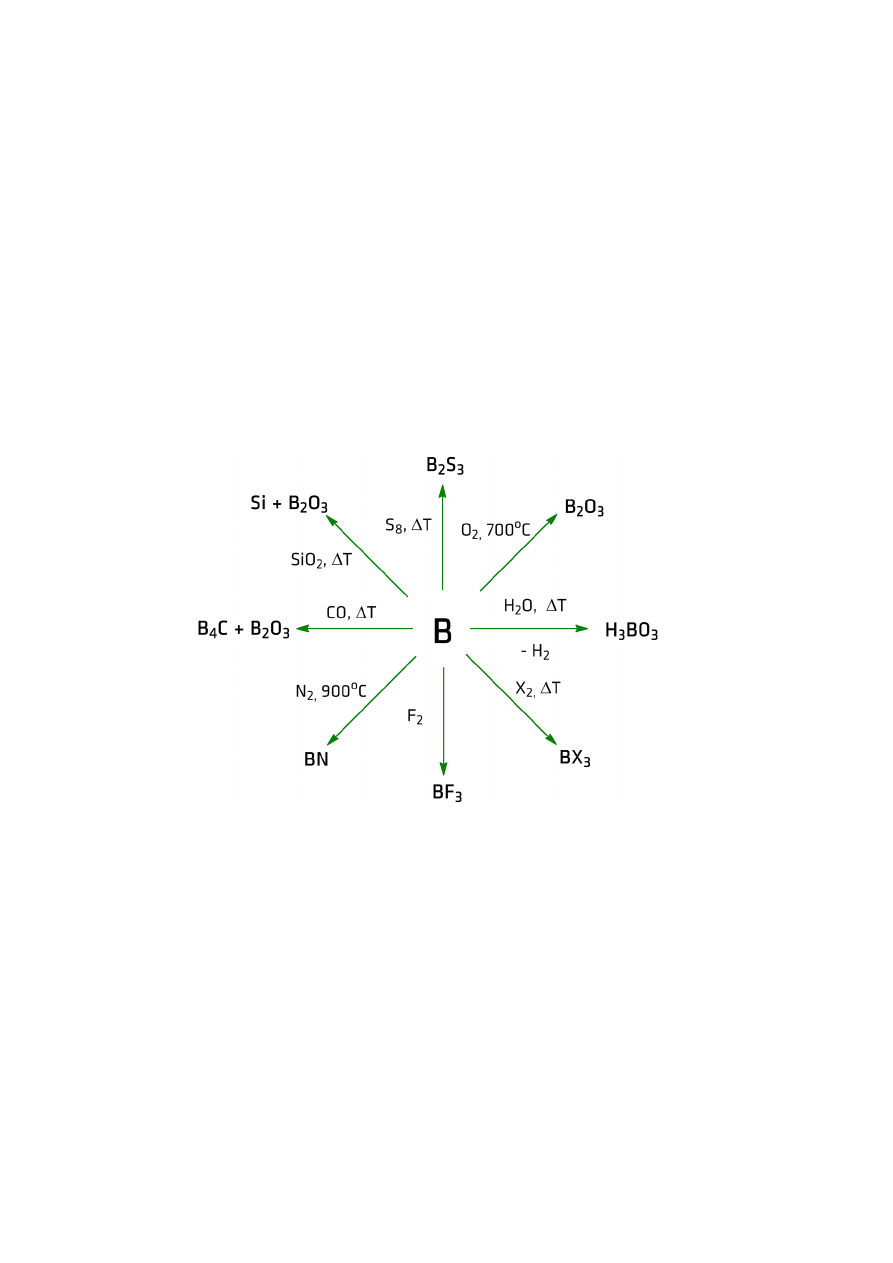
utlenianie powietrzem
o azotki typu MeN
2Me + N
2
→ 2MeN (Be, Al)
4 Ga + 4NH
3
+ 3O
2
→ 4GaN + 6H
2
O
o tlenki
spalanie w powietrzu
4Me + 3O
2
→ 2Me
2
O
3
(B, Al, Ga, In, Tl)
termiczny rozkład węglanów, wodorotlenków, azotowców, siarczanów
2Me(OH)
3
→ Me
2
O
3
+ 3H
2
O ( Al, Ga, In, Tl)
B – nie tworzy wodorotlenków
B
2
O
3
w temperaturze czerownego żaru: H
3
BO
3
→ HBO
2
→ B
2
O
3
nie tworzą nadtlenków i ponadtlenków
reakcje z wodą
BN + 3H
2
O → H
3
BO
3
MeN + 3H
2
O → Me(OH)
2
+ NH
3
(Al, Ga, In)
Be
2
O
3
+ 3H
2
O → 2H
3
BO
3
tlenki metalicznych borowców są nierozpuszczalne w wodzie
związki z wodorem
NIE REAGUJĄ BEZPOŚREDNIO Z WODOREM
diboran B
2
H
6
Mg
3
B
2
+ H
3
PO
4
→ mieszanina boranów → B
2
H
6
2BCl
3
+ 6H
2
→ 2B
2
H
6
+ 6HCl
4BCl
3
+ 3Li[AlH
4
] → B
2
H
6
+ 3AlCl
3
+ 3LiCl
tetrahydroX
4NaH + B(OCH
3
)
3
→ Na[BH
4
] + CH
3
Ona
AlCl
3
+ LiH → (AlH
3
)
n
→ Li[AlH
4
]
Li[GaH
4
]
(InH
3
)
n
Bor:
w naturze w postaci związków
10
-4
% skorupy ziemskiej
występowanie:
o kwas borowy
o oksoborany
kernit
boraks
zastosowanie:
domieszka do półprzewodników, odtleniacze Cu, dodatek do stali
(pierwiastkowy)
nietoksyczne środki owadobójcze, konserwanty
wzmacniacze żywic syntetycznych
materiały pochłaniające promieniowanie neutronowe
otrzymywanie:
redukcja magnezem
B
2
O
3
+ 3Mg → 2B + 3MgO
redukcja w łuku elektrycznym
2BBr
3
+ 3H
2
→ 2B + 6Br
rozkład termiczny (1100-1300K)
2BI
3
→ 2B + 3I
2
49
odmiany alotropowe:
o bor amorficzny – posiadający brązowy kolor
o bor krystaliczny – czarny, bardzo twardy
romboedryczny α
romboedryczny β
tetragonalny
o ikosaedr – buduje każdą odmianę alotropową, jednostka podstawowa
właściwości:
o duża twardość
o szaro-czarna barwa
o wysoka temperatura topnienia
o słaby przewodnik elektryczny
o słaba aktywność chemiczna
o spala się w powietrzu na zanieczyszczony BN
o reaguje z halogenami
o tworzy borki
o HNO
3(stęż)
utlenia metaliczny do H
3
BO
3
związki
o borowodory
B
n
H
n+4
B
n
H
n+6
inne
o borki
Mb + M(M
n
O
m
) – 2300 K → M
n
B
m
elektroliza stopionych oksoboranów odpowiednich metali (katoda – metal
redukuje oksoborany do borków)
borki metali
duża odporność na czynniki chemiczne
wysokie temperatury topnienia (powyżej 2300 K)
w niektórych przypadkach przewodnictwo elektryczne
zastosowania:
o do budowy dysz do rakiet
o do wyrobu elektrod pracujących w wysokich temperaturach
50
o tlenek B
2
O
3
2H
3
BO
3
→ B
2
O
3
+ 3H
2
O
bezbarwny
higroskopijny
zastyga w postaci szkliwa
reakcje
CoO + B
2
O
3
→ Co(BO
2
)
2
metaoksoboran kobaltu
B
2
O
3
+ P
2
O
5
→
2BPO
4
o borany
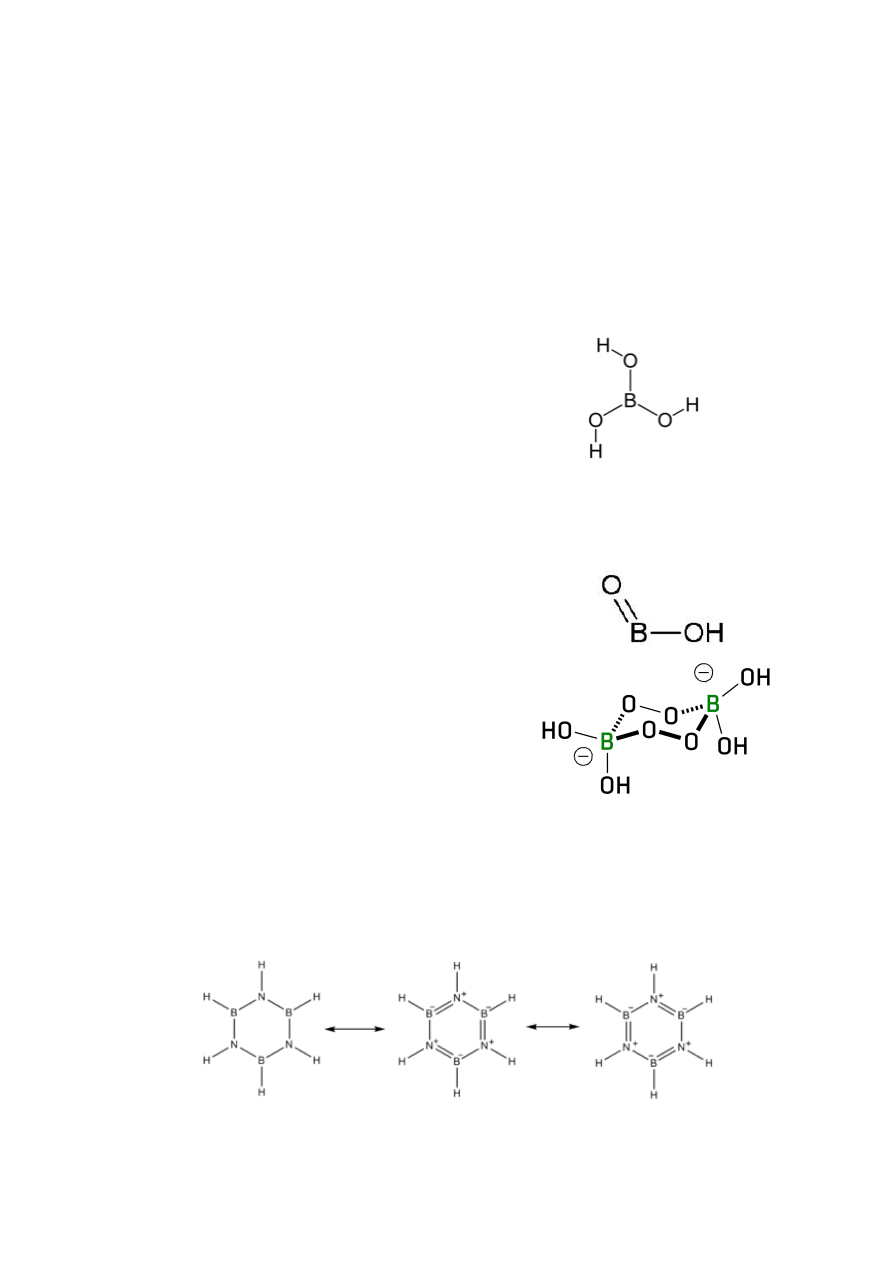
liczba atomów boru: (2-4) gazy; (5-6) ciecze; (7-…) ciała stałe
o kwas ortoborowy, trioksoborowy, borny
zastosowania:
produkcja boraksu
nawóz
lekki środek dezynfekcyjny
insektycyd
H
3
BO
3
↔ B(OH)
3
krystaliczne ciało stałe
postać bezbarwnych lśniących łusek
bardzo słaby kwas
w roztworach wodnych zachowuje się jak akceptor OH
-
B(OH)
3
+ 2H
2
O → B(OH)
4
-
+ H
3
O
+
stosunkowo słabo rozpuszczalny w wodzie
w 20
o
C 5g/100cm
3
H
2
O
w temp. powyżej 130
o
C: H
3
BO
3
↔ HBO
2
+ H
2
O
o kwas metaborowy
HBO
2
; (HBO
2
)
3
- odmiana α, pierścień
o peroksoborany
zastosowania:
rozjaśnianie włosów
środek bielący
o związki boru z azotem
iminoboran
potrójne wiązanie B ≡ N
BN + 3H
2
O → H
3
BO
3
+ NH
3
bardzo reaktywny
borazyny lub borazyny Dewara
struktura podobna do benzenu
otrzymywany z trimeryzacji BN
3B
2
H
6
+ 6NH
3
→ B
3
N
3
H
6
+ 12H
2
stabilność rośnie ze wzrostem wielkości podstawników alkilowych
51
Bor w środkach farmaceutycznych:
kwas borowy
o łagodne działanie antyseptyczne (bakterio- i grzybobójcze)
o likwidacja stanów zapalnych skóry
o używany w maściach do oczu
Na
2
B
4
O
7
.
7H
2
O – boraks
o jw.
związki boru
10
B w terapii nowotworów
o terapia borowo-neutronowa
o działanie wiązką neutronową
o B
12
H
12
; B
10
H
10
; 1,10 C
2
B
8
H
10
bortezomib
o blokowanie proteasomu – apoptoza komórek nowotworowych
o leczenie:
szpiczaka mnogiego
chłoniaka z komórek płaszcza
Glin:
8,23% w skorupie ziemskiej – III miejsce
odmiany w środowisku naturalnym:
o korund: Al
2
O
3
(rubin, szafir)
o boksyt: Al
2
O
3
.
H
2
O
otrzymywanie:
o elektrolit – mieszanina naturalnego boksytu z kryolitem (Na
3
AlF
6
) i flourytem (CaF
2
)
katoda – stopiony Al
anoda – CO + CO
2
reakcje chemiczne
o z powietrzem:
4Al + 3O
2
→ 2Al
2
O
3
o z kwasami:
2Al + 3H
2
SO
4
→ 2AL
3+
+ 3SO
4
2-
+ 3H
2
2Al + 6HCl → 2Al
3+
+ 6Cl
-
+ 3H
2
o z zasadami:
2Al + 2NaOH + 6H
2
O → 2Na
+
+ 2Al(OH)
4
-
+ 3H
2
o z chlorowcami (bez F)
4Al + 3Cl
2
→ 2Al
2
Cl
6
4Al + 3Br
2
→ 2Al
2
Br
6
4Al + 3I
2
→ 2Al
2
I
6
o właściwości amfoteryczne X-O-H
w roztworze (z kwasami):
powstaje sól
z gazowym chlorowcem:
powstaje dimer
52
Ałuny:
są izomorficzne, krystalizują w postaci regularnych ośmiokątów
X
+1
Y
+3
(SO
4
)
2
.
12H
2
O
o (NH
4
)
2
SO
4
Al
2
(SO
4
)
3
.
24H
2
O
o K
2
SO
4
Al
2
(SO
4
)
3
.
24H
2
O
o Na
2
SO
4
Al
2
(SO
4
)
3
.
24H
2
O
zastosowania:
o do garbowania skór
o klejenie papieru
o odtrutka do zatruć solami ołowiu
o w kosmetyce jako środek ściągający
o jako zaprawa do barwienia tkanin
o oczyszczanie wody
Glin w farmaceutyce:
węglany
o leki zobojętniające nadmiar HCl w żołądku
siarczany
o działanie ściągające, środki tamujące krwawienie w skaleczeniach
octowinian glinu
o stłuczenia
węgiel
2s
2
2p
6
niemetal
trw
ał
o
ść
II
st
. u
tlenien
ia
izolator
krzem
3s
2
3p
6
półmetal
półprzewodniki
german
4s
2
4p
6
półmetal
cyna
5s
2
5p
6
metal
ołów
6s
2
6p
6
metal
przewodnik
+2 i +4 stopień utlenienia
otrzymywanie:
o C - węgiel
węgiel kopalny, grafit, diament
koks – produkt zawierający do 94% węgla, koks otrzymuje się przez
ogrzewanie węgla kamiennego w piecach bez dostępu powietrza
o Si – krzem
SiO
2
+ 2C → Si +2CO
SiO
2
+ CaC
2
→ Si + 2CO + Ca
o Ge – german
GeO
2
+2H
2
→ Ge + 2H
2
O
o Pb – ołów
2PbS + 2O
2
→ 2PbO + 2SO
2
PbO + C → Pb +CO
PbS + 2PbO → 3Pb + SO
2
53
właściwości chemiczne
wodór
E
(s)
+ 2H
2
→ EH
4(g)
i inne (E= C, Si)
tlen
E
(s)
+ O
2
→ EO
2(s)
(E= C, Si, Ge, Sn)
Pb
(s)
+ O
2
→ 2PbO
fluorowiec
E
(s)
+ 2X
2(s,c,g)
→ EX
4(s)
(E= C, Si, Ge, Sn)
Pb
(s)
+ X
2(s,c,g)
→ PbX
2(s)
woda
C
(s)
+ H
2
O
(g)
→ CO
(g)
+ H
2(g)
Si
(s)
+ 2H
2
O
(g)
→ SiO
2(g)
+ 2H
2(g)
kwas
E
(s)
+ 2H
3
O
+
(c)
→ E
2+
+ 2H
2
O
(c)
+ H
2(g)
(E= Sn, Pb)
zasada
2 E
(s)
+ 2OH
-
+ 2H
2
O → 2[E(OH)
4
]
2-
+ H
2(g)
(E= Sn, Pb)
Węgiel:
14. miejsce w ilości w skorupie ziemskiej (0,02%)
występuje w postaci
o węglanów
kalcyt CaCO
3
dolomit MgCO
3
.
CaCO
3
magnezyt MgCO
3
syderyt FeCO
3
o CO
2
0,03% powietrza
rozpuszczalny w wodach morskich i lądowych
o Słońce, gwiazdy, komety, atmosfera większości planet
o związki organiczne
o izotopy
12
C i
13
C
związki z fluorowcami
o CX
4
CF
4
– bezbarwny gaz, odporny na podwyższone temperatury i czynniki
chemiczne
CCl
4
CS
2
+ 3Cl
2
→ CCl
4
+S
2
Cl
2
(w obecności MnCl
2
lub I
2
)
gdy obecne FeS: 2S
2
Cl
2
+ CS
2
→ CCl
4
+6S
w reakcji substytucji rodnikowej
C
2
F
4
– teflon
łatwo polimeryzuje
używany przy produkcji naczyń do
mineralizacji (rozbijanie związku na
części pierwsze)
związki z tlenem
o CO (C=O)
bezbarwny
bezwonny
silnie trujący
słabo rozpuszczalny w wodzie
spala się w tlenie z wydzieleniem dużej ilości ciepła, niebieskawy płomień
o CO
2
ze spalanie węgla przy dużym dostępie O
2
wypalanie wapieni w 1200K (CaCO
3
→ CO
2
+ CaO)
CaCO
3
+ 2HCl → CaCl
2
+ CO
2
+ H
2
O
bezbarwny

54
bezwonny
kwaskowaty smak
gęstość: d= 1,9768 g/cm
3
nie pali się, nie podtrzymuje palenia
rozpuszcza się dobrze w wodzie
suchy lód – CO
2
stały
(działanie anhydrazy węglanowej)
o H
2
CO
3
bezwodnik
CO
2
+ H
2
O ↔ H
2
CO
3
dysocjacja kwasu węglowego: H
2
CO
3
↔ H
+
+ HCO
3
-
↔ H
+
+ CO
3
2-
sole są trwalsze od kwasu
rozpuszczalność soli
M
2
CO
3
– dobrze rozpuszczalne (M= metale gr. I)
HCO
3
-
- dobrze rozpuszczalne
wydzielanie CO
2
Na
2
CO
3
+ 2HCl ↔ 2NaCl + CO
2
+ H
2
O
2NaHCO
3
+ (T) ↔ Na
2
CO
3
+ H
2
O + CO
2
CaCO
3
↔ CaO + CO
2
o węgliki – związki węgla z metalami, krzemem i borem
typy:
węgliki jonowe typu soli
o węgliki metali grupy I i II
o C
-4
, C
2
2-
, C
3
4-
o otrzymywanie
ogrzewanie odpowiedniego metalu lub jego tlenku
z węglem lub węglowodorami
o reakcje
CaC
2
+ N
2
↔ CaCN
2
+ C (cyjanamid wapnia)
CaCN
2
+ H
2
O ↔ CaCO
3
+ NH
3
węgliki międzywęzłowe
o substancje trudnotopliwe
o stopy stałe
o twarde i kruche zarazem
o odporne pod względem chemicznym (jedynie substancji
utleniających)
o wykazują cechy metaliczne takie jak:
połysk metali
przewodnictwo elektryczne
cięcie metali
o MC (M= Ti, Mo, W)
o M
2
C (M= V, W)
węgliki kowalencyjne
o związek węgla z pierwiastkami o zbliżonej elektroujemności
(Si, B)
o SiC
SiO
2
+ 3C + (T) ↔ SiC + 2CO

55
Krzem:
II miejsce w skorupie ziemskiej (28,2% litosfery)
występuje tylko w postaci związanej: krzemiany, glinokrzemiany, SiO
2
otrzymywanie
o SiO
2
+ 2Mg ↔ Si + MgO (produkcja laboratoryjna)
o SiO
2
+ 2C ↔ Si + 2CO (2000K, produkcja wielotonażowa)
postać krystalograficzna, która odpowiada sieci krystalicznej podobnej do struktury diamentu
krzem bezpostaciowy
o brunatny proszek
o z redukcji
SiO
2
magnezem
właściwości półprzewodnikowe
o przewodnictwo elektryczne rośnie z e wzrostem temperatury
o można ją zwiększyć przez dodanie różnego rodzaju domieszek
o w temperaturze pokojowej krzem jest mało aktywny
spala się w powietrzu w wysokiej temperaturze
Si + fluorowce
Si + M → krzemki
o Mg
2
Si, Ca
2
Si, CaSi
o nie ulega działaniu kwasów (tylko mieszaninieHNO
3
i HF)
Si + 2NaOH + H
2
O ↔ Na
2
SiO
3
+ 2H
2
związki z wodorem i ich pochodne
o silany
Si
n
H
2n+2
n
max.
=15
liniowe lub cykliczne
monosilan, disilan, heksasilan
n=1,2 – gazy; n>2 – łatwo lotne ciecze
o silikosany
chlorowcosilany
SiCl
3
H, SiCl
2
H
2
, SiClH
3
łatwo ulegają kondensacji przy udziale wody
H
3
SiCl + H
2
O + ClSiH
3
↔ H
3
Si–O–SiH
3
+ 2HCl
o silikony
pochodne silikosanów – wodór zastąpiono grupą alkilową lub arylową (-C
6
H
5
)
SCHEMAT POLIMERYZACJI
zastosowania:
kleje i uszczelnienia
biokompatybilność – medycyna estetyczna
związki z tlenem
o tlenek krzemu (II)
SiO
otrzymywanie
SiO
2
+ Si → 2SiO (1500-1600K; r. synproporcjonowania)
2SiO → SiO
2
+ Si (ochładzanie; r. dysproporcjonowania)
nSiO → (SiO)
n
(szybkie ochładzanie, brunatny)
o tlenek krzemu (IV)
12% skorupy ziemskiej
kwarc
pojedyncze kryształy kwarcu – kryształ górski
zabarwiony na fioletowo – ametyst
składnik skał: piaskowca, granitu, kwarcytu

56
o kwasy krzemowe
uwodnienie SiO
2
można przeprowadzić przez stapianie go z NaOH w celu
otrzymania dobrze rozpuszczalnych krzemianów a następnie działanie
kwasem
jednostka podstawowa jest tetraedrem, która łączy się z innymi mostkami
tlenowymi
występują krzemiany wyspowe grupowe, łańcuchowe, pierścieniowe
związki z fluorowcami
o pochodne Si
n
X
(2n+2)
o Si + 2Br
2
↔ SiBr
4
o 3SiCl
4
+ Si ↔ 2Si
2
Cl
6
o wszystkie połączenia mogą ulec hydrolizie – uwodniona krzemionka
o SiF
4
CaF
2
+ H
2
SO
4
↔ CaSO
4
+ HF
4HF + SiO
2
↔ SiF
4
+ H
2
O
CaSiO
3
+ 6HF ↔ CaF
2
+ SiF
4
+ 3H
2
O
SiF
4
+ (n+2)H
2
O ↔ SiO
2
.
nH
2
O + 4HF
SiF
4
+2HF ↔ H
2
SiF
6
zastosowania:
o szkło laboratoryjne
o sproszkowany do szlifowania szkła i metali
o generatory ultradźwięków
Szkła:
amorficzna przechłodzona ciecz powstająca przez stopienie SiO
2
z różnymi dodatkami, a
następnie szybkie ochłodzenie, by nie doszło do pełnej krystalizacji SiO
2
, lecze by w
strukturze pozostało jak najwięcej fazy amorficznej
dodatki:
o Na
2
CO
3
o CaCO
3
o topniki: B
2
O
3
, PbO
o barwniki
zielone: żelazo (III), chrom (III)
niebieskie: kobalt (II), miedź (II)
fioletowe: mangan (VII)
żółte: związki Cd i S
czerwone: koloidalne cząsteczki złota
Azbest:
grupa materiałów włóknistych
uwodnione krzemiany różnych metali
budowa chemiczna np.
o (Fe
21
Mg)
7
[Si
8
O
22
](OH)
2
57
Węglowce w środkach leczniczych:
węglany
o [Al(OH)
2
]
2
CO
3
, NaAl(OH)
2
CO
3
, MgCO
3
, NaHCO
3
, CaCO
3
, (BiO)
2
CO
3
środki zobojętniające HCl w żołądku ze wskazaniem na: nadkwasotę, wrzody
żołądka i dwunastnicy, nieżyt żołądka i dwunastnicy
o K
2
CO
3
– źródło jonów K
+
o Li
2
CO
3
– źródło jonów Li
+
Mg
2
Si
3
O
8
.
8H
2
O (2MgO
.
3SiO
2
.
8H
2
O)
o działanie zobojętniające
o adsorpcyjne
o osłaniające błony śluzowe żołądka
4SiO
2
.
3MgO
.
H
2
O lub Mg
3
(OH)
2
(Si
4
O
10
) – talk
o środek wysuszający
o adsorpcyjny
o stosowany do zasypki
węgiel
o węgiel aktywowany
silne właściwości adsorbujące i osłaniające
wiąże sole, HCl, produkty gnilne, gazy
działa zapierająco
o grafit
składnik preparatów homeopatycznych
leczenie
zmian skórnych
zaburzeń trawienia
pękania opuszków palców
ołów
o stosowany jako składnik preparatów homeopatycznych na
zaburzenia trawienia
zaparcia
bóle brzucha
miażdżyca naczyń mózgu
anemia
zapalenie nerwu wzrokowego
symbol
stan
skupienia
charakter
liczba
atomowa
stopnie utlenienia
elektroujemność
N
gaz
niemetale
7
-3,-2,-1,1,2,3,4,5
3,0
P
ciało stałe
15
-3,1,3,5
2,1
As
półmetale
33
-3,3,5
2,0
Sb
51
(-3),3,5
1,9
Bi
metal
83
-3,3,5
1,9
Azot:
występowanie
o atmosfera (N
2
, trochę NH
3
i tlenki)
o skorupa ziemska - 1,9*10
-3
% (NaNO
3
, KNO
3
, Ba(NO
3
)
2
, Mn(NO
3
)
2
o organizmy żywe

58
otrzymywanie
o przemysłowo
frakcjonowana destylacja ze skroplonego powietrza
o laboratoryjnie
NH
4
NO
2
(T) → N
2
+ 2H
2
O
NH
4
Cl + NaNO
2
→ N
2
+ NaCl + 2H
2
O
zastosowanie
o gaz ochronny
o otrzymywanie NH
3
.
H
2
O
o do chłodzenia (-195,79
o
C)
Fosfor:
występowanie
o skorupa ziemska – 0,11% (apatyty, apatyt fluorowy – 3Ca(PO
4
)
2
.
CaF
2
o organizmy żywe
muszle, kości, zęby – apatyt węglowy – 3Ca
3
(PO
4
)
2
.
CaCO
3
błony komórkowe – fosfolipidy
kwasy nukleinowe
otrzymywanie
o 2Ca
3
(PO
4
)
2
+ 6SiO
2
+ 10C (1570-1720K) → 6CaSiO
3
+ 10CO +P
4
(pary)
zastosowanie
o produkcja PCl
3
, PCl
5
, P
2
O
5
, H
3
PO
4
o dodatek do brązów fosforowych
Arsen:
występowanie
o skorupa ziemska – 5*10
-4
% (siarczki As
2
S
3
(aurypigment), arsenosiarczki, arsenopiryt
– FeAsS, arsenki)
otrzymywanie
o FeAsS → FeS + As
o As
4
O
6
+ 6C → 4As +6CO
Antymon:
występowanie
o skorupa ziemska – 2*10
-5
% (siarczki – Sb
2
S
3
– antymonit; tlenki – Sb
2
O
3
– walenit)
otrzymywanie
o Sb
2
S
3
+ 5O
2
→ Sb
2
O
4
+ 3SO
2
o Sb
2
O
4
+ 4C → 2Sb + 4CO
zastosowanie
o stop czcionkowy, łożyska – większa trwałość
Bizmut:
występowanie
o skorupa ziemska – 8,5*10
-7
% (siarczki – Bi
2
S
3
– bizmutyn; tlenki – Bi
2
O
3
– ochra
bizmutowa)
otrzymywanie
o Bi
2
S
3
+ 9/2O
2
→ Bi
2
O
3
+ 3SO
2
o Bi
2
O
3
+ 3C → 2Bi + 3CO
o Bi
2
S
3
+ 3Fe → 2Bi + 3FeS
zastosowanie
o łatwo topliwe stopy (stop Wooda-Rosego); Bi, Pb, Sn – łączenie szkła z metalem
59
Właściwości chemiczne:
Substrat
Reakcja z pierwiastkiem z grupy 15.
H
2
N
2(g)
+ 2H
2(g)
→ 2NH
3(g)
P
4(g)
+ 6H
2(g)
→ 4PH
3(g)
O
2
N
2(g)
+ xO
2
→ 2NO
x(g)
P
4(g)
+ 3 lub 5 O
2
→ P
4
O
6(s)
lub P
4
O
10(s)
4 As
(s)
+ 3O
2
→ As
4
O
6(s)
4X
(s)
+ 3O
2
→ X
2
O
3(s)
(X= Sb, Bi)
H
2
O
brak reakcji
17. grupa
2X
(s)
+ 3E
2(s,c,g)
→ 2 XE
3(s,c)
(X= P, As, Sb, Bi)
2X
(s)
+ 5E
2(s,c,g)
→ 2 XE
5(s,c)
(X= P, As, Sb)
Właściwości fizyczne i chemiczne:
azot
o bezbarwny, bezwonny gaz
o 1,2505 g/cm
3
o temperatura wrzenia 77,36 K, temperatura krzepnięcia 63,15 K
o ciekły, stały – bezbarwny
o 2 odmiany alotropowe
fosfor (-biały)
o chemiluminescencja – powolne utlenianie fosforu na powietrzu, któremu
towarzyszy świecenie
o bardzo łatwopalny
o P
4
+ 3KOH + 3H
2
O → PH
3
+ 3KH
2
PO
2
(fosfinian potasu)
o wydziela z roztworów Cu, Ag, Au, Pb
P
4
+ 10CuSO
4
+ 16H
2
O → 10Cu + 4H
3
PO
4
+ 10H
2
SO
4
o 4 odmiany alotropowe
biały
silnie toksyczny
najreaktywniejszy
czerwony
mniej reaktywny, nietoksyczny
nierozpuszczalny w CS
2
reaguje w wyższych temperaturach
nie wypiera metali z ich roztworów
fioletowy
sieć krystaliczna
mało aktywny chemicznie
nierozpuszczalny
czarny
połysk metaliczny, przewodzi prąd elektryczny
struktura warstwowa
polimeryzuje
najgęstsze ułożenie atomów
Związki z wodorem:
powstawanie egzotermiczne
NH
3
– azan, amoniak
PH
3
– fosfina

60
powstawanie endotermiczne
AsH
3
– arsenowodór
SbH
3
– antymonowodór
BiH
3
– bizmutan
Amoniak – NH
3
:
otrzymywanie:
o metoda Habera i Boscha
P= 30-35MPa; T= 770-820K; katalizator: Fe
3
O
4
N
2
+ 3H
2
↔ 2NH
3
; ∆H= -92,4 kJ/mol
reguła Chateliera-Brauna
o laboratoryjnie
2NH
4
Cl + Ca(OH)
2
→ CaCl
2
+ 2H
2
O + 2NH
3
Mg
3
N
2
+ 6D
2
O → 3Mg(OD)
2
+ 2ND
3
(D - deuter, otrzym. ciężkiego amoniaku)
bezbarwny gaz
charakterystyczny zapach
dobrze rozpuszcza się w wodzie
o NH
3
+ H
2
O ↔ NH
4
+
+ OH
-
(K
b
= 1,81*10
-5
, α=1%)
tworzy sole dobrze rozpuszczalne w wodzie
mocne zasady wypierają NH
3
w powietrzu zapala się w zetknięciu z płomieniem
o 4NH
3
+O
2
→ 2N
2
+ 6H
2
O
o 4NH
3
+ 5O
2
(Pt)→ 4NO + 6H
2
O (Metoda Ostwalda z siatką z drucików platynowych)
w wysokich temperaturach ma działanie redukujące
o powstaje wodór
2NH
3
↔ NH
4
+
(słaby kwas) + NH
2
-
(mocna zasada)
ciekły amoniak (nie r-r) przewodzi prąd elektryczny
nawet słabe kwasy ulegają dysocjacji
niezbyt silnej dysocjacji ulegają zasady
o można porównywać ich moc
lepszy rozpuszczalnik dla substancji organicznych
trudno rozpuszczalne związki
o siarczany, węglany, fosforany
rozpuszczalność wzrasta gdy kationy tworzą z NH
3
jony kompleksowe
pochodne NH
3
o amidki
2NH
3
+ 2Na → 2NaNH
2
+ H
2
NaNH
2
+ H
2
O → NH
3
+ NaOH
o imidki
Li
2
NH, CaNH
o azotki
Mg
3
N
2
+ 6H
2
O → 3Mg(OH)
2
+ 2NH
3
o NH
2
OH – hydroksylamina
sole są trwalsze
HNO
3
+ 6H → NH
2
OH + 2H
2
O
redukuje rtęć Hg(II) → Hg(I) → Hg (0)
wydziela Cu
2
O z płynu Fehlinga
61
PH
3
, AsH
3
, SbH
3
, BiH
3
:
nie ulegają asocjacji
nie tworzą wiązań wodorowych
powstawanie:
o Mg
3
Sb
2
+ 6HCl → 3MgCl
2
+ 2SbH
3
o AlP + 3H
2
O → PH
3
+ Al(OH)
3
o 3NaOH + P
4
+ 3H
2
O → 3NaH
2
PO
2
+PH
3
o H
in statu nascendi
+ wolne pierwiastki
Metoda Marsha – wykrywanie śladów As:
utleniamy pobrany fragment organiczny
chloran potasu + nadmiar HCl
H
3
AsO
3
+ 6H → 3H
2
O + AsH
3
mieszanina gazów → rurka szklana → ogrzewanie do temperatury ciemnego żaru → AsH
3
(As +H
2
) → szybkie ochłodzenie → powstaje lustro arsenowe
X
2
H
4
:
N
2
H
4
– diazon (hydrazyna)
P
2
H
4
– difosfan
otrzymywanie:
o NH
3
+ NaClO → NaOH + NH
2
Cl (chloramina)
o NH
2
Cl + NH
3
→ N
2
H
4
+ HCl
2NH
2
Cl + N
2
H
4
→ 2NH
4
Cl + N
2
N
2
H
4
– bezbarwna ciecz, toksyczna
redukuje Fe (III) → Fe (II), wydziela Au, Ag, Pt
używana do sekwencjonowania DNA
Związki z fluorowcami:
YX
3
– trójhalogenki azotu – mała trwałość
NI
3
– wybuchowy przy dotknięciu
hybrydyzacja sp
3
SbCl
3
+ H
2
O → SbOCl + 2HCl
PCl
3
+ 3H
2
O → H
3
PO
3
+ 3 HCl
PCl
3
+ S → PSCl
3
PCl
3
+ Cl
2
→ PCl
5
o YX
5
, PCl
5
o hybrydyzacja dsp
3
, 5 orbitali, bipiramida trygonalna
o PCl
5
– ciało stałe, po stopieniu przewodzi prąd, ulega autodysocjacji
2PbCl
5
→ PCl
4
+
+ PCl
6
-
o PCl
5
+ H
2
O → H
3
PO
4
+ 5HCl
Tlenki i kwasy azotu:
st. utlenienia
tlenek
kwas
nazwa
5
N
2
O
5
HNO
3
azotowy (V)
4
NO
2
2NO
2
→ N
2
O
4
-
-
3
N
2
O
3
HNO
2
azotawy, azotowy (III)
2
NO
-
-
1
N
2
O
H
2
N
2
O
2
ponadazotowy

62
Zastosowanie w farmaceutyce:
Azot:
o HNO
3
składnik preparatów homeopatycznych
przy zmianach skórnych
brodawki podeszwowe o żółtym zabarwieniu
pleśniawki jamy ustnej
zaburzenia trawienia
zaburzenia układu moczowego-płciowego
o N
2
O
składnik znieczulenia
o NH
4
Br
działanie słabo znieczulające
przeciwdrgawkowo
o NaNO
2
źródło NO w organizmie
hamowanie czynności mięśni gładkich
rozszerzanie naczyń krwionośnych
o AgNO
3
miejscowo bakteriobójczy, antyseptyk skóry, błon śluzowych
niszczenie zrogowaceń
o ciekły azot
usuwanie niedoskonałości na skórze
Fosfor:
o w preparatach homeopatycznych
krwotoki z nosa
krwiomocz
choroby układu pokarmowego
wirusowe zapalenia wątroby
zapalenie trzustki
zaburzenia trawienia
BiOH(NO
3
)
2
, Bi(OH)
2
NO
3
o działanie ściągające i słabo zobojętniające
o przeciwbakteryjnie np. Helicobacter pylori
o działanie zapierające i osłaniające
NaH
2
PO
4
.
2H
2
O
o środek zwiększający kwasowość moczu
o środek przeczyszczający
Sb
2
S
3
o zaburzenia żołądkowo-jelitowe (w skutek przejedzenia)
o choroby skóry
Melarsoprol (z arsenem)
o leczenie II stadium śpiączki afrykańskiej (Trypanosomatoza afrykańska)
63
symbol
stan skupienia
charakter
promowany st. utl.
O
gaz
niemetale
-2
S
ciało stałe
-2, +2, +4, +6
Se
półmetale
-2, +4, +6
Te
-2, +4, +6
Po
metal
+4, +6
Występowanie:
tlen – 50%
o litosfera – 46,4%
o hydrosfera – 89%
o atmosfera – 23,15%
siarka – 0,026%
o wolna
o siarczki (ZnS, PbS)
o siarczany (CaSO
4
.
2H
2
O, BaSO
4
, MgSO
4
, Na
2
SO
4
)
o H
2
S
selen, tellur – 5*10
-6
%, 10
-7
%
o zanieczyszczenia rud siarkowych
polon – śladowe ilości
Otrzymywanie:
tlen
o z powietrza
skraplanie w temperaturze ok 90,15K, rozdzielenie N
2
, O
2
przez destylację
frakcyjną (pod ciśnieniem 3MPa)
o w laboratorium
2KMnO
4
(230
o
C) → K
2
MnO
4
+ MnO
2
+ O
2
2KNO
3
(400-440
o
C) → 2KNO
2
+ O
2
2KClO
3
→ 2KCl + 3O
2
(katalizator: MnO
2
, T)
2HgO → 2Hg + O
2
2H
2
O
2
→ 2H
2
O + O
2
(katalizator: MnO
2
)
elektroliza
siarka
o wydobycie z podziemnych złóż
metoda Frasha (wpompowywanie wody w temperaturze wrzenia i
sprężonego powietrza, upłynnienie siarki i wypompowanie na powierzchnię)
o metoda odkrywkowa
o odzysk z gazowych produktów ubocznych procesów rafinacji ropy naftowej i
przeróbki rud
selen
o przemysłowo
produkt uboczny rafinacji rud Cu i S
w czasie prażenia rud powstaje SeO
2
SeO
2
– rozpuszcza się w HNO
3
o laboratoryjnie
redukcja hydrazyną
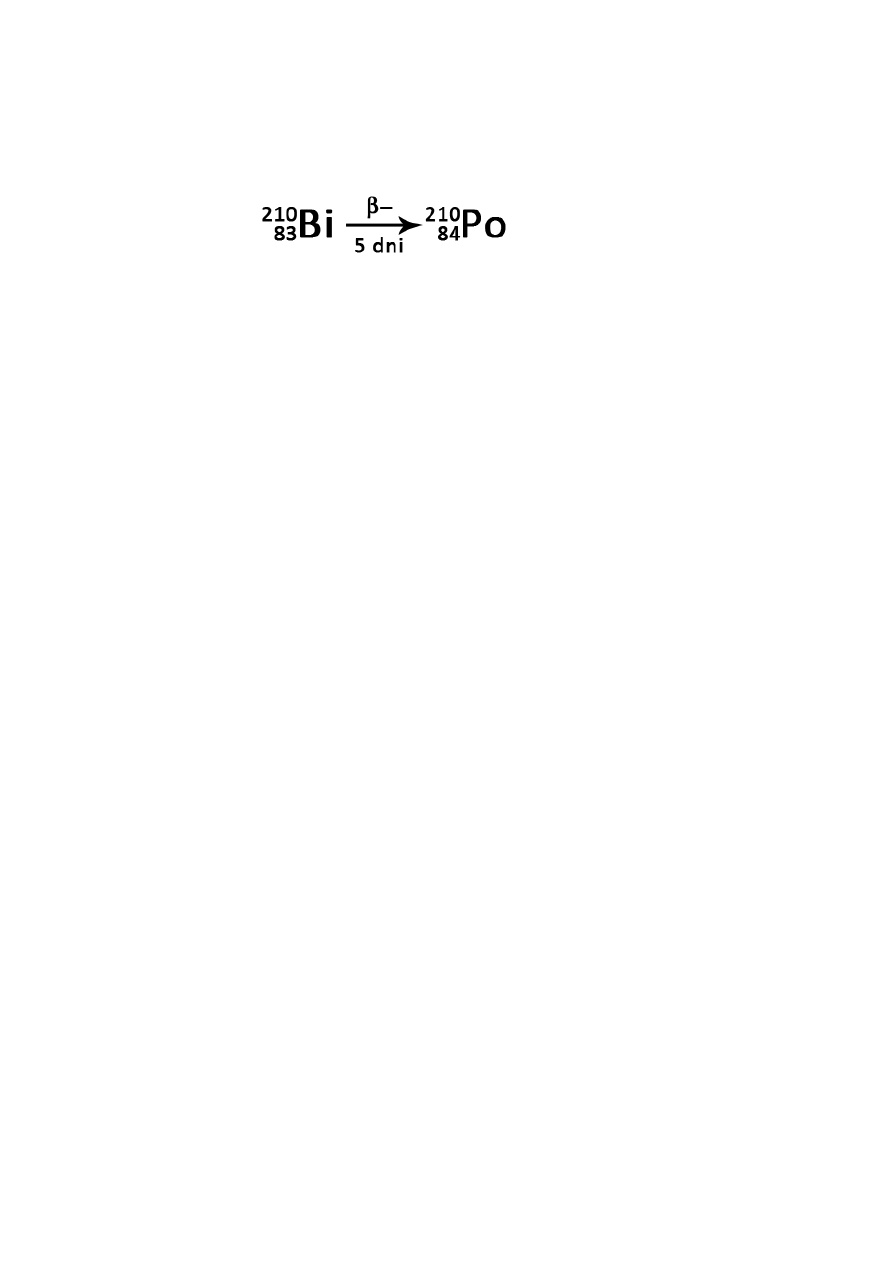
64
tellur
o ruda tellurowa + H
2
SO
4
→ H
2
TeO
4
(SO
2
) → Te
polon
o produkt rozpadów atomowych
Zastosowanie tlenowców:
siarka
o produkcja SO
2
i H
2
SO
4
o wulkanizacja kauczuku
o składnik zapałek
o ogniwa sztuczne i proch
o składnik białek
o do leczenia chorób skóry
o tetoksykacja rtęci metalicznej
tellur
o dodatek stopowy zwiększając odporność na korozję
o produkcja półprzewodników
o jako koloid – barwienie szkła
o dodatek do kauczuku – odporność na starzenie się
o katalizator
selen
o zastosowanie w fotokomórkach i kserokopiarkach – zależność przewodnictwa
elektrycznego od naświetlenia
o dodatek do szkła i stali
o SeS
2
– szampony przeciwłupieżowe
o Na
2
SeO
3
– silny insektycyd
polon
o źródło promieniowania α
o Po, Be – laboratoryjne wytwarzanie neutronów
o jonizacja powietrza i usuwania ładunków elektrostatycznych
technika drukarska i fotografia
o źródło energii dla satelitów
Odmiany alotropowe tlenowców:
tlen
o O
2
o O
3
siarka
o jednoskośna
o rombowa - S
α
trwała do temperatury 95,6
o
C
ciało stałe
słabo rozpuszcza się w alkoholu i C
6
H
6
dobrze rozpuszcza się w CS
2
tellur
o krystaliczny
o bezpostaciowy
65
selen
o Selenα – Seα
cząsteczki liniowe, łańcuchowe
srebrzystoszary
charakter metaliczny
fotoprzewodnictwo
utlenia się na powietrzu powoli
nie reaguje z H
2
O
reaguje z kwasami i zasadami
o Selenβ – Seβ
Se
8
czerwony
bardzo reaktywny
pali się na powietrzu
gwałtownie reaguje z wodą
o Selenγ – Seγ
Typy związków chemicznych:
z wodorem typu H
2
X
z wodorem typy H
2
X
n
ponadtlenki
nadtlenki
związki z fluorowcami
tlenki
Związki z wodorem typu H
2
X: (tetraedry)
przykłady
o oksydan (woda)
o sulfan –H
2
S - gaz
o selan – H
2
Se - gaz
o tellan – H
2
Te - gaz
o polan – H
2
Po – gaz
woda
o największy kąt między wiązaniami
o największy moment dipolowy
o obecność wiązań wodorowych
o gęstość lodu jest dużo mniejsza od wody
H
2
S, H
2
Se, H
2
Te
o nie moją tworzyć wiązań wodorowych
o nie uzyskują w stanie stałym struktury lodu
o sieci cząsteczkowe o bardziej gęstym ułożeniu
o siły międzycząsteczkowe, słabsze od sił tworzących wiązania wodorowe
o temperatura topnienia kilkadziesiąt stopni niższa od lodu
otrzymywanie (maleje reaktywność i trzeba energię dostarczać do układu)
o H
2
+ ½ O
2
→ H
2
O; ∆H<0
o H
2
+ 1/8 S
8
→ H
2
S; ∆H<0
o H
2
+ ½ Se
2
→ H
2
Se; ∆H>0
o H
2
+ ½ Te
2
→ H
2
Te; ∆H>0
spalanie
o H
2
X + 3/2 O
2
→ H
2
O + XO
2
(X= S, Se, Te)
o H
2
X + ½ O
2
→ H
2
O + X
66
dysocjacja
o H
2
X + H
2
O ↔ H
3
O
+
+ HX
-
o HX
-
+ H
2
O ↔ H
3
O
+
+ X
2-
Budowa i właściwości H
2
O
2
skręcone, rozsunięte wiązania
stan gazowy
stan stały
otrzymywanie
o metoda antrachinonowa – katalizator palladowy
o BaO
2
+ H
2
SO
4
→ BaSO
4
+ H
2
O
2
właściwości
o ciecz, bezbarwna, bezwonna, pH lekko kwaśne
o r-r H
2
O
2
nie jest palny, ale może wywołać zapłon materiałów palnych
o miesza się z H
2
O w każdej ilości
o silny utleniacz
SO
2
+ H
2
O
2
→ SO
3
+ H
2
O
Fe
2+
→ Fe
3+
produkt: H
2
O
o reduktor
2MnO
4
-
+ 6H
+
+ 5H
2
O
2
→ 2Mn
2+
+ 8H
2
O + 5O
2
PbO
2
+ 2H
+
+ H
2
O
2
→ Pb
2+
+ 2H
2
O + O
2
HgO + H
2
O
2
→ Hg + H
2
O + O
2
produkt: O
2
o może przekazywać grupę nadtlenową związkom organicznym i nieorganicznym
o tworzy z wieloma metalami sole
trwałość H
2
O
2
o zależy od temperatury, stężenia, wartości pH, zanieczyszczeń, MnO
2
przysp. rozkład
o objawy rozkładu: pęcherzyki gazu, wydziela się O
2
, wzrost temperatury – przy nie
wystarczającym odprowadzeniu ciepła
67
Polisiarczki wodoru (polisulfany):
roztwory siarczków metali alkalicznych łatwo rozpuszczają siarkę po wstaje wówczas jon
są słabymi kwasami
w reakcji z HCl uzyskuje się H
2
S
n
o S
2-
+ (n-1)S → S
n
2-
Tlenowce z fluorowcami:
fluor
chlor
brom
jod
siarka
S
2
F
2
, SF
2
, SF
4
, SF
6
S
x
Cl
2
(x=1-8), SCl
4
S
x
Br
2
(x=2-8)
–––––
selen
SeF
4
, SeF
6
Se
2
Cl
2
, SeCl
4
Se
2
Br
2
, SeBr
2
, SeBr
4
–––––
tellur
TeF
4
, Te
2
F
10
, TeF
6
TeCl
2
, TeCl
4
TeBr
2
, TeBr
4
TeI
2
, TeI
4
polon
–––––
PoCl
2
, PoCl
4
PoBr
2
, PoBr
4
PoI
4
SeF
4
, SeF
6
– oktaedry (SeF
4
- 2 wolne pary elektronowe, stopione przewodzą prąd)
Związki S, Se, Te, Po z tlenem:
st. utl.
I oraz <I
II
IV
VI
siarka
S
2
O, S
n
O, (S
m
O)
n
SO, S
2
O
2
, (S
2
O
3
)
n
SO
2
SO
3
selen
–––––
–––––
SeO
2
SeO
3
tellur
–––––
–––––
TeO
2
TeO
3
polon
–––––
PoO
PoO
2
–––––
Kwasy tlenowe siarki:
wzór
nazwa
st. utl.
struktura
sposób występ.
H
2
S
2
O
4
tetra-disiarkowy
ditionowy (III)
III
sole
H
2
SO
3
trioksosiarkowy
siarkowy (IV)
IV
r-ry, sole
H
2
SO
4
tetraoksosiarkowy
siarkowy (VI)
VI
wolny kwas, sole
H
2
S
n
O
6
(n=2-6)
politionowe
V
sole, kwasy rozc.
H
2
S
2
O
7
pirosiarkowy
VI
sole
H
2
S
2
O
3
tiosiarkowy
V, -I
sole, wolny kwas
w niskich temp.
H
2
SO
5
peroksosiarkowy
VI
wolny kwas, sole
H
2
S
2
O
8
peroksodisiarkowy
VI
wolny kwas, sole
68
Tlenohalogenowe związki siarki i selenu:
typ halogenku
wzór
barwa
halogenki tionylu
SOF
2
SOCl
2
SOBr
2
bezbarwny
bezbarwny
czerwony
halogenki selenylu
SeOF
2
SeOCl
2
SeOBr
2
bezbarwny
jasnożółty
pomarańczowy
halogenki sulfurylu
SO
2
F2
SO
2
Cl
2
bezbarwny
bezbarwny
Tlenowce w środkach leczniczych:
H
2
O, H
2
O
2
MgO – zobojętnianie kwasów w żołądku
ZnO – przyspiesza gojenie ran, składnik maści na choroby skóry
siarka strącona – choroby skóry
BaSO
4
FeSO
4
.
7H
2
O – źródło żelaza łatwo wchłanialne
MgSO
4
.
7H
2
O, Na
2
SO4
.
10H
2
O – zaburzenia jelitowe, osmotyczne środki przeczyszczające
Li
2
SO
4
.
H
2
O – źródło litu dla organizmu, leczenie zaburzeń psychicznych
SeS
2
– suplement diety (zmiatanie wolnych rodników), szampony przeciwłupieżowe;
w czosnku
Pierwiastek Symbol
Stan
skupienia
Konfiguracja
elektronowa
Stopień
utlenienia
elektro-
ujemność
Temp.
topnienia
i wrzenia
Fluor
F
2
gaz
[He] 2s
2
2p
5
-1
Chlor
Cl
2
gaz
[Ne] 3s
2
3p
5
-1, +2, +3, +5, +7
Brom
Br
2
ciecz
[Ar] 3d
10
4s
2
4p
5
-1, +3, +5
Jod
I
2
c. stałe
[Kr]4d
10
5s
2
5p
5
-1, +3, +5, +7
Astat
At
c. stałe
[Xe] 4f
16
5d
10
6s
2
6p
5
+1, +5, +7
fluorowce w związkach z metalami gr. I i II tworzą wiązania jonowe
fluorowce w związkach z pierwiastkami gr. 14., 15., 16. tworzą wiązania kowalencyjne
Występowanie:
fluor
o CaF
2
– fluoryt
o Na
3
AlF
6
– fluoroglinian sodu – kriolit
chlor
o NaCl – sól kamienna
o KCl – sylwin
brom i jod
o towarzyszą pokładom soli kamiennej w postaci KBr, NaBr, KI, NaI
o wody mórz i oceanów (Br
-
i I
-
)

69
Otrzymywanie:
fluor
o anodowe utlenienie fluorków, wodorofluorków (KHF
2
) lub skroplony HF
anoda grafitowa (2F
-
- 2e
-
→ F
2
chlor
o elektroliza stopionego NaCl lub wodnego roztworu NaCl
o w laboratorium przy użyciu MnO
2
brom i jod
o elektroliza
o wypieranie Br
-
i I
-
silniejszym utleniaczem
Cl
2
+ 2NaBr → 2NaCl + Br
2
astat
o przemiany jądrowe
209
Bi cząstkami α (bombardowanie)
Związki z wodorem:
HF
o CaF
2
+ H
2
SO
4
→ CaSO
4
+ 2HF
HCl
o NaCl + H
2
SO
4
→ NaHSO
4
+ HCl
o NaCl + NaHSO
4
→ Na
2
SO
4
+ HCl
HBr, HI
o 3P + 3X
2
→ 2PX
3
o PX
3
+ 3H
2
O → H
3
PO
4
+ 3HX
bezpośrednie reakcje
o H
2
+ F
2
→ 2HF; ∆H = -583kJ/mol
o H
2
+ Cl
2
(hν)→ 2HCl; ∆H = -184kJ/mol
o H
2
+ Br
2
→ 2HBr; ∆H = -72kJ/mol
o H
2
+ I
2
→ 2HI; ∆H = 52kJ/mol
Właściwości redukujące:
HF < HCl <HBr <HI
% wiązania jonowego:
HF:
tworzy wiązania wodorowe
4HF + SiO
2
→ SiF
4
+ 2H
2
O
ciekły fluorowodór ma zdolność do
autodysocjacji – przewodzi prąd
elektryczny
o HF + HF → H
2
F
2
o HF ↔ H
+
+ F
-
o H
2
F
2
↔ H
2
F
+
+ F
-
o HF (2HF) → H
2
F
+
+ H
2
F
-
70
Fluorowce z wodą:
Cl
2
, Br
2
– rozpuszcza się w H
2
O dość dobrze
F – nie rozpuszcza się w wodzie
I
2
– trudnoe rozpuszczalny (I
-
ułatwia rozpuszczanie)
Fluor
o 2F
2
+ 2H
2
O → 4HF + O
2
(reakcja mocno energetyczna, wyparcie tlenu)
Chlor i brom
o X
2
+ H
2
O → HX + HXO
o 2HXO (hν) → 2HX + O
2
Związki z tlenem: (fluor tworzy fluorek), w nawiasach zw. nietrwałe
st. utl.
F
Cl
Br
I
-I
OF
2
, O
2
F
2
--------
--------
--------
III
--------
Cl
2
O
3
--------
--------
IV
--------
ClO
2
, Cl
2
O
4
(BrO
2
)
(I
2
O
4
)
V
--------
--------
--------
(I
2
O
5
)
VI
--------
Cl
2
O
6
--------
--------
VII
--------
Cl
2
O
7
--------
(I
2
O
7
)
Oksokwasy fluorowców:
fluor – HOF
chlor – HClO, HClO
2
, HClO
3
, HClO
4
brom – HBrO, HBrO
2
, HBrO
3
, (HBrO
4
)
klasyczne kwasy tlenowe
jod – HIO, HIO
3
, HIO
4
, H
3
IO
5
, (H
4
I
2
O
9
)
Moc kwasów tlenowych:
HClO < HClO
2
< HClO
3
< HClO
4
HClO > HBrO > HIO
HClO
3
> HBrO
3
> HIO
3
trwały jest tylko HClO
4
na VII stopniu utlenienia
Kwasy tlenowe, właściwości utleniające:
HClO
3
> HBrO
3
> HIO
3
Reakcje z roztworami halogenków:
Cl
2
+ 2NaBr → 2NaCl + Br
2
Br
2
+ NaI → NaBr + I
2
I
2
+ KBr → nie reaguje
Związki międzyhalogenowe:
AX
AX
2
AX
3
AX
5
AX
7
ClF
(g)
--------
ClF
3(g)
ClF
5(g)
--------
BrF
(g)
--------
BrF
3(c)
BrF
5(c)
--------
IF
(g)
--------
IF
3(s)
IF
5(c)
IF
7(g)
BrCl
(g)
BrCl
2
--------
--------
--------
ICl
(c)
--------
--------
--------
--------
IBr
(c)
--------
(ICl
3
)
2(s)
--------
--------
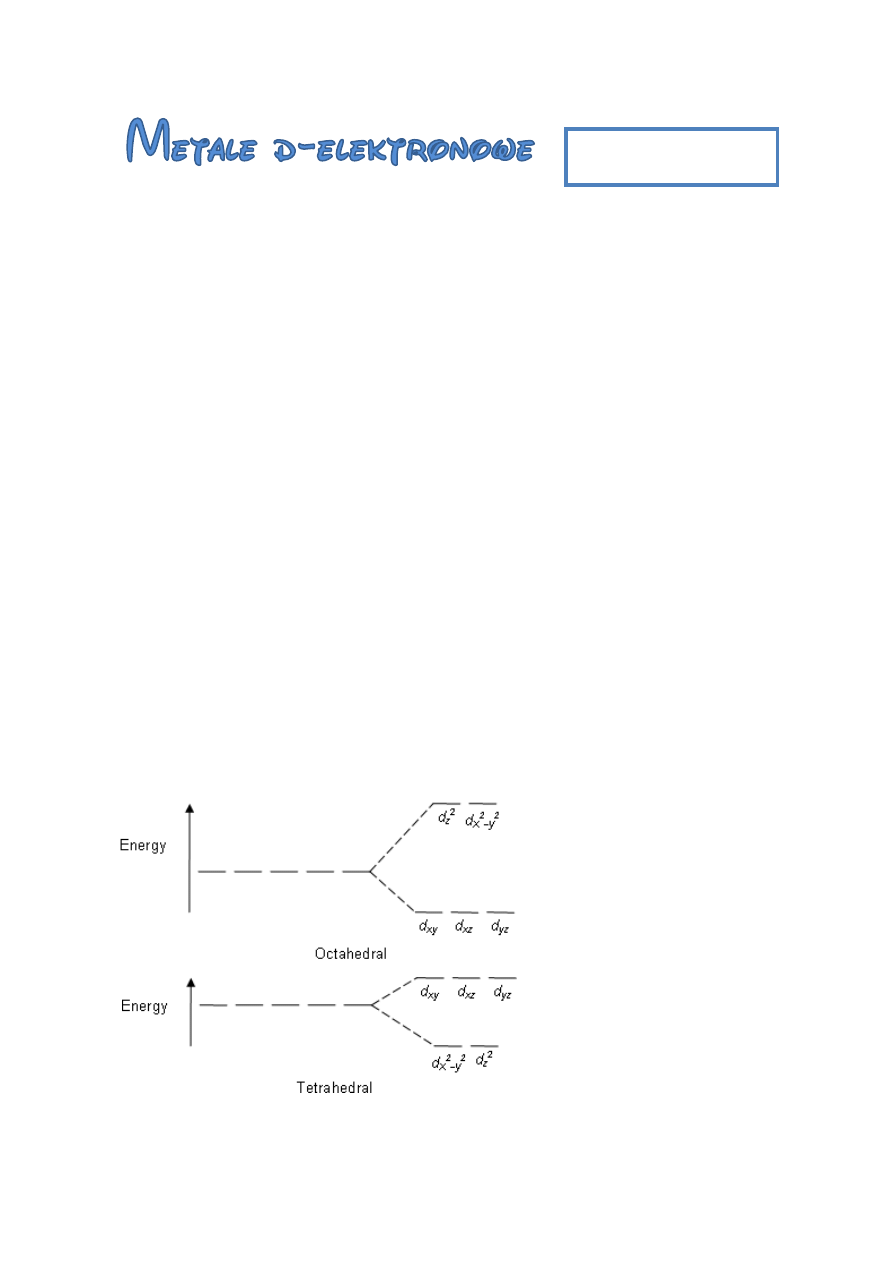
71
obejmuje grupy III – XII
metale
nieprzejściowe – gr. XII
przejściowe – gr. III-XI
promień atomowy rośnie w prawą stronę układu okresowego, zmiany są nieduże
roztwory stałe
o roztwory substytucyjne
pomiędzy metalami d-elektronowymi
poprzez podstawienie
zbliżone promienie atomowe ∆<15%
np. stopy Zn-Cu, Au-Ag
o roztwory międzywęzłowe
przewodnictwo elektryczne zależy od temperatury i rodzaju metalu oraz
rodzaju pierwiastka wbudowanego w sieć
twarde
wysoka temperatura topnienia
wodorki, węgliki, azotki, borki
np. roztwór C w Fe
ferromagnetyzm – obecność domen o uporządkowanych spinach (pole magnetyczne je
porządkuje)
o Fe, Co, Ni, Ga, CrO
2
, Fe
3
O
4
Preferowane stopnie utlenienia:
skandowce – III
cynkowce – II
Rozszczepienie energii, diagramy:
Zwrócić uwagę na kształt
orbitali d w przestrzeni
72
Tytan:
zastosowanie
o budowa rakiet i samolotów
o dodatek stopowy do stali
o implanty, endoprotezy (stabilny, biokompatybilny)
Chrom:
stopień utlenienia
II
III
VI
wzór
Cr(OH)
2
Cr(OH)
3
CrO
2
(OH)
2
kolor
niebieski
zielony
czerwony
charakter
zasadotwórczy
amfoteryczny
kwasotwórczy
III stopień utlenienia
o Cr
2
O
3
o redukcja chromianów
(NH
4
)
2
Cr
2
O
7
(T) → Cr
2
O
3
+ N
2
+ 4H
2
O
o reakcje
Cr
2
O
3
– z H
2
SO
4(stęż.)
i (T) → Cr
2
(SO
4
)
3
Cr
2
O
3
– stopienie → NaCrO
2
o związki
Cr
3+
+ 3H
2
O ↔ Cr(OH)
3
↔ [Cr(OH)
6
]
3-
CrCl
3
otrzymywanie
o Cr
2
O
3
+ 3C + 3Cl
2
→ 2CrCl
3
+ 3CO
o Cr + 3/2 Cl
2
→ CrCl
3
substancja dobrze rozpuszczalne w wodzie
CrCl
3
.
6H
2
O
izomeria hydratacyjna – różne połączenia z cząsteczkami wody
VI stopień utlenienia
o ulega rozkładowi z odszczepieniem O
2
2CrO
3
→ 2CrO
2
+ O
2
4CrO
2
→ 2Cr
2
O
3
+ O
2
o reakcje
2CrO
3
+ 2NH
3
→ N
2
+ Cr
2
O
3
+ 3H
2
O
2CrO
3
+ 3C
2
H
5
OH → Cr
2
O
3
+ 3 CH
3
CHO + 3H
2
O
o chromiany
CrO
3
+ H
2
O → H
2
CrO
4
(słaby kwas) [Na
2
CrO
4
– pH>7; ulega hydrolizie]
2CrO
3
+ H
2
O → H
2
Cr
2
O
7
3CrO
3
+ H
2
O → H
2
Cr
3
O
10
działanie utleniające
CrO
4
2-
+ 8H
+
+3e
-
→ Cr
3+
+ 4H
2
O
2Cr
n
O
3n+1
2-
+ 2H
3
O
+
↔ Cr
2n
O
6n+1
2-
+ 3H
2
O
reakcja jest odwracalna i zależy od pH roztworu

73
funkcje biologiczne chromu
o stabilizuje poziom cukru we krwi
o obniża poziom cholesterolu i trójglicerydów we krwi
o kontroluje poczucie apetytu
o stymuluje przemiany energetyczne
o syntezę kwasów tłuszczowych
o pobudza transport aminokwasów do komórek
o stymuluje działanie insuliny przy wykorzystaniu glukozy
o zwiększa tolerancję na glukozę
Mangan:
reakcje
o MnCO
3
(T) → MnO + CO
2
(szarozielony)
o Mn
2+
+ 2OH
-
→ Mn(OH)
2
(biały osad)
o Mn(II) – analityczne oznaczanie O
2
w H
2
O
o Mn
2+
+ 2OH
-
→ Mn(OH)
2
o 2Mn(OH)
2
+ O
2
→ 2MnO
2
.
H
2
O
o MnO
2
.
H
2
O + 4H
+
→ Mn
4+
+ 3H
2
O
o Mn
4+
+ 2I
-
→ Mn
2+
+ I
2
o I
2
+ 2S
2
O
3
2-
→ S
4
O
6
2-
+ 2I
-
o Mn(IV)
Mn(NO
3
)
2
(T) → MnO
2
(piroluzyt)
zastosowanie
o odbarwianie szkła
rozpuszcza się w stopionej masie szklanej -> krzemiany Mn(III) jednocześnie
utlenianie C i siarczków
czerwonofioletowa barwa krzemianu Mn(III) dopełnia zieloną barwęod Fe
2+
(...)
MnO
2
.
H
2
O
o słabe właściwości amfoteryczne
właściwości zasadotwórcze
MnO
2
+ 4HCl → (MnCl
2
+ Cl
2
) + 2H
2
O
MnO
2
+ H
2
SO
4
→ (MnSO
4
+ O
2
) + H
2
O
właściwości kwasotwórcze
M
4
MnO
4
(w reakcji stapiania MnO
2
z litowcem)
o właściwości katalityczne
rozkład H
2
O
2
(Cu)
CO → CO
2
(oczyszczanie powietrza z CO)
Mn (VI), Mn (VII)
o 3MnO
4
2-
+ 4H
+
→ 2MnO
4
-
+ MnO
2
+ 4OH
-
o K
2
MnO
4
o MnO
4
-
silny utleniacz
środowisko słabo zasadowe
o MnO
4
-
+ H
2
O + 3e
-
→ MnO
4
+ 4OH
-
środowisko silnie zasadowe
o MnO
4
-
+ e
-
→ MnO
4
2-
środowisko kwaśne
o MnO
4
-
+ 8H
+
+ 4e
-
→ Mn
2+
+ 4H
2
O
rozkład
o 2KMnO
4
(490-500K) → K
2
MnO
4
+ MnO
2
+ O
2

74
rola biologiczna
o aktywator enzymów regulujących metabolizm glukozy i innych węglowodanów,
lipidów, łącznie z cholesterolem oraz białek
o składnik kości
o regulacja metabolizmu witamin B
1
i E
o aktywacja niektórych enzymów biorących udział w procesie wytwarzania energii,
syntezie glikogenu, syntezie mocznika, oraz białek uczestniczących w procesie
krzepnięcia krwi i regeneracji tkanki łącznej
o wypiera Mg z połączeń w układach enzymatycznych
o dysmutazy manganowe
Żelazo:
reakcje
o powietrze
uwodnione tlenki Fe
ogrzewanie w O
2
4Fe + 3O
2
→ 2Fe
2
O
3
3Fe + 2O
2
→ Fe
3
O
4
o woda
powietrze + woda → korozja
w T = 470K
3Fe + 4H
2
O → Fe
3
O
4
o kwasy
[Fe(OH
2
)
6
]
2+
Fe + 2H
+
+ SO
4
2-
→ Fe
2+
+ SO
4
2-
+ H
2
jeśli obecny jest O
2
Fe
2+
→ Fe
3+
stężony HNO
3
→ pasywacja
rola biologiczna
o transport O
2
(hemoglobina)
o udział w procesach redoxowych
o znajduje się w centrach aktywnych enzymów (cytochromy)
Platynowce:
Platynowce lekkie
symbol i nazwa
Ru - ruten
Rh - rod
Pd – pallad
powłoka walencyjna
4d
7
5s
1
4d
8
5s
1
4d
10
gęstość
12.37
12.41
12.02
Platynowce ciężkie
symbol
Os - osm
Ir - iryd
Pt - platyna
powłoka walencyjna
5d
6
6s
2
5d
7
6s
2
5d
9
6s
1
gęstość
22.59
22.42
21.45
Ruten, Rod i Platyna stosowane w terapii antynowotworowej. Nie są selektywne, co jest największym
problemem.
Platyna:
przy terapii w nowotworach jąder, jajników, także nowotworów w obrębie głowy i szyi
aktywna jest tylko forma cis (trans nie)
dochodzi do wiązania z DNA, głównie do guanin
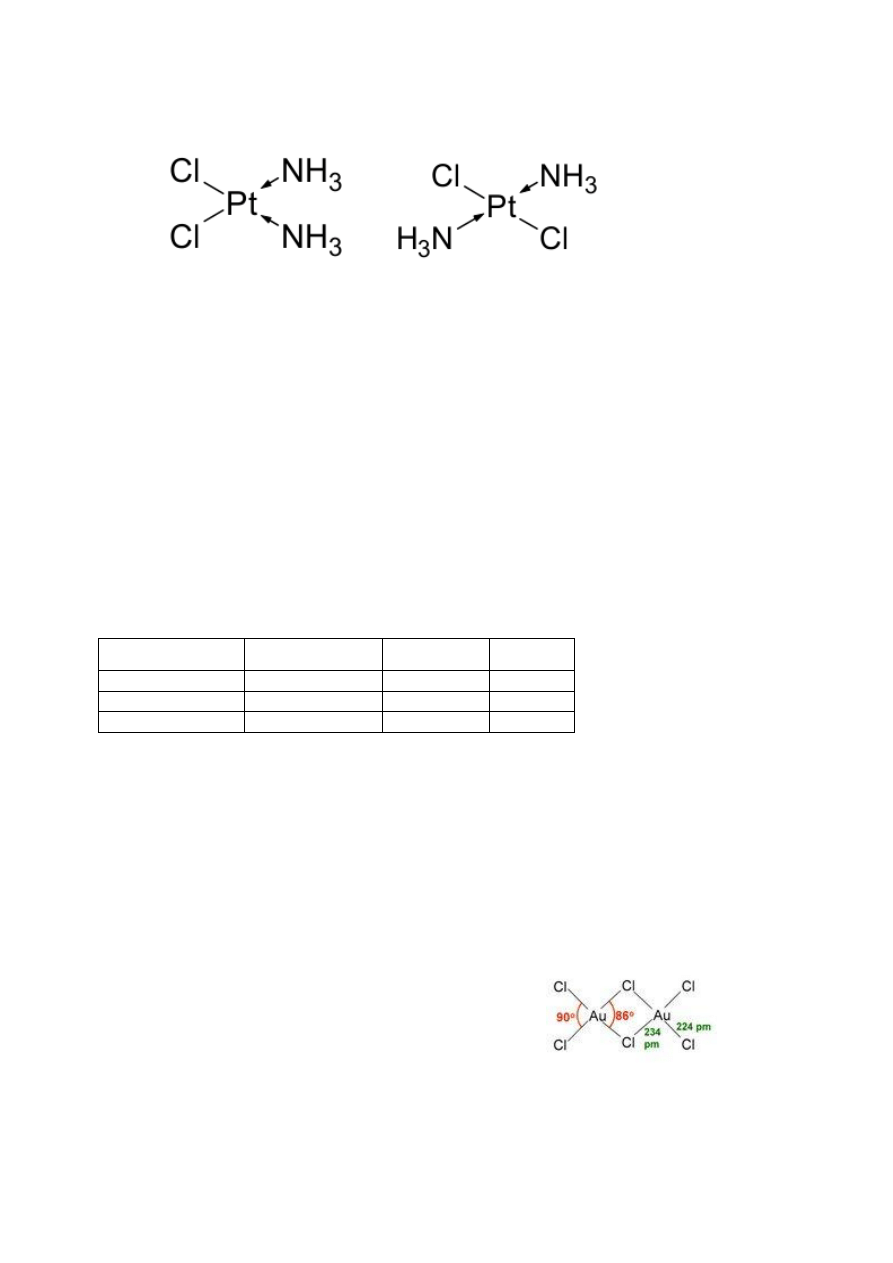
75
stosowany związek: PtCl
2
(NH
3
)
2
izomeria
geometryczna
Miedziowce:
Cu, Ag, Au
nie ulegając korozji na powietrzu
reakcje
o Cu + O
2
4 Cu + O
2(powietrze)
→ 2Cu
2
O
Cu
2
O
(T) → CuO
CuO + CO
2
+ H
2
O
→ (CuOH)
2
CO
3
(patyna – zielona)
duże stężenie SO
2
→ CuSO
4
o rozpuszczanie
Cu, Ag (tylko z kwasami tlenowymi)
3 Cu + 8 HNO
3
→ 3Cu(NO
3
)
2
+ 2NO + H
2
O
Cu + H
2
SO
4(stęż.)
→ CuSO
4
+ SO
2
+ H
2
O
Au
Au + 3HNO
3
+ 4HCl → HAuCl
4
+ 3NO
2
+ 3H
2
O
(kwas tetrachlorozłotowy)
konfiguracja powłoki walencyjnej: (n-1)d
10
ns
1
stopień utlenienia
I
II
III
miedź
Cu
2
O (czerwony)
CuO (czarny)
srebro
Ag
2
O (czarny)
AgO (czarny)
złoto
Au
2
O
3
Związki:
Cu(OH)
2
o rozpuszcza się w NaOH
Cu(OH)
2
+ 2NaOH → Na
2
[Cu(OH)
4
]
o rozpuszcza się w roztworach amoniakalnych
Cu(OH)
2
+ 4NH
3
→ [Cu(NH
3
)
4
](OH)
2
z fluorowcami
o Cu
Cu
2+
+ 3I
-
→ CuI + I
2
CuO + 2HCl → CuCl
2
+ H
2
O
CuCl
2
+ O
2
(T) → 2CuO + 2Cl
2
o Au
2Au + 3Cl
2
→ 2AuCl
3
(AuCl
3
)
2
Zastosowanie miedzi:
do wykrywania alkoholi polihydroksylowych - Cu(OH)
2
reakcja biuretowa – wykrywanie wiązań peptydowych – CuSO
4
z OH
-
(fioletowy – pozytywna)

76
Znaczenie biologiczne:
miedź
o wchodzi w skład enzymów
hemocyjanina
dysmutaza ponadtlenkowa
oksydaza askorbinowa
o wpływa pozytywnie na błony otaczające komórki nerwowe
o bierze udział w:
tworzeniu krwinek czerwonych (transport żelaza)
tworzeniu tkanki łącznej
syntezie prostaglandyn
o genetycznie uwarunkowany defekt metabolizmu miedzi – choroba Wilsona
złoto
o auranofina - Au(Pet
3
)(ttag)
ttag – tetra-O-acettylotioglukoza
używana przy reumatoidalnym zapaleniu stawów, gdy inne leki zawodzą
Cynkowce:
Zn, Cd, Hg
powłoka walencyjna: (n-1)d
10
ns
2
kadm i rtęć toksyczne
roztwór wodny - M
II
o silne kompleksy
Zn < Cd < Hg
[ML
4
]
[HgL
2
], [HgL
3
] (L – ligand)
M
2
2+
o Hg
2
2+
[Hg––Hg]
2+
diamagnetyki
Hg
2
2+
(aq.)
↔ Hg
(c)
+ Hg
2+
(aq.)

77
Cynk:
twardy, kruchy
bardzo reaktywny
na powietrzu ulega pasywacji
o pokrycie cienką warstewką zasadowego węglanu
spala się w powietrzu – biały ZnO
reakcje
o Zn + 2NaOH + 2H
2
O → H
2
+ Na
2
[Zn(OH)
4
] lub Na
2
ZnO
2
o Zn + 2HCl → ZnCl
2
+ H
2
o ZnCl
2
+ 2NaOH → Zn(OH)
2
+ 2NaCl
o Zn(OH)
2
+ 2NaOH → Na
2
[Zn(OH)
4
]
o Zn(OH)
2
+ 4NH
3
→ [Zn(NH
3
)
4
](OH)
2
o H
2
S + ZnCl
2
→ ZnS + 2HCl
o ZnCO
3
(T) → ZnO + CO
2
znaczenie biologiczne
o udział w mineralizacji kości
o gojenie się ran
o wpływ na pracę układu odpornościowego
o wpływ na prawidłowe wydzielanie insuliny
o wpływ na stężenie witaminy A oraz cholesterolu
o regulacja ciśnienia krwi i rytmu serca
o synteza związków regulujących wzrost i rozwój roślin
działanie lecznicze
o wrzody żołądka
o uporczywe żylaki
o trądzik
o choroby skórne
o owrzodzenia
o reumatyzm
Rtęć:
właściwości chemiczne
o nie reaguje z kwasami beztlenowymi
o rozpuszcza się w stężonym HNO
3
i H
2
SO
4
oraz w wodzie królewskiej
o reaguje z siarką
o reakcje
HgS + O
2
→ Hg + SO
2
2Hg + O
2
→ 2HgO (czerwony)
Hg
2+
+ 2OH
-
→ HgO (żółty) + H
2
O
Hg + H
2
) → nie reaguje
o działanie toksyczne
neuro-, kardio-, hepato-, nefro-, immunotoksyczna
kancerogenna
powoduje zaburzenia rozwojowe u dzieci
choroby neurodegeneracyjne u dorosłych (Alzheimer, Parkinson)
różnica koloru wynika
z różnicy rozdrobnienia

78
Wyszukiwarka
Podobne podstrony:
wyk ady z etyki 1 5 internet
ZPKB wyk ady AK
(CHEMIA WYK 4
fizjo - wyk+éady, Leśnictwo UP POZNAŃ 2013, Fizjologia roślin drzewiastych
DI Wyk ady (prof K Marcinek) [2006 2007]
Analiza i przetwarzanie obraz w W.1, !!!Uczelnia, wsti, materialy, III SEM, Wyk ady
chemia wyk
biologia wyk-ady sem 3, Ochrona środowiska, OŚ POLSL, INŻ, SEM. 3, Biologia, Wykłady
egz wyk+éady, Filozofia, Rok IV, polityczna, Materiał
GiH wyk ady
WYK ADY Z C, WYK AD7, GRAFIKA
WYK ADY Z C, WYK AD6, PLIKI:
PM wyk ady 4 rok JM choroby odtytoniowe
WYK ADY FILOZOFIA, INNE KIERUNKI, filozofia
więcej podobnych podstron