Miareczkowanie kwasowo zasadowe
Wstęp teoretyczny:
Miareczkowanie jest jedną z podstawowych czynności laboratoryjnych. Polega ono na
dodawaniu porcjami odczynnika o znanym stężeniu do roztworu oznaczanej substancji, aż do
osiągnięcia tzw. punktu końcowego miareczkowania. Punkt ten oznacza z reguły, że cały
zawarty w roztworze odczynnik o nieznanym stężeniu przereagował całkowicie z dodanym
przez nas odczynnikiem (zwanym titrantem). Ponieważ wiemy ile odczynnika dodaliśmy oraz
znamy stosunek, w jakim reaguje on z oznaczaną substancją, możemy obliczyć ilość i
stężenie składnika miareczkowanego. Jest to jedna z podstawowych metod analizy ilościowej.
Miareczkowanie alkacymetryczne (inaczej: kwasowo-zasadowe) polega na wykorzystaniu
reakcji zobojętniania. Reakcja zobojętniania - to reakcja między kwasem a zasadą, która
prowadzi do zmiany pH środowiska reakcji w kierunku bardziej obojętnego odczynu.
Całkowitą reakcję zobojętniania można ująć następująco:
H
3
O
+
+ A
-
+ B
+
+ OH
-
--> 2H
2
O + B
+
+ A
-
Aparatura:
Biureta Pehametr Pipety Statyw
Wykonanie ćwiczenia:
Ć
wiczenie zacząłem od wykalibrowania pehametru, do zlewki wlałem roztwór o znanym pH,
po czym włączyłem urządzenie pomiarowe. Czekając na odczyt pehametru do birety przy
zakręconym kraniku wlałem 25 cm
3
0,1 molowego kwasu solnego, którym miareczkował
będę pierwszy roztwór, czyli wodorotlenek sodu. Pehametr został wykalibrowany, wskazanie
zgadza się z pH znanego roztworu, przemyłem elektrodę pomiarową wodą destylowaną.
Miareczkowanie NaOH/ HCl
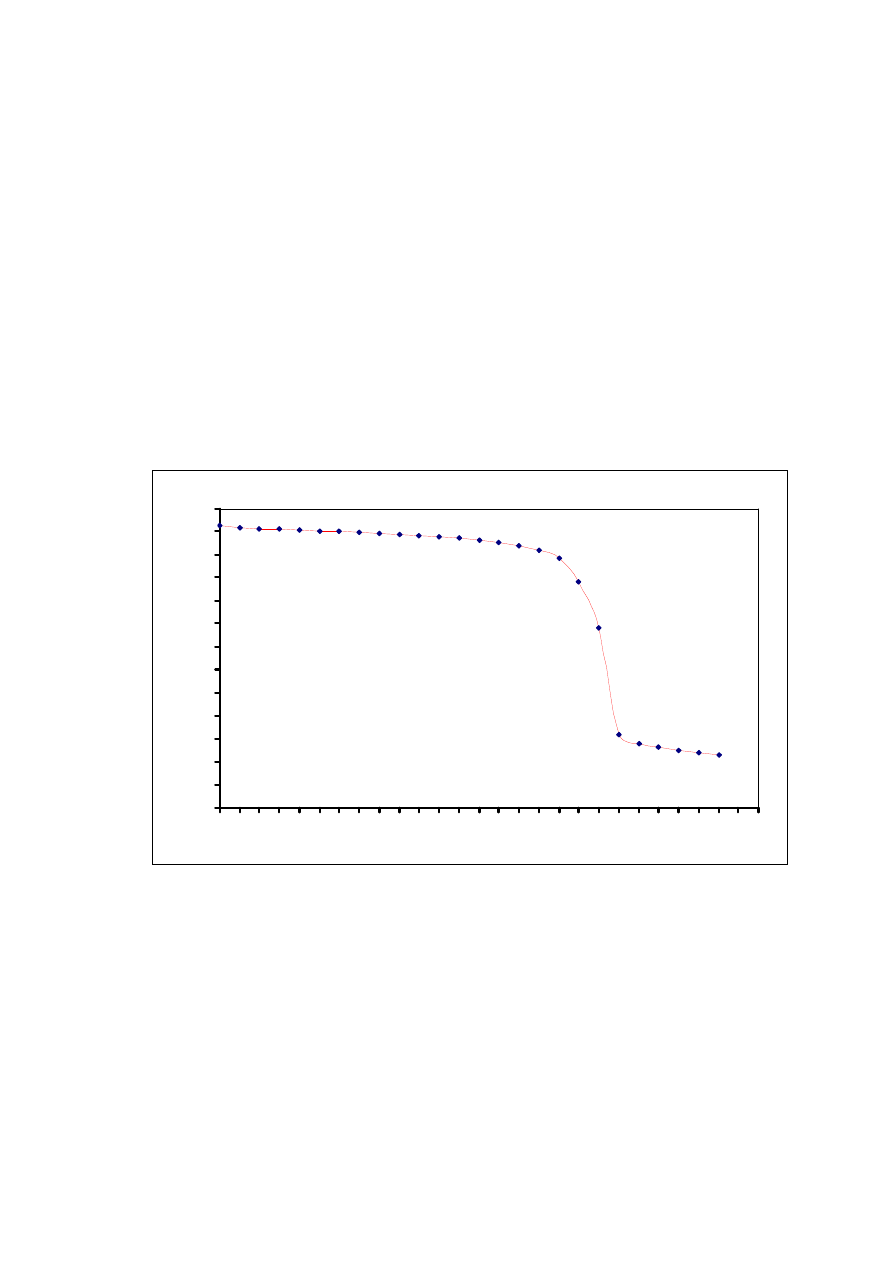
Miareczkowanie NaOH chlorowodorem
0,00
1,00
2,00
3,00
4,00
5,00
6,00
7,00
8,00
9,00
10,00
11,00
12,00
13,00
0
1 2
3
4
5 6
7
8
9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27
cm
pH
Przykład miareczkowania mocnej zasady mocnym kwasem. Odmierzyłem 10 cm
3
0,2
molowego NaOH, po czym rozcieńczyłem do 100cm
3
wodą destylowaną. Zlewkę z zasadą
ustawiłem pod biuretą, po czym włożyłem do niej elektrodę pehametru. Przystąpiłem do
miareczkowania, wpuszczałem po 1cm
3
przygotowany wcześniej kwas, zapisując pH
odczytane z urządzenia pomiarowego po każdej dolanej porcji czekając aż dokładnie się ono
ustali, (wyniki w tabelce na końcu). Rekcję zachodzącą w roztworze możemy przedstawić
następująco:
HCl + NaOH ---> NaCl + H
2
O
H
+
+ Cl
-
+ Na
+
+ OH
-
---> H
2
O + Na
+
+ Cl
-
widzimy, że po obu stronach równania występuje Na
oraz Cl, więc możemy je opuścić i otrzymać następująca postać równania:
H
+
+ OH
-
---> H
2
O (koncepcja Arrheniusa)
H
3
O
+
+ OH
-
---> 2H
2
O (koncepcja Bronsteda)
Krzywą miareczkowania, czyli wykres zależności pH od obojętności dodanego titranta
wygląda następująco:
Analizując wykres możemy stwierdzić, iż zgodnie z przypuszczeniami i teorią stopniowe
dolewanie kwasu powoduje spadek stężenia jonów OH
-
związanego z reakcją zobojętniania.
Można zauważyć, że kolejne zmiana odczynu o jednostkę wymaga dodawania coraz
mniejszych ilości kwasu, co tłumaczy pojawienie się „skoku” na wykresie. Punkt
równoważnikowy to sytuacja, w której ilość kwasu jest równa ilości zasady. Przekroczenie
punktu powoduje, że zmiany, pH są coraz mniejsze gdyż nie następuje już zobojętnianie, lecz
wzrost stężenia jonów wodorowych. Po zakończeniu miareczkowania umyłem biuretę oraz
elektrodę pomiarową pehametru.
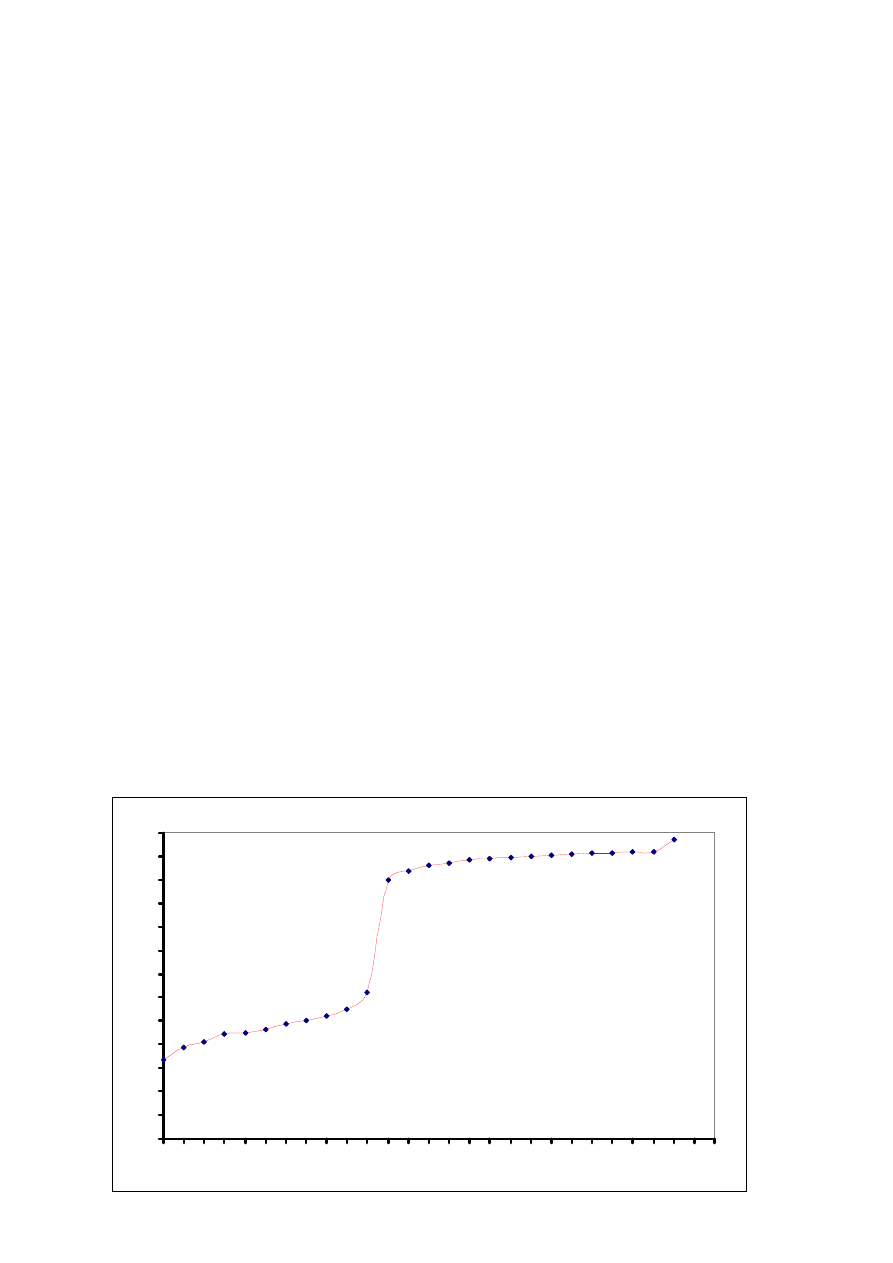
Miareczkowanie kwasu octowego NaOH
0,00
1,00
2,00
3,00
4,00
5,00
6,00
7,00
8,00
9,00
10,00
11,00
12,00
13,00
0
1
2
3
4
5
6
7
8
9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27
cm
pH
Miareczkowanie CH
3
COOOH/NaOH
Przykład miareczkowania słabego kwasu mocna zasadą. HA + OH
-
---> H
2
O + A
-
Do biurety
nalałem 25cm
3
0,2 molowego wodorotlenku sodu, po czym odmierzyłem pipetą 10 cm
3
0,2
molowego kwasu octowego i rozcieńczyłem go do 100 cm
3
woda destylowaną, tak jak
poprzednio miareczkowałem wpuszczając po jednym centymetrze tym razem wodorotlenek
sodu Odczytywałem i notowałem wskazania pehametru po każdej dolanej porcji. Reakcja
zachodząca w roztworze wygląda tak:
CH
3
COOH + NaOH <=> CH
3
COONa + H
2
O
Otrzymany roztwór nie jest obojętny, lecz słabo zasadowy. Czyli w tym przypadku nie
uzyskaliśmy tego, co ogólnie nazwaliśmy "zobojętnieniem".
Dzieje się tak, dlatego, ponieważ
w reakcji powstaje sól, która ulega reakcji hydrolizy. Wynikiem tej reakcji jest nadanie
roztworowi odczynu zasadowego. Zasadowy odczyn roztworu jest spowodowany powstaniem
dodatkowych ilości OH
-
w reakcjach. Przebieg reakcji chemicznej przedstawia poniższe
równanie
CH
3
COOH + Na
+
+ OH
-
<=> CH
3
COO
-
+ Na
+
+ H
2
O
Ponieważ jony sodowe nie uczestniczą realnie w reakcji, więc powyższe równanie możemy
zapisać w postaci
CH
3
COOH + OH
-
<=> CH
3
COO
-
+ H
2
O
kwas I zasada II zasada I kwas II
W napisanej reakcji zgodnie z teorią Bronsteda uczestniczą dwa słabe kwasy (kwas octowy i
woda). Po zmieszaniu roztworów zawierających stechiometryczne ilości kwasu CH
3
COOH i
zasady NaOH ustali się stan równowagi, w którym stężenie jonów wodorotlenowych będzie
większe niż stężenie jonów wodorowych (pochodzących wyłącznie z dysocjacji cząsteczek
wody) - odczyn otrzymanego roztworu w punkcie równoważnikowym będzie słabo zasadowy
(pH > 7). Dalsze dodawanie wodorotlenku sodu powoduje wzrost pH.
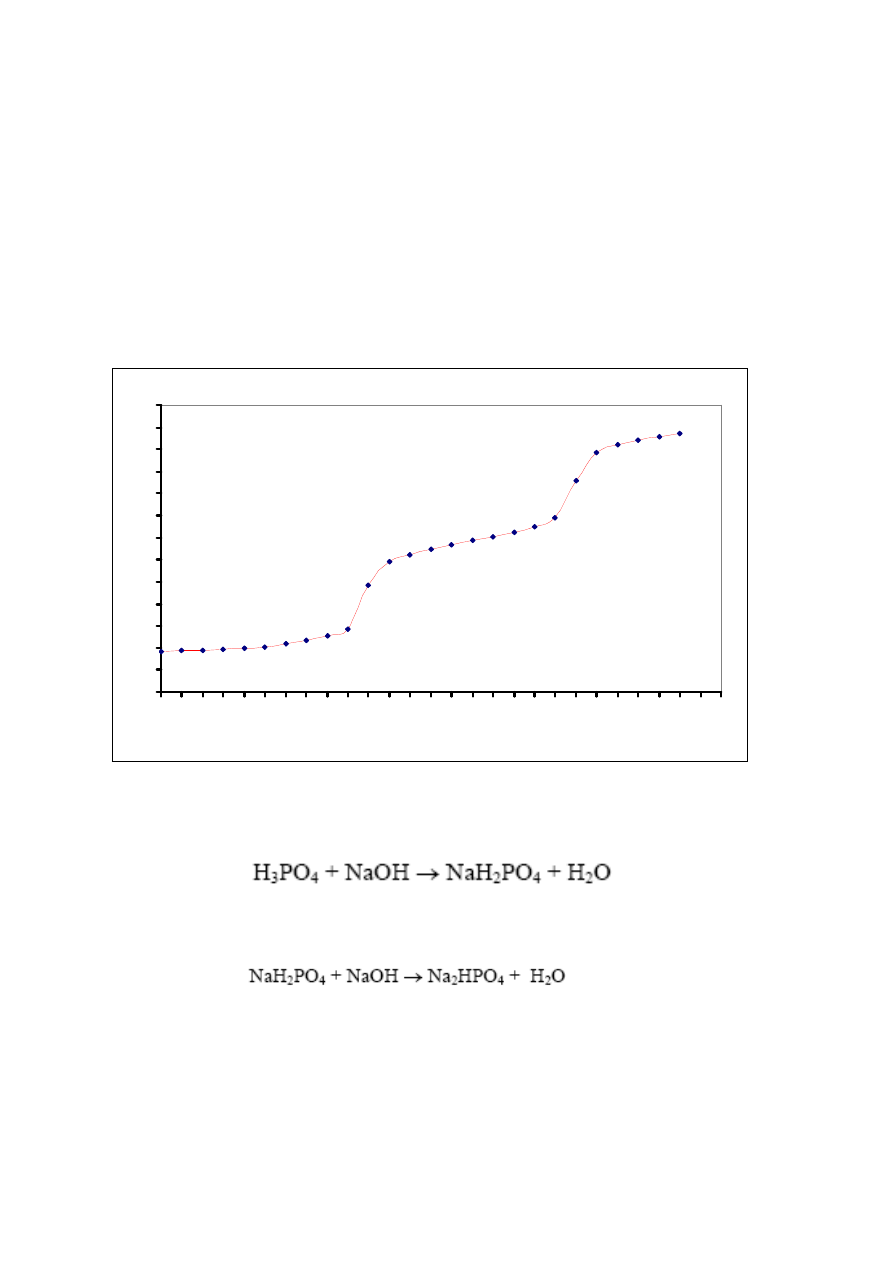
Miareczkowanie kwasu fosworowego (V) NaOH
0,00
1,00
2,00
3,00
4,00
5,00
6,00
7,00
8,00
9,00
10,00
11,00
12,00
13,00
0 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27
cm
pH
Przebieg miareczkowanie przedstawia powyższy wykres, wyniki zebrane są w tabeli na
końcu. Na wykresie widzimy, iż punkt równowagi odpowiada pH > 7 co potwierdza lekko
zasadowe środowisko. Po zakończeniu miareczkowania elektroda została umyta wodą
destylowaną.
Miareczkowanie kwasu fosforowego (V)/ NaOH
Biureta została napełniona do 25cm
3
0,2 molowym wodorotlenkiem sodu, odmierzyłem
10cm
3
0,2 molowego kwasu fosforowego, po czym rozcieńczyłem go do 100cm
3
wodą
destylowaną. Przystąpiłem do miareczkowania zapisując jak poprzednio odczytane wartości
pH (tabela na końcu). Jest to przykład miareczkowania kwasu wieloprotonowego mocną
zasadą. Reakcja zachodzi w kilku etapach. Przebieg miareczkowania przedstawia wykres:
Na wykresie widzimy wyraźnie dwa skoki, pierwszy skok pH około 2,2 do pH około 6
wnioskuję, iż jest to reakcja zobojętniania kwasu fosforowego do diwodorofosforanu sodu:
Drugi skok krzywej miareczkowania od pH około 7,88 do pH około 11 to reakcja
zobojętniania diwodorofosforanu sodu do wodorofosforanu disodu:
Prawdopodobnie warunki doświadczenia nie pozwoliły zaobserwować trzeciego skoku pH,
lecz w górnej części wykresu występuje już praktycznie sam Na
3
PO
4
. Po zakończeniu
miareczkowania umyłem ponownie elektrodę pehametru
.
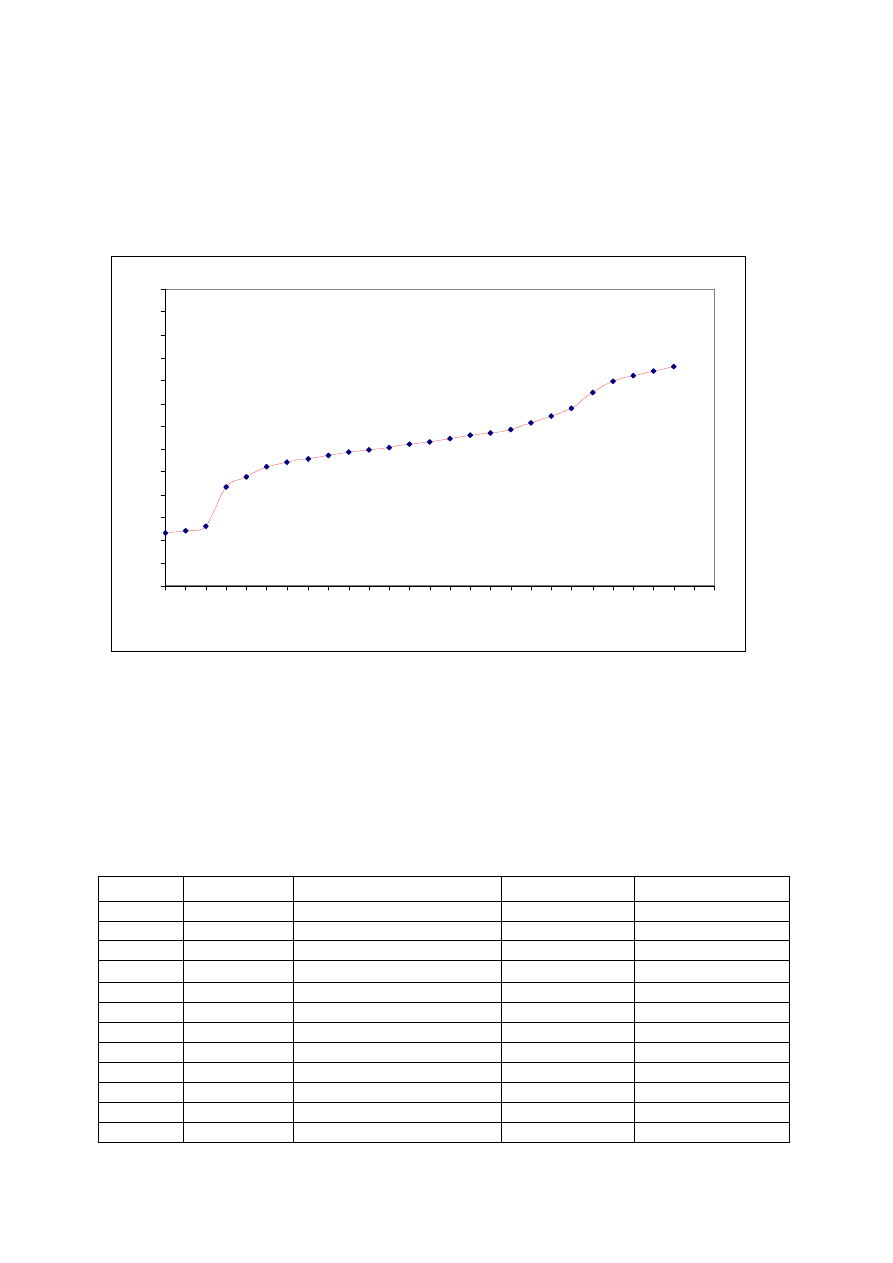
Miareczkowanie coca coli NaOH
0,00
1,00
2,00
3,00
4,00
5,00
6,00
7,00
8,00
9,00
10,00
11,00
12,00
13,00
0
1
2
3
4
5
6
7
8
9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 cm
pH
M
iareczkowanie Coca Coli/ NaOH
Do biurety wlałem ponownie 25 cm
3
0,2 molowego NaOH do zlewki wlałem100cm
3
Coca
Coli, po czym przystąpiłem do miareczkowania podobnie jak poprzednio wlewając po
jednym centymetrze wodorotlenek sodu, zapisywałem wartości pH wskazane przez miernik
(tabela na końcu). Przebieg miareczkowania przedstawia wykres:
Zauważam, że często, na co dzień pita coca cola ma zbliżony wykres miareczkowania do
kwasu fosforowego(V), istotnie w napoju występuje spora dawka tego kwasu, lecz występuje
też wiele dodatkowych substancji nie mamy, więc pewności czy kwas nie jest w znacznym
stopniu zneutralizowany, z czystej ciekawości wykonałem kilka obliczeń, z których
wyznaczyłem średnią zawartość kwasu ortofosforowego w coca coli około 0,008 mol/dm
3
przyjmując gęstość coli równą gęstości wody 1g/cm
3
jest to roztwór w przybliżeniu 0,07% co
w zupełności wystarcza by rozpuścić żyletkę (wykonałem takie doświadczenie).
Zestawienie Wyników:
Centymetr NaOH/HCl
CH
3
COOOH/NaOH
H
3
PO
4
/NaOH
CocaCola/ NaOH
0
12,29
3,35
1,85
2,32
1
12,18
3,88
1,89
2,43
2
12,13
4,10
1,90
2,61
3
12,10
4,43
1,92
4,32
4
12,07
4,51
1,97
4,80
5
12,04
4,63
2,04
5,23
6
12,00
4,86
2,17
5,40
7
11,97
5,02
2,33
5,55
8
11,93
5,20
2,53
5,70
9
11,88
5,52
2,86
5,86
10
11,82
6,19
4,83
5,98
11
11,78
11,01
5,91
6,08
12
11,71
11,39
6,23
6,22
13
11,62
11,60
6,48
6,32
14
11,51
11,71
6,70
6,45
15
11,39
11,85
6,86
6,60
16
11,21
11,92
7,02
6,70
17
10,87
11,96
7,22
6,83
18
9,80
12,02
7,48
7,15
19
7,81
12,06
7,88
7,45
20
3,18
12,09
9,58
7,80
21
2,81
12,12
10,85
8,45
22
2,62
12,15
11,22
8,95
23
2,49
12,18
11,44
9,20
24
2,39
12,21
11,59
9,42
25
2,30
12,72
11,72
9,59
Wnioski:
W każdym z przypadków, w miarę wprowadzania substancji miareczkującej, w roztworze
zachodzą zmiany stężenia jonów wodorowych lub wodorotlenowych, następuje, więc zmiana
pH roztworu. Na przebieg krzywej miareczkowania znaczny wpływ mają takie właściwości
jak: stężenie miareczkowanego roztworu oraz roztworu mianowanego, objętość
miareczkowanego roztworu, w przypadku miareczkowania kwasu ilość protonów. Ćwiczenie
było pouczające gdyż zapoznałem się dokładnie z tą metoda analizy ilościowej oraz reakcjami
zobojętniania, mogłem się przekonać na własne oczy, czym w rzeczywistości jest tak lubiana
coca cola.
Wyszukiwarka
Podobne podstrony:
Miareczkowanie kwasowo-zasadowe
MIARECZKOWANIE KWASOWO ZASADOWE
Równowaga kwasowo zasadowa fizjot3
Rˇwnowaga kwasowo zasadowa
Równowaga kwasowo zasadowa fizjot3
Wskaźniki kwasowo zasadowe
Mechanizm wodno elektrolitowy i kwasowo zasadowy
Fizjologia kolo RKZ, II rok, II rok CM UMK, Giełdy, od Joe, FIZJOLOGIA, KOLOKWIA, RÓWNOWAGA KWASOWO-
woda jako składnik żywności oraz równowagi kwasowo- zasadowe w żywności, żywienie człowieka i ocena
01 rownowaga kwasowo zasadowa
SPEKTROFOTOMETRYCZNE?DANIE RÓWNOWAG KWASOWO ZASADOWYCH W ROZTWORACH WODNYCH sprawozdanie równowag
1ta - wskaźniki kwasowo-zasadowe, dydaktyka, konspekty
więcej podobnych podstron