Wykład 4 – REAKCJE UTLENIANIA I REDUKCJI
REAKCJE
UTLENIANIA I
REDUKCJI
Reakcje utleniania i redukcji. Definicja stopnia utlenienia.
Reakcje oksydacyjno-redukcyjne – utleniacz i reduktor. Metody
dobierania współczynników stechiometrycznych w reakcjach redoks.
Uszeregowanie utleniaczy (jakościowo „szereg elektrochemiczny”).
Roztwarzanie metali w kwasach – metale szlachetne i nieszlachetne
Wykład 4 – REAKCJE UTLENIANIA I REDUKCJI
Przypomnienie:
●
Wymiana elektronów
KLASYFIKACJA REAKCJI CHEMICZNYCH
Kryterium klasyfikacji:
– reakcja Z WYMIANĄ ELEKTRONÓW – reakcja oksydacyjno -
redukcyjna
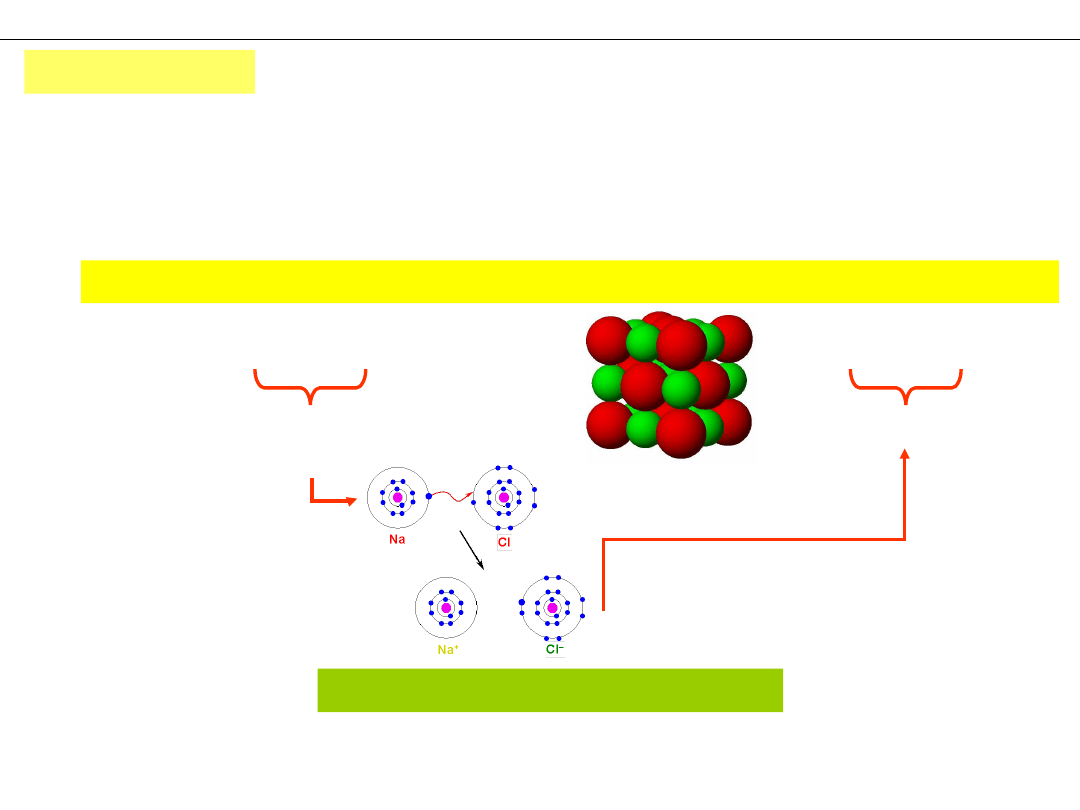
2Na + Cl
2
= 2NaCl → → 2Na
+
+ 2Cl
–
obojętne
atomy
jony
Na
+
Cl
–
Więcej na następnym wykładzie!
Wykład 4 – REAKCJE UTLENIANIA I REDUKCJI
Liczba elektronów wymienianych przez dany pierwiastek opisywana
jest
zmianą stopnia utlenienia tego pierwiastka
Stopień utlenienia atomu (pierwiastka) – pojęcie formalne,
oznaczające liczbę dodatnich lub ujemnych ładunków
elementarnych* , jakie można by przypisać danemu atomowi
gdyby cząsteczka lub jon w którym on występuje miałby
budowę czysto jonową.
*
- ładunek elektronu
Przybliżona interpretacja stopnia utlenienia: – liczba dodatkowych
lub brakujących elektronów w stosunku do stanu wolnego danego
pierwiastka.
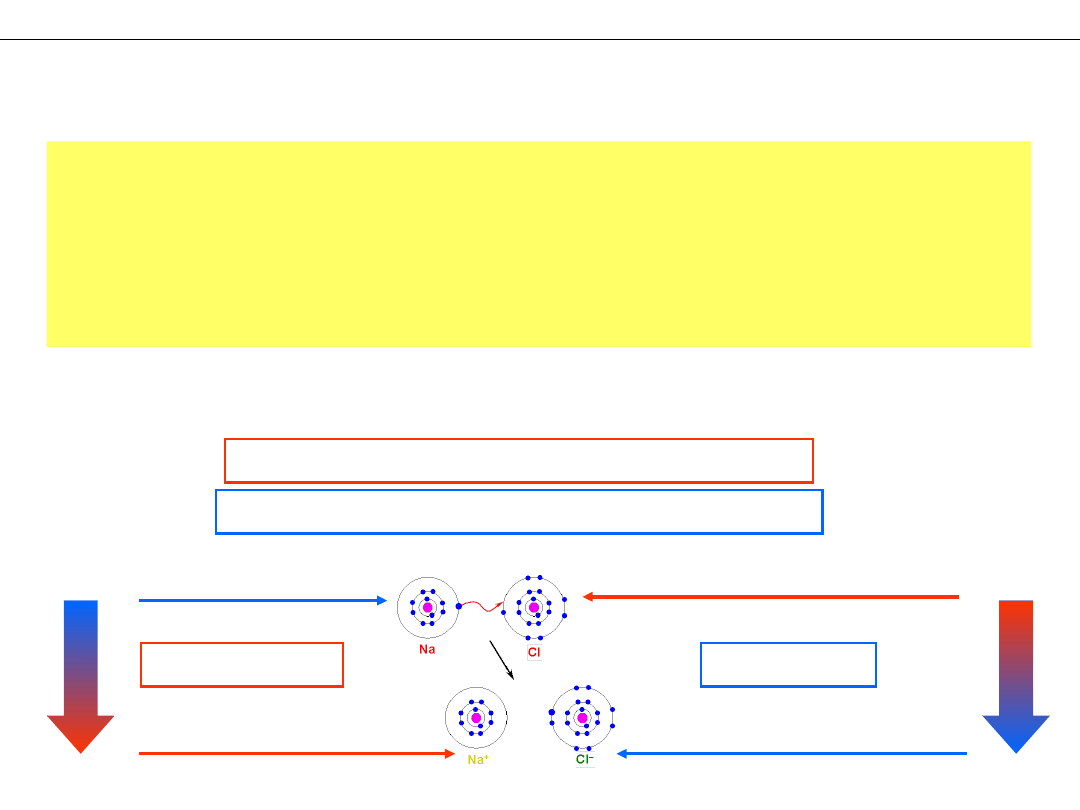
UTLENIANIE – wzrost stopnia utlenienia
REDUKCJA – obniżenie stopnia utlenienia
forma utleniona sodu
forma zredukowana chloru
forma zredukowana sodu
forma utleniona chloru
UTLENIANIE
REDUKCJA

Wykład 4 – REAKCJE UTLENIANIA I REDUKCJI
Reguły służące do wyznaczania stopnia utlenienia
1. Pierwiastki w stanie wolnym (O
2
, Ca)
0
2. Proste jony (Na
+
, Cu
2+
, Al
3+
, Cl
–
,
S
2–
)
ładunek jonu
3. Suma stopni utlenienia w cząsteczce
0
4. Suma stopni utlenienia w jonie
ładunek jonu
5. Wodór w związkach
+1
6. Tlen w związkach
2
Wyjątek: wodorki
(NaH, MgH
2
) –1
Wyjątki: nadtlenki
(H
2
O
2
)
–1
ponadtlenki (KO
2
)
– ½
fluorek tlenu (OF
2
)
+2
7. Formalny stopień utlenienia nie musi być liczbą całkowitą
i może mieć wartości ułamkowe.
Wykład 4 – REAKCJE UTLENIANIA I REDUKCJI
Przykłady obliczania stopni
utlenienia:
formalny
stopień
utlenienia!
b) Siarka w
S
2
O
3
2-
:
a) Siarka w
H
2
SO
3
:
H
2
S
O
3
S
2
O
3
2-
S +6
S –2
O –2
c) Żelazo w Fe
3
O
4
:
3∙x +
4∙(-2) = 0
SO
4
2-
S
2
O
3
2-
Fe +2 Fe +3
formalny
stopień
utlenieni
a!
x = +4
x = +2
FeO ∙
Fe
2
O
3
x = 8/3,
Suma stopni utlenienia w cząsteczce = 0
2∙
(1)
1∙
x
3∙
(-2)
= 0
Suma stopni utlenienia w jonie = ładunek jonu
2·
x
3∙
(-2)
=
2

Wykład 4 – REAKCJE UTLENIANIA I REDUKCJI
Reakcje w których zachodzi zmiana stopni utlenienia pierwiastków
nazywamy reakcjami oksydacyjno – redukcyjnymi (w skrócie
reakcjami „redoks”)
Zn + S = ZnS
Reakcja:
Stopnie utlenienia:
Klasyfikacja:
0
0
+2 –2
2 e
-
REDUKTOR
(dla siarki)
UTLENIACZ
(dla cynku)
Podczas reakcji oksydacyjno – redukcyjnej
REDUKTOR się utlenia, a UTLENIACZ
redukuje
REAKCJE
OKSYDACYJNO – REDUKCYJNE
"REDOKS"
Stopnie utlenienia są przydatne przy dobieraniu
współczynników stechiometrycznych reakcji "redoks"
H
2
S
-2
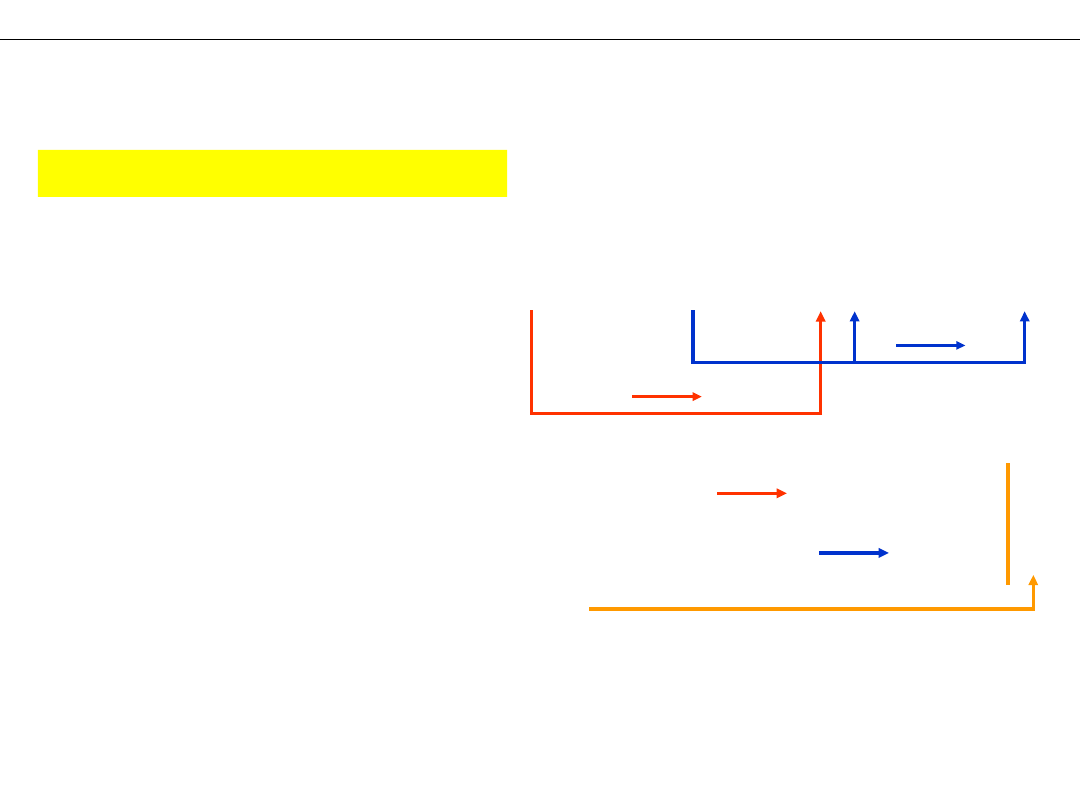
Wykład 4 – REAKCJE UTLENIANIA I REDUKCJI
I. Metoda STOPNI UTLENIENIA
METODY DOBIERANIA WSPÓŁCZYNNIKÓW
REAKCJI "REDOKS"
NH
3
+ O
2
= NO + H
2
O
a) stopnie utlenienia znane:
+1 –2
+1
–2
0
b) stopnie utlenienia wyliczone:
–3
+2
c) pierwiastki zmieniające
stopień utlenienia:
–3
+2
UTLENIANIE
0
REDUKCJA
–2
d) liczba wymienianych
elektronów:
N
–3
N
+2
O
2
0
2O
–2
e) uzgodnienie liczby
elektronów oddanych z pobranymi:
·4
·5
f) równanie końcowe:
4
NH
3
+
5
O
2
=
4
NO +
6
H
2
O
g) sprawdzenie liczności pierwiastków
po obydwu stronach równania:
N: 4 = 4
O: 5·2 = 4 + 6
H:
4·3 = 6·2
+ 5e
–
+ 4e
–
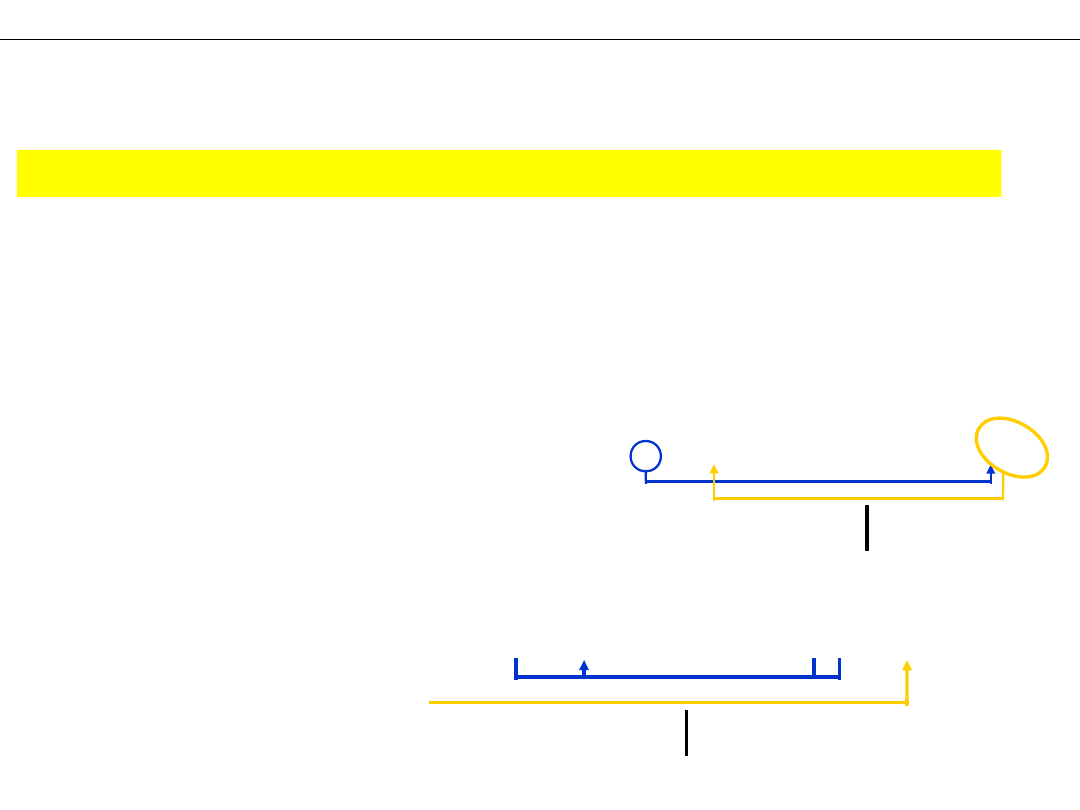
Wykład 4 – REAKCJE UTLENIANIA I REDUKCJI
II. Metoda REAKCJI POŁÓWKOWYCH –
tylko dla reakcji jonowych!
METODY DOBIERANIA WSPÓŁCZYNNIKÓW
REAKCJI "REDOKS"
C
2
H
5
OH + CrO
4
2–
+ H
+
= CH
3
COOH + Cr
3+
+ H
2
O
a) reakcja połówkowa redukcji
chromu:
Metoda reakcji połówkowych jest szczególnie przydatna gdy w reakcji
„redoks” występują substancje organiczne, gdzie trudno wyznaczyć
stopnie utlenienia.
CrO
4
2–
+ = Cr
3+
+ H
2
O
4
8H
+
– uzgodnienie
liczności
pierwiastków:
– uzgodnienie
ładunków:
–2 +8
+3
+3e
–
+3e
–
b) reakcja połówkowa utleniania
alkoholu:
C
2
H
5
OH
= CH
3
COOH
– bilans
tlenu:
+H
2
O
– bilans
wodoru:
+4H
+
– uzgodnienie
ładunków:
0
+4
+4e
–
+4e
–
C
2
H
5
OH
= CH
3
COOH
3C
2
H
5
OH + 3H
2
O = 3CH
3
COOH + 12H
+
+H
2
O
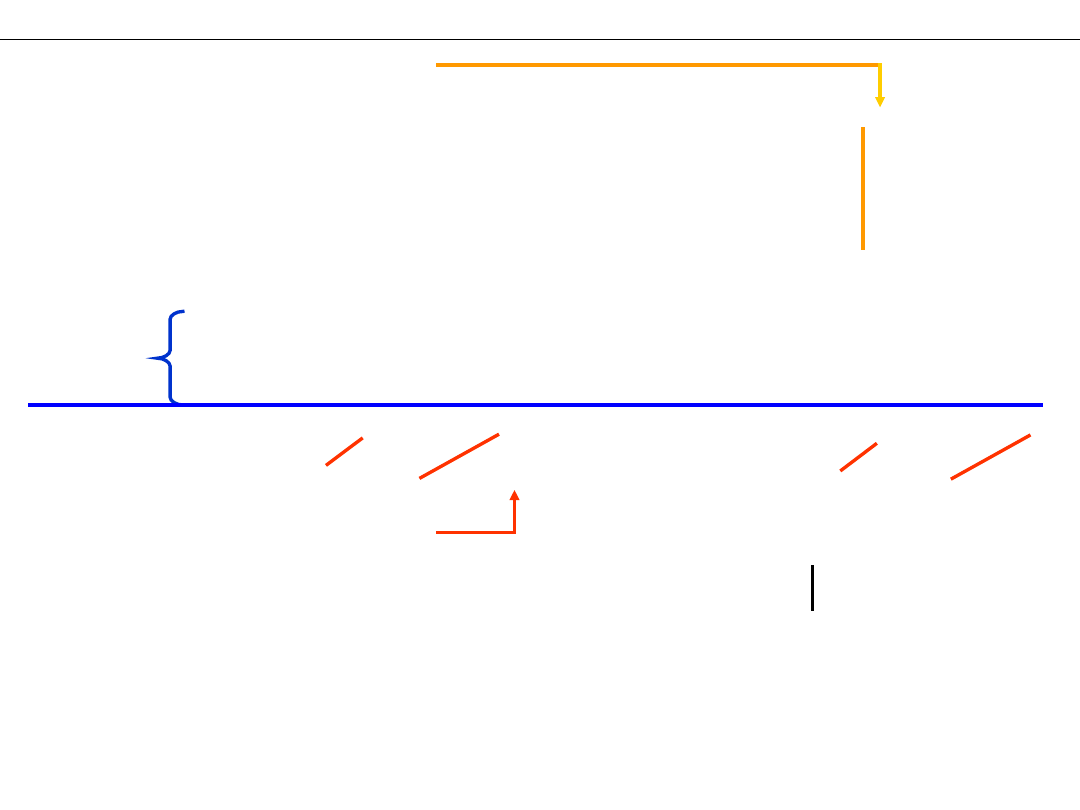
Wykład 4 – REAKCJE UTLENIANIA I REDUKCJI
3C
2
H
5
OH + 4CrO
4
2–
+ 32H
+
+ 3H
2
O = 3CH
3
COOH + 4Cr
3+
+ 16H
2
O + 12H
+
– sprawdzenie bilansu ładunków (WAŻNE !!!):
O: 3 + 4·4 = 3·2 + 13
H:
3·6 + 20 = 3·4 + 13·2
CrO
4
2–
+ = Cr
3+
+ H
2
O
4
8H
+
+3e
–
+4H
+
13
+4e
–
– uzgodnienie liczby
elektronów oddanych z pobranymi:
·4
·3
4CrO
4
2–
+ 32H
+
= 4Cr
3+
+ 16H
2
O
– sumowanie reakcji połówkowych
+
– porządkowanie równania
20
– sprawdzenie liczności pierwiastków
po obydwu stronach równania:
–8 +20
+12
19 =
19
38 =
38
Wykład 4 – REAKCJE UTLENIANIA I REDUKCJI
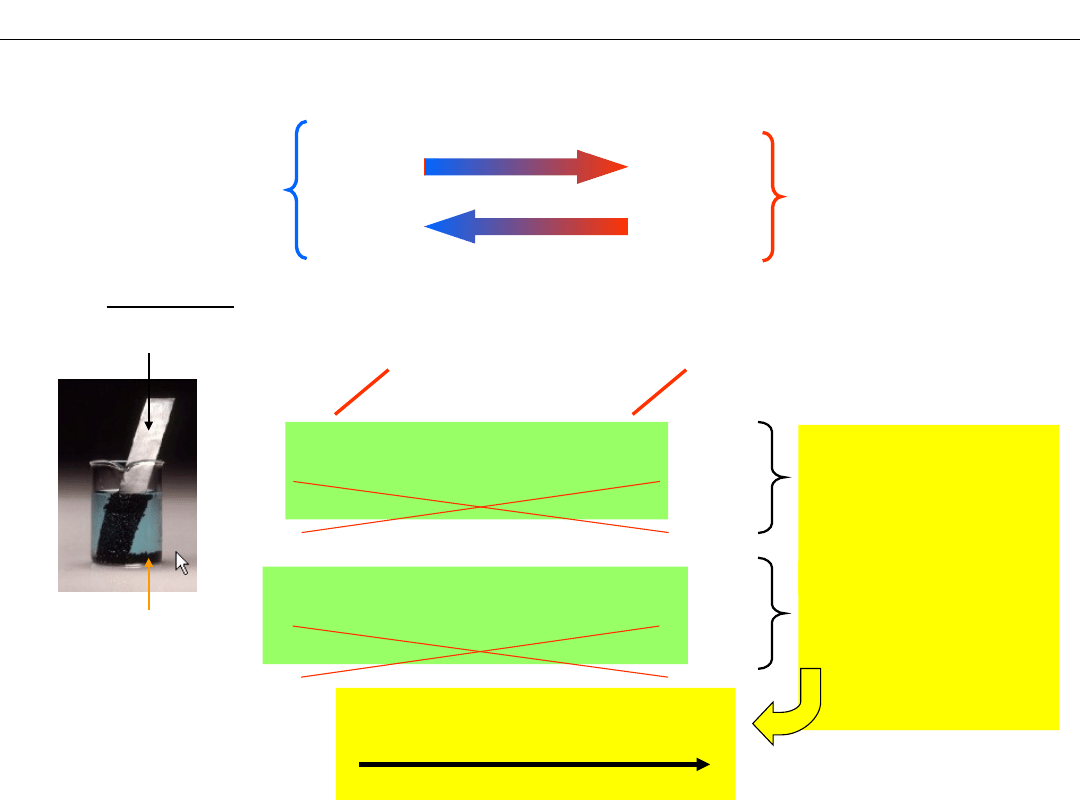
Metale i jony metali jako reduktory i utleniacze
Zn
Cu
Ag
Zn
2+
Cu
2+
Ag
+
forma
zredukowana
REDUKTOR
forma
utleniona
UTLENIACZ
REDUKCJA
UTLENIANIE
Reakcje:
CuCl
2
+ Zn = Cu +
ZnCl
2
Cu
2+
+ 2Cl
–
+ Zn = Cu + Zn
2+
+
2Cl
–
- zapis cząsteczkowy
- zapis jonowy
Cu
2+
+ Zn = Cu +
Zn
2+
TAK
NIE
Cu + Zn
2+
= Cu
2+
+
Zn
2Ag
+
+ Cu = 2Ag +
Cu
2+
TAK
2Ag + Cu
2+
= 2Ag
+
+
Cu
NIE
WNIOSEK:
Ag
+
to
silniejszy
utleniacz niż
Cu
2+
Zn
2+
< Cu
2+
<
Ag
+
UTLENIACZE
Cu
Zn
WNIOSEK:
Cu
2+
to
silniejszy
utleniacz niż
Zn
2+
2HCl + Cu = H
2
+
CuCl
2
Wykład 4 – REAKCJE UTLENIANIA I REDUKCJI
SZEREG ELEKTROCHEMICZNY METALI
Li K Ca Na Al
Zn
Fe Ni Sn Pb
Cu
Ag
Hg Au
jonowo
UTLENIACZE (jako jony)
REDUKTORY (jako metale)
Cu
2+
+ Zn = Cu +
Zn
2+
Utlenianie Zn
CuCl
2
+ Zn = Cu +
ZnCl
2
2HCl + Zn = H
2
+
ZnCl
2
2H
+
+ Zn = H
2
+
Zn
2+
jonowo
UTLENIACZE
2H
+
+ Cu = H
2
+
Cu
2+
jonowo
Li K Ca Na Al
Zn
Fe Ni Sn Pb
Cu
Ag
Hg Au
WNIOSEK
: H
+
to silniejszy utleniacz niż Zn
2+
ale
słabszy niż Cu
2+
H
Metale NIESZLACHETNE
Metale SZLACHETNE
Aktywność chemiczna
Tendencja do występowania w stanie wolnym
Inny utleniacz – H
+
Document Outline
Wyszukiwarka
Podobne podstrony:
04 2 Bilansowanie równań reakcji redoks metodą elektronowo jonową
04 Zabezpieczenia silnikówid 5252 ppt
04 E Model wzorcowyid 5290 ppt
Reakcje redoks doc
Wykłady, Wykład 7, Reakcje redoks polegają na wymianie elektronu między czynnikiem redukującym (redu
Arkusz WSiP Reakcje redoks Elektrochemia
REAKCJE REDOKS
więcej podobnych podstron