
Węglowodory
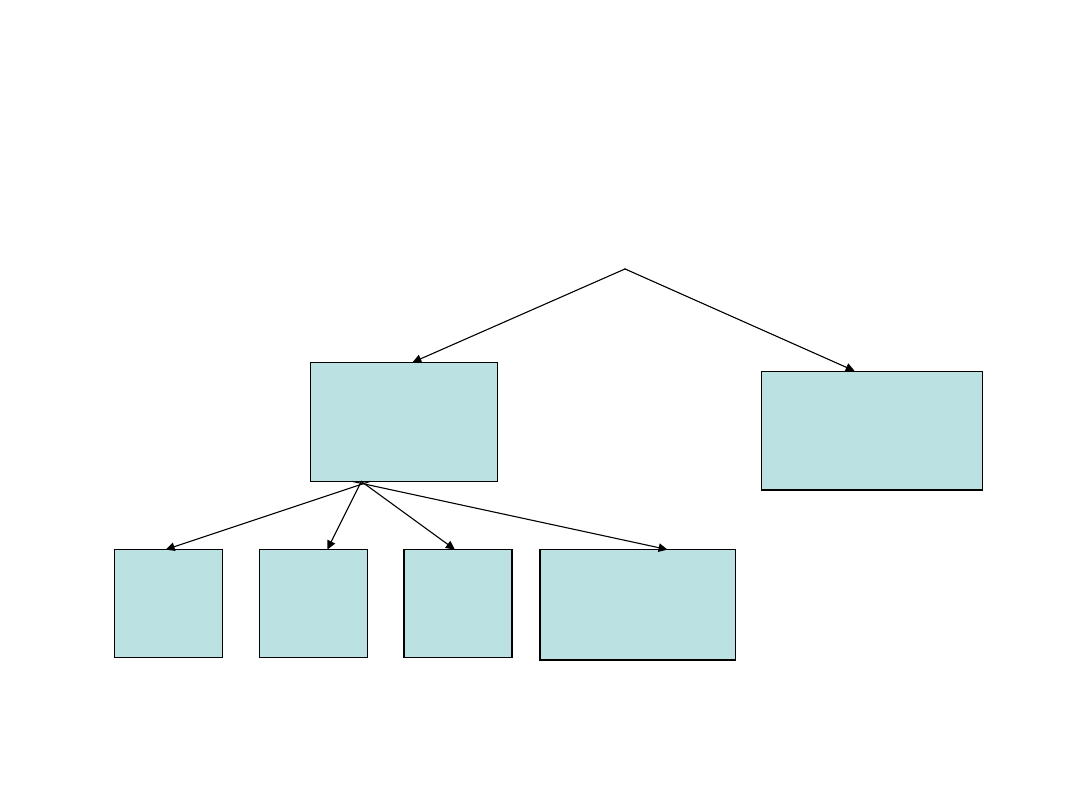
Podział węglowodorów
• Związki zawierające w cząsteczce atomy węgla
(C )i wodoru (H) – nazywamy węglowodorami.
węglowodory
Alkany
Alkeny
Alkiny
Cykliczne
węglowodory
alifatyczne
alifatyczne
aromatyczne
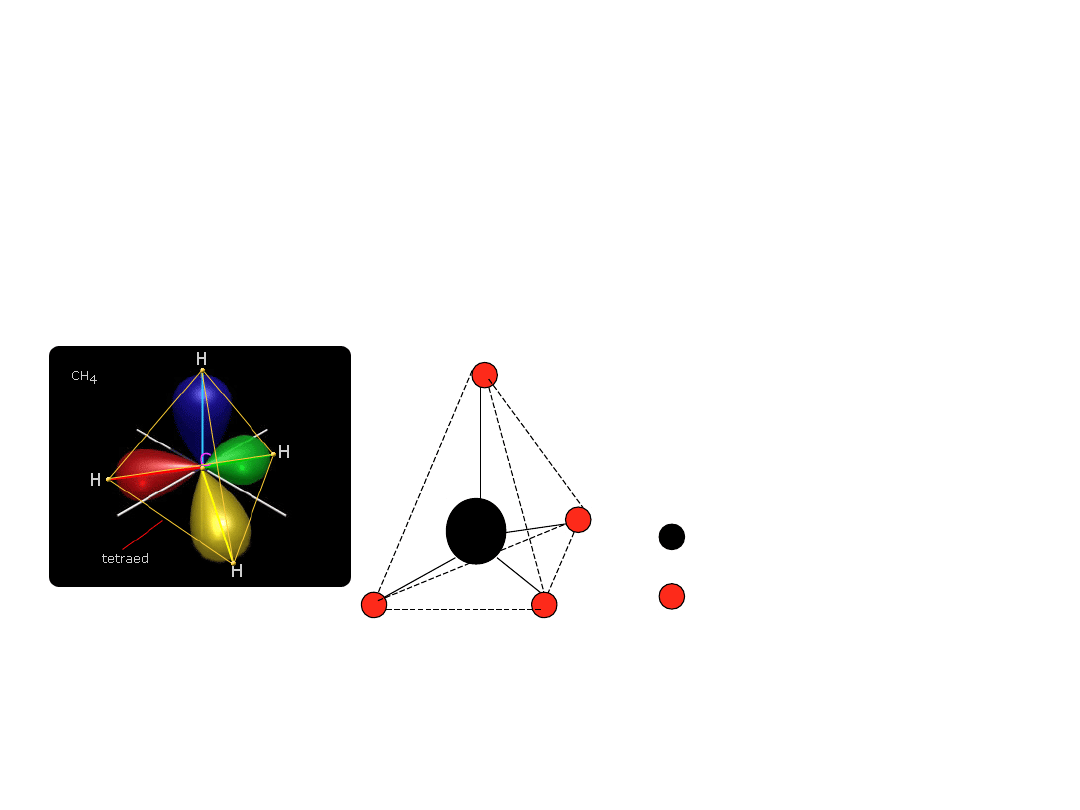
Metan
• Najprostszym alkanem i najprostszym związkiem
organicznym jest metan- CH
4
• W cząsteczce metanu występują wiązanie atomowe
słabo spolaryzowane C-H
• Atom węgla wykazuje hybrydyzację sp
3
– przez co
cząsteczki metanu wykazują strukturę teraedryczną.
Wierzchołki tetraedru zajmują atomy wodoru
C
Atom wodoru
Atom węgla

Właściwości metanu
• Cząsteczka metanu jest symetryczna, więc momenty dipolowe
pojedynczych wiązań C-H równoważą się wzajemnie i w
rezultacie cząsteczka jest niepolarna.
• Oddziaływanie między cząsteczkami sprowadza się do słabych sił
van der Waalsa.
• Temperatura wrzenia (-161,5ºC) i temperatura topnienia (-183
ºC) są bardzo niskie.
• Metan jest bezwonnym i bezbarwnym gazem,
• Nieznacznie rozpuszcza się w wodzie, natomiast bardzo dobrze w
rozpuszczalnikach organicznych
• Właściwości metanu odzwierciedlają właściwości innych alkanów.
• Metan występuje w gazie ziemnym (97%) i tworzy tzw. gaz błotny.
• Metan obok wody, amoniaku i wodoru uważany jest za
„substancję życia”. Mieszanina tych gazów pod wpływem
wyładowań elektrycznych lub promieniowania może prowadzić do
powstawania aminokwasów

Właściwości chemiczne
• Metan jest typowym przedstawicielem alkanów,
związkiem mało reaktywnym.
• Reaguje w bardzo drastycznych warunkach lub z
bardzo reaktywnymi substancjami.
• Utlenianie – spalanie jest podstawową reakcją
alkanów:
CH
4
+ 2O
2
→ CO
2
+ 2H
2
O + Q – spalanie całkowite
2CH
4
+3O
2
→ 2CO+ 4H
2
O – spalanie niecałkowite
CH
4
+ O
2
→ C + 2H
2
O – spalanie niecałkowite
3CH
4
+ 3O
2
→ C
2
H
2
+ CO +5H
2
O
CH
4
+ H
2
O → CO+ 3H
2
– gaz syntezowy
N
i
850º
C

• Halogenowanie - reakcja z chlorowcami:
• Pod wpływem promieniowania UV lub w wysokiej
temperaturze mieszanina metanu i chloru reaguje energicznie
i powstaje mieszanina produktów. Reakcje chlorowcowania są
przykładem reakcji substytucji rodnikowej – czyli
podstawienia rodnikowego.
• Metan może reagować z innymi chlorowcami – fluorem
( nawet po ciemku) oraz bromem. Alkany nie reagują z jodem.
• Atom lub grupa atomów z pojedynczym (niesparowanym)
elektronem - wolny rodnik.
• Rodniki mogą powstawać w wyniku homolizy wiązania
kowalencyjnego, które następuje wówczas gdy dostarczana
energia jest większa niż energia wiązania:
Cl-Cl →Cl• + Cl•
Rodniki są cząstkami bardzo reaktywnymi, ponieważ dążą do
pobrania dodatkowego elektronu aby uzyskać oktet
h
ν

Mechanizm substytucji rodnikowej
•
Chlorowcowanie alkanów jest przykładem reakcji łańcuchowej,
która po zainicjowaniu jest trudna do zatrzymania. Można
wyróżnić 3 etapy:
1.
inicjowanie łańcucha
Cl
2
→ 2Cl•
2. Etap wzrostu łańcucha
Cl• + CH
4
→ HCl + CH
3
•
CH
3
• + Cl
2
→ CH
3
Cl + Cl•
CH
3
Cl + Cl• → CH
2
Cl• + HCl
3. Zakończenie wzrostu łańcucha
Cl• +Cl• → Cl
2
CH
3
• +CH
3
• → CH
3
–CH
3
CH
3
• + Cl• → CH
3
Cl
•
Produktami reakcji mogą być następujące związki CH
3
Cl-
chlorometan, CH
2
Cl
2
– dichlorometan, CHCl
3
-trichlorometan
(chloroform), CCl
4
– terachlorometan (związek niepalny).
h
ν

Etan
• Etan – związek o wzorze C
2
H
6
• Podobnie jak w cząsteczce metanu orbitale
wiążące mają hybrydyzację sp
3
.Rozmieszczenie
elektronów w wiązaniach C-C i C-H jest w
przybliżeniu takie samo, chmura elektronowa jest
cylindrycznie rozmieszczona w stosunku do linii
łączącej oba jądra atomów węgla.
• Wiązanie C-c jest wiązaniem stosunkowo długim,
więc może zachodzić rotacja cząsteczki przez co
następuje zmiana położenia atomów wodoru w
stosunku do siebie- konformacja

• Propan – C
3
H
8
– w przypadku tej cząsteczki może
następować rotacja wokół dwóch wiązań
Projekcja Newmana
• Butan – C
4
H
10
- może mieć dwie różne struktury:
• Związki o takim samym wzorze sumarycznym, ale
różnych wzorach strukturalnych nazywamy
izomerami położeniowymi. Izomery różnią się między
sobą właściwościami fizycznymi i chemicznymi
H
CH
3
H
CH
3
H
H
H
H
H
H
H
H
H
3
C-CH
2
-CH
2
-CH
3
Butan- t
w
=0ºC
H
3
C-CH-CH
3
2-metylopropan
(izobutan)-t
w
=-12ºC
CH
3

ALKANY
• W chemii organicznej mamy do czynienia ze
związkami, dla których budowa strukturalna –
czyli budowa cząsteczki ma zasadniczy wpływ
na właściwości fizyczne i chemiczne związku.
• Związki organiczne zostały podzielone na
różne klasy w zależności od ich struktury. W
obrębie jednej klasy związki wykazują
określony zbiór właściwości.
• Alkanami – węglowodorami nasyconymi -
nazywamy węglowodory alifatyczne, w
których występują tylko pojedyncze wiązania
między atomami węgla.

Szereg homologiczny
Szereg związków organicznych, w którym każdy
następny różni się od poprzedniego o stały człon
np. –CH
2
- nazywamy szeregiem homologicznym, a
przedstawicieli tego szeregu –homologami.
• Metan – CH
4
• etan – C
2
H
6
• Propan – C
3
H
8
• Butan – C
4
H
10
• Pentan – C
5
H
12
• Heksan – C
6
H
14
• Heptan – C
7
H
16
• Oktan – C
8
H
18
• Nonan – C
9
H
20
• Dekan – C
10
H
22
• Undekan –
C
11
H
24
• Dodekan –
C
12
H
26
• Tetradekan –
C
14
H
30
• Heksadekan –
C
16
H
34
• Ejkozan –
C
20
H
42
•
wzór ogólny alkanów
C
n
H
2n+2
Nazwy alkanów mają
końcówkę -an
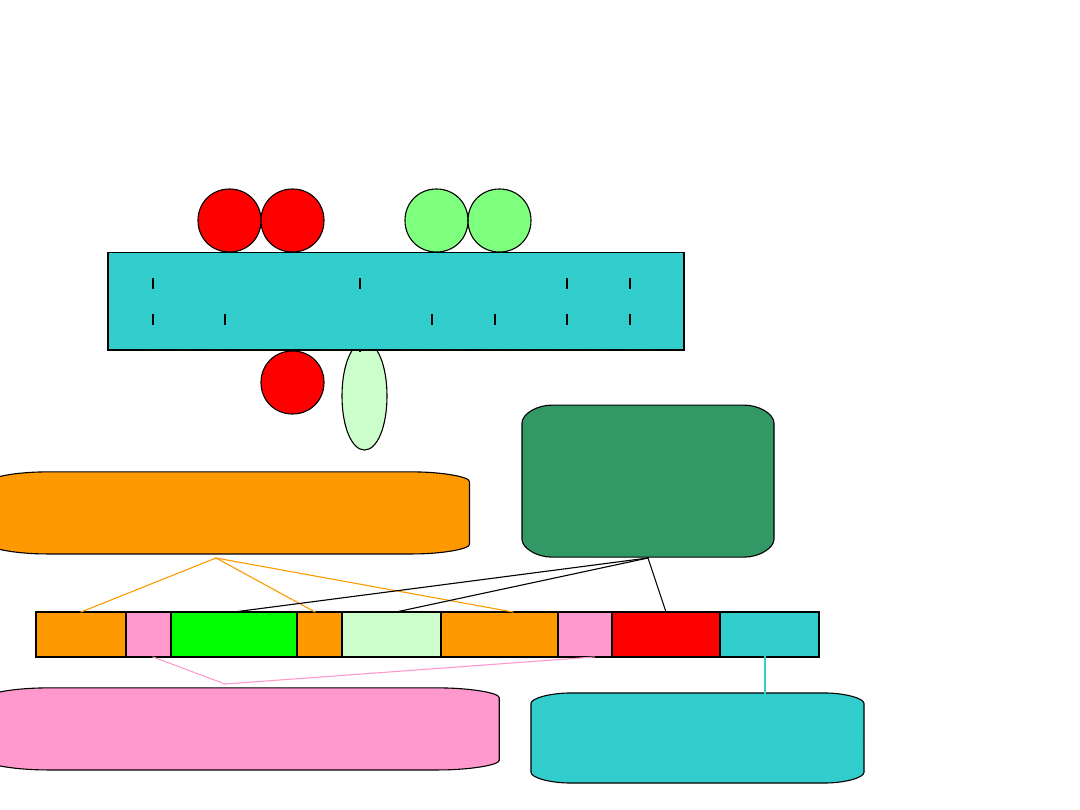
Nazewnictwo alkanów
Numery atomów węgla,
przy których są podstawniki
5,6 - dichloro -4 -etylo -2,3,3 - trimetylooktan
Rodzaj
podstawnika
w kolejności
alfabetycznej
Przedrostki określające liczbę
jednakowych podstawników
Nazwa węglowodoru
o najdłuższym łańcuchu
C C
Cl Cl
C
C
C
-C
1
- C
2
- C
3
- C
4
- C
5
- C
6
-
C
7
- C
8
-

Właściwości fizyczne alkanów
• Cztery pierwsze alkany w szeregu homologicznym to
gazy; od C
5
do C
17
– to ciecze, powyżej C
17
– ciała stałe.
• Cząsteczki alkanów są niepolarne – rozpuszczają się w
rozpuszczalnikach niepolarnych.
• Siły van der Waalsa rosną wraz ze wzrostem masy
cząsteczkowej związków w danej klasie.
• Temperatury wrzenia i topnienia n-alknów zwiększają
się wraz ze wzrostem liczby atomów węgla. Jest to
wynikiem wzrostu oddziaływań między
cząsteczkowych, które rosną wraz ze wzrostem masy
cząsteczki- temperatura wzrasta o 20ºC do 30ºC na
każdy atom węgla.
• Na temperaturę wrzenia i topnienia alkanów ma
wpływ rozgałęzienie łańcucha. Izomery o łańcuchu
prostym mają wyższą temperaturę wrzenia niż izomery
rozgałęzione.
• Gęstość alkanów jest niższa niż gęstość wody.

Otrzymywanie alkanów
• Z ropy naftowej i gazu ziemnego przez destylację.
• Metodami laboratoryjnymi:
- Hydrogenacja alkenów
H
2
C=CH─CH
3
→ H
3
C─CH
2
─CH
3
- Redukcja metalem halogenków alkilu
RX + Zn + H
+
→ R-H + Zn
2+
+ X
-
- Hydroliza odczynnika Grinarda
RX + Mg → RMgX → RH
- Reakcja halogenków alkilów ze związkami
metaloorganicznymi
RX → RLi → R
2
CuI → R-R’
Pt/H
2
H
2
O
R’X
CuX
Li

Reakcje alkanów
• Alkany (dawniej parafiny) są związkami o małej
reaktywności, są odporne na działanie HCl i H
2
SO
4
,
nie reagują z utleniaczami – KMnO
4
lub K
2
Cr
2
O
7
• Alkany ulegają substytucji rodnikowej
CH
3
─CH ─CH
3
→ CH
3
─CH ─CH
2
Cl
Cl
2
>Br
2
3º>2 º>1 º
• Spalanie – w zależności od ilości tlenu – pełne lub
niepełne
• Piroliza (kraking)
CH
3
CH
3
Cl
2
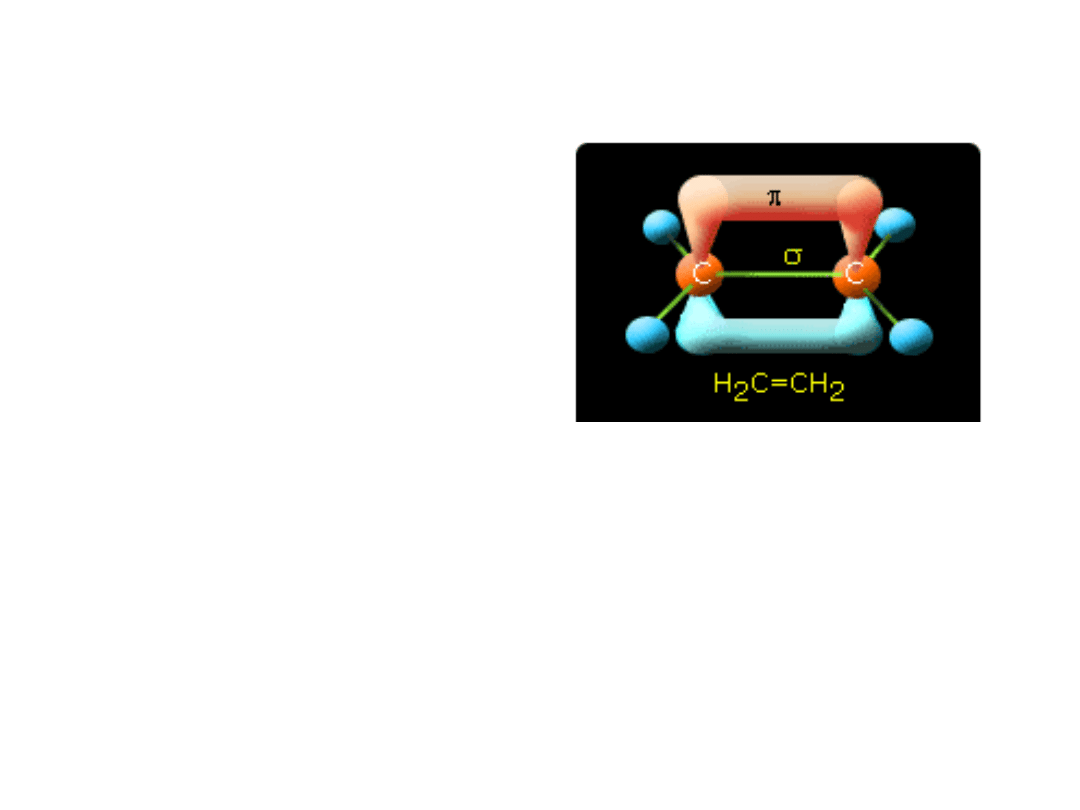
Alkeny
• Należą do
węglowodorów
nienasyconych, w
których występuje
przynajmniej jedno
wiązanie wielokrotne.
W cząsteczce alkenu
występuje jedno
wiązanie podwójne.
• Najprostszym alkenem
jest eten – C
2
H
4
H
2
C=CH
2
W etenie atomy węgla
mają hybrydyzację sp
2
Podwójne wiązanie między
atomami węgla składa się z
mocnego wiązania σ
oraz słabego π.
Pojawienie się wiązania π,
powoduje zahamowanie rotacji

Szereg homologiczny
alkenów
• Et
en
– C
2
H
4
• Prop
en
–
C
3
H
6
• But
en
– C
4
H
8
• Pozostałe homologi analogicznie jak w alkanach
• Wzór ogólny C
n
H
2n
•
Nazewnictwo alkenów – szukamy najdłuższego
łańcucha węglowego z wiązaniem podwójnym.
Wiązanie podwójne powinno znajdować przy
węglu o najniższym numerze
• Alkany w nazwie mają końcówkę -en

Izomeria alkenów
• Obecność wiązania podwójnego
powoduje, że wzrasta liczba
izomerów położeniowych.
• W związkach nienasyconych mamy
również do czynienia z izomerią
geometryczną – diasteroizomery,
powstają na skutek zahamowania
rotacji wzdłuż wiązania podwójnego.

Otrzymywanie alkenów
• Niższe alkeny otrzymuje się w
wyniku destylacji ropy naftowej.
• W laboratorium otrzymuje się je na
drodze eliminacji:
1. dehydrogenacji
2. dehydratacji
3. dehalogenacji
dichlorowcopochodnych

Właściwości fizyczne
• Nie rozpuszczają się w wodzie, dobrze
rozpuszczają się w rozpuszczalnikach
niepolarnych
• Gęstość alkenów jest niższa niż gęstość
wody.
• Temperatura wrzenia i topnienia wzrasta
wraz ze wzrostem łańcucha.
• Obecność wiązania podwójnego nie zmienia
drastycznie właściwości fizycznych alkenów
w porównaniu z alkanami.

Właściwości chemiczne
• Wiązanie podwójne jest elementem
charakterystycznym struktury alkenów.
• Alkeny będą ulegały reakcji, w której będzie
następowało rozerwanie słabego wiązania π oraz
wysycenie tego wiązania – powstanie dwóch mocnych
wiązań σ.
• Wiązanie π posiada łatwo dostępne elektrony π, ma
więc charakter zasady. Cząsteczki, które mają
niedobór elektronów (kwasy) będą reagowały z
alkenami.
• Typową reakcją dla węglowodorów nienasyconych
jest addycja ( przyłączenie) elektrofilowa lub addycja
wolnorodnikowa. W wyniku tych reakcji otrzymamy
różne produkty reakcji.

•
Przykłady:
1. hydrogenacja- uwodornienie- przyłączenie
wodoru
2. Addycja halogenu
3. Addycja halogenowodoru
4. Addycja wody
5. Reguła Markownikowa – wodór przyłącza się do
tego atomu węgla przy, którym jest więcej
atomów węgla
6. Addycja wolnorodnikowa zachodzi niezgodnie z
regułą Markownikowa
7. Reakcje polimeryzacji
8. Reakcje analityczne:
- Alkany odbarwiają wodę bromową oraz KMnO
4

Alkiny
•
Alkiny –węglowodory nienasycone, w których
występuje przynajmniej jedno wiązanie potrójne
między atomami węgla.
•
W tworzeniu wiązania potrójnego biorą udział dwa
zhybrydyzowane orbitale sp , które leżą wzdłuż prostej
przechodzącej przez jądra atomów C- więc kąt między
wiązaniami wynosi 180º, a cząsteczka jest liniowa.
•
Wiązanie potrójne jest krótsze i mocniejsze niż
wiązanie podwójne.
•
Najprostszym alkinem jest etyn (acetylen) C
2
H
2
•
Wzór ogólny alkinów – C
n
H
2n-2
•
Nazewnictwo alkinów – reguły takie jak wyżej – aliny
mają końcówkę – in lub -yn
•
Alkiny maja cząsteczki słabo spolaryzowane i
zasadniczo wykazują podobne właściwości jak alkany i
alkeny.
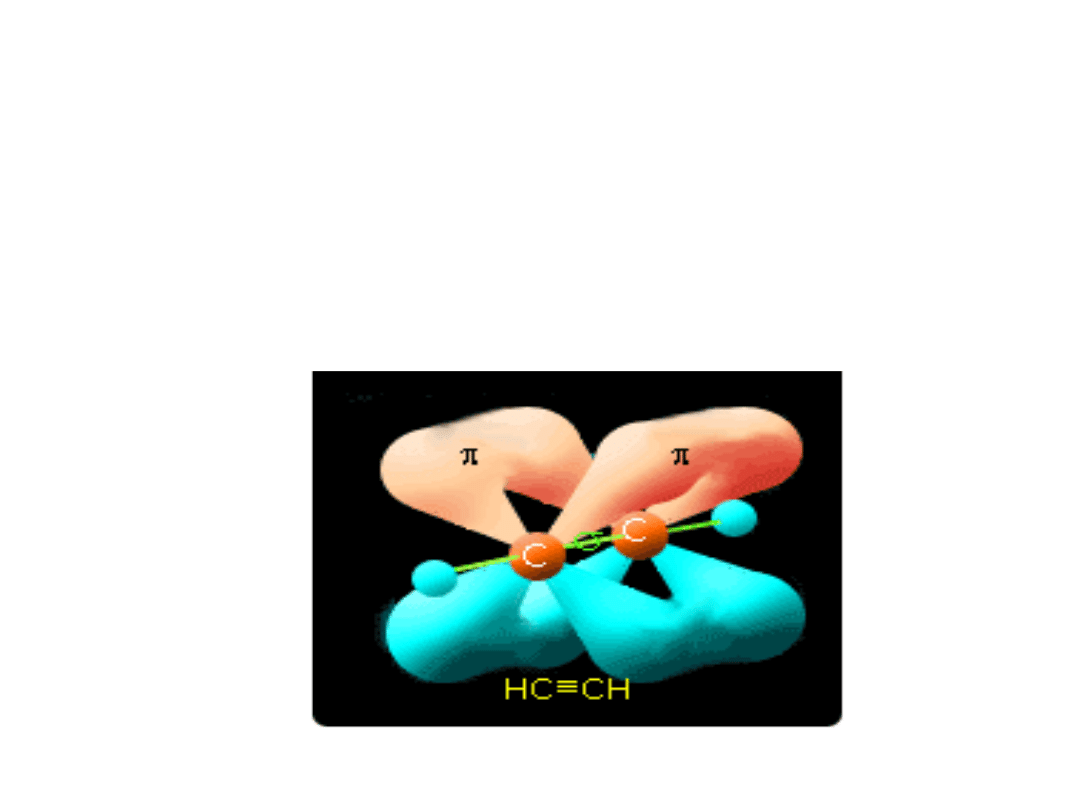
Cząsteczka acetylenu
Otrzymywanie alkinów
• Przemysłowe otrzymywanie acetylenu:
węgiel – koks
Kamień wapienny – CaO
lub
6CH
4
+ O
2
→C
2
H
2
+ 2CO + 10 H
2
O
• Otrzymywanie innych alkinów
- Eliminacja atomów lub grup atomów znajdujących
się przy dwóch sąsiednich atomach
2000ºC
CaC
2
C
2
H
2
+ Ca(OH)
2

Reakcje alkinów
• Podobnie jak alkeny ulegają addycji
elektrofilowej, ponieważ elektrony π
są łatwo dostępne:
- Przyłączanie wodoru
- Addycja chlorowców
- Przyłączenie wody

Dieny
• Związki mające w swojej cząsteczce wiele
wiązań podwójnych
• Mogą to być układy sprzężonych wiązań
podwójnych - ─ C=C─C=C─
• Skumulowany - ─C=C=C─
• Izolowany - ─C─C=C─C─C=C─
• są to bardzo ważne związki, ponieważ są
licznie reprezentowane w przyrodzie –
kauczuk naturaly, terpeny, witamina A,
cholesterol

Węglowodory
aromatyczne
alkohole
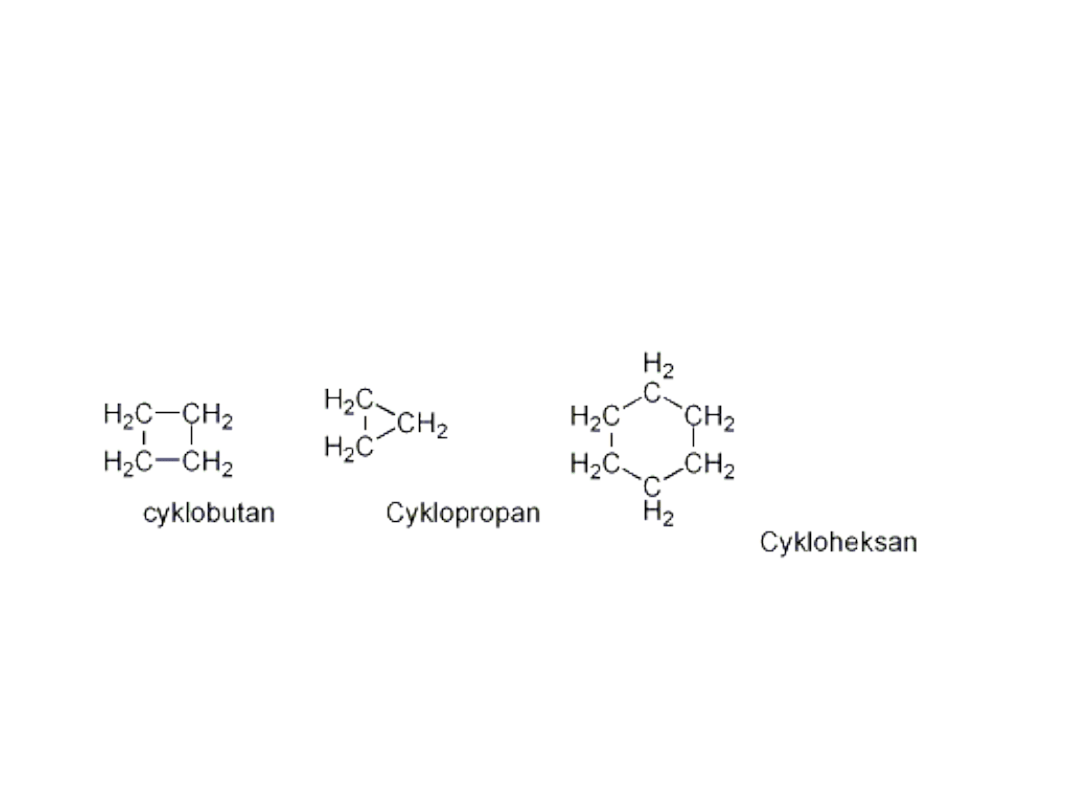
Alifatyczne węglowodory
cykliczne
• Przykłady związków cyklicznych
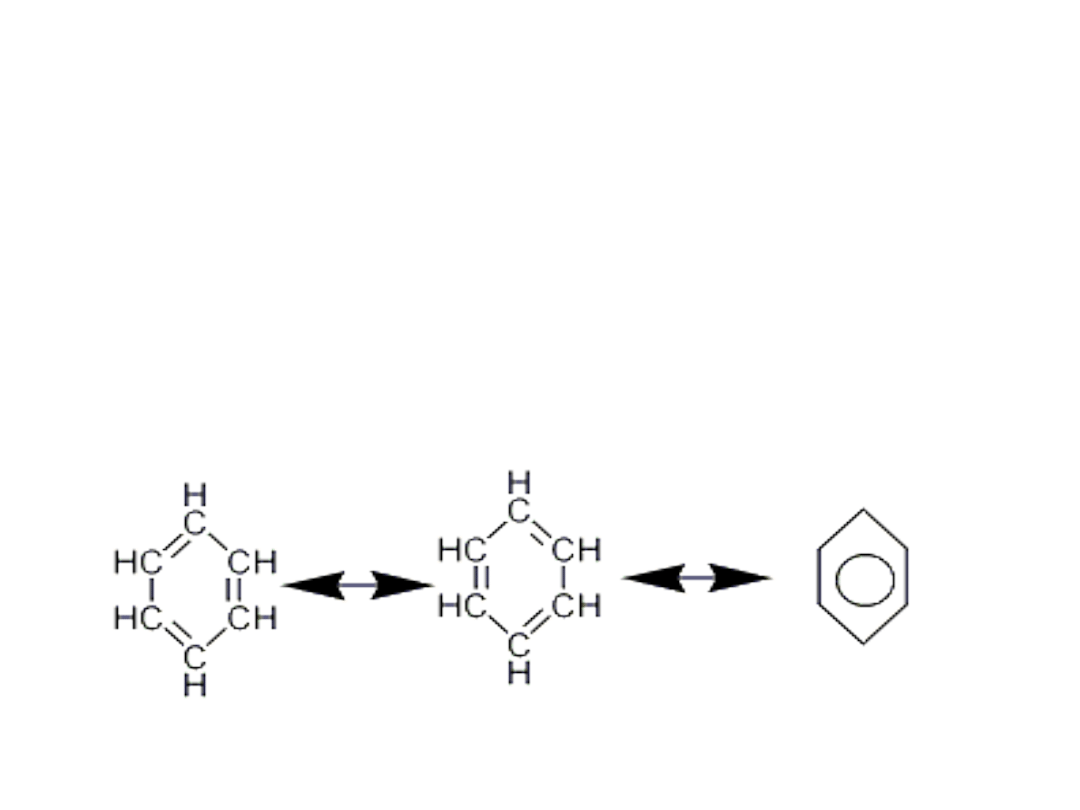
Budowa cząsteczki benzenu
• Benzen należy do grupy węglowodorów
aromatycznych
• Wzór sumaryczny C
6
H
6
• Struktury rezonansowe benzenu – wzory
Kekulego

• Benzen jest hybrydą struktur I i II, długość wiązań między
atomami węgla jest taka sama, w cząsteczce benzenu nie
występują na przemian 3 wiązania pojedyncze i 3
podwójne. Wiązanie C-C ma charakter wiązań
półtorakrotnych. Wszystkie wiązania w benzenie są
równocenne
• W benzenie atomy węgla wykazują hybrydyzację sp
2
–
cząsteczka jest płaska, a kąt między atomami węgla wynosi
120º.
• C C H
Między atomami węgla występuje jedno wiązanie σ i jedno
wiązanie π, które powstaje w wyniku nałażenia bocznego
niezhybrydyzowanych orbitali p węgla. Następuje
delokalizacja elektronów π, które obejmują całą cząsteczkę
i w równym stopniu należą do każdego atomu węgla.
σ
σ

• Elektrony π są łatwo dostępne dla reagentów
poszukujących elektronów (elektrofilów), z powodu
stabilności pierścienia benzenowego, następuje
podstawienie (substytucja) czynnikiem
elektrofilowym i nie zostaje zakłóconych charakter
aromatyczny związku.
• Związek aromatyczny musi posiadać chmurę
zdelokalizowanych elektronów π poniżej i powyżej
płaszczyzny pierścienia ( cząsteczka musi być
płaska) oraz ilość zdelokalizowanych elektronów π
musi spełniać zasadę Hückla 4n + 2 ( n = 0,1,2….)
• Związki aromatycznych nie ulegają reakcjom
charakterystycznym dla węglowodorów
nienasyconych czyli addycji i eliminacji – nie
odbarwiają wody bromowej, nie ulegają hydrogenacji
• Związki aromatyczne ulegają reakcji substytucji
elektrofilowej
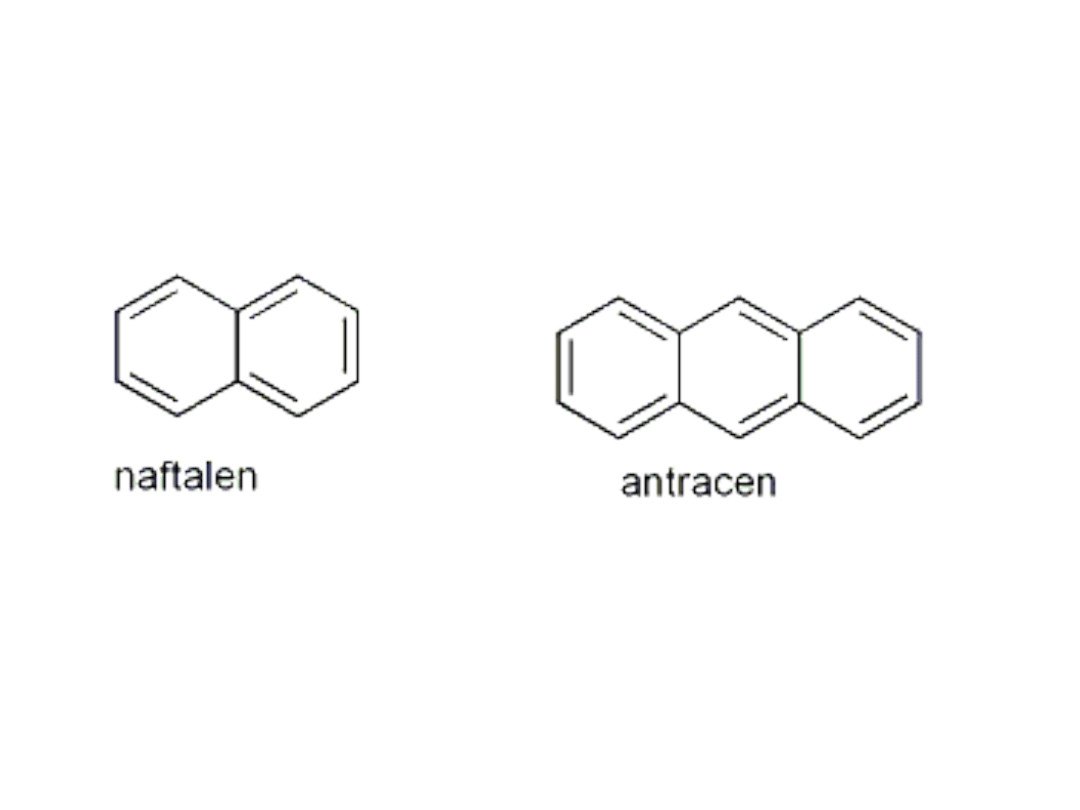
Przykłady innych związków aromatycznych
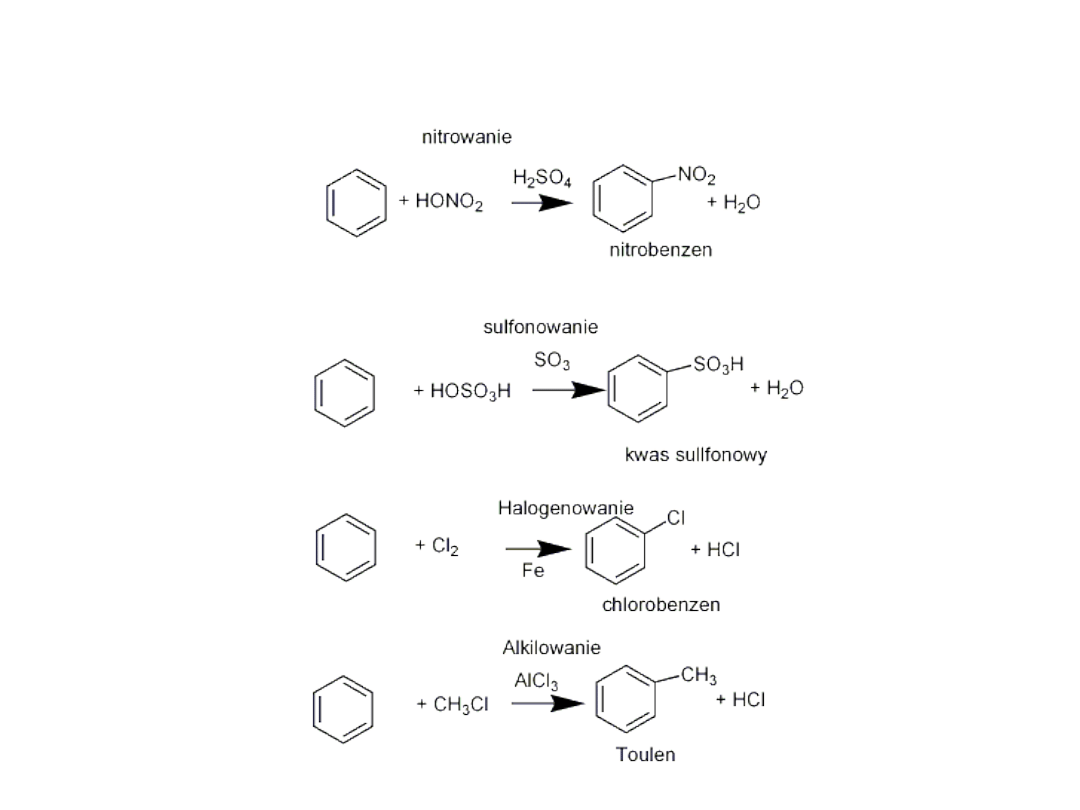
Przykłady reakcji substytucji elektrofilowej
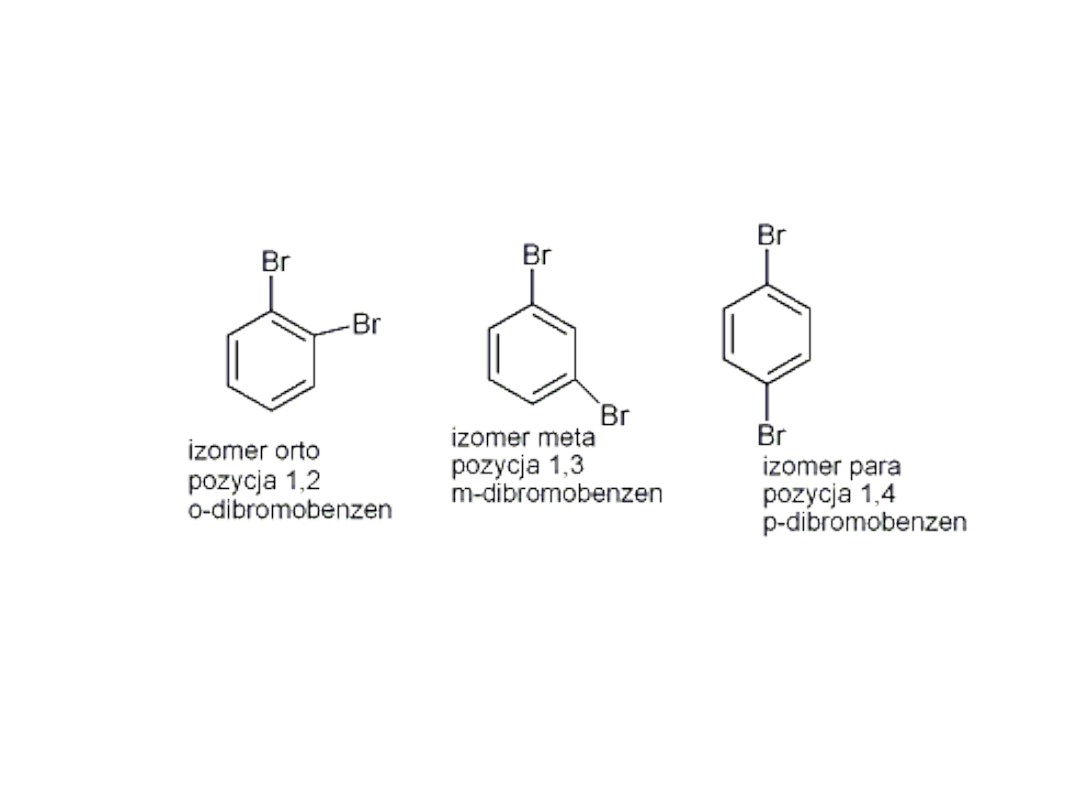
Izomery pochodnych benzenu
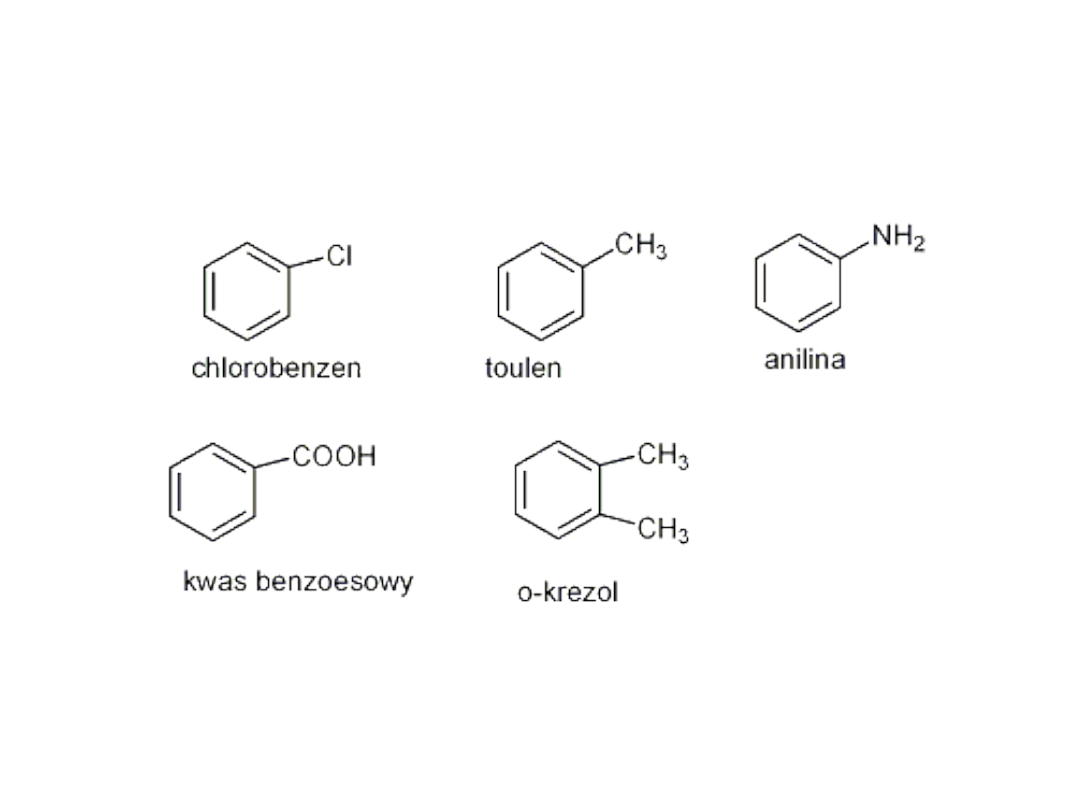
Nazewnictwo pochodnych
benzenu

Kierujący wpływ podstawników
• Grupa, która zwiększa reaktywność pierścienia
aromatycznego nazywa się grupą aktywującą
• Grupa, która obniża jego reaktywność to grupa
dezaktywująca.
• Grupy aktywujące i kierujące w położenie orto i
para - -OH; -CH
3
; -OCH
3
: -NH
2
• Grupy dezaktywujące i kierujące w położenie
orto i para - -F; -Cl; -Br; -I
• Grupy dezaktywujące i kierujące w położenie
meta - -NO
2
; -CN; -COOH; -CHO; - SO
3
H
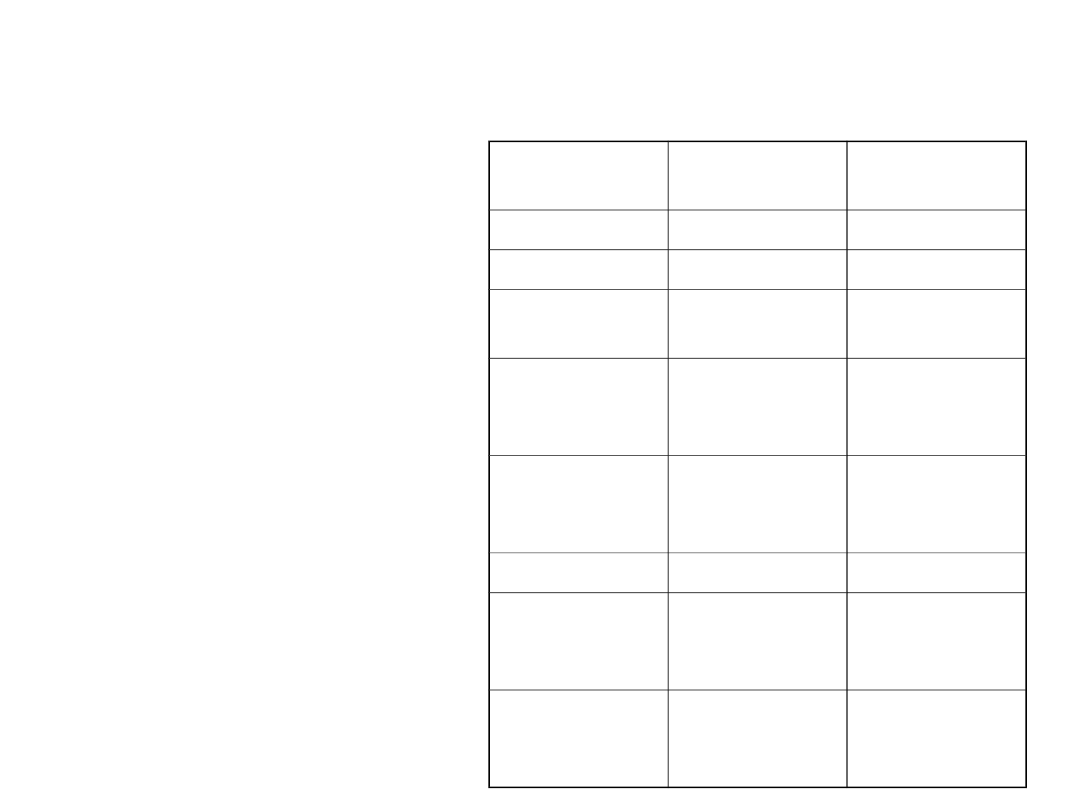
Destylacja i obróbka ropy naftowej
• Ropę naftową rozdziela się
na frakcję przy pomocy
destylacji
frakcja
Temperatura
ºC
Ilość at. C
Gaz
Poniżej 20
1-4
Eter naftowy 20-60
5-6
Lekka nafta
(ligroina)
60-100
6-7
Gazolina
(surowa
benzyna)
40-205
5-10 i
cykloalkany
nafta
175-325
12-18 i zw.
Aromatyczn
e
Olej gazowy
Poniżej 275
12 i wyższe
Olej surowy
Nielotna
ciecz
Rozgałęzion
e długie
łańcuchy
Asfalt i koks
Nielotne
ciało stałe
Struktury
polimeryczn
e

•
Katalityczna izomeryzacja – powoduje przekształcenie
alkanów łańcuchowych w alkany rozgałęzione.
•
Proces krakowania powoduje rozpad wyższych alkanów
do niższych homologów oraz do alkenów – w ten
sposób zwiększa się ilość frakcji benzynowej.
•
Kraking - inaczej piroliza – czyli rozpad związków pod
wpływem ciepła.
•
Rodzaje krakingu:
- katalityczny – olej gazowy poddaje się rozkładowi w
temperaturze 450-550ºC pod niewielkim ciśnieniem
- termiczny alkany przepuszcza się przez ogrzewana
komorę.
•
Reforming katalityczny- alkany i cykloalkany zostają
przekształcone w węglowodory aromatyczne i w ten
sposób uzyskuje się surowce do syntezy przemysłowej
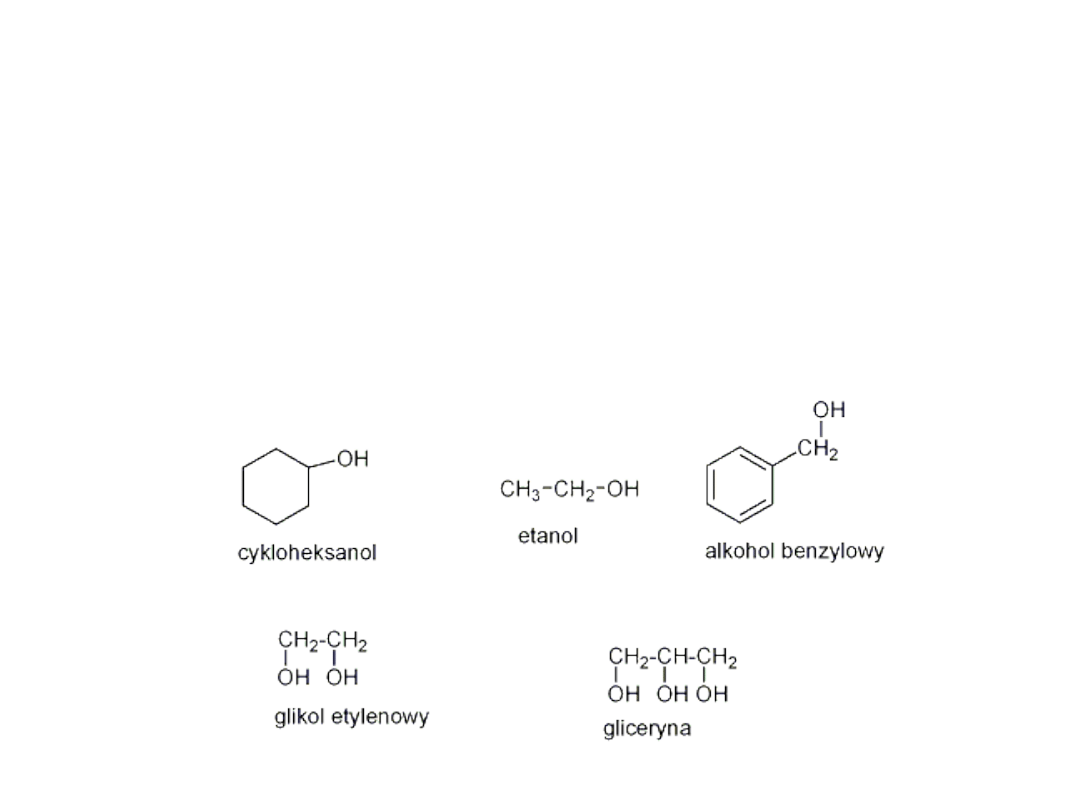
Alkohole
• Alkohole są związkami o wzorze ogólnym R- OH, gdzie
grupa -OH to grupa hydroksylowa –tzw. Grupa funkcyjna ,
decydująca o właściwościach fizycznych i chemicznych tej
grupy związków organicznych.
• Związki w których grupa hydroksylowa jest połączona z
pierścieniem aromatycznym nazywamy fenolami ( ze
względu na różnice we właściwościach chemicznych
omawiane będą oddzielnie).
• Alkohole podobnie jak węglowodory alifatyczne tworzą
szereg homologiczny
• Przykładowe alkohole
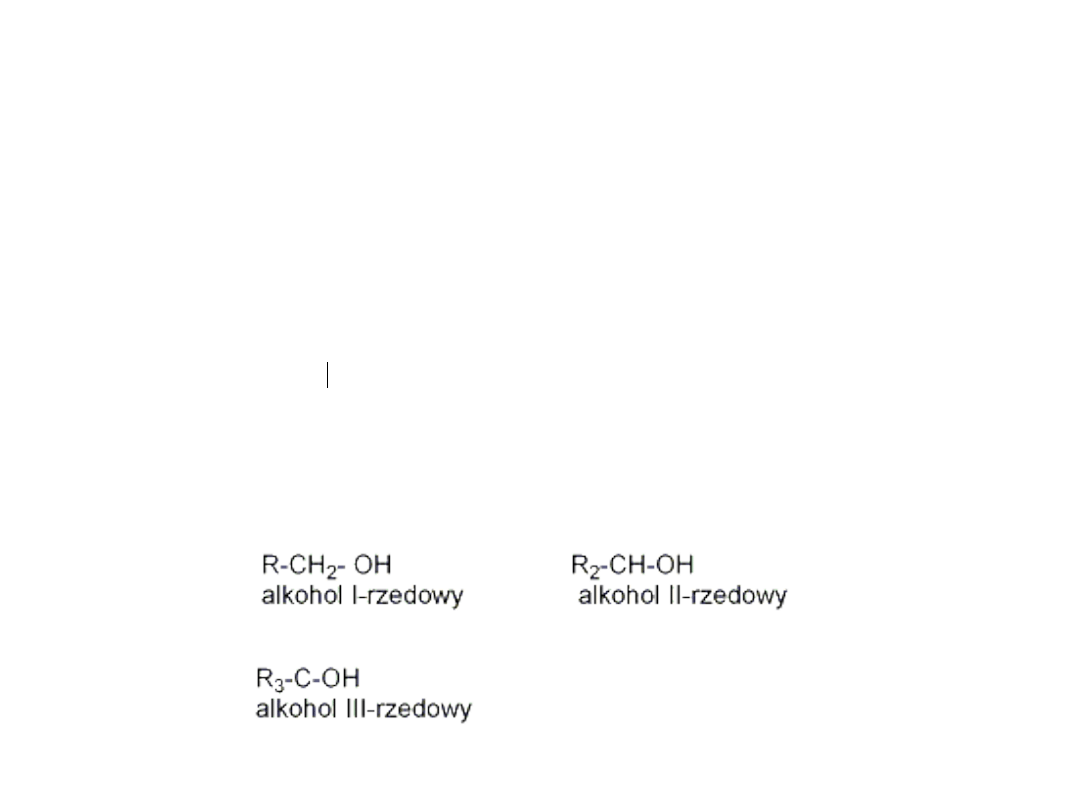
Nazewnictwo alkoholi
• Szukamy najdłuższego łańcucha z którym związana jest
grupa –OH, numerujemy atomy węgla w ten sposób aby
atom C związany z grupą hydroksylową miał najniższy
numer
• Do nazwy węglowodoru, który tworzy łańcuch alifatyczny
dodajemy końcówkę –ol (reszta zasad tak samo jak w
przypadku węglowodorów).
• EX. CH
3
-CH
2
-CH-CH
3
–
butan-2-ol
• Alkohole dzielą się na trzy klasy, przy czym podstawą
podziału jest liczba grup organicznych przyłączonych do
atomu C z grupą -OH
OH

Właściwości fizyczne
• Alkohole o małej masie cząsteczkowej są cieczami.
• Są to związki polarne bardzo dobrze rozpuszczające
się w wodzie ( od 4 do 5 atomów węgla)
• Tworzą wiązania wodorowe między sobą oraz z
cząsteczkami wody, przez co charakteryzują się
bardzo wysokimi temperaturami wrzenia ( analogia
do cząsteczek wody).
• Alkohole wielowodorotlenowe maja jeszcze wyższe
temp. wrzenia, ponieważ posiadają więcej niż jedno
centrum asocjacji.
R-O----H-O
H
R
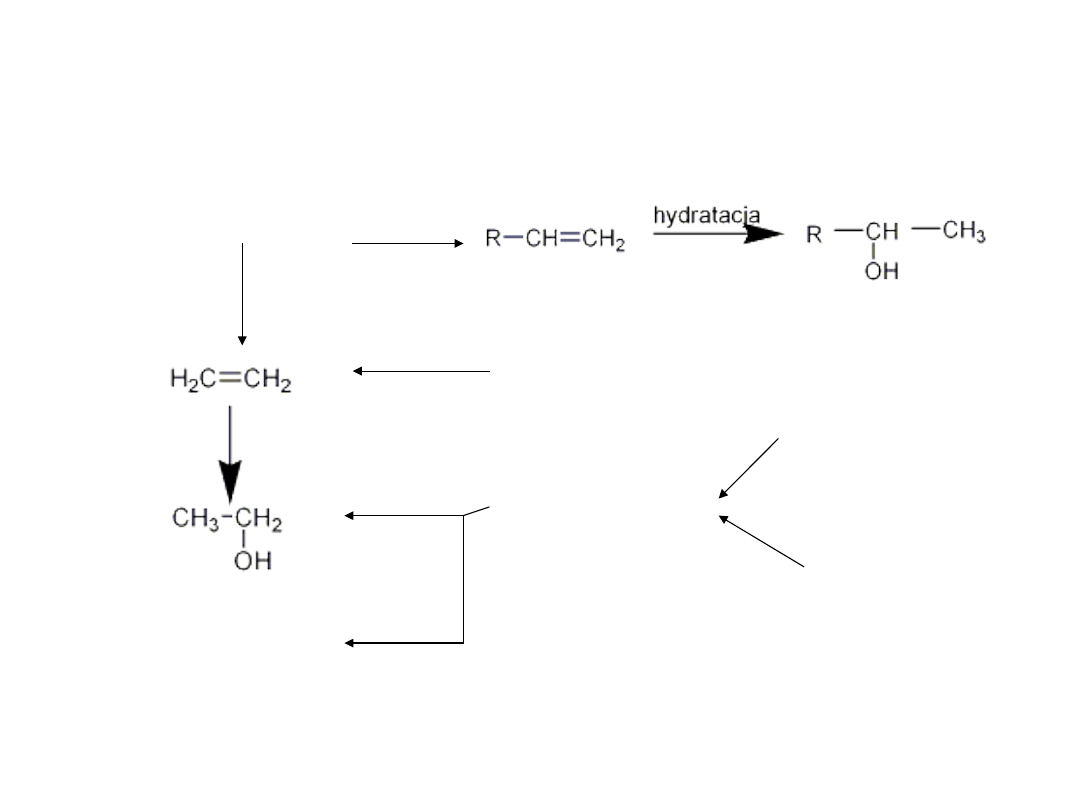
Otrzymywanie przemysłowe
alkoholi
• Alkohole można otrzymać z ropy naftowej
ropa naftowa
kraking
kraking
tłuszcze
fermentacja - cukry
skrobia
melasa
Olej
fuzlowy
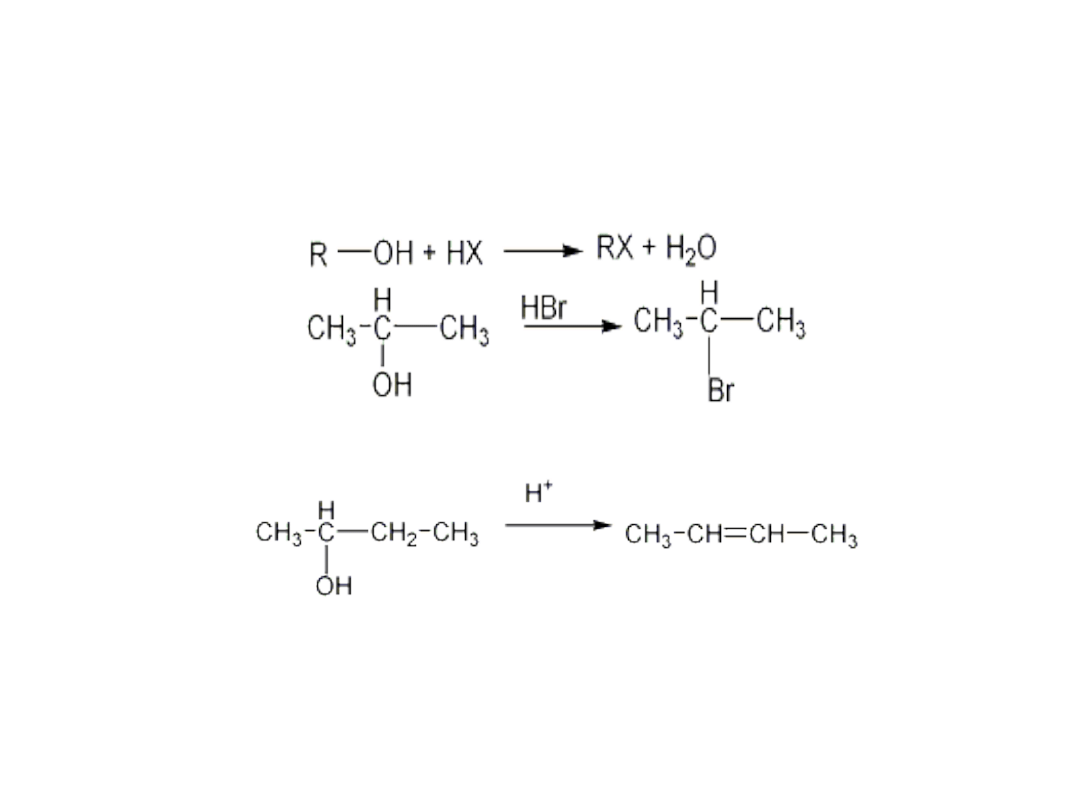
Właściwości chemiczne
• Reakcje alkoholi mogą polegać na rozerwaniu wiązania C-
OH lub O-H
• Reakcje polegające na rozerwaniu wiązania węgiel -grupa
hydroksylowa
• Reakcje dehydratacji
• W rekcjach dehydratacji najbardziej reaktywne są alkohole
III- rzędowe
+ H
2
O
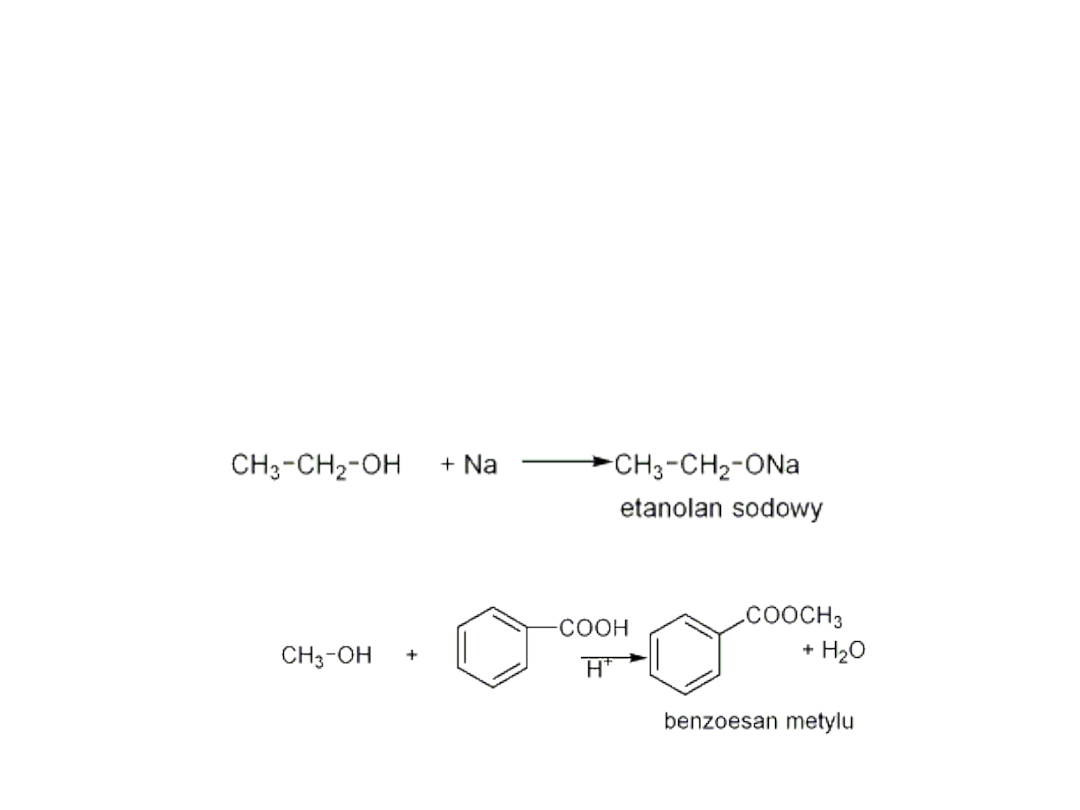
Rozerwanie wiązania O-H
-alkohole nie ulegają dysocjacji elektrolitycznej
( odczyn
roztworu jest obojętny)
- nie reagują z wodnymi roztworami
wodorotlenków np. NaOH
- reagują z reaktywnymi metalami Na, K, w
wyniku reakcji powstają alkoholany
- powstawanie estrów
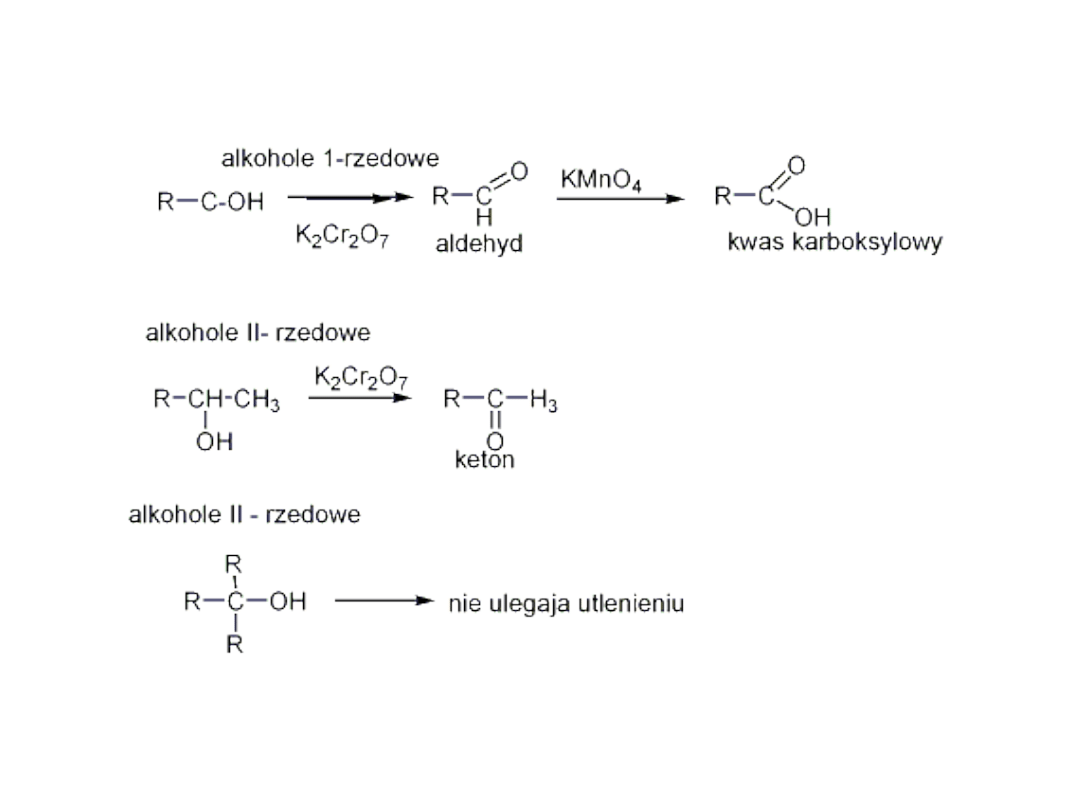
• Utlenianie
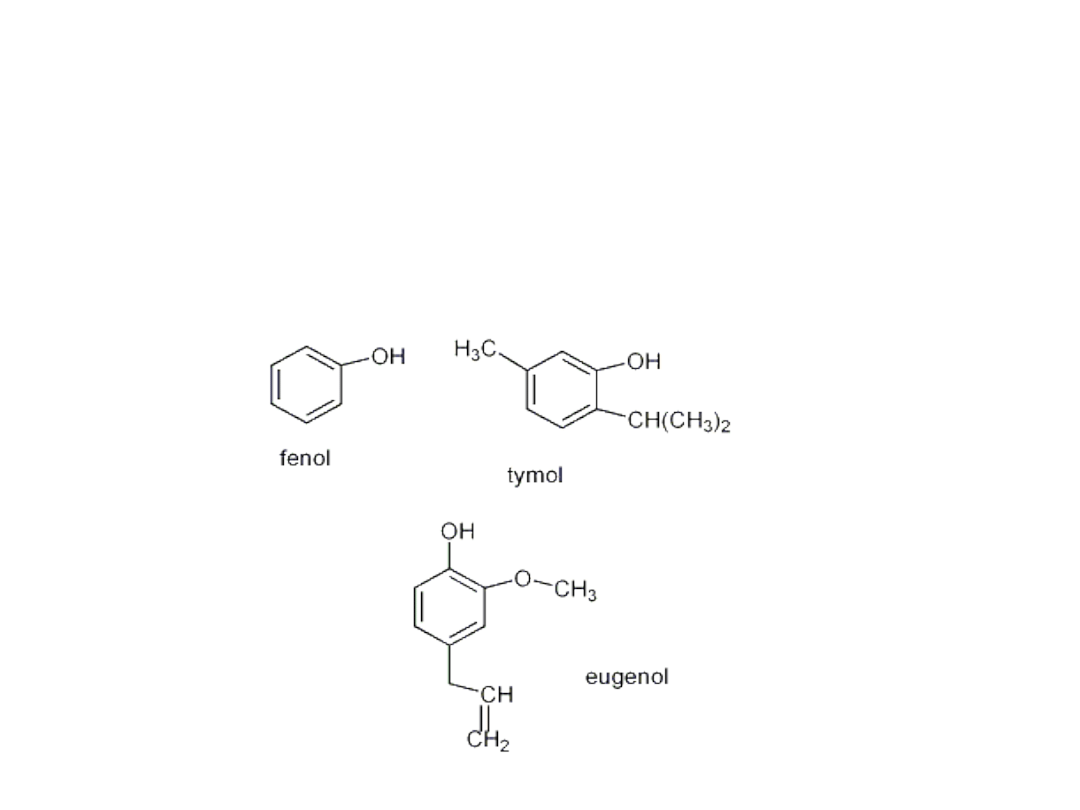
Fenole
• W fenolu grupa hydroksylowa jest połączona z
pierścieniem benzenowym.
• Fenol C
6
H
5
OH, jest białą, krystaliczną substancją stałą o
charakterystycznym zapachu, słabo rozpuszczają się w
wodzie.
• Inne fenole są często składnikami olejków zapachowych
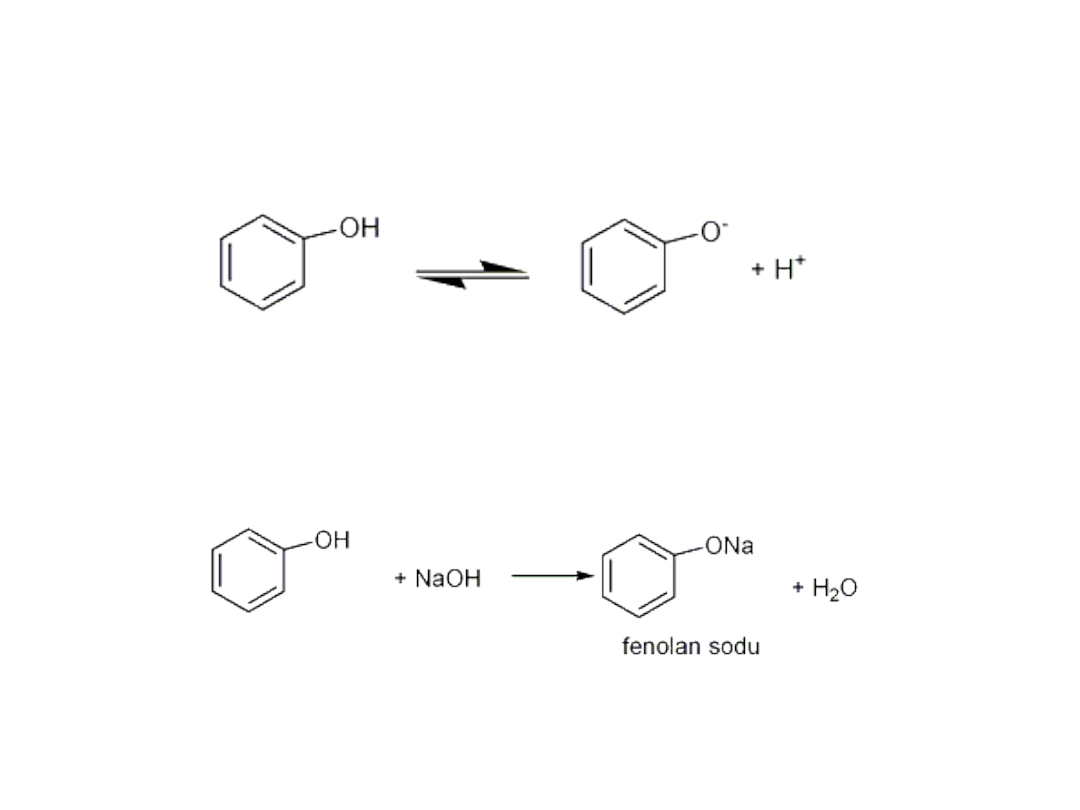
• Fenole różnią się od alkoholi tym, że są słabymi
kwasami, ulegają dysocjacji elektrolitycznej.
• Fenol reaguje z wodnymi roztworami
wodorotlenków, w wyniku czego powstają
fenolany.
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
- Slide 37
- Slide 38
- Slide 39
- Slide 40
- Slide 41
- Slide 42
- Slide 43
- Slide 44
- Slide 45
- Slide 46
- Slide 47
- Slide 48
Wyszukiwarka
Podobne podstrony:
chemia org bud
Chemia org 2 b
Chemia mat. bud, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, 1sem.chemia.laborki, Chemi
egzamin chemia org
Org.bud.- cz.3, Przygotowanie placu budowy, Przygotowanie placu budowy
Org.bud.- cz.3, Przygotowania do budowy ABC, ABC budowy domu - Przygotowania do budowy
Org. bud.- z Internetu, Wytyczenie geodezyjne, Wytyczenie geodezyjne
Org. bud.- z Internetu, Europejski sposób na ciepło
Org.bud.- cz.3, Obowiązki inwestora, Obowiązki inwestora
Org. bud.- z Internetu, Bezpieczeństwo i ochrona zdrowia na budowach, Bezpieczeństwo i ochrona zdrow
pomoc chemia org
Ćwiczenia II-biol, Chemia org
Org.bud. -cz.4, Kolejnośc robót budowlanych, Beton na budowie
Org.bud.- cz.3, UMOWA O ROBOTY BUDOWLANE NR, UMOWA O ROBOTY BUDOWLANE NR
Org.bud.- cz.3, Za ile dom, Za ile dom
Org. bud.- z Internetu, Trudna droga do rozpoczęcia budowy, Trudna droga do rozpoczęcia budowy
więcej podobnych podstron